膜片钳技术SOP
- 格式:doc
- 大小:187.00 KB
- 文档页数:10

膜片钳技术原理与基本操作(总7页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--膜片钳技术原理与基本操作1976 年Neher 和Sakmann 建立了膜片钳技术(Patch clamp technique),这是一种以记录通过离子通道的离子电流来反映细胞膜上单一的或多数的离子通道分子活动的技术。
1981 年Hamill, Neher 等人又对膜片钳实验方法和电子线路进行了改进,形成了当今广泛应用的膜片钳实验技术。
该技术可应用于许多细胞系的研究,也是目前唯一可记录一个蛋白分子电活动的方法,膜片钳技术和克隆技术并驾齐驱给生命科学研究带来了巨大的前进动力,这一伟大的贡献,使Neher 和Sakmann 获得1991 年诺贝尔医学与生理学奖。
一、膜片钳技术的基本原理二、用一个尖端直径在~μm 的玻璃微电极接触细胞膜表面,通过负压吸引使电极尖端与细胞膜之间形成千兆欧姆以上的阻抗封接,此时电极尖端下的细胞膜小区域(膜片,patch)与其周围在电学上分隔,在此基础上固定(钳制,Clamp)电位,对此膜片上的离子通道的离子电流进行监测及记录。
三、基本的仪器设备有膜片钳放大器、计算机、倒置显微镜、示波器、双步电极拉制器、三轴液压显微操纵器、屏蔽防震实验台、恒温标本灌流槽、玻璃微电极研磨器。
膜片钳放大器是离子单通道测定和全细胞记录的关键设备,具有高灵敏度、高增益、低噪音及高输入阻抗。
膜片钳放大器是通过单根电极对细胞或膜片进行钳制的同时记录离子流经通道所产生的电流。
膜片钳放大器的核心部分是以运算放大器和反馈电阻构成的电流-电压(I-V)转换器,运算放大器作为电压控制器自动控制,使钳制电位稳定在一定的水平上。
四、二、操作步骤1.膜片钳微电极制作(1) 玻璃毛细管的选择:有二种玻璃类型,一是软质的苏打玻璃,另一是硬质的硼硅酸盐玻璃。
软质玻璃在拉制和抛光成弹头形尖端时锥度陡直,可降低电极的串联电阻,对膜片钳的全细胞记录模式很有利;硬质玻璃的噪声低,在单通道记录时多选用。


膜片钳技术原理与基本操作1976 年Neher 和Sakmann 建立了膜片钳技术(Patch clamp technique),这是一种以记录通过离子通道的离子电流来反映细胞膜上单一的或多数的离子通道分子活动的技术。
1981 年Hamill, Neher 等人又对膜片钳实验方法和电子线路进行了改进,形成了当今广泛应用的膜片钳实验技术。
该技术可应用于许多细胞系的研究,也是目前唯一可记录一个蛋白分子电活动的方法,膜片钳技术和克隆技术并驾齐驱给生命科学研究带来了巨大的前进动力,这一伟大的贡献,使Neher 和Sakmann 获得1991 年诺贝尔医学与生理学奖。
一、膜片钳技术的基本原理用一个尖端直径在1.5~3.0μm 的玻璃微电极接触细胞膜表面,通过负压吸引使电极尖端与细胞膜之间形成千兆欧姆以上的阻抗封接,此时电极尖端下的细胞膜小区域(膜片,patch)与其周围在电学上分隔,在此基础上固定(钳制,Clamp)电位,对此膜片上的离子通道的离子电流进行监测及记录。
基本的仪器设备有膜片钳放大器、计算机、倒置显微镜、示波器、双步电极拉制器、三轴液压显微操纵器、屏蔽防震实验台、恒温标本灌流槽、玻璃微电极研磨器。
膜片钳放大器是离子单通道测定和全细胞记录的关键设备,具有高灵敏度、高增益、低噪音及高输入阻抗。
膜片钳放大器是通过单根电极对细胞或膜片进行钳制的同时记录离子流经通道所产生的电流。
膜片钳放大器的核心部分是以运算放大器和反馈电阻构成的电流-电压(I-V)转换器,运算放大器作为电压控制器自动控制,使钳制电位稳定在一定的水平上。
二、操作步骤1.膜片钳微电极制作(1) 玻璃毛细管的选择:有二种玻璃类型,一是软质的苏打玻璃,另一是硬质的硼硅酸盐玻璃。
软质玻璃在拉制和抛光成弹头形尖端时锥度陡直,可降低电极的串联电阻,对膜片钳的全细胞记录模式很有利;硬质玻璃的噪声低,在单通道记录时多选用。
玻璃毛细管的直径应符合电极支架的规格,一般外部直径在1.1~1.2mm。


膜片钳系统简明操作规程1.准备(1)相关液体:大部分细胞外液的pH为7.4,电极内液的pH为7.2-7.3;培养细胞的缓冲体系为HEPES,而急性分离细胞或者组织切片的缓冲体系多为碳酸盐体系;至于渗透压,细胞内应高于细胞外(如340mOsmd: 330mOsmd)使细胞微肿胀从而利于封接。
所有液体均应用微孔滤膜过滤,ICS应冻存;如果采用碳酸盐体系,那么实验过程必须灌流。
(2)电极:所用电极控制在2-5MΩ,电阻值越大则tip越细,利于封接而不利于破膜,反之,电阻值越小则tip越粗,利于破膜而不利于封接(注意小细胞有时电极电阻也可大于5MΩ);电极直径最好为5-10μm,即对于400倍的显微镜下2-4mm;电极末端可用火烧平,防止刮掉氯化银。
2. 封接准备(1)打开Clampex的Membrane Test,设定封接测试脉冲电流方波的幅度和频率。
(2)在玻璃微电极内维持一定的正压,用微操作器使电极进入记录液,在Membrane Test中可见测试脉冲方波,观察电极电阻大小。
(3)关闭Membrane Test,用Auto调节Pipette Offset,使METER 中的I (pA)=0。
如果I不显示为0,则可继续手工精确调节补偿的失调电位数值,直至I为0。
3. 封接(1)打开Membrane Test,使玻璃微电极逐渐接触细胞,去除正压并轻轻给予负压以形成稳定封接。
此时,封接测试脉冲消失,仅出现电极电容瞬变值。
封接电阻在1GΩ以上。
(2)补偿电极电容:用Cp Fast和Cp Slow对电极电容进行补偿。
可选Leak Subtraction去除漏电流。
4. 破膜(1)继续给予负压活用Zap功能电击打破细胞膜。
出现膜电容放电。
缓慢撤除电机内负压。
(2)用Auto对膜电容进行补偿,必要时手工进行细微调节。
(3)进行串联电阻补偿:选上Rs Compensation和Disable if oscillation detected,增大Prediction和Compensation对串联电阻进行补偿。

膜片钳技术SOP关键词:膜片钳目的:研究膜片上几个甚至一个离子通道的电流,对单个离子通道在各种电位状态及每种电位状态下对产生电流的离子作出定性、定量的分析,来反映细胞膜上离子通道活动,为研究离子通道结构与功能关系提供关于生物电特性的新资料。
基本原理:膜片钳制技术(patch clamp technique)是对一块单独的细胞膜片(或整个细胞)的电位进行钳制的一项电生理技术。
通过对膜电位的钳制可以观察通过离子通道的电流,膜片钳放大器正是通过维持电压的恒定而测出这种电流。
运用膜片钳技术记到的最小电流可达到pA级(10-12 A)。
膜片钳的本质属于电压钳范畴,其基本工作原理是:采用经典的负反馈放大技术作电压固定,但改用细胞外微吸管作电极,将微电极管尖端与细胞膜表面接触,经负压抽吸,形成具极高阻抗的紧密封接,其电阻值高达10-100千欧(即GΩ=109Ω)。
只有在这种封接存在时,通过膜电极引导记录的电流才是通过该膜的离子通道电流。
膜片钳技术原理示意图Rs是膜片阻抗相串联的局部串联电阻(输入阻抗),Rseal是封接阻抗。
Rs通常为1~5MΩ,如果Rseal高达10GΩ(1010Ω)以上时,IP/I=Rseal/(Rs+ Rseal)-1。
此Ip可为在I-V转换器(点线)内的高阻抗负反馈电阻(Rf)的电压降而被检测出。
药品和试剂:根据不同的实验设计选择不同的药品和试剂。
主要仪器设备与材料:①屏蔽防震实验台(TMC 63-544)②数字式超级恒渐浴槽(HSS-1 CHENDU INSTRUMENT China)③微管电极拉制器(PP-83 NARISHIGE Japan)④微管电极抛光仪(ME-83 NAEISHIFE Japan)⑤电子刺激器(SEN-2030, NIHON KOHDEN, Japan)⑥膜片钳放大器(AXOPATCH 200B Axon Instruments U.S.A)⑦倒置相差显微镜(AXIOVERT 135 ZEISS Germany)⑧计算机(PⅢ 800)⑨A/D、D/A转换器(DIGIDATA-1200 Axon Instruments U.S.A)⑩pClamp软件(10.0)Axon Instruments U.S.A )实验对象:兔、大鼠、猪、和人的组织细胞(直径小于30μm的细胞),都可用于膜片钳实验。

常州细胞生物学脑定位膜片钳原理及步骤
常州细胞生物学脑定位膜片钳是一种用于记录神经元电活动的实验技术。
其原理为利用微型电极穿透细胞膜,直接记录细胞内外电位的变化,并通过程序控制电极的移动,定位到特定的神经元细胞上进行电生理实验分析。
具体步骤如下:
1. 制备膜片钳:制作玻璃微电极,并用火炬加热封闭一端,使其呈现一个微小的孔。
将另一端连接到电极放大器上。
2. 切取小鼠或大鼠脑组织:将小鼠或大鼠的脑组织切成薄片,并将其置于离心管中。
加入缓冲液处理,使脑片柔软并不断吸除液,去除脑组织中的血液和细胞间液。
3. 将片段放在实验器皿中:将制备好的膜片钳放入实验器皿中,将离心管中的脑片放在显微镜下,观察和定位神经元的位置。
4. 穿透细胞膜:通过微调玻璃微电极的位置,将其穿透神经元细胞膜,并记录细胞内外的电位变化。
5. 进行电生理实验:利用程序控制电极的移动,将膜片钳定位到具体的神经元细胞上进行离子通道电流和电势信号的测量。
6. 分析细胞电生理数据:通过数据分析软件对实验结果进行分析,了解神经元细胞的电生理特性和响应情况。
7. 记录实验结果:将数据记录下来,并用图表等方式展示实验结果,以便后续研究或发表论文。
膜片钳技术1、膜片钳技术原理膜片钳技术是用玻璃微电极吸管把只含1-3个离子通道、面积为几个平方微米的细胞膜通过负压吸引封接起来,由于电极尖端与细胞膜的高阻封接,在电极尖端笼罩下的那片膜事实上与膜的其他部分从电学上隔离,因此,此片膜内开放所产生的电流流进玻璃吸管,用一个极为敏感的电流监视器(膜片钳放大器)测量此电流强度,就代表单一离子通道电流。
膜片钳的基本原理则是利用负反馈电子线路,将微电极尖端所吸附的一个至几个平方微米的细胞膜的电位固定在一定水平上,对通过通道的微小离子电流作动态或静态观察,从而研究其功能。
膜片钳技术实现膜电流固定的关键步骤是在玻璃微电极尖端边缘与细胞膜之间形成高阻密封,其阻抗数值可达10~100 GΩ(此密封电阻是指微电极内与细胞外液之间的电阻)。
由于此阻值如此之高,故基本上可看成绝缘,其上之电流可看成零,形成高阻密封的力主要有氢健、范德华力、盐键等。
此密封不仅电学上近乎绝缘,在机械上也是较牢固的。
又由于玻璃微电极尖端管径很小,其下膜面积仅约1 μm2,在这么小的面积上离子通道数量很少,一般只有一个或几个通道,经这一个或几个通道流出的离子数量相对于整个细胞来讲很少,可以忽略,也就是说电极下的离子电流对整个细胞的静息电位的影响可以忽略,那么,只要保持电极内电位不变,则电极下的一小片细胞膜两侧的电位差就不变,从而实现电位固定。
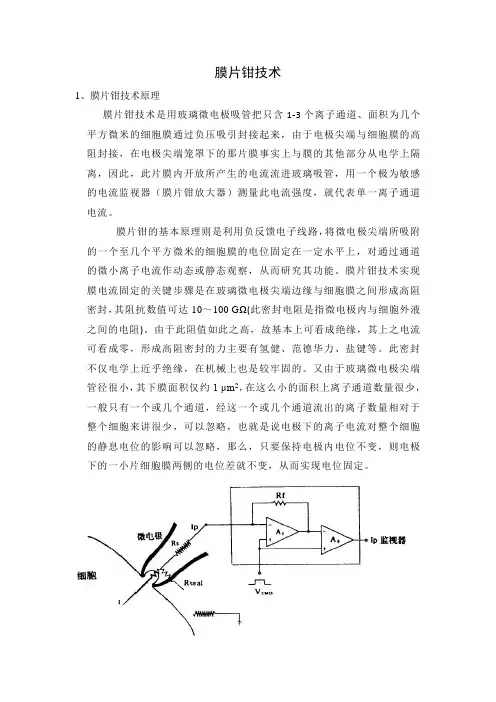
膜片钳技术的原理图[51]Rs是与膜片抗阻串联的局部串联电阻(或称入路阻抗),Rseal是封接阻抗。
RS通常为1~5MΩ,如果Rseal高达10GΩ以上是成为Ip/I=Rseal/(Rs+Rseal)-1。
此Ip可作为I~V转换器(点线)内的高阻抗负反馈电阻(Rf)的电压下降而被检测出。
实际上这是场效应管运算放大器(A1)的输出中包括着膜电阻成分,这部分将在通过第二级场效应管运算放大器(A2)时被减掉。
本实验采用的是全细胞记录模式。
全细胞记录构型(whole-cell recording)高阻封接形成后,继续以负压抽吸使电极管内细胞膜破裂,电极胞内液直接相通,而与浴槽液绝缘,这种形式称为“全细胞”记录。

上海细胞生物学膜片钳电生理技术原理及步骤上海细胞生物学膜片钳电生理技术原理及步骤
一、技术原理
膜片钳电生理学是一种利用膜片平板钳技术来研究细胞内电位
变化和影响细胞内电位的因素的技术。
它可以报道细胞内电位的变化情况,探索细胞的内源性和外源性电位协调机制,研究细胞内电位的调节机制,进而研究细胞内信号转导的机制。
二、实验步骤
1. 膜片制备
(1)将管测仪清洗干净,加入约5ml测定液;
(2)以低浓度药剂去除细胞内的Chloride离子等离子混合物,准备独立的Chloride离子作为探针;
(3)用手注入细胞膜片,将药剂和Chloride离子完全混合;
(4)用滤纸将药剂Wash掉,每次100ul,用重力将它们从滤纸上吸附下来;
(5)将除在管中的细胞膜片送入实验箱中,将其安装在膜片平板钳中;
(6)将管测仪的开关打开,按照软件的指示准备好实验。
2. 测量
(1)定时对每个膜片进行测量,以获取膜片电流的变化;
(2)记录细胞内电位的变化情况;
(3)观察膜片电流在不同条件下的变化趋势。
3. 数据处理
(1)将测量的数据记录在Excel表中;
(2)按照分析要求,对原始的测量数据进行处理;
(3)计算出每个膜片的平均电位和标准差,并将结果可视化;
(4)根据测量的电位,探究细胞内的电位调节机制。
4. 实验结果分析
根据实验结果,进行定量分析,研究细胞内电位的变化、比较不同药剂对电位变化的影响,以及探究细胞内信号转导的机制。

药物⼼脏毒性研究技术之膜⽚钳技术⼀些药物在使⽤的过程中引发的⼼脏毒性是威胁患者⽣命的毒副作⽤之⼀,如抗⼼律失常药物导致的⼼脏不良事件时有报道,虽然这种事件发⽣率低,但是危险性⼤,主要表现为⼼电图QT间隔延长,严重可以引起尖端扭转型室性⼼动过速。
因此在新药上市前,需要进⾏药物安全性评价时,尽早发现药物的潜在⼼脏毒性,以减少新药研发的投⼊和风险。
被称为研究离⼦通道的“⾦标准”的膜⽚钳技术,是药物早期⼼脏毒性评价的主要技术之⼀。
QT间期是指⼼室除极和复极的全过程,即QRS波群的起点到T波终点的时程。
QTc间期是指排除了⼼率影响的校正的QT间期。
⼼脏复极延迟,将导致发⽣⼼律失常的风险明显增⾼,最常见的是引发尖端扭转型室性⼼动过速(TdP), TdP易演变成⼼室纤颤并导致猝死,因此QT间期延长,被认为是预测引发TdP的⽣物标记物。
在新药开发过程中,进⾏药物安全性评价的⼼脏毒性评价时,应确认研究药物对QT间期的影响,防⽌其上市后引起恶性⼼律失常。
hERG通道产⽣的电流是⼼室复极中最重要的电流,通道被药物后抑制直接导致Long QT综合症,很可能演变成尖端扭转型室性⼼动过速,⼼室纤颤,直⾄猝死。
长QT综合症(LQTS)是⼀种异常的⼼肌细胞复极化电活动,获得性的LQTS常常是药物治疗的结果。
研究发现许多常⽤药物包括抗⼼律失常药、抗精神病药物、抗菌素以及可卡因均可引起获得性的LQTS。
⽬前发现⼏乎所有的临床药物所导致的LQT 或者TdP 都作⽤于hERG。
由于导致hERG抑制的药物在化学结构上没有明显的共性,从⽽很难预测,仅有通过实验的⽅式给予解决。
全⾃动膜⽚钳技术⼀个重要的应⽤⽅向是检测早期药物化合物对hERG的毒副作⽤。
美迪西引进HEKA膜⽚钳系统(Patch Clamp System),该系统为放⼤器与数模转换器⼀体,可通过软件与⼿动操作相结合,达到⽐全⾃动更精准的程度,将会⼤⼤增强美迪西体外药物安全性评价服务。

郭静1611210748 北大深圳医院一.概念:膜片钳技术是一种通过微电极与细胞膜之间形成紧密接触的方法,采用电压钳或电流钳技术对生物膜上离子通道的电活动(尤其是可对单通道电流)进行记录的微电极技术。
二.应用:在一个细胞上检测多种离子通道用于离子通道电生理特性的研究研究受体及第二信使对通道活性的作用生理、药理机制研究中的应用三.常用的记录形式:(1) 细胞贴附式:高阻封接后的状态即为细胞贴附式模式,是在细胞内成分保持不变的情况下研究离子通道的活动,进行单通道电流记录。
即使改变细胞外液对电极膜片也没有影响。
(2) 膜内面向外式:在细胞贴附式状态下将电极向上提,电极尖端的膜片被撕下与细胞分离,形成细胞膜内面向外模式。
此时膜片内面直接接触浴槽液,灌流液成分的改变则相当于细胞内液的改变。
可进行单通道电流记录。
此模式下细胞质容易渗漏,影响通道电流的变化,如Ca2+ 通道的run-down 现象。
(3) 全细胞式记录:在细胞贴附式状态下增加负压吸引或者给予电压脉冲刺激,使电极尖端膜片在管口内破裂,即形成全细胞记录模式。
此时电极内液与细胞内液相通成为和细胞内电极记录同样的状态,不仅能记录一个整体细胞产生的电活动,并且通过电极进行膜电位固定,也可记录到全细胞膜离子电流。
这种方式可研究直径小于20μm 以下的小细胞的电活动;也可在电流钳制下测定细胞内电位。
(4) 膜外面向外式(outside-out mode):在全细胞模式状态下将电极向上提,使电极尖端的膜片与细胞分离后又粘合在一起,此时膜内面对电极内液,膜外接触的是灌流液。
可在改变细胞外液的情况下记录单通道电流。
四.全细胞膜片钳的记录过程:1.DRG神经元的急性分离2.玻璃微电极的制备3.计算机操作(1)打开膜片钳放大器(2)打开计算机,进入Patchmaster操作界面。
(3)单击“store”,选择好文件名和保存路径,单击“save”(4)单击“current clamp”,编辑所需的刺激模式。
高通量higher throughput节省成本cost saving 节省时间time saving 自动化automatic 高品质数据better results 全自动膜片钳系统Automated Patch Clamp System Revolutionizing Ion Channel Drug Discovery以离子通道为靶点的药物开发的革命性工具CONTENTS 目录112344556888911131415151518182021封底全自动膜片钳技术及其在药物筛选中的应用全自动膜片钳技术原理全自动膜片钳在药物筛选中的应用Molecular Devices 公司开发的仪器设备为以离子通道为靶点的药物开发提供了完整的解决方案IonWorks Barracuda - 高通量膜片钳系统的新突破简介主要用途产品特征应用实例IonWorks Quattro - 全自动高通量膜片钳药物筛选系统简介主要用途产品特征应用实例重要参考文献IonWorks 的全球用户PatchXpress 7000A - 全自动平行膜片钳系统简介产品特点主要用途应用实例重要参考文献PatchXpress 的全球用户公司简介1膜片钳技术被称为研究离子通道的“金标准”。
是研究离子通道的最重要的技术。
目前膜片钳技术已从传统的常规膜片钳技术 (Conventional patch clamp technique) 发展到全自动膜片钳技术 (Automated patch clamp technique) 。
全自动膜片钳技术及其在药物筛选中的应用不同的全自动膜片钳系统的所采用的技术原理也不完全相同。
大体有以下几种。
1. 全自动膜片钳技术原理将一定密度的细胞悬液灌注在玻璃电极中,下降到电极尖端的单个细胞通过在电极外施加负压与玻璃电极尖端形成稳定的高阻封接,系统自动判断封接形成是否良好并自动打破露在玻璃微电极尖端外的细胞膜形成全细胞模式。
膜片钳与离子系统技术平台的标准操作规程关键词:膜片钳,离子成像目的:本操作规程是关于利用膜片钳与离子成像系统技术平台进行细胞内离子研究的具体操作规程。
仪器负责人:杨琳操作步骤:一、膜片钳系统(一)Sutter P-97拉制仪1、开左侧电源开关,预热10min。
2、运行RAMP TEST坡度测试,确定玻璃管的加热值,使加热能够熔化玻璃但又不至于烧断加热片。
警告:第一次使用拉制仪或更换加热丝、更换不同型号的玻璃时,都应该作RAMP TEST 坡度测试,然后把RAMP TEST的值当做新编辑的程序的HEAT值。
下面是运行RAMP TEST的步骤:(1)进入任一程序(按0-9 Enter回车)。
(2)按清除键<CLR>进入控制功能。
(3)按<0>不要清除参数数值。
(4)按<1>即能运行RAMP TEST 坡度测试。
(5)安装玻璃管和按<PULL>。
(6)记录RAMP TEST值,将用于设置HEAT。
3、做完RAMP TEST后记下它的值按RESET。
选择一个程序,按光标提示输入测试得到的HEA T值,调整PULL、VELOCITY、TIME等参数值,设置拉制步数(Cycle)。
4、安装玻璃管:先将玻璃管安放在一侧的玻璃管夹的槽内,用旋钮固定,然后将玻璃管推过加热小室,用另一侧的玻璃管夹固定。
5、按“PULL”键,拉制电极6、小心取下拉制好的微电极。
7、关闭电源。
注意:1.不能用力按压玻璃管夹!将玻璃管推入加热小室时不能碰到加热丝!2.用户要根据自己的需要先通过RAMP TEST确定HEAT值,再不断调整PULL、VELOCITY、TIME值,使之做一步二步甚至多步拉制达到自己的应用目的。
3.前后面板(按钮、开关、旋钮)控制的功能及作用(1)前面板LCD Display:显示程序参数Reset:初始化复位控制Air Pressure:在拉制周期的有效制冷状态期间设置空气压力的值Keypad:用于设置程序参数值和执行程序0~9:用于选择所要的程序或控制功能,当程序设计时输入数字值和作决定是/否(Yes/No)(1/0)CLR:进入某个程序后本键用于删除程序或数值,也用于作坡度测试(RAMP TEST)的入口ENTER:回车,确定新数值或程序NEXT:编辑时移动到程序的下一行LAST:编辑时移动到程序的上一行PULL:开始执行程序STOP:终止执行程序LCD Display显示:Program (0-9):一个程序由一行(Cycle)或多行组成(一个Cycle包括4个程序参数:HEAT、PULL、VELOCITY、TIME,一个Cycle相当于一行程序代码)。
合肥细胞生物学电生理膜片钳原理及步骤
合肥细胞生物学电生理膜片钳是一种实验技术,用于研究细胞膜的离子转运和通道功能。
具体原理及步骤如下:
原理:
膜片钳分为两种:内破式和外破式。
内破式膜片钳是使用吸管吸引细胞,通过内破细胞膜来接触细胞内部,外破式膜片钳则是通过压力控制膜片和细胞膜的接触。
步骤:
1. 实验者需要制备一些玻璃膜片,并涂上一层细胞贴壁剂,使其变得亲水。
2. 首先,需要生长细胞并将其放入培养皿中,保证其在适当的环境下生长。
3. 实验者使用一个钳子将一块膜片夹在微调杆上,并将其移动以接近细胞膜。
4. 然后,使用一个微小的吸孔将膜片吸附在细胞上,使其吸附在膜片上。
5. 实验者会给膜片和细胞提供一些膜平衡液,帮助膜片更容易地接触到细胞膜。
6. 接下来,实验者会通过调节电路并施加微小电压来观察膜片和细胞膜的交互
作用。
7. 在观察的过程中,实验者可以通过一个耳机来听到来自膜片上的信号。
8. 最后,实验者便可以分析信号并弄清楚细胞膜中的离子转运和通道功能。
膜片钳实验技术入门------基本原理与操作关兵才 李国华 刘理望按:本文乃于2003年根据较旧型号的仪器写成,后被《机能实验科学》 (郑先科主编,北大医学版,2006)收入。
因新旧仪器基本原理和操作步骤大同小异,现对原文略作修改和标注,供同学们参考。
【实验目的】1. 了解膜片钳技术的基本原理和操作。
2. 初步学习电压依赖性离子通道电流的基本记录方法。
【实验原理】一、膜片钳技术原理简介膜片钳(patch clamp)是一种主要用于检测细胞膜离子通道活动的电生理技术,按工作方式可区分为电压钳(voltage clamp)和电流钳是最基本的工作方式,即对细胞膜电位进行人为控制,如将膜电位钳制于某一固定水平,或在此基础上再施以阶跃(step)式或斜坡式(ramp)电压刺激,同时记录跨膜电流,从而分析细胞膜通道的活动。
电流钳即人为控制经微电极对细胞进行注射的电流(等于离子通道电流与细胞膜电容电流之和),同时记录膜电位及其变化。
若注射电流为零即常用的零位钳流,用于测量细胞膜静息电位,若注射方波脉冲刺激电流,用于诱发、观测动作电位。
另外,膜片钳技术还常用于观测细胞膜电容, 从而推测分泌细胞的活动情况。
下面主要介绍其电压钳工作方式的基本原理。
(注:在电生理资料中,因通常将细胞外液和记录系统的“地”点相连作为参考点即零电位点,所以电位和电压两个概念经常混用。
)根据膜片钳实验中受检细胞膜的型式(configuration)不同,又可将膜片钳分为全细胞式(whole-cell)、细胞贴附式(cell-attached 或on-cell)、内面朝外式(inside-out)、外面朝外式(outside-out)等四种模式。
(一)全细胞式1.电压钳制和电流记录的实现图9-9为全细胞式膜片钳工作原理示意图。
图9-9 全细胞膜片钳实验原理示意图A1:运算放大器;A2:单倍增益差动放大器;R f:反馈电阻;V p:电极电位(A1反向输入端电位);V c:A1同向输入端电位;C in:输入端杂散电容;C p:电极电容;Rs:串联电阻;C m:细胞膜电容;R m:细胞膜电阻;E m:细胞膜内在电位(指钳压时的细胞膜诸通道状态决定的内在Goldman-Hodgkin-Katz平衡电位);V o:A2输出端电位;V-offset:偏移电位补偿电位;C c:用于电容补偿的电容;V c(app):表观钳制电压即欲施加于受试膜片的电压;图中⊕和表示求和电路将充有电解质溶液的玻璃微电极(glass microelectrode或 recording pipette)利用负压紧密吸附于细胞表面,形成吉欧即千兆欧(109Ω)级高阻封接,进一步对微电极内施加负压、将放大器(以下简称运放)A1在深度负反馈工作状态下的“虚短路(virtual short circuit)”原理实现,即只要A1工作于线性范围内,其反向输入端的电位V p总是等于同向输入端的电位V c,这两个输入端之间虽非短路却类似于短路。
脑片膜片钳实验流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help yousolve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts,other materials and so on, want to know different data formats and writing methods, please pay attention!脑片膜片钳实验是神经科学研究中常用的一种技术手段,通过这一实验方法可以对大脑功能进行精细的刺激和记录,帮助科研人员深入了解神经元之间的相互作用和信息传递过程。
膜片钳技术SOP关键词:膜片钳目的:研究膜片上几个甚至一个离子通道的电流,对单个离子通道在各种电位状态及每种电位状态下对产生电流的离子作出定性、定量的分析,来反映细胞膜上离子通道活动,为研究离子通道结构与功能关系提供关于生物电特性的新资料。
基本原理:膜片钳制技术(patch clamp technique)是对一块单独的细胞膜片(或整个细胞)的电位进行钳制的一项电生理技术。
通过对膜电位的钳制可以观察通过离子通道的电流,膜片钳放大器正是通过维持电压的恒定而测出这种电流。
运用膜片钳技术记到的最小电流可达到pA级(10-12 A)。
膜片钳的本质属于电压钳范畴,其基本工作原理是:采用经典的负反馈放大技术作电压固定,但改用细胞外微吸管作电极,将微电极管尖端与细胞膜表面接触,经负压抽吸,形成具极高阻抗的紧密封接,其电阻值高达10-100千欧(即GΩ=109Ω)。
只有在这种封接存在时,通过膜电极引导记录的电流才是通过该膜的离子通道电流。
膜片钳技术原理示意图Rs是膜片阻抗相串联的局部串联电阻(输入阻抗),Rseal是封接阻抗。
Rs通常为1~5MΩ,如果Rseal高达10GΩ(1010Ω)以上时,IP/I=Rseal/(Rs+ Rseal)-1。
此Ip可为在I-V转换器(点线)内的高阻抗负反馈电阻(Rf)的电压降而被检测出。
药品和试剂:根据不同的实验设计选择不同的药品和试剂。
主要仪器设备与材料:①屏蔽防震实验台(TMC 63-544)②数字式超级恒渐浴槽(HSS-1 CHENDU INSTRUMENT China)③微管电极拉制器(PP-83 NARISHIGE Japan)④微管电极抛光仪(ME-83 NAEISHIFE Japan)⑤电子刺激器(SEN-2030, NIHON KOHDEN, Japan)⑥膜片钳放大器(AXOPATCH 200B Axon Instruments U.S.A)⑦倒置相差显微镜(AXIOVERT 135 ZEISS Germany)⑧计算机(PⅢ 800)⑨A/D、D/A转换器(DIGIDATA-1200 Axon Instruments U.S.A)⑩pClamp软件(10.0)Axon Instruments U.S.A )实验对象:兔、大鼠、猪、和人的组织细胞(直径小于30μm的细胞),都可用于膜片钳实验。
动物由泸州医学院(许可证号:SYXK(川)2008-063)提供;人体组织来源于临床手术丢弃物。
本SOP以猪冠状动脉平滑肌细胞为例,选取体重约120~150 Kg的猪,雌雄不拘,猪心脏购自泸州市屠宰场。
实验环境:常温(22o C)下进行, 湿度(70-80%)操作步骤:1.液体配制主要根据研究通道的不同,所用细胞的不同,配制相应的液体,可参考相应的文献进行调整。
包括:电极液;细胞外液等。
基本原则是保持2个平衡,渗透压平衡和酸碱平衡。
另外,所有液体在使用前必须过滤,以保持液体洁净。
(详见细胞的分离与培养SOP:L Y-XJD-SYJS-014/015)2.标本制备膜片钳实验一般是在单个细胞上进行。
实验用单细胞主要来自培养细胞或急性酶分离的细胞,也可来自脑片细胞中的原位细胞。
常用的酶是胶原酶和蛋白酶,单独或联合使用,有些组织还要加用其它酶,如弹性纤维酶等。
(详见细胞的分离与培养SOP:L Y-XJD-SYJS-014/015)3.微管电极的制备一般采用常规二步法完成,电极尖端直径在1~2μm之间,抛光与涂布液体硅酮树酯后,充灌电极液。
3.1微管电极拉制电极经两步拉制,经过一次粗拉使玻璃管中间拉成一窄细状,第二次拉制窄细部位断成两根。
调节第一步和第二部拉制时的加热线圈电流,就可得到所需要的尖端直径。
拉制电极的毛细玻璃管(Hematocrit Tubes,Drummond,U.S.A.)长度约为75mm。
首先设定电极两步拉制参数: 第一步为59mA,第二步为54mA; 然后将制备电极的毛细玻璃管固定于PC-10垂直微管电极拉制仪上。
经过两步拉制后电极尖端直径约为1~2μm,充灌电极液后电极阻抗为2~4 MΩ。
3.2绝缘树脂涂抹为了克服热噪声和封接阻抗噪声及电极浸入溶液产生的浮游电容噪声,需要在微电极尖颈部(距微电极尖端50nm)的表面薄薄地涂一层硅酮树脂,将涂好的电极移放到镍铬电阻线圈制成的电炉上烘干待用。
3.3电极热抛光将两步拉制成的电极置于MF-83微管电极抛光仪的垂直推进架上,在低倍镜下(15×4)找到电极尖端和加热电阻丝,然后换成高倍镜(15×33)。
将加热电阻丝和电极尖端调整到一个平面内,进行瞬间加热,可使电极尖平滑并烧去多余的硅酮树脂薄层,使电极尖端圆钝平滑有利于高阻封接的形成。
3.4电极液充灌用注射器反向充灌,即用拉细的聚乙烯胶管从电极尾部插入到电极尖端,再注入溶液。
充灌后用左手夹住电极使其尖端向下,用右手指轻弹电极排出电极尖端的少许气泡。
4.高阻抗封接形成4.1在恒温条件下,将细胞贴壁良好的载玻片移入有浴液的浴槽中。
浴槽不能太深,以尽量减少电极进入浴液的深度,从而减少浮游电容;4.2倒置相差显微镜下选择立体感强、活性好的细胞进行实验;4.3使用新拉制的微管电极,用细塑料管以反充灌方式灌电极液入电极尖端,若含有气泡,可手持微电极使其尖端朝下,用手指敲弹几下管壁即可排除,然后再将微电极安装在探头上。
4.4当微管电极在微推进器帮助下进入浴液时,用注射器向电极施加一正压(1~2cm H2O),以防液气表面颗粒堵塞微管电极尖端;调节放大器上pipette offset旋钮,将电极电压补偿到零。
同时由膜片钳放大器向微管电极发放—电压为5mV、波宽40ms的方波脉冲信号,用于观察封接过程。
4.5微推进器将微管电极送入到即将接触细胞时,撤去正压,并继续向选定的细胞表面推进,当电极尖端轻触到细胞表面时其应答电流变小,这时只要给微管电极尖端管腔内施加一负压(10~20cm H2O),若在计算机屏幕上看到应变电流突然下降至零,电流噪声随之减少,则提示微管电极尖端与细胞形成近似电绝缘,其阻抗约10~100GΩ,说明高阻抗封接(giga seal)形成,这时的膜片为细胞贴附式膜片。
在此基础上,根据不同的实验要求,再制成不同类型的膜片构型。
5.膜片钳制技术记录方式5.1细胞贴附式膜片(cell-attached patch)由于细胞牢固贴附于微管电极的尖端而得名。
它可用于记录各种细胞的单通道电流,而且是在细胞完整无损的状态下研究通道的活动。
优点:不破坏细胞的完整性,不需要胞内灌流,不影响细胞质且调制系统完整。
可研究通过细胞对单通道的调制,也可在正常离子环境中研究递质和电压激活的单通道活动。
缺点:不能改变细胞内成分,也不能精确测定膜电位。
同时由于许多细胞膜上存在有牵张激活的离子通道,细胞膜与电极间轻微的张力变化往往会增加记录的背景噪声。
5.2内面向外式膜片(inside-out patch)细胞贴附式膜片形后,提起电极时,与电极尖端相接的细胞膜被撕脱下来开成小泡,将电极尖端在空气中暴露几秒钟后小泡很快破裂,形成胞浆侧向外的内面向外式膜片。
特点:较易改变细胞内的离子或物质浓度,也能把酶等直接加入膜的内侧面,适宜研究胞内物质对通道活动的影响。
但实验中改变膜外侧物质困难,且需侵入低钙液中,以免小泡形成。
应用:可研究胞内信使物质cAMP、cGMP、Ca2+,三磷酸肌醇(IP3)等对受体型通道的调节,以及胞内激素对通道的调节。
这种方式可使通道与细胞的调节机制脱耦联,使第二信使直接作用于膜内,引起通道开闭。
5.3外面向外式膜片(outside out patch)细胞贴附式膜片形成后,向微管电极内给予较强的负压将膜片吸破,再将电极从细胞膜上拔起,但不暴露于空气中,被撕脱下来的膜便形成外面向外式膜片。
优点:可以任意改变胞外物质的浓度,有利于研究递质对膜离子通道外侧面的作用。
缺点:实验中难以改变胞内成分,电极管必须充以低钙溶液以防小泡形成。
应用:可研究腺苷酸环化酶、蛋白激酶C等活性变化,以及细胞膜上信使物质二酰甘油、花生四稀酸、GABA、Ach等对受体型的离子通道研究。
5.4全细胞记录构型(whole cell recording)在细胞贴附式膜片形成的基础上,向微管电极内给予较强的负压将膜片吸破,而高阻封接稳定,即形成全细胞记录构型。
记录的电流属于宏观电(macroscopical current),是整个细胞离子通道活动形成的总和电流。
若采用膜片钳放大器内的电流钳模式,还可以记录细胞的静息电位和动作电位。
特点:①电极管内与细胞之间弥散交换与平衡快,因而容易控制细胞内液的成分;②记录的是许多通道的综合电流,需改变内部介质以分离电流;③适合于对小细胞的电压钳位,对直径大于30μm的细胞很难实现钳制;④该方法使电生理研究的重点从无脊椎动物大细胞中解脱出来,而向人类和哺乳类细胞发展。
5.5穿孔膜片记录技术(perforated patch recording technique)Hom和Marty于1988年首次建立了一种对传统全细胞记录法改进的方法,该方法是基于某些抗生素如制霉菌素(Nystatin),两性霉素B(Amphotericin B)等具有在生物膜上形成通透性孔道的特性,将这类抗生素充灌在电极液中,在形成高阻封接后,可使电极液与细胞内液在电学上相通,因而称作穿孔膜片记录技术。
配制方法如下:首先在避光条件下配制二性霉素B的二甲基亚砜(DMSO)储备液。
用EP管称取适量二性霉素B,按照二性霉素B(mg):DMSO(µL)=1:4的比例加入DMSO,在超声震荡器中加速溶解至其呈现澄清透明的橘黄色液体,然后置于-20οС冰箱中低温保存备用。
实验前用微量移液管吸取5µL二性霉素B的DMSO液加入到含5mL电极液的棕色小瓶内,适当吹打后经超声振荡助溶。
穿孔电极液中二性霉素B的终浓度为250µg/mL,其中DMSO的浓度为0.1%。
配制好的穿孔液转入用锡箔纸包裹的注射器后置于4οС冰箱中备用。
优点:与全细胞记录相比,该技术相比有如下优点①由抗生素形成的孔道对于等于或大于葡萄糖的分子均不能通过。
因此,在全细胞记录时可避免对胞内重要物质的渗析影响,通道电流衰减现象显著减慢,那些对细胞内通讯及通道调控具有重要作用的第二信使物质仍可正常运行。
②因抗生素形成的孔道对多价离子不通透,故胞内的这些离子的浓度就不受电极液的影响。
因此可在全细胞电流记录的同时用Ca2+染料测定胞内游离的Ca2+水平。
③对细胞的损伤作用明显小于微电极细胞内记录及膜片钳全细胞记录,记录时间可持续3小时。
④高阻封接不易被破坏,而全细胞记录的负压脉动式抽吸和电压脉冲易致高阻封接破坏。