膜片钳记录和分析技术
- 格式:doc
- 大小:145.50 KB
- 文档页数:7




膜片钳记录钠电流实验结果膜片钳是一种用于记录细胞膜上离子通道电流的实验技术。
在钠电流实验中,膜片钳被广泛应用于研究神经元细胞膜上的钠离子通道的活动。
本文将详细介绍如何使用膜片钳记录钠电流实验结果。
一、实验目的通过使用膜片钳记录钠电流,我们可以了解神经元细胞膜上钠离子通道的特性和功能。
具体而言,我们可以研究钠离子通道的开放概率、电流大小和动力学特性等。
二、实验材料和设备1. 膜片钳:包括一个玻璃微电极和一个放大器。
2. 玻璃微电极:用于穿刺神经元细胞膜,并记录离子通道电流。
3. 放大器:用于放大微弱的离子通道电流信号。
4. 实验室常规设备:显微镜、注射器、培养皿等。
三、实验步骤1. 准备工作:a. 准备好玻璃微电极。
将一根玻璃毛细管拉制成细微的一端,并用火烧熔封,形成一个小孔。
b. 准备好实验室常规设备,确保实验环境安全和卫生。
2. 细胞准备:a. 选择合适的细胞进行实验。
可以使用培养的原代神经元细胞或转染表达特定蛋白质的细胞系。
b. 将培养皿中的细胞置于显微镜下,选择一个健康、完整的细胞。
3. 穿刺膜片:a. 将玻璃微电极连接到放大器上,并调整放大器参数,使其适应记录离子通道电流信号。
b. 控制玻璃微电极接近选定的细胞,并轻轻穿刺膜片,使其与玻璃微电极相连。
c. 在穿刺过程中,需要注意保持薄膜完整性和稳定性。
4. 录制钠电流:a. 穿刺成功后,将放大器参数调整到合适的范围。
通常需要设置合适的增益、滤波和采样频率等参数。
b. 开始记录钠电流。
通过施加一系列不同电压的脉冲,可以激活和测量钠离子通道的电流。
c. 记录一段时间内的电流数据,并保存以备后续分析。
5. 数据分析:a. 使用适当的软件对记录的数据进行分析。
可以计算钠离子通道的开放概率、电流大小和动力学特性等。
b. 可以绘制电流-电压曲线(I-V曲线)来描述钠离子通道的特性。
c. 进一步分析和比较不同条件下钠离子通道活动的差异。
四、实验注意事项1. 实验环境应保持安静和稳定,以避免噪音干扰。

九洲健康咨询台供膜片钳记录和分析技术细胞是动物和人体的基本组成单元,细胞与细胞内的通信,是依靠其膜上的离子通道进行的,离子和离子通道是细胞兴奋的基础,亦即产生生物电信号的基础,生物电信号通常用电学或电子学方法进行测量。
由此形成了一门细胞学科-电生理学(electrophysiology),即是用电生理的方法来记录和分析细胞产生电的大小和规律的科学。
早期的研究多使用双电极电压钳技术作细胞内电活动的记录。
现代膜片钳技术是在电压钳技术的基础上发展起来的。
1976年德国马普生物物理研究所Neher和Sakmann创建了膜片钳技术(patch clamp recording technique)。
这是一种以记录通过离子通道的离子电流来反映细胞膜单一的(或多个的离子通道分子活动的技术)。
以后由于吉欧姆阻抗封接(gigaohm seal, 109W)方法的确立和几种方法的创建。
这种技术点燃了细胞和分子水平的生理学研究的革命之火,它和基因克隆技术(gene cloning)并架齐驱,给生命科学研究带来了巨大的前进动力。
这一伟大的贡献,使Neher和Sakmann获得1991年度的诺贝尔生理学与医学奖。
一、膜片钳技术发展历史1976年德国马普生物物理化学研究所Neher和Sakmann首次在青蛙肌细胞上用双电极钳制膜电位的同时,记录到ACh激活的单通道离子电流,从而产生了膜片钳技术。
1980年Sigworth等在记录电极内施加5-50cmH2O的负压吸引,得到10-100GW10-100G?的高阻封接(Giga-seal),大大降低了记录时的噪声实现了单根电极既钳制膜片电位又记录单通道电流的突破。
1981年Hamill和Neher等对该技术进行了改进,引进了膜片游离技术和全细胞记录技术,从而使该技术更趋完善,具有1pA的电流灵敏度、1µm的空间分辨率和10µs的时间分辨率。
1983年10月,《Single-Channel Recording》一书问世,奠定了膜片钳技术的里程碑。


常州细胞生物学脑定位膜片钳原理及步骤
常州细胞生物学脑定位膜片钳是一种用于记录神经元电活动的实验技术。
其原理为利用微型电极穿透细胞膜,直接记录细胞内外电位的变化,并通过程序控制电极的移动,定位到特定的神经元细胞上进行电生理实验分析。
具体步骤如下:
1. 制备膜片钳:制作玻璃微电极,并用火炬加热封闭一端,使其呈现一个微小的孔。
将另一端连接到电极放大器上。
2. 切取小鼠或大鼠脑组织:将小鼠或大鼠的脑组织切成薄片,并将其置于离心管中。
加入缓冲液处理,使脑片柔软并不断吸除液,去除脑组织中的血液和细胞间液。
3. 将片段放在实验器皿中:将制备好的膜片钳放入实验器皿中,将离心管中的脑片放在显微镜下,观察和定位神经元的位置。
4. 穿透细胞膜:通过微调玻璃微电极的位置,将其穿透神经元细胞膜,并记录细胞内外的电位变化。
5. 进行电生理实验:利用程序控制电极的移动,将膜片钳定位到具体的神经元细胞上进行离子通道电流和电势信号的测量。
6. 分析细胞电生理数据:通过数据分析软件对实验结果进行分析,了解神经元细胞的电生理特性和响应情况。
7. 记录实验结果:将数据记录下来,并用图表等方式展示实验结果,以便后续研究或发表论文。

膜片钳记录法(Patch Clamp Recording)是一种生理学实验技术,用于测量细胞膜离子通道或受体的电生理特性和活动。
该技术的基本原理是使用微型玻璃电极将一个非常小的玻璃管(称为膜片)贴附到单个细胞的表面上,从而形成一个微小的、高阻抗的突触点。
然后在膜片和细胞膜之间形成一个密封,并使用微电极或电极芯片记录跨越这个突触点的电位变化。
这种技术可以测量非常小的电流变化(尤其是亚毫安级别),因此非常适合研究离子通道和受体的活动。
通过控制细胞环境的情况,例如改变温度、pH值或添加化学物质,可以进一步调节离子通道和受体的电生理属性及其响应模式。
这种方法还可以用于研究各种细胞类型的电生理特性,包括神经元和心肌细胞等。
膜片钳记录法是一种十分精密的技术,在操作过程中需要非常小心谨慎,以避免损坏细胞或膜片。
同时,该技术需要一定的专业知识和设备支持,因此通常由有经验的生理学家和技术人员来执行。
总之,膜片钳记录法是一种重要的电生理技术,已经成为研究离子通道和受体的电生理学特性的关键工具之一,对于揭示神经、心血管等多种疾病的发病机制和治疗方法也具有重要意义。
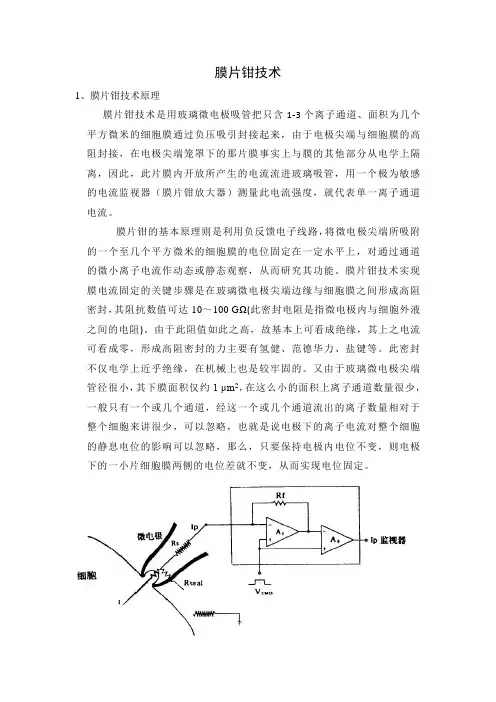
膜片钳技术1、膜片钳技术原理膜片钳技术是用玻璃微电极吸管把只含1-3个离子通道、面积为几个平方微米的细胞膜通过负压吸引封接起来,由于电极尖端与细胞膜的高阻封接,在电极尖端笼罩下的那片膜事实上与膜的其他部分从电学上隔离,因此,此片膜内开放所产生的电流流进玻璃吸管,用一个极为敏感的电流监视器(膜片钳放大器)测量此电流强度,就代表单一离子通道电流。
膜片钳的基本原理则是利用负反馈电子线路,将微电极尖端所吸附的一个至几个平方微米的细胞膜的电位固定在一定水平上,对通过通道的微小离子电流作动态或静态观察,从而研究其功能。
膜片钳技术实现膜电流固定的关键步骤是在玻璃微电极尖端边缘与细胞膜之间形成高阻密封,其阻抗数值可达10~100 GΩ(此密封电阻是指微电极内与细胞外液之间的电阻)。
由于此阻值如此之高,故基本上可看成绝缘,其上之电流可看成零,形成高阻密封的力主要有氢健、范德华力、盐键等。
此密封不仅电学上近乎绝缘,在机械上也是较牢固的。
又由于玻璃微电极尖端管径很小,其下膜面积仅约1 μm2,在这么小的面积上离子通道数量很少,一般只有一个或几个通道,经这一个或几个通道流出的离子数量相对于整个细胞来讲很少,可以忽略,也就是说电极下的离子电流对整个细胞的静息电位的影响可以忽略,那么,只要保持电极内电位不变,则电极下的一小片细胞膜两侧的电位差就不变,从而实现电位固定。
膜片钳技术的原理图[51]Rs是与膜片抗阻串联的局部串联电阻(或称入路阻抗),Rseal是封接阻抗。
RS通常为1~5MΩ,如果Rseal高达10GΩ以上是成为Ip/I=Rseal/(Rs+Rseal)-1。
此Ip可作为I~V转换器(点线)内的高阻抗负反馈电阻(Rf)的电压下降而被检测出。
实际上这是场效应管运算放大器(A1)的输出中包括着膜电阻成分,这部分将在通过第二级场效应管运算放大器(A2)时被减掉。
本实验采用的是全细胞记录模式。
全细胞记录构型(whole-cell recording)高阻封接形成后,继续以负压抽吸使电极管内细胞膜破裂,电极胞内液直接相通,而与浴槽液绝缘,这种形式称为“全细胞”记录。

郭静1611210748 北大深圳医院一.概念:膜片钳技术是一种通过微电极与细胞膜之间形成紧密接触的方法,采用电压钳或电流钳技术对生物膜上离子通道的电活动(尤其是可对单通道电流)进行记录的微电极技术。
二.应用:在一个细胞上检测多种离子通道用于离子通道电生理特性的研究研究受体及第二信使对通道活性的作用生理、药理机制研究中的应用三.常用的记录形式:(1) 细胞贴附式:高阻封接后的状态即为细胞贴附式模式,是在细胞内成分保持不变的情况下研究离子通道的活动,进行单通道电流记录。
即使改变细胞外液对电极膜片也没有影响。
(2) 膜内面向外式:在细胞贴附式状态下将电极向上提,电极尖端的膜片被撕下与细胞分离,形成细胞膜内面向外模式。
此时膜片内面直接接触浴槽液,灌流液成分的改变则相当于细胞内液的改变。
可进行单通道电流记录。
此模式下细胞质容易渗漏,影响通道电流的变化,如Ca2+ 通道的run-down 现象。
(3) 全细胞式记录:在细胞贴附式状态下增加负压吸引或者给予电压脉冲刺激,使电极尖端膜片在管口内破裂,即形成全细胞记录模式。
此时电极内液与细胞内液相通成为和细胞内电极记录同样的状态,不仅能记录一个整体细胞产生的电活动,并且通过电极进行膜电位固定,也可记录到全细胞膜离子电流。
这种方式可研究直径小于20μm 以下的小细胞的电活动;也可在电流钳制下测定细胞内电位。
(4) 膜外面向外式(outside-out mode):在全细胞模式状态下将电极向上提,使电极尖端的膜片与细胞分离后又粘合在一起,此时膜内面对电极内液,膜外接触的是灌流液。
可在改变细胞外液的情况下记录单通道电流。
四.全细胞膜片钳的记录过程:1.DRG神经元的急性分离2.玻璃微电极的制备3.计算机操作(1)打开膜片钳放大器(2)打开计算机,进入Patchmaster操作界面。
(3)单击“store”,选择好文件名和保存路径,单击“save”(4)单击“current clamp”,编辑所需的刺激模式。

膜片钳是一种常用于神经生理学研究中的技术工具,用于记录细胞膜电位和电流,从而了解神经细胞的功能和信号传递机制。
下面是一些常用的膜片钳全细胞记录方式:
1.空穴记录法:将膜片钳的微管插入到细胞内,以空穴为单位记录膜上电位。
2.全细胞当前记录法:将膜片钳的微管插入到细胞内,通过电压脉冲激活膜上离子通道,
记录电流和电压。
3.药物切断记录法:在浸润液中加入特定的药物,如Tetrodotoxin(TTX)或
Tetraethylammonium(TEA),可以切断细胞膜上特定的离子通道,从而更好地观察细胞的响应。
4.双电极电压钳法:使用两个电极对细胞进行记录,一个电极记录膜上电位,另一个电极
提供平衡电流,使得膜上电位不变。
5.模拟器记录法:使用模拟器对细胞膜施加电流和电压,观察细胞的响应。
以上是常用的膜片钳全细胞记录方式。
需要注意的是,在进行膜片钳实验时,需要精细的操作技巧和高质量的实验设备,同时还需要对结果进行仔细的分析和解释。
南京细胞生物学膜片钳电生理技术原理及步骤
南京细胞生物学膜片钳电生理技术是一种用于测量细胞膜电位和离子通道电流的重要技术。
其原理是利用微细玻璃针在单个细胞的膜上形成一个微小的穴孔,通过这个穴孔可以控制细胞膜内外的离子流动,并进行电位和离子电流的记录和分析。
具体步骤如下:
1. 准备工作:制备膜片钳装置,选择合适的细胞类型和培养条件。
2. 制备膜片:用注射器吸取一小块细胞培养皿上的细胞外液,然后把这个液珠吹到一块膜片上,用细胞外液倒置技术制备成一个密封的膜片。
3. 固定细胞:将选择的细胞放置在一支玻璃管内,用吸管吸入细胞培养液,使其浸润整个玻璃针。
4. 形成穴孔:在细胞膜上选定一个穴孔位置,将玻璃管快速向下移动,从而在细胞膜上形成一个穴孔。
5. 测量电位:将电极引入穴孔,通过随时间变化的电势变化来记录细胞膜的电位。
6. 测量电流:通过光学放大器将细胞膜内外离子的电流信号放大并记录下来。
需要注意的是,南京细胞生物学膜片钳电生理技术需要高超的技术和经验,操作方法需要谨慎,以保证实验结果的可靠性。
膜片钳实验技术脑片膜片钳实验方法文献综述一1966年,Yamamoto和McIlwain首次在脑片上记录了电生理活动(1966a, b),证实了脑组织在体外也能存活,并保持很好的活性状态。
此后,该方法在生理学研究中的应用越来越广泛,并为中枢神经系统生理和药理学领域突飞猛进的发展奠定了基础。
1989年,Blanton将脑片电生理记录与细胞的膜片钳记录结合起来,建立了脑片膜片钳记录技术,这为在细胞水平研究中枢神经系统离子通道或受体在神经环路中的生理和药理学作用及其机制提供了可能性。
在脑片电生理记录中,实验者可以按不同的实验目的直接准确地改变脑片灌流液的成份和条件,如温度、酸度和渗透压、通氧状态、以及离子通道或细胞信号转导通路的阻断剂等;另外,实验者还能借助显微镜准确地放置记录电极和刺激电极,同时,可借助一些特殊的加药装置,将一定浓度的药物加到整个脑片或是脑片上的特定区域上,研究电信号沿神经环路的传递规律。
在电生理学实验结束后,活性较好的脑片还可用于生物化学或解剖学的分析。
这些优点使实验者能获得准确的神经生理学的研究结果,也是其应用较在位大脑广泛的原因所在。
海马脑片是中枢神经系统研究中应用最为广泛标本之一。
其原因有以下几点:1、海马与脑的其它部位相对隔离,较易剥离,且剥离后受到的损伤较小;2、海马具有高度分化的片层结构,一方面,海马神经环路在片层中的分布有一定的空间规律,如锥体细胞胞体分布在锥体细胞层,而雪氏侧支突触分布于辐射层,且海马中存在一个三突触联系的回路,即穿通纤维-齿状回颗粒细胞层、苔状纤维-CA3区锥体细胞层、雪氏侧支-CA1区锥体细胞层等,因此,在海马中可以较准确地记录到特定神经元或突触的反应;另一方面,这种板层结构有利于解释在某一部位记录到的细胞外场电位的意义。
这些都使海马成为电生理学研究的理想标本。
本文对海马脑片膜片钳的操作规程及注意事项总结如下。
一、海马脑片的制备脑片制备中,海马分离应在断头后10分钟内完成,5~6分钟为宜。
膜片钳实验技术入门------基本原理与操作关兵才 李国华 刘理望按:本文乃于2003年根据较旧型号的仪器写成,后被《机能实验科学》 (郑先科主编,北大医学版,2006)收入。
因新旧仪器基本原理和操作步骤大同小异,现对原文略作修改和标注,供同学们参考。
【实验目的】1. 了解膜片钳技术的基本原理和操作。
2. 初步学习电压依赖性离子通道电流的基本记录方法。
【实验原理】一、膜片钳技术原理简介膜片钳(patch clamp)是一种主要用于检测细胞膜离子通道活动的电生理技术,按工作方式可区分为电压钳(voltage clamp)和电流钳是最基本的工作方式,即对细胞膜电位进行人为控制,如将膜电位钳制于某一固定水平,或在此基础上再施以阶跃(step)式或斜坡式(ramp)电压刺激,同时记录跨膜电流,从而分析细胞膜通道的活动。
电流钳即人为控制经微电极对细胞进行注射的电流(等于离子通道电流与细胞膜电容电流之和),同时记录膜电位及其变化。
若注射电流为零即常用的零位钳流,用于测量细胞膜静息电位,若注射方波脉冲刺激电流,用于诱发、观测动作电位。
另外,膜片钳技术还常用于观测细胞膜电容, 从而推测分泌细胞的活动情况。
下面主要介绍其电压钳工作方式的基本原理。
(注:在电生理资料中,因通常将细胞外液和记录系统的“地”点相连作为参考点即零电位点,所以电位和电压两个概念经常混用。
)根据膜片钳实验中受检细胞膜的型式(configuration)不同,又可将膜片钳分为全细胞式(whole-cell)、细胞贴附式(cell-attached 或on-cell)、内面朝外式(inside-out)、外面朝外式(outside-out)等四种模式。
(一)全细胞式1.电压钳制和电流记录的实现图9-9为全细胞式膜片钳工作原理示意图。
图9-9 全细胞膜片钳实验原理示意图A1:运算放大器;A2:单倍增益差动放大器;R f:反馈电阻;V p:电极电位(A1反向输入端电位);V c:A1同向输入端电位;C in:输入端杂散电容;C p:电极电容;Rs:串联电阻;C m:细胞膜电容;R m:细胞膜电阻;E m:细胞膜内在电位(指钳压时的细胞膜诸通道状态决定的内在Goldman-Hodgkin-Katz平衡电位);V o:A2输出端电位;V-offset:偏移电位补偿电位;C c:用于电容补偿的电容;V c(app):表观钳制电压即欲施加于受试膜片的电压;图中⊕和表示求和电路将充有电解质溶液的玻璃微电极(glass microelectrode或 recording pipette)利用负压紧密吸附于细胞表面,形成吉欧即千兆欧(109Ω)级高阻封接,进一步对微电极内施加负压、将放大器(以下简称运放)A1在深度负反馈工作状态下的“虚短路(virtual short circuit)”原理实现,即只要A1工作于线性范围内,其反向输入端的电位V p总是等于同向输入端的电位V c,这两个输入端之间虽非短路却类似于短路。
膜片钳记录和分析技术2010-12-15 16:41 来源:美国分子仪器点击次数:2186 关键词:膜片钳细胞信号分享到:∙收藏夹∙腾讯微博∙新浪微博∙开心网细胞是动物和人体的基本组成单元,细胞与细胞内的通信,是依靠其膜上的离子通道进行的,离子和离子通道是细胞兴奋的基础,亦即产生生物电信号的基础,生物电信号通常用电学或电子学方法进行测量。
由此形成了一门细胞学科-电生理学(electrophysiology),即是用电生理的方法来记录和分析细胞产生电的大小和规律的科学。
早期的研究多使用双电极电压钳技术作细胞内电活动的记录。
现代膜片钳技术是在电压钳技术的基础上发展起来的。
1976年德国马普生物物理研究所Neher和Sakmann创建了膜片钳技术(patch clamp recording technique)。
这是一种以记录通过离子通道的离子电流来反映细胞膜单一的(或多个的离子通道分子活动的技术)。
以后由于吉欧姆阻抗封接(gigaohm seal, 109W)方法的确立和几种方法的创建。
这种技术点燃了细胞和分子水平的生理学研究的革命之火,它和基因克隆技术(gene cloning)并架齐驱,给生命科学研究带来了巨大的前进动力。
这一伟大的贡献,使Neher和Sakmann获得1991年度的诺贝尔生理学与医学奖。
一、膜片钳技术发展历史1976年德国马普生物物理化学研究所Neher和Sakmann首次在青蛙肌细胞上用双电极钳制膜电位的同时,记录到ACh激活的单通道离子电流,从而产生了膜片钳技术。
1980年Sigworth等在记录电极内施加5-50 cmH2O的负压吸引,得到10-100GW10-100G?的高阻封接(Giga-seal),大大降低了记录时的噪声实现了单根电极既钳制膜片电位又记录单通道电流的突破。
1981年Hamill和Neher等对该技术进行了改进,引进了膜片游离技术和全细胞记录技术,从而使该技术更趋完善,具有1pA的电流灵敏度、1µm的空间分辨率和10µs的时间分辨率。
1983年10月,《Single-Channel Recording》一书问世,奠定了膜片钳技术的里程碑。
Sakmann 和Neher也因其杰出的工作和突出贡献,荣获1991年诺贝尔医学和生理学奖。
二、膜片钳技术原理膜片钳技术是用玻璃微电极吸管把只含1-3个离子通道、面积为几个平方微米的细胞膜通过负压吸引封接起来(见下图),由于电极尖端与细胞膜的高阻封接,在电极尖端笼罩下的那片膜事实上与膜的其他部分从电学上隔离,因此,此片膜内开放所产生的电流流进玻璃吸管,用一个极为敏感的电流监视器(膜片钳放大器)测量此电流强度,就代表单一离子通道电流。
膜片钳技术的建立,对生物学科学特别是神经科学是一资有重大意义的变革。
这是一种以记录通过离子通道的离子电流来反映细胞膜单一的(或多个的离子通道分子活动的技术。
些技术的出现自然将细胞水平和分子水平的生理学研究联系在一起,同时又将神经科学的不同分野必然地融汇在一起,改变了既往各个分野互不联系、互不渗透,阻碍人们全面认识能力的弊端。
这一技术的发现和基因克隆技术并架齐驱,给生命科学研究带来了巨大的前进动力。
三、全自动膜片钳技术膜片钳技术被称为研究离子通道的"金标准"。
是研究离子通道的最重要的技术。
目前膜片钳技术已从常规膜片钳技术(Conventional patch clamp technique)发展到全自动膜片钳技术(Automated patch clamp technique)。
传统膜片钳技术每次只能记录一个细胞(或一对细胞),对实验人员来说是一项耗时耗力的工作,它不适合在药物开发初期和中期进行大量化合物的筛选,也不适合需要记录大量细胞的基础实验研究。
全自动膜片钳技术的出现在很大程度上解决了这些问题,它不仅通量高,一次能记录几个甚至几十个细胞,而且从找细胞、形成封接、破膜等整个实验操作实现了自动化,免除了这些操作的复杂与困难。
这两个优点使得膜片钳技术的工作效率大大提高了!签于全自动膜片钳技术的这些优点,目前已经广泛的用于药物筛选。
四、膜片钳技术的应用1、应用学科膜片钳技术发展至今,已经成为现代细胞电生理的常规方法,它不仅可以作为基础生物医学研究的工具,而且直接或间接为临床医学研究服务,目前膜片钳技术广泛应用于神经(脑)科学、心血管科学、药理学、细胞生物学、病理生理学、中医药学、植物细胞生理学、运动生理等多学科领域研究。
随着全自动膜片钳技术(Automatic patch clamp technology)的出现,膜片钳技术因其具有的自动化、高通量特性,在药物研发、药物筛选中显示了强劲的生命力。
2、应用的标本种类使用的标本种类繁多。
从最早的肌细胞(心肌、平滑肌、骨骼肌)、神经元和内分泌细胞发展到血细胞、肝细胞、耳窝毛细胞、胃壁细胞、上皮细胞、内皮细胞、免疫细胞、精母细胞等多种细胞;从急性分散细胞和培养细胞(包括细胞株)发展到组织片(如脑片、脊髓片)乃至整体动物;从蜗牛、青蛙、蝾螈、爪蟾卵母细胞发展到鸡细胞、大鼠细胞、人细胞等等;从动物细胞发展到细菌、真菌以及植物细胞。
此外,膜片钳技术还广泛地应用到平面双分子层(Planar bilayer)、脂质体(Liposome)等人工标本上。
3、研究对象研究对象已经不局限于离子通道。
从对离子通道(配体门控性、电压门控性、第二信使介导的离子通道、机械敏感性离子通道以及缝隙连接通道等等)的研究发展到对离子泵、交换体以及可兴奋细胞的胞吞、胞吐机制的研究等。
4、应用举例:(1) 膜片钳技术在通道研究中的重要作用应用膜片钳技术可以直接观察和分辨单离子通道电流及其开闭时程、区分离子通道的离子选择性、同时可发现新的离子通道及亚型,并能在记录单细胞电流和全细胞电流的基础上进一步计算出细胞膜上的通道数和开放概率,还可以用以研究某些胞内或胞外物质对离子通道开闭及通道电流的影响等。
同时用于研究细胞信号的跨膜转导和细胞分泌机制。
结合分子克隆和定点突变技术,膜片钳技术可用于离子通道分子结构与生物学功能关系的研究。
利用膜片钳技术还可以用于药物在其靶受体上作用位点的分析。
如神经元烟碱受体为配体门控性离子通道,膜片钳全细胞记录技术通过记录烟碱诱发电流,可直观地反映出神经元烟碱受体活动的全过程,包括受体与其激动剂和拮抗剂的亲和力,离子通道开放、关闭的动力学特征及受体的失敏等活动。
使用膜片钳全细胞记录技术观察拮抗剂对烟碱受体激动剂量效曲线的影响,来确定其作用的动力学特征。
然后根据分析拮抗剂对受体失敏的影响,拮抗剂的作用是否有电压依赖性、使用依赖性等特点,可从功能上区分拮抗剂在烟碱受体上的不同作用位点,即判断拮抗剂是作用在受体的激动剂识别位点,离子通道抑或是其它的变构位点上。
(2) 与药物作用有关的心肌离子通道心肌细胞通过各种离子通道对膜电位和动作电位稳态的维持而保持正常的功能。
近年来,国外学者在人类心肌细胞离子通道特性的研究中取得了许多进展,使得心肌药理学实验由动物细胞模型向人心肌细胞成为可能。
(3) 对离子通道生理与病理情况下作用机制的研究通过对各种生理或病理情况下细胞膜某种离子通道特性的研究,了解该离子的生理意义及其在疾病过程中的作用机制。
如对钙离子在脑缺血神经细胞损害中作用机制的研究表明,缺血性脑损害过程中,Ca 2+ 介导现象起非常重要的作用,缺血缺氧使Ca2+通道开放,过多的Ca2+进入细胞内就出现Ca2+超载,导致神经元及细胞膜损害,膜转运功能障碍,严重的可使神经元坏死(4) 对单细胞形态与功能关系的研究将膜片钳技术与单细胞逆转录多聚酶链是反应技术结合,在全细胞膜片钳记录下,将单细胞内容物或整个细胞(包括细胞膜)吸入电极中,将细胞内存在的各种mRNA全部快速逆转录成cDNA,再经常规PCR扩增及待检的特异mRNA的检测,借此可对形态相似而电活动不同的结果做出分子水平的解释或为单细胞逆转录多聚酶链式反应提供标本,为同一结构中形态非常相似但功能不同的事实提供分子水平的解释。
目前国际上掌握此技术的实验室较少,我国北京大学神经科学研究所于1994年在国内率先开展。
(5) 对药物作用机制的研究在通道电流记录中,可分别于不同时间、不同部位(膜内或膜外)施加各种浓度的药物,研究它们对通道功能的可能影响,了解那些选择性作用于通道的药物影响人和动物生理功能的分子机理。
这是目前膜片钳技术应用最广泛的领域,既有对西药药物机制的探讨,也广泛用在重要药理的研究上。
如开丽等报道细胞贴附式膜片钳单通道记录法观测到人参二醇组皂苷可抑制正常和"缺血"诱导的大鼠大脑皮层神经元L-型钙通道的开放,从而减少钙内流,对缺血细胞可能有保护作用。
陈龙等报道采用细胞贴附式单通道记录法发现乌头碱对培养的Wistar大鼠心室肌细胞L-型钙通道有阻滞作用。
(6) 在心血管药理研究中的应用随着膜片钳技术在心血管方面的广泛应用,对血管疾病和药物作用的认识不仅得到了不断更新,而且在其病因学与药理学方面还形成了许多新的观点。
正如诺贝尔基金会在颁奖时所说:"Neher和Sadman n的贡献有利于了解不同疾病机理,为研制新的更为特效的药物开辟了道路"。
(7) 创新药物研究与高通量筛选目前在离子通道高通量筛选中主要是进行样品量大、筛选速度占优势、信息量要求不太高的初级筛选。
最近几年,分别形成了以膜片钳和荧光探针为基础的两大主流技术市场。
将电生理研究信息量大、灵敏度高等特点与自动化、微量化技术相结合,产生了自动化膜片钳等一些新技术。
五、厂家简介膜片钳技术的核心部分是膜片钳放大器系统,包括:膜片钳放大器(Amplifier)、数模/模数转换器(Digitizer)和数据采样和分析软件(Software)三个部分,共同完成离子通道电流的采集、处理和分析。
由于离子通道电流的大小通常是在pA 到nA 范围内,要记录如此微弱的通道电流信号,就需要特殊电路设计的膜片钳放大器和高精度、低噪声的数模/模数转换器。
在膜片放大器系统领域,美国MDC 公司生产的AXON 系列膜片钳放大器系统占有主导地位,无论从产品的技术含量还是从产品的应用领域上来看,在膜片钳技术中始终处于领先的地位,代表着膜片钳技术发展的方向,是国内外膜片钳实验室首选实验仪器,这可以从下面几个方面得到体现:1、专业的生产厂家AXON 是最早生产膜片钳放大器的厂家,从早期的1D 到200A,200B,700A,700B等传统膜片钳放大器,到今天的全自动膜片钳系统的开发和应用,始终引领着膜片钳技术的发展方向。
其pClamp10记录分析软件是一款功能全面强大的软件,可以满足膜片钳和电生理所有的需要。