广州电生理膜片钳原理
- 格式:docx
- 大小:10.84 KB
- 文档页数:2


膜片钳技术的基本原理膜片钳技术的基本原理膜片钳技术运用微玻管电极(膜片电极或膜片吸管)接触细胞膜,以千兆欧姆[gigaohm seal,1010欧姆(GΩ)]以上的阻抗使之对接,使与电极尖开口处相接的细胞膜小片区域(膜片)与其周围在电学上分隔,在此基础上固定电位,对此膜片上的离子通道的离子电流(pA 级)进行检测记录。
膜片钳技术的原理及应用(综述)Intro:细胞是构成生物体的基本单位。
细胞内和细胞之间的信号传导的重要途径是通过镶嵌在细胞膜上的离子通道蛋白进行的。
1976年,德国的两位细胞生物学家埃尔温. 内尔(Erwin Neher)和贝尔特. 萨克曼(Bert Sakmann)建立了一种以记录通过离子通道的离子电流来反映细胞膜上单一或多数离子通道分子活动的技术,成为膜片钳技术(Patch Clamp)。
这一技术使对细胞电活动的研究精度提高到1pA 的电流分辨率,1μm的空间分辨率和10μs的时间分辨率水平,是细胞和分子水平的生理学研究领域的一次革命性突破。
它与基因克隆技术(Gene Cloning)并驾齐驱,推动了生命科学研究的迅速发展。
为此,1991年的诺贝尔医学与生理学奖授予了这两位学者,以表彰他们的突出贡献。
这一能精确描述细胞通道特征的实验方法在问世后的短短十几年时间里,已经在生物学研究领域显示出了非常重要的意义和广阔的应用前景。
一. 膜片钳技术的基本原理膜片钳技术运用微玻管电极(膜片电极或膜片吸管)接触细胞膜,以千兆欧姆[gigaohm seal,1010欧姆(GΩ)]以上的阻抗使之对接,使与电极尖开口处相接的细胞膜小片区域(膜片)与其周围在电学上分隔,在此基础上固定电位,对此膜片上的离子通道的离子电流(pA 级)进行检测记录。
(如图1)图1 膜片钳技术原理图Rs是与膜片阻扰相串联的局部串联电阻(或称入路阻扰),Rseal 是封接阻抗。
Rs通常为1-5MΩ,若Rseal高达10GΩ以上时成为Ip/I=Rseal/(Rs+Rseal)-1,此Ip可作为在I-V转换器(点线)内的高阻扰反馈电阻(Rf)的电压下降而被检出。


膜片钳技术原理与基本操作1976 年Neher 和Sakmann 建立了膜片钳技术(Patch clamp technique),这是一种以记录通过离子通道的离子电流来反映细胞膜上单一的或多数的离子通道分子活动的技术。
1981 年Hamill, Neher 等人又对膜片钳实验方法和电子线路进行了改进,形成了当今广泛应用的膜片钳实验技术。
该技术可应用于许多细胞系的研究,也是目前唯一可记录一个蛋白分子电活动的方法,膜片钳技术和克隆技术并驾齐驱给生命科学研究带来了巨大的前进动力,这一伟大的贡献,使Neher 和Sakmann 获得1991 年诺贝尔医学与生理学奖。
一、膜片钳技术的基本原理用一个尖端直径在1.5~3.0μm 的玻璃微电极接触细胞膜表面,通过负压吸引使电极尖端与细胞膜之间形成千兆欧姆以上的阻抗封接,此时电极尖端下的细胞膜小区域(膜片,patch)与其周围在电学上分隔,在此基础上固定(钳制,Clamp)电位,对此膜片上的离子通道的离子电流进行监测及记录。
基本的仪器设备有膜片钳放大器、计算机、倒置显微镜、示波器、双步电极拉制器、三轴液压显微操纵器、屏蔽防震实验台、恒温标本灌流槽、玻璃微电极研磨器。
膜片钳放大器是离子单通道测定和全细胞记录的关键设备,具有高灵敏度、高增益、低噪音及高输入阻抗。
膜片钳放大器是通过单根电极对细胞或膜片进行钳制的同时记录离子流经通道所产生的电流。
膜片钳放大器的核心部分是以运算放大器和反馈电阻构成的电流-电压(I-V)转换器,运算放大器作为电压控制器自动控制,使钳制电位稳定在一定的水平上。
二、操作步骤1.膜片钳微电极制作(1) 玻璃毛细管的选择:有二种玻璃类型,一是软质的苏打玻璃,另一是硬质的硼硅酸盐玻璃。
软质玻璃在拉制和抛光成弹头形尖端时锥度陡直,可降低电极的串联电阻,对膜片钳的全细胞记录模式很有利;硬质玻璃的噪声低,在单通道记录时多选用。
玻璃毛细管的直径应符合电极支架的规格,一般外部直径在1.1~1.2mm。



膜片钳记录法(Patch Clamp Recording)是一种生理学实验技术,用于测量细胞膜离子通道或受体的电生理特性和活动。
该技术的基本原理是使用微型玻璃电极将一个非常小的玻璃管(称为膜片)贴附到单个细胞的表面上,从而形成一个微小的、高阻抗的突触点。
然后在膜片和细胞膜之间形成一个密封,并使用微电极或电极芯片记录跨越这个突触点的电位变化。
这种技术可以测量非常小的电流变化(尤其是亚毫安级别),因此非常适合研究离子通道和受体的活动。
通过控制细胞环境的情况,例如改变温度、pH值或添加化学物质,可以进一步调节离子通道和受体的电生理属性及其响应模式。
这种方法还可以用于研究各种细胞类型的电生理特性,包括神经元和心肌细胞等。
膜片钳记录法是一种十分精密的技术,在操作过程中需要非常小心谨慎,以避免损坏细胞或膜片。
同时,该技术需要一定的专业知识和设备支持,因此通常由有经验的生理学家和技术人员来执行。
总之,膜片钳记录法是一种重要的电生理技术,已经成为研究离子通道和受体的电生理学特性的关键工具之一,对于揭示神经、心血管等多种疾病的发病机制和治疗方法也具有重要意义。
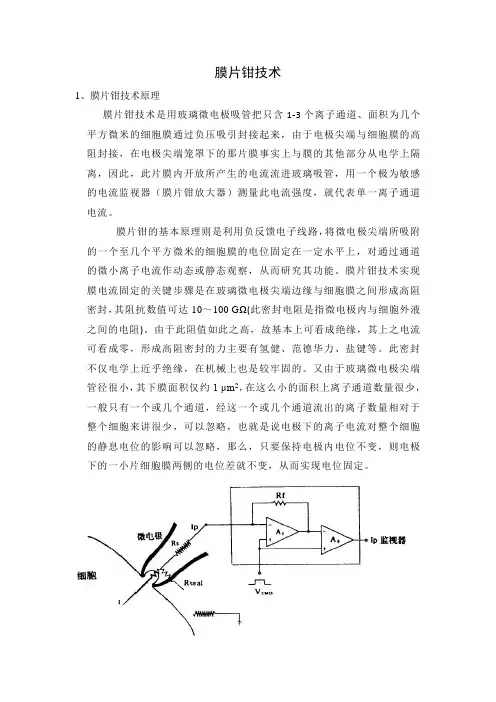
膜片钳技术1、膜片钳技术原理膜片钳技术是用玻璃微电极吸管把只含1-3个离子通道、面积为几个平方微米的细胞膜通过负压吸引封接起来,由于电极尖端与细胞膜的高阻封接,在电极尖端笼罩下的那片膜事实上与膜的其他部分从电学上隔离,因此,此片膜内开放所产生的电流流进玻璃吸管,用一个极为敏感的电流监视器(膜片钳放大器)测量此电流强度,就代表单一离子通道电流。
膜片钳的基本原理则是利用负反馈电子线路,将微电极尖端所吸附的一个至几个平方微米的细胞膜的电位固定在一定水平上,对通过通道的微小离子电流作动态或静态观察,从而研究其功能。
膜片钳技术实现膜电流固定的关键步骤是在玻璃微电极尖端边缘与细胞膜之间形成高阻密封,其阻抗数值可达10~100 GΩ(此密封电阻是指微电极内与细胞外液之间的电阻)。
由于此阻值如此之高,故基本上可看成绝缘,其上之电流可看成零,形成高阻密封的力主要有氢健、范德华力、盐键等。
此密封不仅电学上近乎绝缘,在机械上也是较牢固的。
又由于玻璃微电极尖端管径很小,其下膜面积仅约1 μm2,在这么小的面积上离子通道数量很少,一般只有一个或几个通道,经这一个或几个通道流出的离子数量相对于整个细胞来讲很少,可以忽略,也就是说电极下的离子电流对整个细胞的静息电位的影响可以忽略,那么,只要保持电极内电位不变,则电极下的一小片细胞膜两侧的电位差就不变,从而实现电位固定。
膜片钳技术的原理图[51]Rs是与膜片抗阻串联的局部串联电阻(或称入路阻抗),Rseal是封接阻抗。
RS通常为1~5MΩ,如果Rseal高达10GΩ以上是成为Ip/I=Rseal/(Rs+Rseal)-1。
此Ip可作为I~V转换器(点线)内的高阻抗负反馈电阻(Rf)的电压下降而被检测出。
实际上这是场效应管运算放大器(A1)的输出中包括着膜电阻成分,这部分将在通过第二级场效应管运算放大器(A2)时被减掉。
本实验采用的是全细胞记录模式。
全细胞记录构型(whole-cell recording)高阻封接形成后,继续以负压抽吸使电极管内细胞膜破裂,电极胞内液直接相通,而与浴槽液绝缘,这种形式称为“全细胞”记录。

广州细胞生物学膜片钳电生理技术原理
膜片钳电生理技术是一种记录单个细胞或亚细胞电生理活动的方法。
其原理是利用玻璃膜片将电极与细胞膜间隔开,形成一个微型细胞质突起,称为膜片钳。
在膜片钳的控制下,能够在缺氧水剂下保存细胞,使得电极能够记录到细胞的电活动信号。
膜片钳技术是通过将精细的电子测量技术应用于生物膜的研究来揭示细胞的电生理活动。
底部的电极通过玻璃杆和吸盘进入细胞,并形成一个不透明的,含有许多离子通道的孔,称为膜片。
这种技术可以通过放置离子通道调节剂在膜片上,从而控制细胞内离子通道的打开或关闭,以观察和解析细胞膜电势以及离子流动的变化和机制。
膜片管电生理技术常用于研究包括细胞膜静息膜电势、兴奋性质和传感器响应等生理过程,还用于研究神经元膜上参与神经递质释放或细胞内导致细胞凋亡的离子通道等多个研究领域。

膜片钳技术及其在神经科学研究中的应用膜片钳技术是一种在神经科学研究中广泛应用的技术,它可以用来记录和操纵神经元的电活动,为研究神经系统的功能和疾病提供重要的工具。
本文将介绍膜片钳技术的原理和应用,并探讨其在神经科学研究中的重要性。
膜片钳技术是一种通过在神经元的细胞膜上形成一个微小的孔洞,并利用微电极记录神经元内外的电位差的方法。
这种技术可以精确地记录神经元的动作电位,从而了解神经元的兴奋性和抑制性。
膜片钳技术的原理基于电生理学的基本原理,即神经元的电活动是由离子通道的开关控制的。
通过在神经元膜上形成一个微小的孔洞,可以通过微电极记录到神经元内外的电位差,从而了解离子通道的开关状态和神经元的电活动。
膜片钳技术在神经科学研究中有广泛的应用。
首先,它可以用来研究神经元的膜电位和动作电位。
研究人员可以通过在神经元膜上形成一个微小的孔洞,并利用膜片钳记录到神经元内外的电位差,从而了解神经元的电活动。
这对于研究神经元的兴奋性和抑制性非常重要,有助于理解神经元的工作原理和信息传递过程。
膜片钳技术还可以用来研究离子通道的功能。
离子通道是神经元膜上的蛋白质通道,它们控制着离子在神经元膜上的通透性,从而调节神经元的电活动。
通过利用膜片钳技术,研究人员可以记录到离子通道的电流,并分析离子通道的开关状态和功能特性。
这对于研究离子通道的结构和功能非常重要,有助于揭示离子通道与神经系统功能和疾病之间的关系。
膜片钳技术还可以用来研究突触传递和突触可塑性。
突触是神经元之间的连接点,通过突触传递神经信号。
膜片钳技术可以用来记录到突触传递的电位变化,并研究突触的功能特性和可塑性。
这对于理解神经系统的信息传递和学习记忆等高级功能非常重要。
在神经科学研究中,膜片钳技术的应用还包括单细胞蛋白质表达、药物筛选和基因编辑等方面。
通过将膜片钳技术与其他技术结合,研究人员可以进一步探索神经系统的功能和疾病机制,为神经科学研究提供更加全面和深入的理解。

细胞电生理学基本原理与膜片钳技术细胞电生理学是研究细胞内外电流、电压变化以及与生物学功能的关系的学科。
而膜片钳技术则是细胞电生理学中最重要的实验技术之一,用于测量细胞膜上离子通道的电流。
细胞电生理学的基本原理是通过测量细胞膜上的电位变化来研究细胞内外离子的分布和运动。
细胞膜是由脂质双层组成的,其中包含了各种离子通道和离子泵,这些离子通道和泵的开闭状态会导致细胞内外离子浓度的变化,从而产生电位的变化。
膜片钳技术是一种高精度的电生理记录技术,通过将玻璃微电极与细胞膜紧密接触,形成一个微小的隔离空间,从而可以测量细胞膜上的电位变化。
膜片钳技术主要包括两种形式:全细胞膜片钳和单通道膜片钳。
全细胞膜片钳技术是将玻璃微电极与细胞膜上的一个小区域接触,通过控制微电极与细胞膜的紧密接触程度,形成一个微小的隔离空间,从而可以记录到整个细胞膜上的电位变化。
全细胞膜片钳技术可以用来研究细胞内外离子浓度的变化、离子通道的活性以及细胞内外离子的转运等。
单通道膜片钳技术是将玻璃微电极与细胞膜上的某一个离子通道接触,通过控制微电极与细胞膜的紧密接触程度,形成一个微小的隔离空间,从而可以记录到单个离子通道的电流变化。
单通道膜片钳技术可以用来研究离子通道的电导率、选择性以及开闭状态等。
膜片钳技术的关键是保持微电极与细胞膜的紧密接触,这需要一定的技术和经验。
在进行膜片钳实验时,需要注意控制微电极与细胞膜的距离、微电极的阻抗以及细胞膜的稳定性等因素,以确保记录到准确的电位变化或电流变化。
膜片钳技术的应用非常广泛。
它可以用来研究离子通道的结构和功能,揭示离子通道与各种生物学功能的关系。
比如,通过记录钠通道的电流变化,可以研究神经细胞的兴奋性和抑制性传递过程;通过记录钾通道的电流变化,可以研究细胞的稳定性和兴奋性调节等。
膜片钳技术还可以用于药物筛选和药理学研究。
通过记录离子通道的电流变化,可以评估不同药物对离子通道的影响,从而筛选出具有特定药理作用的药物。
(一)膜片钳技术的基本原理:膜片钳技术是用尖端直径1~2μm的玻璃微电极吸管与经蛋白酶处理干净的细胞膜接触,通过20~30cm H2O的负压吸引造成电极尖端与细胞膜形成高阻封接(10~100GΩ),使电极尖端下的小块膜片与膜的其它部分在电学上绝缘,并在此基础上固定膜片电位,监测几个μm2膜片上1~3个离子通道活动的方法。
高阻封接的形成:高阻封接形成与否是记录细胞离子通道电流能否成功的前提,是进行膜片钳实验的关键一步。
微电极尖端与细胞膜形成封接的过程,可以采用软件或刺激器发出一个脉冲电压作用于微电极,造成膜两侧电位差发生变化,产生电极电流,再通过示波器或显示屏,观察电极电流幅度的变化来确定封接程度。
在电极未入溶液之前,在显示器或示波器上可见一直线。
当电极入液后,软件或刺激器发出的电脉冲经记录微电极、浴液及参考电极形成回路,1mV的封接电压流径5MΩ的电极阻抗,则会产生0.2nA的电流浮动,随着微电极尖端接近、接触细胞膜,电极电阻则进一步增加,而电流幅度则随之减小,当在显示器或示波器上看到电流方波变为直线时,则形成低阻封接(50MΩ),然后经微电极给予负压(-10~-30cm H2O),即可形成高阻封接。
再将电脉冲调为10mV,调节快、慢电容电流补偿,消除电容电流,就可进行细胞贴附式膜片钳实验,如果在此基础上再次给予负压或电脉冲,使微电极尖端下膜片破裂,则形成全细胞式。
进行高阻封接时,需注意的是:①在微电极未入液之前常施以正压,使电极内有液体从电极尖端流出,防止浴液表面灰尘或溶液中粒子附着于电极尖端,影响高阻封接。
②如果微电极尖端与细胞膜接触后,仍不能形成高阻封接,则电极即不能再用,需重新换一根微电极继续封接。
③电极尖端与细胞膜接触,稍加负压后电流波形变得平坦,此时,如使电极超极化,则有助于加速形成高阻封接。
④电极入液后封接的成功率与入浴液后的时间呈反比,电极内液中的肽类或蛋白质成分也会有碍于封接形成。
膜片钳实验技术入门------基本原理与操作关兵才 李国华 刘理望按:本文乃于2003年根据较旧型号的仪器写成,后被《机能实验科学》 (郑先科主编,北大医学版,2006)收入。
因新旧仪器基本原理和操作步骤大同小异,现对原文略作修改和标注,供同学们参考。
【实验目的】1. 了解膜片钳技术的基本原理和操作。
2. 初步学习电压依赖性离子通道电流的基本记录方法。
【实验原理】一、膜片钳技术原理简介膜片钳(patch clamp)是一种主要用于检测细胞膜离子通道活动的电生理技术,按工作方式可区分为电压钳(voltage clamp)和电流钳是最基本的工作方式,即对细胞膜电位进行人为控制,如将膜电位钳制于某一固定水平,或在此基础上再施以阶跃(step)式或斜坡式(ramp)电压刺激,同时记录跨膜电流,从而分析细胞膜通道的活动。
电流钳即人为控制经微电极对细胞进行注射的电流(等于离子通道电流与细胞膜电容电流之和),同时记录膜电位及其变化。
若注射电流为零即常用的零位钳流,用于测量细胞膜静息电位,若注射方波脉冲刺激电流,用于诱发、观测动作电位。
另外,膜片钳技术还常用于观测细胞膜电容, 从而推测分泌细胞的活动情况。
下面主要介绍其电压钳工作方式的基本原理。
(注:在电生理资料中,因通常将细胞外液和记录系统的“地”点相连作为参考点即零电位点,所以电位和电压两个概念经常混用。
)根据膜片钳实验中受检细胞膜的型式(configuration)不同,又可将膜片钳分为全细胞式(whole-cell)、细胞贴附式(cell-attached 或on-cell)、内面朝外式(inside-out)、外面朝外式(outside-out)等四种模式。
(一)全细胞式1.电压钳制和电流记录的实现图9-9为全细胞式膜片钳工作原理示意图。
图9-9 全细胞膜片钳实验原理示意图A1:运算放大器;A2:单倍增益差动放大器;R f:反馈电阻;V p:电极电位(A1反向输入端电位);V c:A1同向输入端电位;C in:输入端杂散电容;C p:电极电容;Rs:串联电阻;C m:细胞膜电容;R m:细胞膜电阻;E m:细胞膜内在电位(指钳压时的细胞膜诸通道状态决定的内在Goldman-Hodgkin-Katz平衡电位);V o:A2输出端电位;V-offset:偏移电位补偿电位;C c:用于电容补偿的电容;V c(app):表观钳制电压即欲施加于受试膜片的电压;图中⊕和表示求和电路将充有电解质溶液的玻璃微电极(glass microelectrode或 recording pipette)利用负压紧密吸附于细胞表面,形成吉欧即千兆欧(109Ω)级高阻封接,进一步对微电极内施加负压、将放大器(以下简称运放)A1在深度负反馈工作状态下的“虚短路(virtual short circuit)”原理实现,即只要A1工作于线性范围内,其反向输入端的电位V p总是等于同向输入端的电位V c,这两个输入端之间虽非短路却类似于短路。
广州电生理膜片钳原理
一、膜片钳技术简介
膜片钳技术是一种用于记录单个细胞或亚细胞电生理活动的方法。
它通过在细胞膜上形成一个小型突起,称为膜片,以隔离细胞膜和电极之间的直接接触。
这种技术使得科学家能够精确地测量细胞膜电位的变化,进而研究细胞的功能和生理过程。
二、广州电生理膜片钳原理详解
在膜片钳的控制下,一个被称为玻璃膜片的薄而坚硬的玻璃片将电极与细胞膜间隔开。
这使得电极能够记录到细胞的电活动信号,而不会干扰细胞膜的电位。
同时,膜片钳技术还能保护细胞免受电极插入引起的损伤。
此外,在缺氧水剂下保存细胞是膜片钳技术的另一个重要特点。
这种方法可以保持细胞的活性和完整性,使得电极能够记录到更加真实和可靠的细胞电活动信号。
因此,广州电生理膜片钳是一种高效、准确的电生理记录技术,被广泛应用于神经科学、心血管研究等领域。
三、广州电生理膜片钳技术的应用
广州电生理膜片钳技术在神经科学领域的应用主要包括研究神经元电活动、离子通道功能以及神经递质的释放和转运等。
此外,在心血管研究领域,该技术也被用于研究心肌细胞的电活动和离子通道功能等。
总之,广州电生理膜片钳技术是一种重要的电生理记录技术,能够精确地测量细胞膜电位的变化,进而研究细胞的功能和生理过程。
它具有高精度、高保真度和高可靠性等优点,被广泛应用于神经科学、心血管研究等领域。