核心的化学概念知识及教学共33页文档
- 格式:ppt
- 大小:3.67 MB
- 文档页数:17
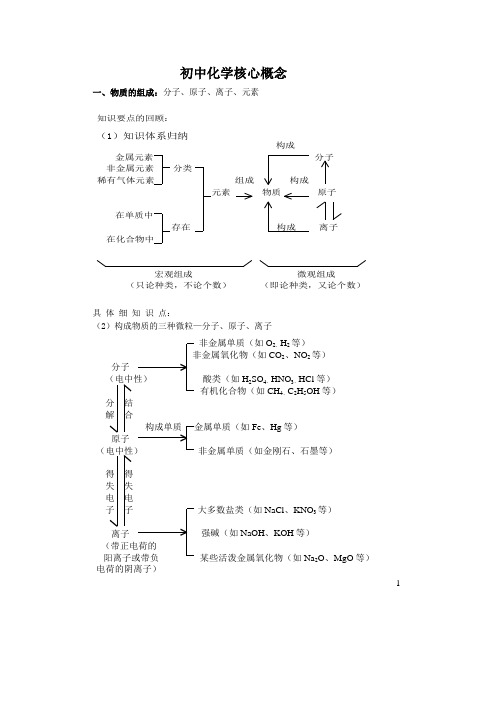
初中化学核心概念一、物质的组成:分子、原子、离子、元素知识要点的回顾:构成金属元素分子非金属元素分类稀有气体元素组成构成元素物质原子在单质中存在构成离子在化合物中宏观组成微观组成(只论种类,不论个数)(即论种类,又论个数)(1)知识体系归纳具 体 细 知 识 点:(2)构成物质的三种微粒—分子、原子、离子非金属单质(如O 2、H 2等)非金属氧化物(如CO 2、NO 2等)分子(电中性)酸类(如H 2SO 4、HNO 3、HCl 等)有机化合物(如CH 4、C 2H 5OH 等)分结解合构成单质金属单质(如Fe 、Hg 等)原子(电中性)非金属单质(如金刚石、石墨等)得得失失电电子子大多数盐类(如NaCl 、KNO 3等)强碱(如NaOH 、KOH 等)(带正电荷的阳离子或带负某些活泼金属氧化物(如Na 2O 、MgO 等)电荷的阴离子)离子1(3) 元素与原子的比较:元素原子区别(1)元素只能以"种类”分,,没有“个数”之分(2)元素是宏观名称(3)元素只能组成物质,不能构成分子或原子(4)任何化学反应中元素的种类不变①原子既有种类之分,又有“个数”之分②原子是微观粒子③原子是构成物质的一种微粒,也可构成分子④化学反应中可以组成分子等微粒相互联系元素是质子数相同的同一类原子的总称。
原子是元素的个体,体现元素性质最小单位。
(4) 分子与原子的比较:分子原子本质区别在化学反应中可以分成原子在化学反应中不能再分不同点构成物质情况分子能直接构成物质原子也能直接构成物质,但分子又是由原子构成的相同点①质量和体积都很小;②都在不停地运动;③微粒间都有一定的间隔,都是构成物质的微;④同种微粒性质相同,不同种微粒性质不同注意点(1)分子是保持物质化学性质的一种微粒。
原子是化学变化中的最小微粒(2)分子是由原子构成的,原子是由原子核和核外电子构成的(5)原子与离子的比较:微粒结构电性微粒名称符号结构示意图原子核电荷数=核外电子总数不显电性原子Ne28+10阳离子核电荷数>核外电子总数带正电钠离子Na+28+11离子阴离子核电荷数<核外电子总数带负电氯离子Cl-28+178原子和离子的相互转变阳离子得电子原子得电子阴离子失电子失电子2二、物质结构的初步知识:原子的构成(B)、核外电子排布(A)、 化合价(化合价和化学式的关系 C )1、知识点回顾:电性电量相对质量质子带正电 1 1中子不带电 0 1带负电1 1/1836核外电子原子核原子核外电子排布初步化合物的形成化合价分层排布每层电子数离子化合物共价化合物(1)离子符号与元素(原子团)化合价表示法:化合价离子电荷标号不同正负号写在数字前面+1,+2,+3,―1,―2,―3正负号写在数字后面2+,3+,2-,3-(1省略不写)标号位置不同标在元素符号正上方H 2,Na,Mg,O,Cl,OH,SO 4标在元素符号右上角Na +、Cl -、Mg 2+、O 2-、OH -、SO 42-区别意义不同元素的原子在化学变化时所表现的一种性质表示离子所带电荷的电性和电量联系离子所带电荷的正负及数值与该元素(或根)的化合价的正负及价数相同钠原子结构示意图:钠离子结构示意图:核外电子层原子核(2)原子(离子)结构示意图:28+11128+11该层上的电子数核电荷数三、物质的分类:基础知识 (理解单质、化合物的概念;其余是了解层次;要求能判断常见物质的类别)(1)纯净物混合物纯净物混合物由一种物质组成由两种或多种物质混合而成有固定不变的组成没有一定的组成能用一个化学式表示不可用一个化学式表示不同点有一定的物理性质和化学性质没有固定的性质、和物质保持原有的化学性质举例氧气、氯酸钾、水等泥土、海水、空气、溶液等联系纯净物不同种物质简单混合混合物用过滤、结晶方法分离(2)单质化合物单质概念由同种元素组成的纯净物由不同种元素组成的纯净物分类按性质分:金属(Cu 、Fe 、Ag 、等)非金属(如O 2、H 2、等)、稀有气体(如He 、Ar 等)无机化合物:酸、碱、盐、氧化物有机化合物:如CH 4C 2H 5OH 等联系某些不同单质通过化合反应单质化合物某些化合物在一定条件下分解化合物混合物:如金属单质:物质单质非金属单质:纯净物化合物从结构上分从组成上分离子化合物共价化合物有机化合物无机化合物碱盐稀有气体:::::可溶性碱不溶性碱正盐酸式盐碱式盐氧化物酸性氧化物碱性氧化物其它氧化物酸含氧酸无氧酸:::::::::3 4(3)关于氧化物的分类氧化物按组成分按性质分金属氧化物(如CuO等)非金属氧化物(如SO 2等)碱性氧化物(如CaO等)酸性氧化物(如CO 2等)(4)酸碱盐概念分类酸电离时生成的阳离子全部是H +的化合物按酸分子中是否有氧原子分:含氧酸-H 2SO 4、HNO 3无氧酸-HCL 、H 2S 酸分子电离生成H +个数分:一元酸-HNO 3、HCL 二元酸-H 2CO 3、H 2SO 4三元酸-H 3PO 4碱电离时生成的阴离子全部是OH –的化合物按溶解性分:可溶解性碱-NaOH 、KOH 不熔性碱-Cu(OH)2、Fe(OH)3盐由金属离子和酸根离子组成的化合物根据组成不同分:正盐-Na 2SO 4、K 2CO 3、CuCL 2酸式盐-NaHCO 3、NaHSO 4碱式盐-Cu 2(OH)2CO3四、物质的性质和变化: (一)物质的性质和变化 1、物质的性质物理性质:物质不需要发生化学变化就能表现出来的性质例如:颜色、状态、气味、熔点、沸点、密度、硬度、溶解性等 化学性质:物质在化学变化中表现出来的性质例如:氧化性、还原性、酸性、碱性、可燃性、稳定性等 2、物质的变化物理变化:没有新物质生成的变化化学变化:有新物质生成的变化,又称化学反应。


初中化学知识点的核心概念归纳化学是一门探索物质性质和变化规律的科学,它研究物质的组成、性质以及与其他物质的相互作用。
作为中学阶段的学科,初中化学旨在培养学生的观察、实验和思考能力,帮助学生理解物质世界的奥秘。
为了更好地理解初中化学知识,下面将对初中化学的核心概念进行归纳总结。
1. 物质与分子物质是组成自然界一切物体的基本元素。
在初中化学中,我们需要了解物质的组成和性质。
物质可以分为单质和化合物。
单质是由同一种元素组成的物质,如金属、非金属等。
化合物是由两种或多种不同元素的原子组成的物质,如氧气、水等。
化学式是用化学符号表示化合物中元素的种类和个数的方法。
分子是组成物质的最小粒子,可以由一个或多个原子组成。
2. 元素与周期表元素是组成物质的基本单位,由一种类型的原子组成。
从这一层面看,化学可以被认为是研究元素及其组合的科学。
元素以原子符号表示,如氢(H)、氧(O)等。
世界上已知的元素共有118种,这些元素根据其性质被归类为不同的组,组成了周期表。
周期表按照一定的规则排列了所有的元素。
通过周期表,我们可以了解元素的性质、周期性规律和元素之间的关系。
3. 化学反应与化学方程式化学反应是指物质之间的转化过程,反应物经过化学变化形成产物。
我们通过化学方程式来描述化学反应。
化学方程式由反应物、产物和化学反应条件组成。
反应物位于方程式的左侧,产物位于方程式的右侧,中间用箭头表示反应方向。
化学方程式也能够表示反应物的质量比例。
4. 酸碱与pH值酸碱是常见的化学性质之一。
酸是指能够产生氢离子的物质,而碱是指能够产生氢氧离子的物质。
酸碱指示剂是用于检测酸碱性质的物质,根据颜色的变化来判断溶液的酸碱性。
pH值是衡量溶液酸碱性的指标,pH小于7的溶液为酸性,pH 大于7的溶液为碱性,pH等于7的溶液为中性。
5. 氧化还原与电化学氧化还原是指物质中的原子失去或获取电子的过程。
氧化作用是指物质失去电子,而还原作用是指物质获取电子。


化学知识点总结doc化学是一门自然科学,研究物质的组成、性质、结构、变化规律以及能量变化的学科。
化学知识是我们理解世界的基础,应用非常广泛。
化学知识点包括物质的基本性质、化学键、化学反应、化学平衡、酸碱中和、化学物质的分类等方面。
下面将就这些知识点进行总结。
一、物质的基本性质1.1 物质的物理性质物质的物理性质是指物质不发生化学变化时所表现出来的性质。
常见的物理性质包括密度、颜色、硬度、电导率、熔点、沸点等。
这些物理性质可以用来鉴别物质、判断物质的纯度、获得物质的一些重要信息。
1.2 物质的化学性质物质的化学性质是指物质在与其他物质反应时所表现出来的性质。
比如可燃性、氧化性、还原性、腐蚀性等。
化学性质决定了物质在化学反应中的行为和特性。
通过研究物质的化学性质,可以了解物质的内部结构和相互作用。
1.3 物质的结构和组成物质的结构和组成决定了其所有的性质和行为。
分子和原子是物质的基本组成单元,不同的分子和原子组合产生了多样的物质,形成了丰富的物质世界。
通过研究物质的结构和组成,可以了解物质的性质和行为规律。
二、化学键2.1 化学键的概念化学键是由原子之间的相互作用形成的。
在化学键中,原子通过共享电子、捐赠电子或者接受电子来共享或转移电荷,形成了稳定的化合物。
不同的化学键包括共价键、离子键、金属键等。
2.2 共价键共价键是由原子之间的电子共享形成的化学键。
在共价键中,两个原子通过共享电子对来维持相互间的吸引力,形成稳定的分子。
共价键的强度一般比较大,在化学反应中不容易断裂。
共价键是有机化合物、无机分子化合物以及大多数固体的重要化学键。
2.3 离子键离子键是由正负电荷之间的静电吸引力形成的化学键。
在离子键中,金属原子通常失去电子,成为正离子;非金属原子通常接受电子,成为负离子。
正负离子之间的吸引力形成了离子晶体,是离子化合物的重要化学键。
2.4 金属键金属键是由金属原子之间的电子“海洋”形成的化学键。
在金属键中,金属原子失去部分外层电子,形成正电荷的金属离子。

初中化学基本概念大全.doc一、物质的物理变化和化学变化1. 物理变化:指物质在保持化学成分不变的情况下,其形态、状态、性质等物理特征发生改变的现象。
2. 化学变化:指物质在化学反应过程中,原有物质的分子结构、化学成分等发生改变的现象。
(1)物理变化只改变物质的外观和性质,但不改变其化学成分和分子结构;化学变化会使物质的化学成分和分子结构发生改变。
(2)物理变化中,物质的质量、密度、体积等物理特征通常不会发生变化;化学变化中,物质的质量、密度、体积等物理特征都可能发生改变。
二、元素和化合物1. 元素:指由相同原子构成的种类纯净物质,无法通过化学反应分解成更简单的物质。
2. 化合物:指由不同元素化合形成的、具有特定化学成分的纯净物质。
3. 元素和化合物的区别:(1)元素是最基本的物质单位,不能被分解成其他物质;化合物由不同元素结合而成,可以通过化学反应分解成其它物质。
(2)元素在自然界中基本保持不变;化合物可以在化学反应中被合成或分解。
三、化学式和化学方程式1. 化学式:用符号表示化合物中元素种类和原子数量的一种符号表示方式。
2. 化学方程式:描述化学反应过程中反应物和生成物之间的化学变化,反应物与生成物之间的数量关系用化学式表示的表达式。
(1)化学式表示化合物的组成,而化学方程式描述化学反应的过程。
四、物质的分类3. 物质的分类是根据其化学成分和化学性质进行分析的,不同种类的物质在实验上展现不同的性质和特征,而分类则给人们提供了认识和研究物质的基础。
五、物质的性质2. 化学性质:指物质在发生化学反应时的性质,如易燃、易氧化、腐蚀性等。
3. 物质的性质可以通过实验和测试进行分析和检测,不同的物质在性质上有所区别,这也是物质分类的重要依据。
六、分子和离子1. 分子:是由两个或两个以上的原子通过共用电子对组成的具有一定稳定性的粒子。
2. 离子:是在化学反应中失去或获取一个或一个以上电荷的粒子。
(1)分子是由同种或不同种原子共用电子对通过共价键化学结合而成的;离子是失去或获取了电子而带有正负电荷的粒子。
初中化学核心概念初中化学是培养学生科学素养的重要学科之一。
在研究初中化学时,学生需要掌握一些核心概念,这些概念是化学研究的基础,也是进一步深入研究化学知识的关键。
以下是初中化学的核心概念:1. 物质:物质是构成一切物体的基本单位。
物质可以是固体、液体、气体,它们具有不同的物态特性。
物质:物质是构成一切物体的基本单位。
物质可以是固体、液体、气体,它们具有不同的物态特性。
2. 元素:元素是由具有相同原子序数的原子组成的基本物质。
元素由一个或多个原子构成,每个元素具有特定的原子序数、原子量和化学符号。
元素:元素是由具有相同原子序数的原子组成的基本物质。
元素由一个或多个原子构成,每个元素具有特定的原子序数、原子量和化学符号。
3. 化合物:化合物是由两种或更多种元素以固定的化学比例结合而成的物质。
化合物具有独特的物理和化学性质,可以通过化学反应进行分解或合成。
化合物:化合物是由两种或更多种元素以固定的化学比例结合而成的物质。
化合物具有独特的物理和化学性质,可以通过化学反应进行分解或合成。
4. 分子:分子是由两个或更多个原子通过共价键结合而成的最小化学单位。
分子可以由相同元素的原子组成(如氧分子-O2),也可以由不同元素的原子组成(如水分子-H2O)。
分子:分子是由两个或更多个原子通过共价键结合而成的最小化学单位。
分子可以由相同元素的原子组成(如氧分子-O2),也可以由不同元素的原子组成(如水分子-H2O)。
5. 离子:离子是由一个或多个带电荷的原子或原子团组成的粒子。
阳离子带正电荷,阴离子带负电荷。
离子通过电荷吸引力相互结合,形成化合物。
离子:离子是由一个或多个带电荷的原子或原子团组成的粒子。
阳离子带正电荷,阴离子带负电荷。
离子通过电荷吸引力相互结合,形成化合物。
6. 化学反应:化学反应是物质发生变化的过程,原有物质被转化成新的物质。
化学反应可以是吸热反应(吸收热量)或放热反应(释放热量)。
化学反应:化学反应是物质发生变化的过程,原有物质被转化成新的物质。
初中化学学科的核心知识点梳理化学是一门研究物质性质、组成以及变化规律的科学。
在初中阶段,学生开始接触并学习化学的基本知识和概念。
为了更好地帮助学生理解和掌握这门学科,以下是初中化学学科的核心知识点梳理。
1. 原子与物质结构在化学领域,原子是构成物质的基本单位。
初中化学课程强调学生对原子的理解,包括原子的结构和组成。
了解原子的基本组成以及各种不同元素的原子数量和特征可以帮助学生理解化学反应和物质的性质。
2. 元素与化合物元素是由相同类型的原子组成的纯物质。
学生需要了解元素的符号、原子序数和相对原子质量等概念。
化合物是由不同类型的原子通过化学键结合而成的物质。
学生需要学习化合物的命名规则和化学式的书写,并理解化学键的类型和强度。
3. 化学反应与化学方程式学生需要了解不同类型的化学反应、反应条件以及化学方程式的书写和平衡。
学生还需要学习如何计算反应的摩尔比例和化学反应的能量变化。
4. 酸、碱和盐学生需要了解和区分酸、碱和盐的性质。
他们还需要学习酸碱中和反应和盐的形成。
此外,学生还需要了解酸碱指示剂和pH值的概念。
5. 溶液与浓度学生需要理解溶液的概念,包括溶质和溶剂,并学习浓度的计算方法。
他们需要了解饱和溶液、稀释以及浓液和稀液的相互转化。
6. 常见气体的性质学生需要了解常见气体的特性,包括气体压力、体积和温度之间的关系,以及气体在加热或冷却时的体积和压力的变化情况。
7. 化学能量转化学生需要了解化学能量转化的基本原理,包括燃烧、放热反应和吸热反应。
他们还需要了解能量守恒定律以及化学反应中的能量转化方式。
8. 金属与非金属学生需要了解金属和非金属的性质和特点。
他们需要了解不同金属的用途和生产方法,以及非金属的重要性和用途。
9. 碳化合物和有机化学学生需要了解碳化合物和有机化学的基础知识。
他们需要了解碳的特性,有机化合物的命名和结构,以及常见有机化合物的用途。
10. 化学实验与实验室安全学生需要通过做实验来巩固和应用学到的化学知识。
初中化学核心概念理解化学是一门研究物质组成、性质和变化的科学。
初中化学的核心概念是理解基本的物质的性质和变化的原理。
以下是初中化学的几个核心概念:原子和分子原子是构成物质的最基本的单位,它们由质子、中子和电子组成。
分子是由原子通过化学键连接在一起形成的。
理解原子和分子的概念对于理解物质的组成和性质至关重要。
元素元素是由具有相同原子数的原子组成的物质。
元素可以通过化学符号来表示,比如氧元素用符号O表示。
了解常见元素及其特性可以帮助我们更好地理解化学反应和化合物的形成。
化学方程式化学方程式用化学符号和化学式来描述化学反应。
它显示了反应物和生成物之间的转化关系。
理解化学方程式可以帮助我们预测反应的结果和进行计算。
元素周期表元素周期表是用来组织和分类元素的工具。
它按照元素的原子数和性质进行排列。
熟悉元素周期表可以帮助我们发现元素之间的共性和规律。
化学反应化学反应是物质发生变化的过程。
化学反应可以通过观察物质的颜色、气体的产生或消失、温度的变化等来判断。
了解化学反应的类型和条件可以帮助我们解释和预测实验现象。
酸碱中和反应酸碱中和反应是一种常见的化学反应类型,通过酸和碱反应生成盐和水。
酸的特征是酸性溶液可以使蓝色石蕊试剂变红,而碱的特征是可以使红色石蕊试剂变蓝。
理解酸碱中和反应可以帮助我们了解酸碱性物质和中和反应的原理。
以上是初中化学的核心概念,理解这些概念可以为我们进一步研究和探索化学提供基础。
参考文献:- 杨守利,孙泉,康纪林,吴志鼎,周俊华,朱玲,朱燕荣(2017)。
初中化学,北京市教育出版社。
化学学科的核心概念和基础知识化学是一门研究物质的组成、结构、性质以及变化规律的基础自然科学。
以下是化学学科的核心概念和基础知识:1.物质的组成和分类–元素:组成物质的基本粒子,具有相同核电荷数的一类原子的总称。
–化合物:由两种或两种以上不同元素组成的纯净物。
–混合物:由两种或两种以上的物质组成,其组成物质之间没有发生化学反应。
–纯净物:只由一种物质组成的物质。
2.原子和分子–原子:物质的基本组成单位,具有化学性质的最小粒子。
–分子:由两个或两个以上原子通过共价键连接而成的粒子。
3.化学反应–化学反应:物质在原子、离子或分子层面上发生的转化过程,伴随着能量的变化。
–反应物:参与化学反应的起始物质。
–生成物:化学反应过程中产生的新物质。
–反应条件:影响化学反应速率、程度和产物的重要因素。
4.化学平衡–化学平衡:在封闭系统中,正反两个化学反应的速率相等,各种物质的浓度保持不变的状态。
–平衡常数:描述化学平衡状态的一个数值,表示反应物浓度与生成物浓度之间的比例关系。
–溶液:由溶剂和溶质组成的均匀透明的混合物。
–溶剂:能够溶解其他物质的物质。
–溶质:被溶剂溶解的物质。
–酸:在电离时产生的阳离子全部是H⁺的化合物。
–碱:在电离时产生的阴离子全部是OH⁻的化合物。
–盐:由金属离子(或铵根离子)与酸根离子组成的化合物。
5.有机化学基础–有机物:大多数含碳的化合物,如烃、醇、醚、酮、羧酸、酯等。
–无机物:不含碳的化合物,如水、二氧化碳、盐等。
6.化学实验技能–基本操作:称量、溶解、过滤、蒸馏、萃取、滴定等。
–实验仪器:显微镜、试管、烧杯、蒸馏瓶、滴定管等。
7.化学与生活、生产–物质的用途:根据物质的性质来确定其在生活和生产中的应用。
–环境保护:化学在防治环境污染、保护生态环境方面的作用。
–健康生活:化学物质对人体健康的影响,如食品添加剂、药物等。
8.化学思想方法–实证主义:化学研究的基本方法,强调观察、实验和验证。