初中化学_第五单元《定量研究化学反应》单元复习课教学课件设计
- 格式:ppt
- 大小:1.81 MB
- 文档页数:20

课题:第五单元定量研究化学反应复习教案课标要求:1.认识质量守恒定律,能说明常见化学反应中的质量关系;用微粒的观点对质量守恒定律作出解释。
明确化学反应前后的“六个不变”和“两个不变”、“一个可能变”。
2.理解化学方程式的涵义,了解书写化学方程式要遵守的原则。
能正确书写简单的化学方程式。
3.能根据化学反应方程式进行简单的计算。
能从定量的角度理解化学反应。
4.认识定量研究对于化学科学发展的重大作用。
内容和学情分析:学生通过实验探究化学反应中的质量关系,形成了一切化学反应都遵守质量守恒定律。
并且能够利用质量守恒定律解释常见化学反应中的质量关系,并且能够利用化学变化中的微粒观与元素观解释质量守恒的原因。
化学方程式是化学反应的一种表征形式,它反映了宏观物质和微观粒子的定量关系。
通过理解化学方程式的涵义,学生才能够根据化学方程式进行简单的计算。
复习时不仅要对知识点温习巩固,而且要对化学方程式和质量守恒定律的应用进行整合提升,突出化学反应原理、符号表征在认识物质方面的应用。
学习目标:1.通过自主学习,梳理知识,能自主形成知识网络。
2.通过复习质量守恒定律,能解释化学反应中的质量关系,能推断化学反应中某物质的组成元素。
3.通过复习化学方程式的意义、写法,能根据反应事实书写化学方程式及其进行简单计算。
知识点(重点、难点):重点:质量守恒定律和化学方程式难点:根据化学方程式的简单计算。
实验准备:多媒体【学习过程】教师活动 学生活动 设计意图 环节一:【展示目标 明确任务】直接引入:复习第五单元定量研究化学反应展示复习目标,明确复习任务。
一生读,其余学生领悟。
让学生明确复习任务,做到有的放矢进行复习。
环节二:【自主学习 梳理知识】(一)质量守恒定律 1.内容: 化学反应的各物质的质量总和等于反应后 的各物质的质量总和,这个规律叫做质量守恒定律。
注意:(1)适用于一切化学反应(2)是 守恒而不是体积守恒。
(3)必须是真正参加反应的物质没有参加反应的物质,不能计算在内。
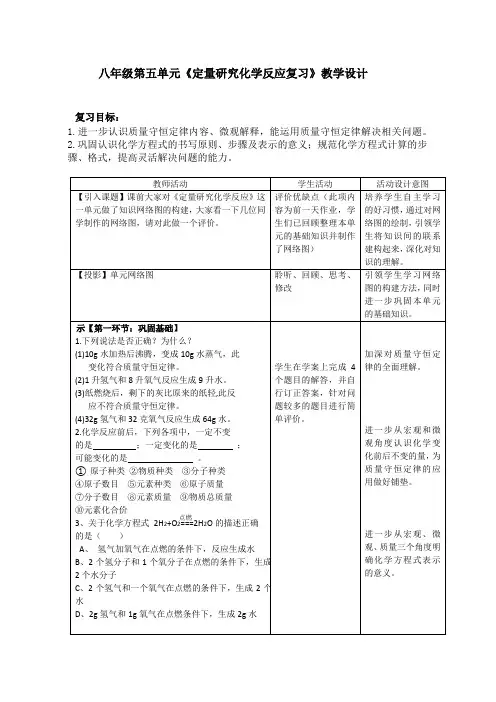
八年级第五单元《定量研究化学反应复习》教学设计复习目标:1.进一步认识质量守恒定律内容、微观解释,能运用质量守恒定律解决相关问题。
2.巩固认识化学方程式的书写原则、步骤及表示的意义;规范化学方程式计算的步骤、格式,提高灵活解决问题的能力。
4、下列化学方程式是否正确?为什么?点燃 (1) 4P +5O 2 ===2P 2O 5点燃 (2)4Fe+3O 2===2Fe 2O 3 (3) H 2+O 2===H 2O点燃 (4)CH 4+2O 2===CO 2 +2H 2O通过该题组练习,强化化学方程式书写的注意事项,为正确书写做好铺垫。
【第二环节:强化重点】一、质量守恒定律的探究和应用1:在课堂教学中,老师们引导同学们进行“化学反应中反应物与生成物的质量关系”的实验探究,同学们都进行了规范的操作、准确的称量和细致的观察。
实验装置和选用药品分别以ABC 表示如下:(1)上述三个实验探究反应前后天平仍平衡的是 ,天平不平衡的是 。
(2)B 实验天平不平衡的原因是 。
若要得到正确结论,请帮助改进实验装置。
【小结】探究设计质量守恒定律时,若有气体参加或生成的反应要在 装置中进行 。
2:甲乙丙丁四种物质在密闭容器内混合后,在一定的条件下充分反应,测得反应前后各物质的质量分数如下表所示,说法正确的是( )A.丁一定是这个反应的催化剂B.参加反应的甲和乙的质量之和一定等于生成的丙的质量C.甲一定是化合物,乙一定是单质甲 乙 丙 丁 反应前质量分数/% 70 15 6.25 8.75 反应后质量分数/% 35 7.5 48.75 x学生口答,针对气球反应完后是否胀大产生浮力展开实验创新,观看微视频,充分理解实验改进方法和原理。
学生讲解解题的思路和方法。
通过该问题解答,使学生明确探究设计质量守恒定律时的注意事项:若有气体参加或生成的反应要在密闭装置中进行 ,并学习灵活进行实验的创新性改进通过该表格题的解答,使学生明确用质量守恒定律进行未知质量的求算是解决问题的关键。








