硫酸的物理性质
- 格式:docx
- 大小:12.44 KB
- 文档页数:1



浓硫酸的理化特性与应急处置方法1、浓硫酸物理性质硫酸(H2S04)在浓度高时具有强氧化性,这是它与普通硫酸或普通浓硫酸最大的区别之一。
俗称坏水。
由于浓硫酸中含有大量未电离的硫酸分子,所以具有吸水性、脱水性和强氧化性等特殊性质;而在稀硫酸中,硫酸分子已经完全电离,所以不具有浓硫酸的化学特性。
纯硫酸是一种无色无味油状液体。
常用的浓硫酸中H2S04的质量分数为98.3%,其密度为1.84gcm-3,其物质的量浓度为18.4mol-1。
98.3%熔点:10℃;沸点:338℃。
92%硫酸为-25.6℃;93.3%硫酸为-37.85℃;硫酸为0.1℃;100%无水硫酸则为110.45℃;20%发烟硫酸为 2.5℃,65%发烟硫酸为-0.35℃。
硫酸的沸点,当含量在98.3%以下时是随着浓度的升高而增加的,98.3%硫酸的沸点最高,为338.8℃。
发烟硫酸的沸点是随着游离S04的增加,由279. 69C渐至44. 7℃。
当硫酸溶液蒸发时,它的浓度不断增高,直至98.3%后保持恒定,不再继续升高。
浓硫酸和稀硫酸的性质有差别。
硫酸是一种高沸点难挥发的强酸,易溶于水,能以任意比与水混溶。
浓硫酸溶解时放出大量的热,因此浓硫酸稀释时应该“酸入水,器壁,慢慢倒,不断搅。
”2、浓硫酸化学性质脱水性(1)就硫酸而言,脱水性是浓硫酸的性质,而非稀硫酸的性质,即浓硫酸有脱水性且脱水性强。
(2)脱水性是浓硫酸的化学特性,物质被浓硫酸脱水的过程是化学变化的过程,反应时,浓硫酸按水分子中氢氧原子数的比(2:1)夺取被脱水物中的氢原子和氧原子。
(3)可被浓硫酸脱水的物质一般为含氢、氧元素的有机物,其中蔗糖、木屑、纸屑和棉花等物质中的有机物,被脱水后生成浓硫酸的腐蚀性了黑色的炭(炭化)。
强氧化性(1)跟金属反应①常温下,浓硫酸能使铁、铝等金属钝化。
②加热时,浓硫酸可以与除金、铂之外的所有金属反应,生成高价金属硫酸盐,本身一般被还原成SO2Cu+2H2SO4(浓)==(加热)==CuSO4+SO2+2H20 2Fe+6H2SO4(浓)===Fe2(SO4)3+3S02个+6H2O(2)跟非金属反应热的浓硫酸可将碳、硫等非金属单质氧化到其高价态的氧化物或含氧酸,本身被还原为SO2C+2H2SO4(浓)=(加热)==CO2个+2S02个+2H2OS+2H2SO4(浓)===3SO2个+2H20吸水性(1)就硫酸而言,吸水性是浓硫酸的性质而不是稀硫酸的性质。

硫酸物理知识点总结1. 物理性质硫酸是一种极强的酸性物质,呈无色透明的液体,有强烈的腐蚀性。
其密度为1.84 g/cm3,沸点为337°C,熔点为10°C。
在常温下,硫酸是一种无色透明的液体,具有很高的溶解性,能够溶解许多物质,包括金属、盐类、有机物等。
硫酸还具有极强的腐蚀性,能够对人体皮肤和黏膜产生严重损伤,因此在使用过程中必须小心操作,避免接触皮肤和吸入蒸气。
2. 化学性质硫酸是一种极强的酸性物质,具有强烈的腐蚀性和氧化性。
它能够与碱反应生成盐和水,例如与氢氧化钠反应生成硫酸钠和水:H2SO4 + 2NaOH -> Na2SO4 + 2H2O硫酸还具有很强的氧化性,在与许多物质接触时会发生氧化反应,如与金属反应生成相应的硫酸盐和氢气:H2SO4 + Mg -> MgSO4 + H2↑此外,硫酸还能够与许多有机物反应,产生硫酸酯等化合物。
总的来说,硫酸的化学性质非常活泼,它能够与许多物质发生反应,产生各种化合物。
3. 制备方法硫酸的常见制备方法包括接触法、铁铜法和浓缩硫酸法等。
其中,接触法是最常用的工业生产方法,它是通过将硫磺和空气在催化剂的作用下氧化生成二氧化硫,再通过氧化反应产生三氧化硫,最终与水反应生成硫酸:S + O2 -> SO22SO2 + O2 -> 2SO3SO3 + H2O -> H2SO4铁铜法是通过硫磺和稀硫酸反应,产生硫酸和二氧化硫的混合气体,再经过氧化反应生成三氧化硫,最终与水反应生成硫酸:S + 6FeSO4 -> H2SO4 + 3Fe2(SO4)3Fe2(SO4)3 + Cu -> 3CuSO4 + 2Fe浓缩硫酸法是通过将稀硫酸经过蒸馏和浓缩,逐渐提高浓度,最终得到纯净的浓硫酸。
这三种方法中,接触法是最常用的工业生产方法,它不仅生产效率高,而且可以得到高纯度的硫酸。
4. 应用领域硫酸是一种非常重要的化学品,具有广泛的应用领域。
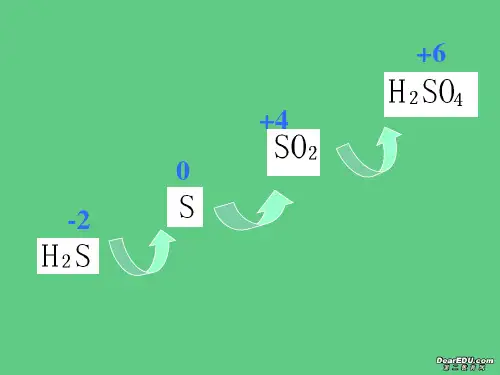

硫酸及硫酸根离子的检验1.硫酸的物理性质H 2SO 4是无色液体,能与水以任意比互溶,溶解时可放出大量的热,浓H 2SO 4稀释的方法是将浓H 2SO 4沿烧杯内壁缓缓倒入水中并用玻璃棒不断搅拌。
2.硫酸是强电解质,写出稀硫酸与下列物质反应的离子方程式: ①铁:Fe +2H +===Fe 2++H 2↑; ②MgO :MgO +2H +===Mg 2++H 2O ;③Ba(OH)2:Ba 2++2OH -+2H ++SO 2-4===BaSO 4↓+2H 2O ; ④Na 2SO 3:SO 2-3+2H +===H 2O +SO 2↑; ⑤BaCl 2:Ba 2++SO 2-4===BaSO 4↓。
3.浓H 2SO 4的特性 (1)填写下表实验实验现象 硫酸的特性 少量胆矾加入浓硫酸中 蓝色固体变白 吸水性 用玻璃棒蘸取浓硫酸滴在滤纸上沾有浓H 2SO 4的滤纸变黑 脱水性将铜片加入盛有浓硫酸的试管中加热铜片逐渐溶解,产生无色刺激性气味的气体强氧化性(2)分别写出浓硫酸与Cu 、C 反应的化学方程式:Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O 、C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 。
(3)常温下,铁、铝遇浓H 2SO 4――→钝化可用铝槽车运浓H 2SO 4。
4.SO 2-4的检验检验SO 2-4的正确操作方法:被检液――→加足量盐酸酸化取清液――→滴加BaCl 2溶液有无白色沉淀(判断有无SO 2-4)先加稀盐酸的目的是防止CO 2-3、SO 2-3、Ag +干扰,再加BaCl 2溶液,有白色沉淀产生,可能发生反应的离子方程式:CO 2-3+2H +===CO 2↑+H 2O 、SO 2-3+2H +===SO 2↑+H 2O 、Ag ++Cl -===AgCl ↓、Ba2++SO 2-4===BaSO 4↓。

硫酸工艺设计手册物化数据篇硫酸是一种广泛应用于工农业生产中的重要化学品,其工艺设计对于生产过程的安全性、经济性和环境友好性具有重要意义。
物化数据是进行硫酸工艺设计必不可少的一部分,它包括硫酸的物理性质、化学性质、热力学性质等方面的数据。
本文将对硫酸的物化数据进行详细介绍。
首先,硫酸的物理性质主要包括密度、熔点、沸点、折射率等。
硫酸的密度与浓度有关,在20℃下,浓度为1.84 g/cm³的硫酸密度为1.84 g/cm³,浓度为98%的硫酸密度为1.84 g/cm³。
硫酸的熔点为10.3℃,沸点为337℃。
硫酸的折射率为1.425。
其次,硫酸的化学性质是指硫酸与其他物质发生化学反应的能力。
硫酸是一种强酸,在水中完全离解,生成H+和HSO4-离子。
硫酸可以与金属发生反应,生成相应的硫酸盐,例如硫酸与铁反应生成硫酸铁。
此外,硫酸还可以与碱反应生成相应的盐和水,例如硫酸与氢氧化钠反应生成硫酸钠和水。
硫酸与非金属氧化物也能发生反应,生成相应的酸和水,例如硫酸与二氧化硫反应生成亚硫酸和水。
第三,硫酸的热力学性质包括焓、熵、自由能等。
焓是物质在恒定压力条件下吸收或放出的热量,硫酸的标准燃烧焓为-2719.0kJ/mol。
熵是物质的无序程度,硫酸的标准熵为157.6 J/(mol·K)。
自由能是物质在恒定温度和压力下的稳定状态,硫酸的标准自由能变为-570.5 kJ/mol。
需要注意的是,硫酸是一种高度腐蚀性的物质,对皮肤和眼睛有刺激作用,必须严格遵守安全操作规程。
当进行硫酸工艺设计时,必须考虑到硫酸的危险特性,并采取相应的安全措施,如佩戴防腐剂、穿戴防腐服装等。
此外,在硫酸工艺设计中还需要考虑硫酸的纯度要求。
一般情况下,工业用硫酸的纯度要求为98%,电子级硫酸的纯度要求更高,通常在99.999%以上。
硫酸的纯度对于生产过程的安全稳定以及产品质量的合格性都有重要影响。
总之,物化数据是进行硫酸工艺设计不可或缺的一部分。



硫酸的主要理化和危险特性硫酸是一种常见的无机酸,其化学式为H2SO4。
它是一种无色、无臭、有强烈腐蚀性的液体,通常在实验室和工业中使用。
在本文中,我们将探讨硫酸的主要理化和危险特性。
1. 硫酸的物理和化学性质硫酸是一种高度亲水的液体,其密度大约为1.84克/毫升,沸点为337℃,熔点为10℃。
它是一种高度酸性的液体,可以与大多数物质反应。
在水中很容易溶解,是一种十分重要的化学品。
硫酸是一种双酸,它可以和水反应,产生一定的热量。
这是因为硫酸的离子化程度较高,可以快速释放出H+离子,与水中的OH-离子结合,形成H3O+离子。
这个过程称为自离解反应,化学方程式如下:H2SO4 + H2O ⇆ H3O+ + HSO4-HSO4- + H2O ⇆ H3O+ + SO42-在实验室和工业中,硫酸常用作强酸,用于提纯、脱水和酸性反应。
例如,硫酸可以用于制造硝酸和某些磷酸盐。
它还可以用于处理废水、制造肥料、提取精炼金属和制造化学品等应用方面。
2. 硫酸的危险特性尽管硫酸在实验室和工业中有很多应用,但它的使用也存在危险性。
硫酸腐蚀性很强,可能会对皮肤和眼睛造成严重灼伤。
当硫酸泼溅到皮肤上时,会迅速吸收水分,引起局部脱水和淤血,导致严重的疼痛和灼伤。
在吸入硫酸蒸气时,也会造成呼吸道刺激和感染,在短时间内可能会出现窒息和死亡。
在使用硫酸时,必须采取必要的防护措施。
例如,必须在通风良好的地方使用,并穿戴合适的防护衣、手套和眼镜等。
在使用后必须及时清洗洗手、更衣和防护设备。
此外,硫酸也有一些环境影响。
由于它是一种强酸,如果排入水体或土壤中,会对周围环境造成污染和破坏。
因此,必须采取适当的处理和处置方法,以最大限度地减少其环境影响。
3. 总结硫酸是一种常见的无机酸,具有强烈的化学反应性和腐蚀性。
在实验室和工业中,它有很多应用,例如用作强酸、提纯、脱水和酸性反应等。
然而,硫酸也存在危险性,可能会对人体和环境造成严重的损害。
因此,在使用时必须采取必要的防护措施,并在使用后进行适当的处置。

硫酸的物理性质如下:
1、纯硫酸一般为无色油状液体,密度1.84 立方米每克,沸点337摄氏度,能与水以任意比例互溶,同时放出大量的热,使水沸腾。
加热到290摄氏度时开始释放出三氧化硫,最终变成为百分之98.54的水溶液,在317摄氏度时沸腾而成为共沸混合物。
2、硫酸的沸点及粘度较高,是因为其分子内部的氢键较强的缘故。
由于硫酸的介电常数较高,因此它是电解质的良好溶剂。
3、纯硫酸是一种极性非常大的液体,其介电系数大约为100。
因为它分子与分子之间能够互相质子化对方,造成它极高的导电性。
浓度的差异:
尽管可以制出浓纯净的硫酸,并且室温下是无限稳定的(所谓的分解成恒沸物的反应发生在接近沸点的高温之下),但是纯硫酸凝固点过高(283.4K),所以为了方便运输通常制成98%硫酸,故一般所说的“高浓度硫酸”指的便是浓度为98%的硫酸。
化学硫酸知识点总结硫酸是一种重要的化学品,广泛应用于工业生产、化学实验和其他领域。
本文将从硫酸的性质、制备、应用等方面对硫酸的知识点进行总结。
一、硫酸的性质1. 物理性质硫酸为无色、透明、沸点337℃,密度1.84g/cm³,易溶于水并放出大量热量。
2. 化学性质(1)和金属的反应:硫酸能与金属发生反应,生成相应的硫酸盐和氢气。
例如:H2SO4 + Zn → ZnSO4 + H2↑(2)与碱的反应:硫酸能与碱发生中和反应,生成相应的盐和水。
例如:H2SO4 + 2NaOH → Na2SO4 + 2H2O(3)脱水性:硫酸具有很强的脱水性,能够使许多物质脱水,如脱水醇生成烯烃等。
(4)氧化性:浓硫酸是一种氧化剂,能够与许多物质发生氧化反应。
二、硫酸的制备1. 浓硫酸的制备浓硫酸通常采用铁的接触法进行制备,主要步骤包括将浓硫酸蒸气通入浓硫酸中,然后将浓硫酸和蒸汽混合气体通过铁丝塞的塔体进行接触反应。
2. 稀硫酸的制备稀硫酸的制备方法有很多,一般采用恩格勒法或铁法,也可以用硫和水的氧化反应生成二氧化硫然后再与氧气进一步反应制备硫酸。
三、硫酸的应用1. 工业上的应用硫酸是一种重要的工业原料,广泛用于矿山冶炼、化肥生产、有机合成、电镀等领域。
其中,硫酸最主要的用途是用作化肥、废水处理、矿山浸出和石油冶炼等。
2. 化学实验室中的应用硫酸也是实验室中常用的试剂,用于调节溶液的pH值,进行有机合成反应,还可以用作干燥剂和脱水剂等。
四、硫酸的安全性硫酸具有强酸性和腐蚀性,对皮肤、眼睛和呼吸系统都有一定的危害。
在使用硫酸时,应穿戴好防护装备并注意通风,避免接触皮肤、呼吸道和眼睛。
五、硫酸的环境影响硫酸的环境影响主要表现在两个方面:一是其腐蚀性和毒性对环境造成直接伤害,二是硫酸在大气和水循环中形成酸雨,对土壤、湖泊等造成一定污染,影响自然环境和生态平衡。
结语硫酸是一种重要的化学品,其性质、制备和应用都具有重要意义。
硫酸的主要理化和危险特性硫酸是一种重要的化学物质,在日常生产和生活中广泛应用。
它是一种无色、透明的液体,有着强烈的刺激性气味和酸味。
硫酸是强酸之一,容易与许多物质反应,所以需要非常小心。
本文将介绍硫酸的主要理化和危险特性。
一、硫酸的理化特性1、化学式:H2SO4。
2、分子量:98.076。
3、相态:在室温下为无色、透明液体,密度较大。
4、熔点:10.4℃。
5、沸点:338℃。
6、水溶性:易溶于水,水溶液有强酸性,可以腐蚀金属和织物。
7、物理性质:具有强烈的腐蚀性,会引起皮肤和眼睛的刺痛和严重的灼伤。
此外,硫酸还有高度的挥发性,能够刺激肺部和呼吸道,长期吸入过量的硫酸蒸气,会引起严重的呼吸道问题。
二、硫酸的危险特性1、腐蚀性硫酸是一种强酸,具有很强的腐蚀性。
它可以腐蚀皮肤和眼睛以及导致人体发生化学灼伤。
一旦硫酸接触到皮肤或眼睛,需要立即进行水冲洗,避免继续伤害。
2、毒性高浓度的硫酸气体对人体有毒性,它会引起呼吸困难、头痛、呕吐等不良症状。
高浓度的硫酸气体会引起严重的呼吸道问题,需要尽快进行急救和治疗。
3、易燃性硫酸有着易燃性,不能与某些物质混合,如草木灰、纸张、有机物质等。
4、环境污染硫酸在生产和处理过程中,会产生大量的二氧化硫,这种气体对环境有很大的危害。
二氧化硫会与其他气体反应,产生酸雨,导致土壤和水质的污染,对环境和人类健康造成很大的伤害。
三、使用硫酸的注意事项1、保持室内通风,保证通风口和排气口畅通。
2、注意个人防护,穿上透气且不易着火的工作服,并佩戴防护眼镜和口罩。
3、禁止直接与皮肤或眼睛接触,一旦发生接触,需要立即用清水冲洗10-15分钟,并就医处理。
4、存储在干燥通风的地方,远离强酸、碱和易燃物。
5、在使用和处理过程中,需要严格按照安全操作规程,以避免发生意外或化学事故。
总之,硫酸是一种非常重要的化学物质,但也具有强烈的腐蚀性和毒性。
在使用和处理硫酸的过程中,我们应该保持高度警惕,妥善处理废弃物、尽快清除泄漏,并进行安全操作。
硫酸的物理性质
纯硫酸是一种无色无味油状液体。
100%硫酸在20℃下的比重为 1.8305 g·cm-3。
硫酸的比重与硫酸的浓度和温度有关。
硫酸水溶液比重随硫酸含量增加而增大,且随温度升高而减小,因此可利用比重或密度来测定硫酸的浓度。
硫酸的结晶温度和沸点随硫酸浓度和组成而变化。
硫酸的沸点随其浓度的增加而升高,当硫酸浓度达到98.3%时,沸点为338.8℃,此为硫酸溶液的最高温度,称为恒沸点。
104.5%发烟硫酸结晶温度为2.5℃,98%硫酸结晶温度为-1℃,93%硫酸结晶温度为-27℃。
因此在确定硫酸生产品种时,应根据当地的气候状况,采取必要的措施。
硫酸是一种高沸点难挥发的强酸,易溶于水,能以任意比与水混溶。
浓硫酸溶解时放出大量的热。
另外,硫酸的粘度大小对管道输送时所产生的阻力有很大影响,因此,它既是决定酸泵动力消耗因素之一,又是影响传热、硫酸盐溶解度和金属溶解速度等的因素之一。
硫酸的热化学数据是硫酸加水、混酸、稀酸浓缩和三氧化硫在酸中的溶解热等热量计算的重要参数。
硫酸的导电率,是确定硫酸浓度以实现硫酸浓度自动测量等的重要参数。