酸和酸的性质
- 格式:ppt
- 大小:16.65 MB
- 文档页数:27


酸的性质和分类酸是化学中常见的物质之一,它具有一些独特的性质和特点。
本文将详细介绍酸的性质和分类,并探讨它们在日常生活和工业中的重要应用。
一、酸的性质1.酸味和腐蚀性:酸通常呈酸味,且具有腐蚀性,可以腐蚀或侵蚀许多物质,如金属和皮肤等。
这是由于酸能够释放出氢离子(H+),与其他物质发生反应。
2.酸性溶液的导电性:酸性溶液中含有大量的离子,这些离子能够导电。
酸能够在水中产生杂质离子,如H+离子和对于它们有强烈吸引力的阴离子。
3.酸和金属的反应:酸能够与金属发生反应并产生氢气。
例如,硫酸可以与锌反应生成硫酸锌和氢气。
4.酸和碱的中和反应:酸可以与碱进行中和反应,产生盐和水。
这是因为酸中的氢离子与碱中的氢氧根离子(OH-)结合形成水。
二、酸的分类按照性质和来源的不同,酸可以分为以下几类:1.无机酸:无机酸是指由无机物质形成的酸,如硫酸(H2SO4)、盐酸(HCl)和硝酸(HNO3)等。
它们广泛应用于化肥、化学工业、冶金工业等领域。
2.有机酸:有机酸是指含有碳元素的酸,如乙酸(CH3COOH)、柠檬酸(C6H8O7)和醋酸(C2H4O2)等。
有机酸主要存在于植物和动物体内,并且在食品加工、医药和化妆品等行业有重要应用。
3.单质酸:单质酸是指由单质原子形成的酸,如二氧化碳(CO2)和一氧化碳(CO)等。
尽管它们不是典型的酸,但在某些条件下能够表现出酸性。
4.超强酸:超强酸是指具有极强酸性的酸。
它们通常是有机物质和无机物质的混合物,如三氟化硼(BF3·HF)和三氯化铁(FeCl3)等。
超强酸在有机合成和石油化工等领域具有重要作用。
三、酸的应用1.食品加工:柠檬酸和苹果酸等有机酸可以用作食品酸味剂和防腐剂,提供食物的酸味并延长其保鲜时间。
2.医药制造:许多药物的制造过程中需要使用酸来催化或调节反应,例如合成维生素C和抗生素等。
3.化学工业:酸在化学工业中具有广泛应用,其中硫酸是一种重要的原料,广泛用于生产肥料、玻璃、纺织品等。

酸碱盐的化学性质酸、碱、盐是化学中三种重要的物质,它们各自具有不同的化学性质。
1. 酸的化学性质酸是一类能够在水或其他溶液中产生氢离子(H+)的化合物。
酸的化学性质通常体现在三个方面:(1)酸与碱反应酸与碱在适当的条件下可以发生酸碱中和反应,生成盐和水。
例如,氢氧化钠(NaOH)和盐酸(HCl)的反应:NaOH + HCl → NaCl + H2O在这里,盐酸是酸,氢氧化钠是碱,它们反应生成氯化钠和水。
(2)酸与金属反应在适当条件下,酸可以与金属反应,生成盐和氢气。
例如,硫酸和锌的反应:H2SO4 + Zn → ZnSO4 + H2在这里,氢气是由锌与酸反应产生的,盐是由硫酸和锌生成的。
(3)酸与碳酸盐反应酸还可以与碳酸盐反应,生成盐、二氧化碳和水。
例如,盐酸和碳酸钙(CaCO3)的反应:2HCl + CaCO3 → CaCl2 + CO2 + H2O在这里,盐是由盐酸和碳酸钙生成的,二氧化碳是由碳酸钙分解而来。
2. 碱的化学性质碱是一类在水或其他溶液中能产生氢氧根离子(OH-)的化合物。
它们的化学性质主要体现在两个方面:(1)碱与酸反应碱与酸在适当条件下可以发生酸碱中和反应,生成盐和水。
例如,在上面的NaOH + HCl → NaCl + H2O的反应中,氢氧化钠是碱,它与盐酸反应生成氯化钠和水。
(2)碱与酸盐反应碱也可以与酸盐反应,生成盐和水。
例如,氢氧化钠和硫酸的反应:NaOH + H2SO4 → Na2SO4 + 2H2O在这里,盐是由氢氧化钠和硫酸生成的,水是由反应产生的。
3. 盐的化学性质盐是由酸和碱中和反应后生成的化合物。
它们有一些特殊的化学性质:(1)盐水的电解性当盐溶解于水中时,它们会分解成正负离子,盐水具有电导性。
例如,氯化钠(NaCl)在水中的电离:NaCl → Na+ + Cl-在这里,Na+和Cl-是离子,它们在水中离解。
(2)盐水的酸碱性质盐溶解于水中会产生酸碱性质,具体取决于其所属的酸或碱的强度。


化学酸的定义酸是化学中一类常见的物质,具有酸性质的物质被称为酸。
酸是化学反应中重要的参与者,广泛应用于日常生活和科学研究中。
本文将从不同角度来解释酸的定义、性质和应用。
一、酸的定义酸的定义有多种,其中较为常见的有三种:阿伦尼乌斯酸、布朗酸和路易斯酸。
1. 阿伦尼乌斯酸:阿伦尼乌斯酸是最早被提出的酸的定义。
根据这个定义,酸是能够释放出氢离子(H+)的物质。
阿伦尼乌斯酸常常以H开头,比如盐酸(HCl)、硫酸(H2SO4)等。
2. 布朗酸:布朗酸是酸的另一种定义。
根据这个定义,酸是能够接受一对电子的物质。
布朗酸常常是一种含有可供给电子对的原子或离子的物质,比如氯离子(Cl-)。
3. 路易斯酸:路易斯酸是酸的第三种定义。
根据这个定义,酸是能够接受电子对的物质。
路易斯酸常常是一种缺少电子对的原子或离子,比如铝离子(Al3+)。
二、酸的性质酸具有以下几个常见的性质:1. 酸味:酸常常具有酸味,比如柠檬酸和醋酸都带有酸味。
2. 腐蚀性:酸具有强腐蚀性,可以腐蚀金属和有机物质。
比如硫酸可以腐蚀金属,醋酸可以腐蚀纸张。
3. 酸碱指示剂反应:酸可以与碱发生中和反应,这是酸碱指示剂的基本原理。
比如酸性溶液与酸碱指示剂酚酞反应,会使溶液颜色变红。
4. 酸性电离:酸可以在溶液中电离产生氢离子(H+)。
酸性溶液的pH值小于7,pH值越小,酸性越强。
三、酸的应用酸在许多领域都有广泛的应用,以下是其中几个例子:1. 工业应用:酸在工业生产中有重要的应用。
例如,硫酸被广泛用于肥料、化肥和制药工业;盐酸被用于金属清洗和废水处理等。
2. 食品和饮料工业:柠檬酸和醋酸等酸被广泛用于食品和饮料中,起到增加酸味和保鲜的作用。
3. 医学应用:酸在医学中有重要的应用。
例如,胃酸(盐酸)在消化过程中起到重要作用,某些酸也用于药物制备。
4. 实验室研究:酸在实验室研究中常常作为试剂使用。
例如,盐酸和硫酸常用于调节溶液的酸碱度。
总结:酸是一类能够释放氢离子、接受电子对或接受电子对的物质。

酸的五条性质酸是一种物质,能与氢离子反应,并会产生卤素类物质的氧化物。
它有着唾液般的刺激性,并伴有强烈的酸味,因此也称为“酸”。
大多数酸都是以离子形式存在的,可以分为两类:弱酸和强酸。
弱酸是如氢氟酸和盐酸等,它们能与氢离子反应而生成卤素化合物,但反应程度不大;强酸则是如硫酸、磷酸、硝酸等,其反应程度非常强烈,产生的卤素也非常活跃。
二、酸的五个性质1、可溶解性:酸可以溶解在水中,其可溶解性取决于它的比重。
一般来说,强酸的可溶解性要大于弱酸的可溶解性,另外,有些酸可以溶解于有机溶剂中,而有些则不能溶解。
2、强度:酸的强度指的是它的水解程度,由它的弱离子常数K 值决定。
K值越大,酸的强度越大,也就是说,K值越大的酸更易被水解。
3、pH值:pH是用来衡量溶液酸碱性的量度。
高于7的溶液为碱性,低于7的溶液为酸性,7为中性,其单位是pH值。
4、把持:酸能把持水中的离子,除了氢离子之外,还可以与其它金属离子如钠、铜、锌、铁等部分反应生成化合物,从而把持水中的离子。
5、稳定性:酸的稳定性指的是它在一定条件下,其强度是否能持续保持不变,一般来说,温度越高,酸的稳定性越差。
三、酸的主要用途酸作为一种重要的化工原料,广泛应用于精细化工、制药、石油化工、冶金、农业、烟草等领域,是工业生产中不可缺少的物质。
1、酸在精细化工方面有着重要作用,其中包括用于制造合成树脂、纤维素醚醚酯等,其还可以用于化学染料的生产等。
2、在制药领域,酸的作用也非常广泛,如用于药物调节酸度;此外,还可用于制备多种有用的药物,如尿酸复合药物、甲氧基磺酰胺药物等。
3、石油化工方面,酸也可以用来催化反应,如催化发动机排气后残留的烃分子,以及烷基烃的活性催化剂制备等。
4、酸还可以用于冶金工业,如用于炼钢、提纯铁及其他金属等。
5、在农业领域,酸也有着重要的作用,许多农药都是以酸作为前体,其中包括甲醇酸等。
四、酸的安全性酸具有较强的毒性,因此在进行酸处理时,须采取安全措施,避免受伤或造成环境污染。

酸的知识点总结一、基础概念酸是化学中的重要物质,通常被定义为能够在水中释放氢离子(H+)的化合物。
酸的特征包括酸味、与碱发生中和反应、与金属反应产生氢气等。
酸还可以被分为强酸和弱酸,其酸度大小取决于水溶液中所含的氢离子浓度。
二、酸的性质1. 酸的味道酸的味道可以描述为酸或酸涩,这是由于酸对舌头的刺激产生的感觉。
2. 酸的电离酸在水溶液中会发生电离,产生氢离子(H+)。
溶液中的氢离子浓度可以用pH值来表示。
3. 酸与金属的反应酸与金属反应会生成氢气,这是因为金属与酸反应会释放出氢气并生成相应的盐。
4. 酸与碱的中和反应酸与碱会发生中和反应,生成盐和水。
中和反应是化学中重要的反应类型。
5. 酸的性质影响因素酸的性质可以受到溶液浓度、分子结构以及温度等多种因素的影响。
三、常见酸的种类1. 强酸强酸是指在水溶液中完全电离产生氢离子(H+)的酸,如盐酸、硫酸等。
2. 弱酸弱酸是指在水溶液中只部分电离产生氢离子(H+)的酸,如乙酸、碳酸等。
3. 有机酸有机酸是指含有羧基(-COOH)的有机物质,如柠檬酸、乙酸等。
4. 矿酸矿酸是指含有硫酸根离子(SO4²-)的酸,如硫酸、硝酸等。
四、酸碱中和反应酸碱中和反应是指酸与碱反应生成盐和水的化学反应。
反应的一般形式可以表示为:酸 + 碱→ 盐 + 水在这个反应中,酸和碱互相中和产生盐和水。
盐是酸和碱中所含的阳离子和阴离子组合而成的化合物。
五、酸的应用1. 工业生产酸在工业生产中有广泛的应用,如在化肥生产、金属加工、皮革加工等领域。
2. 医药领域酸在医药领域有着重要的用途,如在药物生产、药品稳定性调节等方面。
3. 食品加工酸在食品加工中也有一定的应用,比如在起酵制作中使用的柠檬酸、醋等。
4. 化妆品酸在化妆品生产中也有一定的作用,如在调节pH值、防腐等方面的应用。
六、酸的安全注意事项1. 酸具有腐蚀性,接触皮肤或眼睛会引起灼伤,应当避免直接接触。
2. 酸与碱混合会产生强烈的反应,可能产生毒气,需要小心操作。
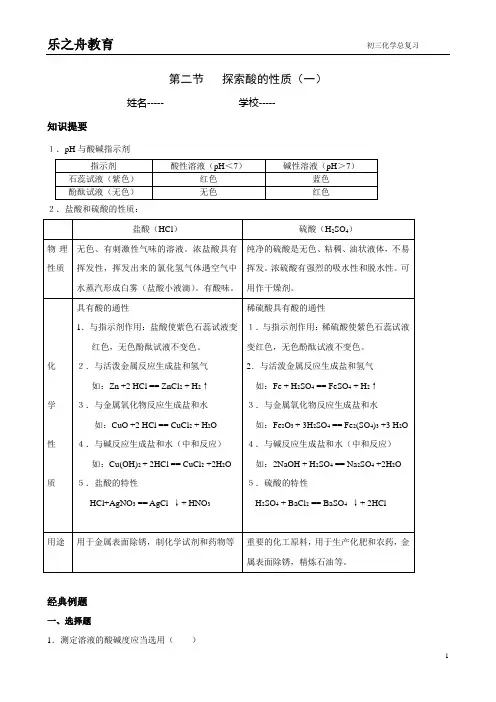
第二节探索酸的性质(一)姓名----- 学校-----知识提要1.pH与酸碱指示剂2.盐酸和硫酸的性质:经典例题一、选择题1.测定溶液的酸碱度应当选用()A.紫色石蕊试液B.pH试纸C.无色酚酞试液D.以上都可以2.能把稀盐酸、水和氢氧化钠三种无色溶液鉴别出来,应选择()A.石蕊试液B.无色酚酞C.紫色石蕊试液和氯化钡溶液D.硝酸银溶液3.土壤的酸碱度直接影响农作物的生长,已知某地土壤显微酸性,从土壤的酸碱性考虑在该地区不适宜种植的作物是()A.西瓜B.甘草C.小麦D.油菜4.区别稀盐酸和稀硝酸,选用的试剂是()A.AgNO3B.Na2CO3 C.BaCl2 D.石蕊试剂5.能跟盐酸反应放出可燃性气体的是()A.Na2CO3B.NaHCO3C.Zn D.AgNO36.要除去硝酸中溶有的少量盐酸选用()A.硝酸银B.氢氧化钠C.金属铜D.金属锌7.根据果汁瓶标签上标出的化学物质,请你运用学过的有关知识解答下列各题。
(1)这种果汁喝起来有酸味,则对果汁pH的判断,正确的是()A.pH>7 B.pH=7 C.pH<7 D.pH=14(2)已知苯甲酸钠是一种防腐剂,化学方程式是C6H5COONa。
下列各组中,前面一个数表示苯甲酸钠中元素的种类,后面一个数表示1个苯甲酸钠分子中原子的个数,正确的一组是()A.4 15 B.5 16 C.6 15 D.4 68.如图,往稀盐酸中滴加氢氧化钠溶液至完全中和时,溶液的pH变化的图象正确的是()二、填空题 9.认识酸(1)写出下列物质的化学式:盐酸 硫酸 硝酸 (2)盐酸、硫酸、硝酸电离时生成的 全部是 ,所以它们都是 。
(3)根据酸的分子里是否含有氧原子,可以把酸分为含氧酸和无氧酸,上述三种酸中,属于含氧酸的是 。
(4)酸溶液的pH 值 7(<、>、=),酸溶液中加入石蕊溶液,变 色。
10.指出下列物质中加入石蕊试液或酚酞试液后的颜色变化:11.盐酸的主要化学性质:12.将一枚生锈的铁钉放入足量的盐酸中,先观察到的现象是 ,化学方程式为 ;过一会又观察到的现象 是 ,化学方程式是。

化学九年级关于酸的知识点酸是我们日常生活中常见的一种化学物质,它具有酸味和腐蚀性。
在化学九年级的学习中,我们需要掌握关于酸的一些基本知识点,包括酸的性质、酸的分类、酸的反应和酸的应用等。
下面将介绍这些知识点,以帮助同学们更好地理解和掌握酸的特性。
一、酸的性质1. 酸味:酸溶液具有酸味,但我们不能随意尝试,以免对身体造成伤害。
2. 腐蚀性:酸有强腐蚀性,可以溶解金属、腐蚀皮肤和食物等,因此要小心使用和储存。
3. 酸性物质:酸能够与碱反应,呈现酸性物质的性质,并且能改变指示剂的颜色。
二、酸的分类1. 按溶解度:可溶性酸和不溶性酸。
可溶性酸是指能够在水中溶解的酸,如硫酸、盐酸;不溶性酸是指不能在水中溶解的酸,如二氧化碳。
2. 按酸的强弱:强酸和弱酸。
强酸是指酸性强,能完全电离产生H+离子的酸,如盐酸、硫酸;弱酸是指酸性较弱,只能部分电离产生H+离子的酸,如乙酸、硼酸。
3. 按化学成分:无机酸和有机酸。
无机酸是指由无机物质构成的酸,如硫酸、盐酸;有机酸是指由有机物质构成的酸,如乙酸、柠檬酸。
三、酸的反应1. 酸与金属反应:酸与活泼金属反应能生成盐和氢气,如盐酸与锌反应生成氯化锌和氢气的方程式为:2HCl + Zn → ZnCl2 +H2↑。
2. 酸与碱反应:酸与碱反应能生成盐和水,这种反应称为中和反应。
如盐酸与氢氧化钠反应生成氯化钠和水的方程式为:HCl + NaOH → NaCl + H2O。
3. 酸与金属氧化物反应:酸与金属氧化物反应能生成盐和水。
如硫酸与氧化铜反应生成硫酸铜和水的方程式为:H2SO4 + CuO→ CuSO4 + H2O。
四、酸的应用1. 工业上的应用:酸被广泛应用于冶金、制药、染料、塑料和化肥等工业领域。
2. 日常生活中的应用:酸被用于制作食品酸化剂、饮料、清洁剂等,同时也是调味品和食品添加剂的重要成分。
3. 医学上的应用:酸被用于药物的生产和酸碱平衡的调节等方面,如胃酸能够消化食物。

酸的知识点归纳总结一、酸的概念酸是一类化合物的总称,它们具有一些共同的化学性质,例如酸味、导电性、酸碱指示剂变色、与碱起反应等。
常见的酸包括无机酸和有机酸,它们可以溶解在水中,产生氢离子,使溶液呈酸性。
二、酸的分类1. 按化学性质分(1)无机酸:是指由无机物质组成的酸,如硫酸、盐酸、硝酸等;(2)有机酸:是指由碳和氢以及其他元素组成的酸,如乙酸、柠檬酸等。
2. 按酸度分(1)强酸:指在水中完全离解的酸,产生大量氢离子的酸,例如硫酸、盐酸等;(2)弱酸:指在水中部分离解的酸,产生少量氢离子的酸,例如乙酸、柠檬酸等。
3. 按产生氢离子速度分(1)氧化性酸:是指与金属反应能产生氢气的酸,例如硫酸;(2)非氧化性酸:是指不能与金属反应产生氢气的酸,例如盐酸。
三、酸的性质1. 酸味在酸的水溶液中有酸味,但酸的味道通常不是很强烈,因此并不是鉴别酸的最可靠特征。
2. 导电性酸水溶液能导通电流,这是因为酸性溶液中含有大量的氢离子,它们能在电场的作用下迅速移动,形成电流。
3. 对蓝色石蕊试纸的反应酸性的物质能使蓝色石蕊试纸变红,这是因为酸使得石蕊试纸上的蓝色物质变为红色。
4. 与碱反应酸和碱反应生成盐和水的反应称为中和反应,这是酸的又一种特征。
四、酸的应用1. 工业生产某些酸是工业生产中重要的原料,如硫酸广泛应用于肥料、玻璃、造纸等工业;2. 食品加工食品加工中有机酸如柠檬酸、醋酸等是常用的酸味剂;3. 医药卫生酸可以用作药物的中和剂、漱口水和清洗剂。
五、常见的酸1. 硫酸硫酸是一种强酸,可以溶解许多金属和非金属,也是很多化学反应的重要试剂,如制取氢气、氧气、二氧化硫等。
2. 盐酸盐酸是一种强酸,可以用于清洗金属表面、去油污等,也是很多工业过程中的重要原料。
3. 硝酸硝酸是一种强酸,可以用于金属表面的抛光、石英和玻璃的蚀刻等。
4. 醋酸醋酸是一种有机酸,常用于食品加工和食品保鲜,也是溶剂和试剂的重要原料。
5. 柠檬酸柠檬酸是一种有机酸,广泛用于食品加工、化妆品和清洗剂等领域,也是生物化学实验中的重要试剂。

酸及其化学性质1.电离:一些物质溶解于水或者受热熔化而离解成自由移动离子的过程叫做电离2.酸:电离产生的阳离子只有氢离子的化合物。
如HCl、H2SO4、HNO3、H2CO3等;3.酸的通性:(1)跟指示剂反应PH<7酸能使紫色石蕊变红色,不能使无色酚酞变色。
注意:用玻璃棒蘸少许溶液PH 试纸时滴在PH试纸中部.酸的PH<7,但PH<7的不一定都是酸。
(2)酸+ 碱--- 盐+ 水(中和反应)①用胃舒平中和过多胃酸 3HCl + Al(OH)3==== AlCl3+ 3H2O 。
②硫酸和氢氧化铜反应Cu(OH)2+ H2SO4 === CuSO4+ 2H2O。
(3)金属氧化物+酸---- 盐+ 水(复分解反应)①用盐酸除铁锈Fe2O3+ 6HCl === 2FeCl3+ 3H2O (Fe离子二绿三黄)②变黑的铜丝和稀硫酸反应 CuO + H2SO4==== CuSO4+ H2O(4)酸+ 盐----- 另一种酸+ 另一种盐(复分解反应)①检验氢氧化钠已变质(加盐酸)Na2CO3+ 2HCl === 2NaCl + H2O + CO2↑②检验盐酸中的氯离子HCl + AgNO3=== AgCl↓+ HNO3③检验硫酸中的硫酸根离子H2SO4+ BaCl2==== BaSO4↓+ 2HCl(5)金属单质+酸(稀盐酸,稀硫酸,醋酸)---- 盐+ 氢气(置换反应)金属活动性顺序K Ca Na Mg Al、Zn Fe Sn Pb (H)、 Cu Hg Ag Pt Au①生锈铁钉在足量盐酸中产生气泡Fe + H2SO4= FeSO4+ H2↑②实验室制氢气 Zn + H2SO4= ZnSO4+ H2↑像以上的(2)(3)(4)反应中,都是两种化合物互相交换成分,生成新的两种化合物,我们把它叫做复分解反应。
复分解反应是有一定的要求的,要求反应物必须要溶于水,而且生成的产物中必须要有气体或沉淀或水(其中1个即可)。
酸的性质酸度和常见酸的性质酸是一种常见的化学物质,具有特定的性质和化学反应。
酸性指标酸度以及常见酸的性质对于理解酸的本质和应用具有重要意义。
本文将探讨酸的性质、酸度和常见酸的特点,以及它们在日常生活和实验室中的应用。
一、酸的性质酸是指可以产生氢离子(H+)的物质。
一种常见的定义是布朗斯特德(Bronsted)酸,即能够给出质子(H+)的物质。
根据这个定义,酸能够与碱进行酸碱中和反应,形成水和盐。
酸具有以下特点:1. 酸味:大多数酸都具有酸味,例如柠檬汁和醋都具有酸味。
然而,强酸如硫酸等并不具有酸味,这是因为它们具有腐蚀性。
2. 腐蚀性:许多酸能够腐蚀金属和其他材料。
例如,稀硫酸可以腐蚀铁,形成氢气和铁离子。
这是由于酸能够与金属反应,释放出氢气。
3. 导电性:酸在溶液中能够导电。
酸溶液中的酸分子会离解生成氢离子(H+),这些离子能够导电。
导电性强弱与酸的浓度有关,浓度越高,导电性越强。
4. 反应性:酸与许多物质都能够发生反应。
与碱的中和反应是最常见的反应,但酸还可以与金属、碳酸盐等广泛反应,产生相应的盐和其他产物。
二、酸度酸度是衡量酸强度的指标。
常见的酸度标度有pH值和酸解离常数(Ka)。
1. pH值:pH是表示溶液酸碱性的负对数指标,范围从0到14。
pH 值低于7表示酸性,高于7表示碱性,等于7表示中性。
pH值越小,溶液越酸。
2. 酸解离常数(Ka):酸解离常数描述了酸分子在溶液中解离的程度。
酸解离常数越大,酸越强。
三、常见酸的性质1. 盐酸(HCl):盐酸是一种无色液体,具有强酸性。
它能够与碱迅速中和,产生氯化物盐。
盐酸广泛用于实验室中,也用于化学工业中。
2. 硫酸(H2SO4):硫酸是一种无色液体,也是一种强酸。
它具有强腐蚀性,能够与许多物质反应,包括金属和有机物。
硫酸广泛用于电池制造、肥料生产和石油工业等。
3. 醋酸(CH3COOH):醋酸是一种常见的有机酸,主要存在于醋中。
它具有酸味和弱酸性,能够与碱反应。
九年级化学酸的知识点
九年级化学中,酸是一个重要的知识点。
以下是关于酸的一些基本知识点:
1. 酸的定义:酸是指在水中能够产生氢离子(H+)的物质。
根据酸的氧化还原性质,还可以将酸定义为可以接受电子对的物质。
2. 酸的性质:
- 酸味酸性:大多数酸都具有酸味,但强酸的酸味往往无法通过嗅觉感知。
酸味是由于酸分子与味蕾的刺激作用。
- 酸性:酸溶液具有酸性,可以导致 pH 值小于7。
酸性越强, pH 值越低。
- 腐蚀性:许多酸具有腐蚀性,可以与其他物质发生化学反应,损坏材料。
- 导电性:酸溶液可以导电,因为酸溶液中的酸分子能够解离为离子。
3. 酸的种类:
- 强酸:酸解离程度高,可以完全解离(如盐酸、硫酸)。
- 弱酸:酸解离程度低,只有一小部分酸分子解离(如乙酸、柠檬酸)。
4. 酸的常见实例:
- 盐酸(HCl):可以从氯化氢气体溶解或用氢氯酸得到,是强酸。
- 硫酸(H2SO4):可以从硫酸铜溶解或用二氧化硫与氧气反应得到,是强酸。
- 醋酸(CH3COOH):主要成分是乙酸,是弱酸。
- 柠檬酸(C6H8O7):柠檬中的主要成分,是弱酸。
5. 酸的产生:
- 酸可以通过氧化金属、非金属元素或其化合物得到。
- 酸也可以通过电离和溶解来产生。
这些是九年级化学中关于酸的基本知识点,希望对你有帮助!。