铜与浓硫酸的反应探究(旧人教版必修1)
- 格式:ppt
- 大小:1.09 MB
- 文档页数:19

浓硫酸与铜反应的实验探究高中化学教材必修1(新课标)第四章第四节《氨硝酸硫酸》中,为了讲解浓硫酸的氧化性,设计了浓硫酸与铜反应的实验(实验4-9),教材中关于浓硫酸与铜反应的实验是这样叙述的:“我们已经知道,铜不能与酸反应放出H2。
但浓硫酸却可以与铜发生氧化还原反应,反应除生成硫酸铜外,还生成二氧化硫和水。
”(实验装置及现象如下图-1所示)一、提出问题在实际操作时,试管底部往往有黑色沉淀物,反应所形成的溶液呈灰绿色,加热时间长一些,溶液颜色可变浅。
如果有硫酸铜生成,溶液应该是蓝色,为什么溶液呈灰绿色而且试管底部有黑色物质出现呢?为了达到理想的实验效果并且解释这些现象,我们从反应产物和反应条件两方面着手对浓硫酸与铜的反应做了一些探究。
二、实验验证实验仪器:铁架台、酒精灯、大试管、小试管、单孔橡皮塞、双孔橡皮塞、温度计、导管与橡皮管若干;实验药品:铜丝、铜片、不同浓度的浓硫酸、品红溶液、蒸馏水。
(一)浓硫酸的浓度对反应的影响我们先来探究当铜片规格相同、硫酸过量时,浓硫酸浓度对实验的影响。
1.实验过程【实验1-1】取18.4mol/L浓硫酸3mL置于试管中,向其中放一小块铜片,并用酒精灯加热。
实验现象:开始加热一会儿后产生气泡,在铜片表面有细小黑色颗粒状物质生成并进入浓硫酸中,形成黑色悬浊液。
随着温度升高,直至沸腾,黑色颗粒状物质逐渐转变成细小灰白色颗粒状。
试管中出现大量白雾,品红溶液褪色。
停止加热静置,未反应的铜表面有黑色物质,试管底部沉淀的固体物质呈灰白色,试管中的液体呈灰绿色。
继续冷却试管时,溶液的颜色慢慢变浅。
将此无色溶液倒入废液缸中,向试管中残留的灰白色固体中加少量蒸馏水,所得溶液呈很浅的蓝色。
【实验1-2】取16mol/L浓硫酸3mL置于试管中,向其中放一小块铜片,并用酒精灯加热。
实验现象:与【实验1-1】现象相似,但溶液中灰白色沉淀较少,溶液也呈浅蓝色。
冷却后溶液仍然为浅蓝色。
【实验1-3】取14mol/L浓硫酸3mL置于试管中,向其中放一小块铜片,并用酒精灯加热。

浓硫酸与铜反应的实验探究高中化学教材必修1(新课标)第四章第四节《氨硝酸硫酸》中,为了讲解浓硫酸的氧化性,设计了浓硫酸与铜反应的实验(实验4-9),教材中关于浓硫酸与铜反应的实验是这样叙述的:“我们已经知道,铜不能与酸反应放出H2。
但浓硫酸却可以与铜发生氧化还原反应,反应除生成硫酸铜外,还生成二氧化硫和水。
”(实验装置及现象如下图-1所示)一、提出问题在实际操作时,试管底部往往有黑色沉淀物,反应所形成的溶液呈灰绿色,加热时间长一些,溶液颜色可变浅。
如果有硫酸铜生成,溶液应该是蓝色,为什么溶液呈灰绿色而且试管底部有黑色物质出现呢?为了达到理想的实验效果并且解释这些现象,我们从反应产物和反应条件两方面着手对浓硫酸与铜的反应做了一些探究。
二、实验验证实验仪器:铁架台、酒精灯、大试管、小试管、单孔橡皮塞、双孔橡皮塞、温度计、导管与橡皮管若干;实验药品:铜丝、铜片、不同浓度的浓硫酸、品红溶液、蒸馏水。
(一)浓硫酸的浓度对反应的影响我们先来探究当铜片规格相同、硫酸过量时,浓硫酸浓度对实验的影响。
1.实验过程【实验1-1】取18.4mol/L浓硫酸3mL置于试管中,向其中放一小块铜片,并用酒精灯加热。
实验现象:开始加热一会儿后产生气泡,在铜片表面有细小黑色颗粒状物质生成并进入浓硫酸中,形成黑色悬浊液。
随着温度升高,直至沸腾,黑色颗粒状物质逐渐转变成细小灰白色颗粒状。
试管中出现大量白雾,品红溶液褪色。
停止加热静置,未反应的铜表面有黑色物质,试管底部沉淀的固体物质呈灰白色,试管中的液体呈灰绿色。
继续冷却试管时,溶液的颜色慢慢变浅。
将此无色溶液倒入废液缸中,向试管中残留的灰白色固体中加少量蒸馏水,所得溶液呈很浅的蓝色。
【实验1-2】取16mol/L浓硫酸3mL置于试管中,向其中放一小块铜片,并用酒精灯加热。
实验现象:与【实验1-1】现象相似,但溶液中灰白色沉淀较少,溶液也呈浅蓝色。
冷却后溶液仍然为浅蓝色。
【实验1-3】取14mol/L浓硫酸3mL置于试管中,向其中放一小块铜片,并用酒精灯加热。

2018年第1期教育与装备研究卖验教学铜和浓硫酸反应实验的探究宋志贵摘要:针对中学化学教学中铜和浓硫酸反应实验出现的问题,通过文献和实验探究了影 响铜和浓硫酸反应实验现象的因素,在文献资料的指导下,对铜与浓硫酸反应从反应的温 度、硫酸的浓度、铜的用量、实验操作的方法等方面对反应进行了研究,得出了获得铜和浓 硫酸反应理想实验现象应注意的问题和实验的方法。
关键词:铜;浓硫酸;实验;温度;浓度;操作方法一、问题的提出浓硫酸和稀硫酸性质的不同,表现在浓硫 酸在加热的条件下能和铜发生反应。
中学化 学教材中通过铜和浓硫酸反应的实验来说明 浓硫酸的强氧化性以及反应生成的产物。
对 于铜和浓硫酸反应的实验,让学生认识浓硫 酸的强氧化性的最适宜的现象,就是反应过 程中溶液变为蓝色、品红溶液褪色。
但是按 照教材中的方法进行实验,出现的现象并不 是这样,这就给学生认识铜和浓硫酸反应造 成了困惑。
苏教版高中化学必修1中浓硫酸和铜反应 的实验方法为[1]:将一小块铜片放入试管中, 然后加入2m L 浓硫酸,用如图1所示的实验装 置进行实验,观察实验现象。
按照教材中的方法进行实验,我们观察到 的现象是:在对反应物加热的过程中,铜片首先 变为黑色,然后溶液先由无色变为浅蓝色;继续 加热,液体的蓝色消失,出现灰褐色或灰白色的 浑浊物,品红溶液褪色。
这样的实验现象对铜图1 铜和浓硫酸反应实验装置和浓硫酸反应的教学是不利的,让学生难以理 解,实验也不能突出课堂教学的重点。
实验能 不能避免出现对学生造成困惑的多余的现象? 教材中书写的化学方程式为:Cu + 2H2S04 (浓)j =CuS04+S02T +2H 20。
实验出现的现象 能否和教材书写的化学方程式相一致呢?我们 对此进行了研究。
二、铜和浓硫酸反应的实验研究(一)铜和浓硫酸反应的文献[2]文献资料表明,在不同的温度下,98%的浓 硫酸和金属铜发生的发应不同,产物复杂多样。
温度在543K 以上发生的反应主要为:宋志贵,江苏省徐州市第一中学,高级教师,江苏省特级教师。


实验(铜与浓硫酸反应)(1)仔细观察铜与浓硫酸的反应,发现:开始给试管中的铜与浓硫酸加热,无现象。
反应是在有气泡产生,随之铜片表面变黑时开始的。
当大量气泡产生,体系达沸腾后,铜片表面的黑色物质不断脱落,并在沸腾的溶液中由大到小,铜片表面继续变黑。
停止加热,铜片上仍有黑色物质附着,试管底部有黑白相间的固体,溶液并无明显的蓝色。
(2)停止反应后,将铜片取出,用少许水洗涤。
可见洗液呈明显蓝色。
且铜片上黑色物质减少,但不能完全溶解。
(3)向(2)之黑色未溶物中加入氰化钾溶液,则全部溶解。
向此溶液中加入亚硝酰铁氰化钠,则溶液显紫色,示有S2-。
(4)取少量(1)中清液,加水稀释,无明显蓝色,加入浓氨水有[Cu(NH3)4]2+的蓝色出现。
用K4Fe(CN)6检验,有铜色Cu2Fe(CN)6沉淀生成,示有Cu2+。
(5)继续加热(1)试管中的浓硫酸及黑白相间物质,则固体物质有部分溶解现象。
将未溶物按前面的程序操作,结果相同。
(6)将铜与浓硫酸反应时的气体导出,使之通入碘酸钾溶液中,片刻后加CCl4并振荡,有单质碘的紫色出现,继续通气体,I2的紫色又褪去;将气体通入品红溶液中——品红褪色,示有SO2气体。
将余烬火柴放入气体中,偶尔有闪点出现,示有少量氧放出。
分析实验(2)可认为黑色物质部分溶于稀硫酸,即有Cu2O或CuO存在。
实验(3)可认为黑色物质是Cu2S或CuS。
实验(4)可知铜与浓硫酸的反应,体系中游离的Cu2+不多。
实验(1)(5)(6)可知铜与浓硫酸的反应中有单质硫、氧气、二氧化硫产生。
热力学分析用热力学分析以上现象则结论更可靠。
1.对于简单反应的热力学分析Cu与浓H2SO4的反应,如果有CuO、Cu2O、CuS、Cu2S生成,则可能有下列反应发生:① Cu+H2SO4==CuO+SO2+H2O②2Cu+H2SO4==Cu2O+SO2+H2O2Cu+2H2SO4==2CuS+2H2O+3O2④4Cu+2H2SO4==2Cu2S+2H2O+3O2这四个反应的热力学计算结果,列于表1。

浓硫酸与铜反应的实验改进【问题的提出】在研究浓H2SO4的化学性质时,Cu与浓H2SO4的反应是用来说明浓H2SO4具有很强的氧化性的一个典型反应,为使学生能全面理解并掌握这一重要化学反应,在教材中设计了有关铜和浓硫酸发生反应的演示实验。
人教版教材必修一中的实验装置图为:但若按教材中所提供的装置进行实验,很难得到预期的实验现象,在实验过程中过多的浪费药品,而且会产生大量的有毒气体污染环境,尾气处理得不够充分,因此,我们应该从实验装置入手,在原有的基础上对实验进行必要的改进。
【实验目的】1.认识浓硫酸与铜的反应,进一步了解SO2的性质。
2.学会发现问题,提出问题,进而学会运用学过的化学知识设计实验方案,从实验中学会得出结论解决问题。
3.培养思考能力和动手能力,体会设计实验以及验证实验的乐趣。
【实验原理】铜与浓硫酸之间反应的化学方程式如下:2H2SO4(浓)+Cu===CuSO4+2H2O+SO2↑Cu与浓H2SO4反应生成SO2说明浓H2SO4具有很强的氧化性,而产生的SO2具有漂白性,同时SO2也是一种酸性气体,在实验中可以用品红试纸验证SO2具有漂白性,用蓝色石蕊试纸验证SO2是一种酸性气体。
【实验仪器与试剂】石蕊试纸1片【实验装置图】【实验步骤】1.取适量浓硫酸加入到具支试管中,用量不超过试管体积的三分之一(约10ml);2.取铜丝穿过胶塞,使铜丝能在胶塞中上下活动,塞紧胶塞,然后将伸入试管中的铜丝一端拴上一束细铜丝,使铜丝下端没入浓硫酸之中;3.在硬质玻璃管中分别放上湿润的品红试纸、湿润的石蕊试纸,在烧杯中加入适量饱和NaOH溶液;4. 如图组装好装置后,用酒精灯加热浓硫酸5.待反应结束后,使大试管中浓硫酸与金属铜片发生脱离,移去酒精灯,加热硬质玻璃管,观察试纸颜色的变化;【实验现象】1.加热浓硫酸时产生大量白雾,直形玻璃管处有水珠生成2.硬质玻璃管中品红试纸由红色变为无色,蓝色石蕊试纸变为红色3.加热结束之后具支试管内液体变为浅绿色,试管底部有灰色粉末状沉淀。


高中化学探究课:探究铜与浓硫酸的反应林绮玲汕头市第一中学一、背景人民教育出版社出版的《普通高中课程标准实验教科书化学•必修①》第四章第四节中的实验4—8,演示铜与浓硫酸的反应实验时,依着实验步骤,将铜片加入浓硫酸中并加热之,结果看到有使品红溶液褪色的气体生成,但并没有看见蓝色的Cu2+出现,反而出现了黑色的固体颗粒,依照课本的反应方程式,产物应该是CuSO4、SO2、H2O,该黑色产物究竟是什么,引起了我们探究的兴趣。
二、目的和意义目的:探究铜与浓硫酸反应的产物。
意义:通过铜与浓硫酸反应产物的探究,增强对氧化还原反应、铜与硫酸反应的了解;通过对已知到未知,再从未知到已知,扩展学生的视野,养成务实求真、勇于创新、积极实践的科学态度。
三、教学模式问题发现—实验探究。
四、教学过程(一)准备阶段1.教师提出问题。
提前一节课,教师演示铜与浓硫酸的反应,要求学生观察实验现象,学生清楚地观察到有异常的黑色固体物质生成。
2.教师引导学生,该黑色固体物质究竟是什么?怎样检验?怎样才能避免黑色固体物质产生?怎样通过实验进行探究?教师点拨学生根据化学实验的目的、要求,运用有关的化学知识和基本的实验操作技能,对实验的仪器、药品、装置、步骤等进行设想和规划,要求各小组提出一个合理的实验方案。
3.学生成立课题小组。
班级分成2个大组,每组再细分为5个小组,各小组推选一名组长。
第一大组探究如何避免黑色固体物质产生;第二大组探究温度与反应产物的关系及黑色固体物质的成分。
4.学生设计探究实验方案。
由各组长主持,学生课余分小组讨论,查阅资料、设计方案。
其方案包括研究的问题、对所研究的问题提出的假设、实验研究计划(包括实验目的、实验原理、实验用品、实验装置、实验步骤和研究方法、小组成员分工情况等内容)。
学生撰写实验方案:由各组长收集、整理、归纳、总结实验方案。
5.实验材料准备。
开放实验室。
请实验室的老师协助,学生根据自己制定的实验研究计划,自主准备实验材料。
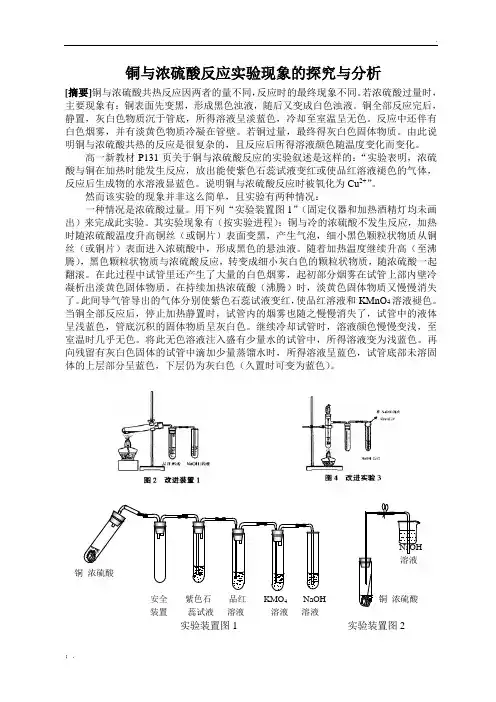
铜与浓硫酸反应实验现象的探究与分析[摘要]铜与浓硫酸共热反应因两者的量不同,反应时的最终现象不同。
若浓硫酸过量时,主要现象有:铜表面先变黑,形成黑色浊液,随后又变成白色浊液。
铜全部反应完后,静置,灰白色物质沉于管底,所得溶液呈淡蓝色,冷却至室温呈无色。
反应中还伴有白色烟雾,并有淡黄色物质冷凝在管壁。
若铜过量,最终得灰白色固体物质。
由此说明铜与浓硫酸共热的反应是很复杂的,且反应后所得溶液颜色随温度变化而变化。
高一新教材P131页关于铜与浓硫酸反应的实验叙述是这样的:“实验表明,浓硫酸与铜在加热时能发生反应,放出能使紫色石蕊试液变红或使品红溶液褪色的气体,反应后生成物的水溶液显蓝色。
说明铜与浓硫酸反应时被氧化为Cu2+”。
然而该实验的现象并非这么简单,且实验有两种情况:一种情况是浓硫酸过量。
用下列“实验装置图1”(固定仪器和加热酒精灯均未画出)来完成此实验。
其实验现象有(按实验进程):铜与冷的浓硫酸不发生反应,加热时随浓硫酸温度升高铜丝(或铜片)表面变黑,产生气泡,细小黑色颗粒状物质从铜丝(或铜片)表面进入浓硫酸中,形成黑色的悬浊液。
随着加热温度继续升高(至沸腾),黑色颗粒状物质与浓硫酸反应,转变成细小灰白色的颗粒状物质,随浓硫酸一起翻滚。
在此过程中试管里还产生了大量的白色烟雾,起初部分烟雾在试管上部内壁冷凝析出淡黄色固体物质。
在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢消失了。
此间导气管导出的气体分别使紫色石蕊试液变红,使品红溶液和KMnO4溶液褪色。
当铜全部反应后,停止加热静置时,试管内的烟雾也随之慢慢消失了,试管中的液体呈浅蓝色,管底沉积的固体物质呈灰白色。
继续冷却试管时,溶液颜色慢慢变浅,至室温时几乎无色。
将此无色溶液注入盛有少量水的试管中,所得溶液变为浅蓝色。
再向残留有灰白色固体的试管中滴加少量蒸馏水时,所得溶液呈蓝色,试管底部未溶固体的上层部分呈蓝色,下层仍为灰白色(久置时可变为蓝色)。

铜与浓硫酸反应实验现象的探究与分析引言:铜是一种常见的金属元素,而浓硫酸是一种强酸。
对铜与浓硫酸的反应进行实验,可以观察到一系列的反应现象。
本文将探究铜与浓硫酸反应的实验现象,并对其进行分析。
实验材料与方法:实验材料:铜片、浓硫酸、试管、酒精灯、玻璃棒等。
实验方法:1.将一块铜片放入试管中;2.将一定量的浓硫酸添加到试管中,确保完全覆盖铜片;3.观察反应现象并记录。
实验现象:1.硫酸的变化:浓硫酸是一种无色液体,但在与铜反应后会出现变化。
观察可发现,起初的浓硫酸逐渐变为深蓝色或浅蓝色。
这是因为铜与硫酸反应生成了硫酸铜,导致溶液颜色变化。
2.产生气体:在铜与浓硫酸反应的过程中,可以观察到气泡产生。
这是因为铜与硫酸反应生成了氢气。
氢气一般是无色无味的,用酒精灯的火焰进行点燃,其会发出“呼呼”声并燃烧。
3.产生热量:观察可发现,铜片与浓硫酸反应时会发热。
这是因为铜与硫酸反应是一个放热反应,反应过程中释放出热量。
4.产生溶液:在铜与浓硫酸反应的过程中,可以观察到铜片逐渐溶解在溶液中,并且观察到溶液的体积逐渐增大。
这是因为铜与浓硫酸反应生成了硫酸铜,使得溶液中溶质的体积增加。
5.反应结束:当铜片完全消耗后,反应会停止。
此时,溶液中的溶质浓度不再改变,并且铜片完全溶解。
分析:Cu+2H2SO4->CuSO4+2H2O+SO2↑反应过程可以分为以下几个步骤:1.铜片表面生成一层氧化铜膜:浓硫酸是一种强氧化剂,与铜金属直接接触后会使铜金属表面发生氧化反应,生成一层氧化铜膜。
这层氧化铜膜起到了保护铜片不被进一步腐蚀的作用。
2.硫酸离子进入氧化铜膜:在氧化铜膜上形成了一个正电荷,吸引硫酸离子进入氧化铜膜中。
3.铜离子释放:硫酸离子进入氧化铜膜后,将氧化铜膜中的铜离子释放出来,进一步进行反应。
4.生成硫酸铜溶液:铜离子与硫酸根离子结合,生成硫酸铜溶液。
5.产生气体:反应中释放的氢气会导致气泡的产生。
6.反应结束:当铜片完全溶解时,反应会结束,溶液中的溶质浓度不再改变。

对浓硫酸与铜反应实验的深入探究作者:曹万宝来源:《学园》2010年第06期一问题缘起人教版高一《化学》教科书对浓硫酸与铜的反应实验过程描述如下:在一支试管里加入一小块铜片,然后再加入3ml浓硫酸,用装有玻璃导管的单孔胶塞塞好,加热,放出的气体分别通入紫色石蕊试液或品红溶液中,观察反应现象。
反应完毕,冷却后,将试管中的液体慢慢倒入另一支盛有少量水的试管中,观察溶液的颜色。
教材上对实验现象的描述和解释是:浓硫酸与铜在加热时能发生反应,放出能使紫色石蕊变红或使品红溶液褪色的气体。
反应后生成物的水溶液显蓝色。
说明铜与浓硫酸反应时被氧化成了Cu2+,生成的气体是SO2。
反应方程式为:Cu+2H2SO4(浓)== CuSO4+SO2↑+2H2O可是笔者在做实验时发现:开始加热一会后先产生气泡,有细小黑色颗粒状物质从铜片表面进入浓硫酸中,形成黑色悬浊液;随着温度升高(至沸腾),试管中产生了细小的白色颗粒状物质,出现了大量白雾,品红溶液褪色;停止加热静置,未反应完的铜表面有黑色的不溶物,试管底部沉积的固体物质有黑色的和白色的,试管中的液体呈灰白色,将试管内的溶液倒入另一支盛有水的试管中,溶液的蓝色不够明显。
出现了这种情况,导致课堂演示实验没有达到演示的目的,而且在教学过程中很难向学生解释实验过程中出现的异常现象。
二探究过程1.黑色物质成分的探究取18.4mol/L浓硫酸3ml和一小块铜片,按课本要求做实验。
试验完成后,笔者仔细进行了以下实验过程,探究试管中产物的成分。
(1)取少量试管中白色物质,加入另一支试管中,再加入适量水并振荡,发现白色固体溶解,溶液呈现蓝色;向此蓝色溶液中加入少量K4[Fe(CN)6]后,发现产生红棕色沉淀,说明是Cu2+,由此可知铜与浓硫酸反应产生了CuSO4。
(2)将铜片取出,用少许水洗涤中,黑色物质脱落但不溶解。
往洗涤液中滴加稀硫酸,发现部分黑色物质溶解,溶液呈现蓝色,由此说明黑色物质中有CuO。
铜与浓硫酸反应实验的探究作者:罗金虹刘茜来源:《课程教育研究·新教师教学》2017年第02期【摘要】对高中化学人教版教材《化学1(必修)》中“铜与浓硫酸反应”实验的装置进行了改进,改进后可同时检验SO2的漂白性、还原性和酸性,增加了简易尾气吸收装置。
分析了实验过程中上层溶液呈绿色的原因并进行实验验证。
结果表明,棕黄色的热浓硫酸与蓝色水合铜离子混合导致上层溶液呈绿色。
【关键词】铜;浓硫酸;实验改进;绿色溶液【中图分类号】G633.8 【文献标识码】B 【文章编号】2095-3089(2017)02-0276-02Cu与浓H2SO4反应实验是高中化学教材中经典的实验之一,旨在让学生理解浓硫酸的强氧化性及SO2的检验方法[1]。
按照高中化学人教版教材《化学1(必修)》第101页图4-32操作,实验过程中会遇到以下情况:在橡胶塞上直接抽拉铜丝不易操作,抽动铜丝时可能会使橡胶塞与铜丝的接触处漏气;该装置可以验证二氧化硫的漂白性,但不能体现SO2的其它性质,如酸性和还原性;没有尾气吸收装置;可能发生倒吸现象,给实验带来安全隐患[2]。
针对以上不足,我们从绿色环保、装置简约安全等角度对该实验进行了改进,并对实验条件及实验现象进行了讨论。
一、实验改进1.实验药品与仪器药品:98%浓硫酸溶液、高锰酸钾溶液、紫色石蕊溶液、碱性品红溶液、20%氢氧化钠溶液。
仪器:铁架台、具支试管、量筒、绕成螺旋状的铜丝、单孔橡胶塞、T形管、橡胶帽、双联打气球、长直玻管、气球、棉花、试纸、橡胶管、止水夹。
2.实验过程实验装置如图1所示。
将铜丝灼烧至绿色火焰消失后,用砂纸反复打磨,再将其穿过与T 形管连接好的胶帽。
使用胶帽既避免了装置漏气又方便了抽拉铜丝。
在长直玻璃管中从左向右依次放入润湿的品红试纸、紫色石蕊试纸、高锰酸钾试纸,三个试纸分别检验SO2的漂白性、酸性和还原性。
如图1连接好实验装置,检查装置的气密性。
用量筒量取一定体积的98%的浓硫酸溶液倒入具支试管中,塞好橡胶塞。
铜与浓硫酸反应实验现象的探究与分析[摘要]铜与浓硫酸共热反应因两者的量不同,反应时的最终现象不同。
若浓硫酸过量时,主要现象有:铜表面先变黑,形成黑色浊液,随后又变成白色浊液。
铜全部反应完后,静置,灰白色物质沉于管底,所得溶液呈淡蓝色,冷却至室温呈无色.反应中还伴有白色烟雾,并有淡黄色物质冷凝在管壁。
若铜过量,最终得灰白色固体物质。
由此说明铜与浓硫酸共热的反应是很复杂的,且反应后所得溶液颜色随温度变化而变化。
高一新教材P131页关于铜与浓硫酸反应的实验叙述是这样的:“实验表明,浓硫酸与铜在加热时能发生反应,放出能使紫色石蕊试液变红或使品红溶液褪色的气体,反应后生成物的水溶液显蓝色。
说明铜与浓硫酸反应时被氧化为Cu2+”.然而该实验的现象并非这么简单,且实验有两种情况:一种情况是浓硫酸过量。
用下列“实验装置图1"(固定仪器和加热酒精灯均未画出)来完成此实验。
其实验现象有(按实验进程):铜与冷的浓硫酸不发生反应,加热时随浓硫酸温度升高铜丝(或铜片)表面变黑,产生气泡,细小黑色颗粒状物质从铜丝(或铜片)表面进入浓硫酸中,形成黑色的悬浊液。
随着加热温度继续升高(至沸腾),黑色颗粒状物质与浓硫酸反应,转变成细小灰白色的颗粒状物质,随浓硫酸一起翻滚。
在此过程中试管里还产生了大量的白色烟雾,起初部分烟雾在试管上部内壁冷凝析出淡黄色固体物质。
在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢消失了。
此间导气管导出的气体分别使紫色石蕊试液变红,使品红溶液和KMnO4溶液褪色。
当铜全部反应后,停止加热静置时,试管内的烟雾也随之慢慢消失了,试管中的液体呈浅蓝色,管底沉积的固体物质呈灰白色。
继续冷却试管时,溶液颜色慢慢变浅,至室温时几乎无色。
将此无色溶液注入盛有少量水的试管中,所得溶液变为浅蓝色。
再向残留有灰白色固体的试管中滴加少量蒸馏水时,所得溶液呈蓝色,试管底部未溶固体的上层部分呈蓝色,下层仍为灰白色(久置时可变为蓝色)。
铜与浓硫酸反应的实验探索第12卷第1期2010年2月遵义师范学院JournalofZunyiNormalCollegeV o1.12.No.1Feb.2010铜与浓硫酸反应的实验探索陈文兴,王敏,罗宿星(1.遵义师范学院化学系,贵州遵义563002;2.仁怀酒都高级中学,贵州仁怀564500) 摘要:对高中化学第一册中"铜与浓硫酸反应"演示实验的实验装置和实验方法进行了改进,用可移动的铜丝代替铜片,并对硫酸的浓度进行了探索.结果表明,当硫酸的浓度为80%时,实验现象鲜明,反应时问短,教学效果明显.关键词:铜丝;铜片;浓硫酸;改进中图分类号:G633.8文献标识码:C文章编号:1009—3583(2010)-01-011l_o3 TheResearchonExperimentinReactionofCopperandConcentratedSulfuricAcidCHENWen-xingJ,W ANGMin2,LUOSu-xing'(1.DepartmentofChemistry,ZunyiNormalCollege,Zunyi563002,China;2.Seniormidges choolofJiudu,Renhuai,564500,China)Abstract:Therearemanyinsufficienciesinthedemonstrationexperimentofcopperreaction withconcentratedsulfuric acidinBookoneofchemistrycourseinseniorhighschoo1.Byimprovingexperimentalmetho dandexperimentaldevice, ifwerisemoveablecoppersheetinsteadofbrasswires,andexploredtheconcentrationofsulfuricacidinthisexperiment, theresultsshowedthatwhentheeonncentrtionofsulfuricacidwas80%,theexperimentalphe nomenonwasmoreobvious, thereactiontimeWasshorterandtheteachingeffectwasbetter.Keywords:brasswires;coppersheet;concentratedsulfuricacid;experimentalimprovement ;amelioration铜与浓硫酸的反应是高中化学教材中重要的演示实验之一,实验的原理是:Cu+2H~S04(浓)CuSO+SO2t+2H20,实验方法是:在一支试管中加入一小块铜片,再加人3mL浓硫酸,然后用装有玻璃导管的单孔橡皮塞好,加热.将放出的气体通人品红溶液中,观察反应现象,见图1.反应完毕,冷却后,将试管中的液体慢慢倒入另一支盛有少量水的试管中,观察溶液的颜色【l】.该实验的教学目的是让学生通过观察到的实验现象(生成物溶于水后溶液呈蓝色,放出的气体能使品红溶液褪色),了解并掌握浓硫酸的氧化性质.然而.教材提供的实验方法和步骤存在四方面的欠缺:第一,装置属半敞开式,蘸有NaOH溶液的棉花团不敝fNaOIl溶/浊的梳他川图1课本演示实验能保证完全吸收多余的二氧化硫气体,就有可能造成环境污染,达不到当今绿色化学的标准;第二,要将反应后的液体倒入另一支盛有水的试管中,必须将反应物冷却,使得实验时间较长操作又烦琐,导致教学环节松散;第三,生成物中仍有浓硫酸,溶于水收稿日期:2009—10—15基金项目:遵义师范学院基础教育研究资助项目(基2008003)作者简介:陈文兴,女,贵州遵义人,遵义师范学院化学系高级实验师. 第12卷第1期遵义师范学院2010年2月图2改进装置1时放出大量的热,给实验带进安全隐患;第四,生成物中夹杂有大量的黑色物质,这些黑色物质不溶于水影响对溶液颜色的观察,甚至根本观察不到蓝色的溶液,使得实验现象既不鲜明,教学效果又不明显.针对这些问题,作者对课本实验作了探索性的改进.1仪器与试剂实验仪器:试管(20x180mm),具支试管(20x180mm),酒精灯,橡皮塞,乳胶头,导气管.实验药品:2moa0H,0.05%品红,98%浓硫酸,棉花,铜片,铜丝.2试验方法2.1改进方法一将蘸有NaOH溶液的棉花团改为装NaOH溶液的试管,确保完全吸收多于的二氧化硫气体.按图2所示安装实验装置,检查装置的气密性;在装有铜片的试管中加入3mL98%的浓硫酸,加热.待品红溶液褪至无色时,停止加热.2.1.1实验现象反应过程中出现大量的黑色固体物质沉淀于试管底部,试管中产生大量白色烟雾,品红溶液褪至无色.2.1.2结果讨论改进后的实验只解决了污染问题.但由于反应后期产生的SO气体量减少,装置内的气压降低,易导致品红溶液倒吸.品红溶液一旦倒吸,就会产生干扰,导致实验失败.2.2改进方法二增加缓冲装置,改品红溶液为蘸有品红溶液的长纸条放人试管内.图3所示.2.2.1实验现象溶液开始变蓝的同时出现黑色的物质,并产生大量的白色烟雾,待品红试纸完全褪成无色时,试管中只有黑色固体和无色液体.l】2,图3改进实验22.2.2实验结果分析由于98%的浓硫酸沸点是338~0",而硫酸铜晶体在218℃时就全部失水冈.随着反应时间的增加, 反应体系中的水分被蒸发,浓硫酸部分生成发烟硫酸,故产生大量的白色烟雾;产物硫酸铜处在非水体系中不显蓝色,因而观察不到蓝色的硫酸铜溶液生成.黑色的固体物质可能是铜与浓硫酸共热时反应生成的硫化亚铜和硫化铜的混合物.因为铜与浓硫酸反应时会有多种副反应发生13],低于IO0~C时5Cu+4H~O4(浓)一Cu+3CuSO4+4H20随着温度的升高,浓硫酸氧化性增强,继续发生如下的副反应:Cu~S+2H2SO4(浓)一CuS+CuSO~SO2T+2H20 CuS+2H~O4(浓)一CuS04+SO2T+S+2H20所以,在实验过程中由于黑色固体物质的干扰,既观察不到CuSO的白颜色,也不易观察到Cu(H~O)SO 呈现的蓝色.由此可知,影响反应的因素有:反应温度,反应时间,硫酸溶液的浓度.而导致黑色物质产生的主要原因是:反应时间过长,硫酸的浓度过大及未控制反应温度.当98%的浓HaSO.体积为3mL时,铜片的质量为0.1—0.6g(或相当于此用量比),实验效果较明显,实验成功率较高,故再次将实验改进.2.3改进方法三2.3.1实验方法改试管为具支试管.将铜片改为可上下抽动的铜丝.在橡皮塞上插入带有乳胶头的短玻璃管,将铜丝经乳胶头穿过玻璃管插入具支试管内,把铜丝末端绕成团,上端弯成小钩状(便于抽取悬人硫酸溶液中央的铜丝团,同时保证气密性),如图4所示.由于6o%的浓硫酸就具有一定的氧化性H.向具支试管中加入3mL80%的硫酸溶液,预热硫酸溶液接近沸腾时,撤离酒精灯,将铜丝伸人硫酸溶液中,反应立即发生.当品红试纸褪至无色时,把铜丝抽离硫酸溶液.陈文兴?铜与浓硫酸反应的实验探索图4改进实验32.3.2实验现象与结果反应开始试管中溶液逐渐变蓝,当品红试纸褪至无色时,溶液的蓝色鲜明,且没有黑色物质产生.2.4最佳反应条件配制50%—95%不同浓度的硫酸溶液.分别用相同体积不同浓度的硫酸溶液与质量相同的可移动铜丝按图4的装置和2.3.1的方法做对比实验,得到表1所示的一组实验数据:表1铜丝与5O盼—95%的硫酸溶液反应C/%5O6070758O859095L无色无色淡蓝色蓝色蓝色蓝色蓝黑色蓝黑色M无无无无无少许多大量t/min5.05.04.54.03.02.52.01.5注:C一硫酸的浓度;L_溶液的颜色;M一黑色固体;r 品红试纸褪色所需时间,下同.实验数据表明:硫酸溶液的浓度在70%一85%时,反应所需要时间较短,几乎看不到黑色沉淀,试管中溶液呈现的蓝色鲜明.再用72%一84%不同浓度的硫酸溶液,按2.3.l的方法进行对比试验,得到表2所示的一组实验数据:表2铜丝与72%一84%的硫酸溶液反应C,%72747678808284L淡蓝色淡蓝色淡蓝色蓝色蓝色蓝色蓝黑色M无无无元无很少少许t/min454.03.53.53.03.02.53结果与讨论根据表1和表2所示的实验数据得出:用80%的硫酸溶液做此实验.品红试纸褪至无色时只需3.0 分钟,试管中溶液呈现明显的蓝色,且没有黑色物质生成,是浓硫酸氧化铜的最佳反条件.实验中应注意:(1)控制反应温度,温度不宜太高,用小火加热;(2)硫酸溶液加热至接近沸腾时再将铜丝团伸进硫酸溶液中,并且铜丝团应悬在硫酸溶液中央;(3)品红试纸褪成无色后,应立即把铜丝团抽离硫酸溶液终止反应.改进后的实验具有以下优点:(1)整个实验装置简单,气密性良好,即能确保尾气被完全吸收,又避免了溶液倒吸;(2)可移动的铜丝既能灵活地控制反应进程,又可以重复使用,节约了药品;(3)简化了实验步骤,缩短了演示实验的时间.总之,经过探索改进后的实验现象既鲜明,教学效果又明显,不但达到绿色化学与环保的目的,同时还能开拓学生的思维,提高学生分析问题的能力.参考文献:【1】人民教育出版社化学室.全日制普通高级中学教科书(必修)化学嗍.北京:人民教育出版社,2003.【2】北京师范大学无机化学教研室,东北师范大学无机化学教研室.华中师范大学无机化学教研室,等.无机化学实验(第三版)【.北京:高等教育出版社,2001.【3】杨丽君,沙丽丽.铜与浓硫酸反应实验的探究【J】.玉溪师范学院,2005,22(12):43-45.[4]王贵和.中学化学实验研究[M】.贵阳:贵州教育出版社,2oo0.(责任编辑:朱彬)113。
铜与浓硫酸反应
铜与浓硫酸反应,铜逐渐溶解,有气泡生成,产生的气体能使紫色石蕊变红或红溶液褪色。
溶液冷却后稀释呈蓝色。
1铜与浓硫酸反应
铜与浓硫酸反应:铜逐渐溶解,有气泡生成,产生的气体能使紫色石蕊变红或红溶液褪色。
溶液冷却后稀释呈蓝色。
反应方程式为Cu + 2H2SO4(浓)(加热) ====CuSO4+ SO2↑+ 2H2O。
副反应有5Cu+4H2SO4(浓)=加热=3CuSO4+Cu2S+4H2O等。
2浓硫酸
浓硫酸,俗称坏水,化学分子式为H₂SO₄,是一种具有高腐蚀性的强矿物酸。
浓硫酸指质量分数大于或等于70%的硫酸溶液。
浓硫酸还具有强腐蚀性:在常压下,沸腾的浓硫酸可以腐蚀除铱和钌之外所有金属(甚至包括金和铂),其可以腐蚀的金属单质种类的数量甚至超过了王水。
硫酸在浓度高时具有强氧化性,这是它与稀硫酸最大的区别之一。
同时它还具有脱水性,难挥发性,酸性,吸水性等。