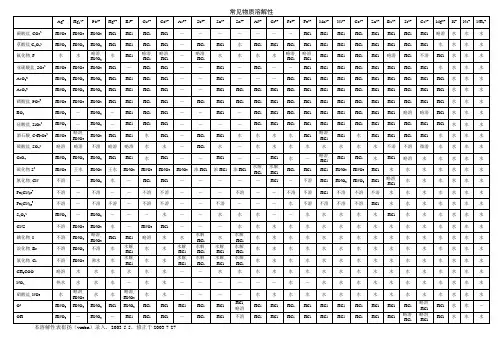
常见物质溶解性及溶度积
- 格式:doc
- 大小:2.72 MB
- 文档页数:57

难溶电解质的溶度积与溶解度之间的关系在化学溶解度常数的研究中,我们经常会遇到难溶电解质。
它们是指在水中溶解度非常小的电解质物质,比如银氯化物、铅碘化物等。
在研究这些物质时,我们需要了解它们的溶度积与溶解度之间的关系,这有助于我们更深入地理解溶解度常数的概念。
1. 溶度积的定义溶度积是指在一定温度下,难溶电解质在水中达到溶解平衡时,其离子浓度的乘积。
以银氯化物(AgCl)为例,其离子方程式为AgCl ⇄Ag⁺ + Cl⁻,在溶解平衡时,Ag⁺和Cl⁻的浓度分别为x,那么AgCl的溶度积Ksp就等于x²。
对于难溶电解质来说,Ksp的值通常非常小,代表其溶解度极低。
2. 溶解度与溶度积的关系难溶电解质的溶解度通常定义为单位体积溶液中难溶物质的质量。
溶解度是溶液饱和时,溶液中包含的物质的量,可以用溶度积来表达。
具体而言,当难溶电解质达到溶解平衡时,其溶解度与溶度积之间的关系为溶解度=√(Ksp)。
这表明,溶解度与溶度积之间存在平方根的关系。
3. 溶度积与溶解度的意义溶度积和溶解度的关系对我们有着重要的意义。
通过溶度积,我们可以了解难溶电解质在溶解平衡时离子的浓度,从而推导出其溶解度。
溶度积和溶解度的关系也是我们研究难溶电解质在水溶液中的行为和性质时的重要依据。
它还可以帮助我们预测在不同条件下溶液中难溶电解质的溶解度变化。
总结回顾通过上述分析,我们不难发现,难溶电解质的溶度积与溶解度之间存在着明显的关系。
溶度积是在溶解平衡下离子浓度的乘积,而溶解度则是溶液饱和时单位体积溶液中难溶物质的质量,其与溶度积之间存在平方根的关系。
这种关系帮助我们更深入地了解难溶电解质的溶解特性,以及在不同条件下其溶解度的变化规律。
个人观点对于难溶电解质的溶度积与溶解度之间的关系,我个人认为应该结合实际,在化学实验中进行验证和观察,以更加深入地了解其内在规律。
我们也可以进一步探讨难溶电解质的相关性质和应用,从而拓展对这一主题的理解和认识。

溶度积与溶解度的关系关键词:溶度积,溶解度难溶电解质的溶度积及溶解度的数值均可衡量物质的溶解能力。
因此,二者之间必然有着密切的联系,即在一定条件下,二者之间可以相互换算。
根据溶度积公式所表示的关系,假设难溶电解质为A m B n,在一定温度下其溶解度为S,根据沉淀-溶解平衡:B n(s)mA n+ + nB m−A[A n+]═ m S,[B m−]═ n S则K sp(A m B n)═ [A n+]m[B m−]n ═ (m S)m(n S)n ═ m m n n S m+n(8-2)溶解度习惯上常用100g溶剂中所能溶解溶质的质量[单位:g/(100g)]表示。
在利用上述公式进行计算时,需将溶解度的单位转化为物质的量浓度单位(即:mol/L)。
由于难溶电解质的溶解度很小,溶液很稀,可以认为饱和溶液的密度近似等于纯水的密度,由此可使计算简化。
【例题8-1】已知298K时,氯化银的溶度积为1.8×10−10,Ag2CrO4的溶度积为1.12×10−12,试通过计算比较两者溶解度的大小。
解(1)设氯化银的溶解度为S1根据沉淀-溶解平衡反应式:AgCl(s)Ag++Cl−平衡浓度(mol/L)S1S1K sp(AgCl)═ [Ag+][Cl−]═ S12S1 ═10⨯═ 1.34×10−5(mol/L)8.1-10(2)同理,设铬酸银的溶解度为S2AgCrO4(s)2Ag++ CrO42-平衡浓度(mol/L)2S2 S2K sp(Ag2CrO4)═[Ag+]2 [CrO42-]═(2S2)2S2═4S23S2 6.54×10−5(mol/L)>S1在上例中,铬酸银的溶度积比氯化银的小,但溶解度却比碳酸钙的大。
可见对于不同类型(例如氯化银为AB型,铬酸银为AB2型)的难溶电解质,溶度积小的,溶解度却不一定小。
因而不能由溶度积直接比较其溶解能力的大小,而必须计算出其溶解度才能够比较。

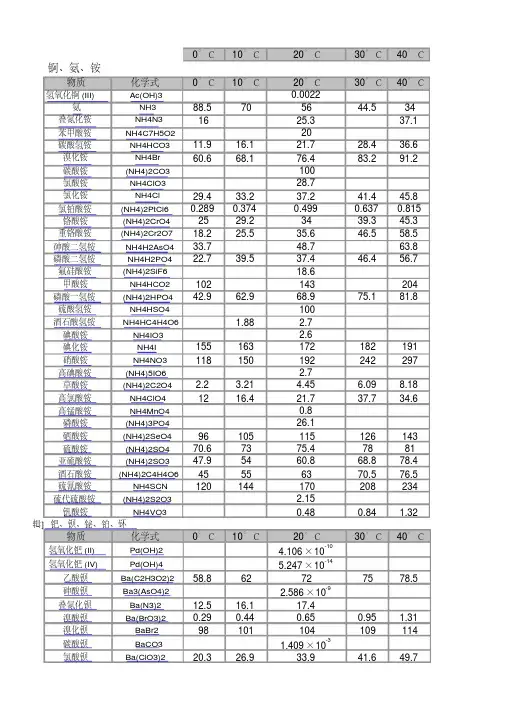

溶度积与溶解度关系嘿,朋友们!今天咱来聊聊溶度积和溶解度这对“好兄弟”。
咱先来说说溶解度,这就好比是一个班级里能容纳的学生数量。
有的物质比较容易溶解在溶剂里,就像那些性格开朗好相处的同学,能在班级里很自在地待着,数量也会比较多;而有的物质就比较难溶解,像是性格有点古怪的同学,在班级里的数量就比较少啦。
那溶度积呢,它就像是班级里的一种特殊规定或者标准。
只有达到了这个标准,物质才能稳定地存在于溶液中。
如果没达到,就好像不符合班级规定的同学,可能就待不下去啦。
你想想看,要是一种物质的溶解度很大,那是不是意味着它很容易就达到溶度积的要求呀?这就好像一个很优秀的同学,很轻松就能符合班级的各种标准。
但要是溶解度很小呢,那要达到溶度积可就有点费劲咯,就跟一个学习有点吃力的同学要达到很高的标准一样。
比如说盐吧,我们做菜经常会用到盐。
盐在水里的溶解度还不错,所以我们很容易就能在水里溶解一定量的盐。
但是如果水里已经溶解了很多盐,接近了溶度积,那再想溶解更多可就难喽。
这就好像班级里的座位有限,已经坐满了人,再想加人就不太容易啦。
再比如一些难溶的物质,就像有些很难融入集体的同学。
它们的溶解度很小,要达到溶度积就更是难上加难啦。
那这溶度积和溶解度的关系对我们生活有啥用呢?这用处可大啦!咱就说在化工生产中吧,工程师们得知道各种物质的溶度积和溶解度,这样才能合理地控制反应条件,让反应顺利进行,生产出我们需要的产品呀。
在环境保护方面也很重要哦!如果我们不了解一些污染物在水里的溶度积和溶解度,怎么能有效地治理水污染呢?总之,溶度积和溶解度的关系就像生活中的很多道理一样,看似简单,实则蕴含着大奥秘呢!我们要好好去研究它们,利用它们,让它们为我们的生活和社会发展服务呀!所以,可别小瞧了这溶度积和溶解度的关系哟!。

溶度积定义对于物质 AnBm(s)=n Am+(aq)+ mBn-(aq), 溶度积(Ksp)=(C(Am+) )^n ( C(mBn-))^m溶度积的应用很广泛。
在定性分析中,利用金属硫化物、氢氧化物、碳酸盐等溶度积的差异分离金属离子。
若往氯化铅饱和溶液中加入氯化钾时,溶液中Cl-浓度增大,Pb2+和Cl-的浓度系数次方之积较氯化铅的溶度积大,这时将有部分离子发生Pb2++2Cl- --→PbCl2的反应,将过剩的PbCl2沉淀出来,直至两种离子的浓度系数次方之积等于氯化铅的溶度积为止。
因此,为使溶解度小的物质完全沉淀,需要加入含有共同离子的电解质。
人教版化学选修4化学反应原理第三章沉淀的溶解平衡涉及溶度积的计算溶解度与溶度积的关系溶解度和溶度积的互相换算:两者都可以用来表示难溶电解质的溶解性。
溶度积是微溶解的固相与溶液中相应离子达到平衡时的离子浓度的乘积,只与温度有关。
溶解度不仅与温度有关,还与系统的组成,PH的改变,配合物的生成等因素有关。
只有同一类型的难溶电解质才能通过溶度积比较其溶解度(mol/l)的相对大小。
大多数实际溶解度S比由c计算得到的要大。
溶度积规则与离子积的关系离子积IP(ion product):任一条件下离子浓度幂的乘积。
Ksp表示难溶电解质的饱和溶液中离子浓度幂的乘积,仅是IP的一个特例。
数值分析1. IP=Ksp 表示溶液是饱和的。
这时溶液中的沉淀与溶解达到动态平衡,既无沉淀析出又无沉淀溶解。
2. IP<Ksp 表示溶液是不饱和的。
溶液无沉淀析出,若加入难溶电解质,则会继续溶解。
3. IP>Ksp 表示溶液为过饱和。
溶液会有沉淀析出常用溶度积常数。

沉淀溶解平衡沉淀溶解平衡在一定温度下难溶电解质晶体与溶解在溶液中的离子之间存在溶解和结晶的平衡,称作多项离子平衡,也称为沉淀溶解平衡。
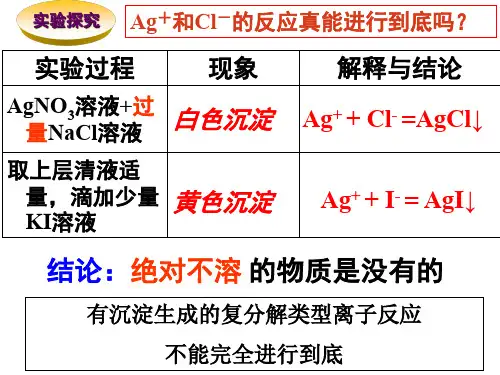
以AgCl为例,尽管AgCl在水中溶解度很小,但并不是完全不溶解。
从固体溶解平衡角度认识:AgCl在溶液中存在下属两个过程:①在水分子作用下,少量Ag+和Cl-脱离AgCl表面溶入水中;②溶液中的Ag+和Cl-受AgCl表面正负离子的吸引,回到AgCl表面,析出沉淀。
在一定温度下,当沉淀溶解和沉淀生成的速率相等时,得到AgCl的饱和溶液,即建立下列动态平衡:AgCl(s)<=> Ag+(aq)+ Cl-(aq)溶解平衡的特点是动态平衡,即溶解速率等于结晶速率,且不等于零。
其平衡常数Ksp称为溶解平衡常数;它只是温度的函数,即一定温度下Ksp一定。
溶解度和物质溶解性的划分中学里介绍过把某温度下100克水里某物质溶解的最大克数叫溶解度.。
习惯上把溶解度小于0.01g/100g 水的物质叫“难溶物”。
其实,从相平衡的角度理解溶解度更确切,即在一定温度和压力下,固液达到平衡时的状态。
这时把饱和溶液里的物质浓度称为“溶解度”,常用S(mol/L)表示. 极性溶剂水分子和固体表面粒子(离子或极性分子)相互作用,使溶质粒子脱离固体表面成为水合离子进入溶液的过程叫溶解。
溶液中水合离子在运动中相互碰撞重新结合成晶体从而成为固体状态并从溶液中析出的过程叫沉淀。
溶解、沉淀两个相互矛盾的过程是一对可逆反应,存在平衡状态,此平衡称为沉淀溶解平衡。
在科研和生产过程中,经常要利用沉淀反应制取难溶化合物或抑制生成难溶化合物,以鉴定或分离某些离子。
究竟如何利用沉淀反应才能使沉淀能够生成并沉淀完全、或将沉淀溶解、转化,这些问题要涉及到难溶电解质的沉淀和溶解平衡。
本节将对此进行讨论。
难溶电解质的溶度积严格地说,在水中绝对不溶的物质是不存在的。
通常将溶解度小于0.01 g/L的物质称为难溶电解质。


溶度积和溶解度间的关系
溶解度用S表示,其意义是实现沉淀溶解平衡时,某物质的体积摩尔浓度,它的单位是mol/L。
S 和从不同侧面描述了物质的同一性质—溶解性,尽管二者之间有根本的区别,但其间会有必然的数量关系。
在相关溶度积的计算中,离子浓度必须是物质的量浓度,其单位是mol/dm3,而溶解度的单位往往是g/100g水。
因此,计算时有时要先将难溶电解质的溶解度S 的单位换算成mol/L。
【例1】已知 CaCO3的= 8.7×10-9,求 CaCO3在水中的溶解度。
解:设CaCO3在水中的溶解度为S,则S为平衡浓度。
平衡浓度:(mol/L) S S
与S之间存在数量关系,是由于某些离子的浓度与S有关,例如在本例中[Ca2+]和[]均等于S。
【例2】298K 时,Ag2CrO4的溶解度为 1.34×10-4 mol/L,求 Ag2CrO4的溶度积。
解:
平衡浓度:(mol/L) 2S S
=[]2[]=(2S)2·(S)=4S3=4×(1.34×10-4)3=9.64×10-12
通过上面两个例子可知:相同类型的难溶电解质,其大的S也大。
不同类型的难溶电解质不能直接用溶度积比较其溶解度相对大小。
【AB型难溶强电解质】计算结果表明:对于基本上不水解的AB型难溶强电解质,其溶解度S在数值上等于其溶度积的平方根。
即:
S= (单位:mol/L)
【AB2型难溶强电解质】同时可推导出AB2(或A2B)型难溶电解质(如CaF2、Ag2CrO4等)
其溶度积和溶解度的关系为:
S =(单位:mol/L)。
难溶电解质的溶度积与溶解度的关系1. 难溶电解质的概念难溶电解质是指在水中溶解度非常小的电解质,即使在饱和溶液中也很难溶解。
通常来说,难溶电解质的溶解度小于0.1mol/L。
这类物质在水中的溶解度十分有限,常常需要一定的条件或者较长的时间才能达到饱和。
2. 溶度积的概念溶度积是指在一定温度下,固体电解质在溶液中达到饱和时,其浓度乘积的值。
对于一般的电解质,其溶度积等于它的溶解度(mol/L)的n次方,其中n是电解质溶解时生成的离子数。
3. 难溶电解质的溶度积对于难溶电解质来说,由于它们在水中的溶解度极低,因此其溶度积也会非常小。
对于银氯化物(AgCl),其溶度积表达式为[K+] * [Cl-] = 1.8*10^-10,可以看出其溶度积的值非常小,说明了它在水中的溶解度很低。
4. 溶度积与溶解度的关系溶度积表示了固体电解质在溶液中达到饱和时的离子浓度乘积,而溶解度则是指在一定温度下,单位体积溶液中能溶解固体电解质的量。
二者是密切相关的,溶解度积的大小决定了电解质在水中的溶解度大小。
5. 个人观点和理解从溶度积和溶解度的关系来看,溶度积可以被看作是电解质在水溶液中溶解程度的衡量标准。
对于难溶电解质来说,其溶度积很小,导致其溶解度也非常低。
在化学实验和生产中,我们常常会根据溶度积的大小来判断一个物质在水中的溶解程度,这对于溶液的制备和纯度的控制都有着重要的意义。
总结回顾难溶电解质的溶度积与溶解度的关系,是化学中重要的概念之一。
通过对这一概念的深入理解,我们能更好地把握电解质在水溶液中的溶解特性,进而为化学实验和产业生产提供参考依据。
以上就是我对于难溶电解质的溶度积与溶解度的关系的见解和探讨,希望对您有所帮助。
难溶电解质是指在水中溶解度非常小的电解质,即使在饱和溶液中也很难溶解。
通常来说,难溶电解质的溶解度小于0.1mol/L。
这类物质在水中的溶解度十分有限,常常需要一定的条件或者较长的时间才能达到饱和。
溶解度溶度积
溶解度和溶度积是化学中的两个重要概念,它们关系密切,常常一起出现。
溶解度是指在特定条件下,某种物质在溶液中最多可以溶解的量。
溶解度通常用单位质量的溶剂中可以溶解的最大物质量来表示,常用的单位有克/毫升或克/升等。
不同物质的溶解度受到温度、压力、溶剂种类和溶质浓度等因素的影响。
溶度积是指在特定条件下,某种物质在溶液中达到饱和溶解度时,其离解产物的浓度的乘积。
溶度积通常用Ksp表示,是一个反应的平衡常数。
溶度积越大,说明离解产物浓度越高,物质越难溶解。
溶度积的大小受到溶剂种类、温度等因素的影响。
溶解度和溶度积在化学实验和工业生产中都有广泛应用。
通过研究它们的特性和影响因素,可以为溶解过程的控制和调节提供理论基础和实践指导。
- 1 -。
溶度积和溶解度的换算公式如果一种物质是可溶的,它就可以溶解。
溶解度是指在规定温度下,在一定量的溶剂中溶解的溶质的最大量。
溶剂的用量通常为克,温度为25°c。
当离子物质在水中溶解时,它会分解成离子。
溶液中生成的离子数与离子化合物的配方有直接关系。
离子物质在水中溶解的一般形式如下:ax(s) → a+(aq) + x-(aq)例题1.当1摩尔氯化钙在水中溶解时,溶液中会产生多少摩尔离子?请问:为了解决这个问题,必须找到正确的氯化钙配方和溶解方程式。
cacl2(s) → ca2+(aq) + 2cl-(aq)在这个例子中,1摩尔的氯化钙cacl2会产生1摩尔的钙离子ca2+和2摩尔的cl-氯离子,因此总共有3摩尔离子在溶液中生成。
物质熔化是否,溶解能力的大小,一方面同意于物质的本性;另一方面也与外界条件例如温度、溶剂种类等有关。
在相同条件下,有些物质不易熔化,而有些物质则难于熔化,即为相同物质在同一溶剂里溶解能力相同。
通常把某一物质熔化在另一物质里的能力称作溶解性。
比如,糖易溶于水,而油脂不溶水,就是它们对水的溶解性相同。
溶解度就是溶解性的定量则表示。
气体的溶解度还和压强有关。
压强越大,溶解度越大,反之则越小;温度越高,气体溶解度越低。
七溶解度曲线:1点溶解度曲线上的每个点则表示的就是某温度下某种物质的溶解度。
2线溶解度曲线则表示某物质在相同温度下的溶解度或溶解度随其温度的变化情况。
根据溶解度曲线,选择分离某些可溶性混合物的方法。
3交点两条溶解度曲线的交点表示该点所示的温度下两物质的溶解度相同,此时两种物质饱和溶液的溶质质量分数也相同。
大部分液态随其温度增高溶解度减小,例如硝酸钾;少部分液态溶解度受到温度影响并不大,例如食盐;极少数物质溶解度随其温度增高反而增大,例如氢氧化钙。
1.概念:在一定温度下,某液态物质在g溶剂里达至饱和状态时,所熔化溶质的质量,叫作这种物质在这种熔化里的溶解度。
2.影响固体溶解度大小的因素(1)溶质、溶剂本身的性质(2)温度3.溶解度曲线(1)溶解度曲线的意义:①溶解度曲线则表示某物质在相同温度下的溶解度或溶解度随其温度的变化情况。
实验三 电导法测定难溶盐的溶度积和溶解度的测定作者:李俊杰摘要:以测量待测溶液的电导为基础的分析方法。
电导是电阻的倒数, 测电导实质就是测电阻。
电导分析也可以说是通过测量两电极间溶液的电阻来确定离子含量的方法。
电导分析法, 可分为直接电导法和电导滴定法两类。
直接电导法简称电导法, 它是通过测量溶液的电导值, 并根据电导与溶液中待测离子的浓度之间的定量关系来确定待测离子的含量。
电导滴定法是以测量滴定过程中电导值的突跃变化来确定滴定分析终点关键词:电导率、溶度积、溶解度。
前言:电导率是物质传送电流的能力,是电阻率的倒数。
在液体中常以电阻的倒数——电导来衡量其导电能力的大小。
水的电导是衡量水质的一个很重要的指标。
它能反映出水中存在的电解质的程度。
根据水溶液中电解质的浓度不同,则溶液导电的程度也不同。
通过测定溶液的导电度来分析电解质在溶解中的溶解度。
这就是电导仪的基本分析方法。
溶液的电导率与离子的种类有关。
同样浓度电解质,它们的电导率也不一样。
通常是强酸的电导率最大,强碱和它与强酸生成的盐类次之,而弱酸和弱碱的电导率最小。
因此,通过对水的电导的测定,对水质的概况就有了初步的了解。
一、实验目的1、掌握电导法测定难溶盐溶解度和溶度积的原理和方法。
2、加深对溶液电导概念的理解及电导测定应用的了解。
3、测定在AgCl 在25℃的溶度积和溶解度。
二、基本原理1.电导法测定难溶盐溶解度的原理难溶盐的溶解度很小,其饱和溶液可近似为无限稀,饱和溶液的摩尔电导率m Λ与难溶盐的无限稀释溶液中的摩尔电导率m ∞Λ是近似相等的,即 m Λ≈m ∞Λ在一定温度下,电解质溶液的浓度c 、摩尔电导率m Λ与电导率κ的关系为m c κΛ=(Ⅰ)难溶盐在水中的溶解度极微,其饱和溶液的电导率κ溶液实际上是盐的正、负离子和溶剂(H 2O )解离的正、负离子(H +和OH -)的电导率之和,在无限稀释条件下有κ溶液=κ盐+κ水 (Ⅱ) 因此,测定κ溶液后,还必须同时测出配制溶液所用水的电导率κ水 ,才能求得κ盐。
溶解度和溶度积的换算公式
溶解度和溶度积是溶解过程中的重要参数,它们可以用来衡量溶解物的溶解能力。
溶解度是指
溶解物在一定温度和压力下,在溶解剂中的溶解量,而溶度积是指溶解物在一定温度和压力下,在溶解剂中的溶解量与溶解剂的体积之比。
溶解度和溶度积之间的换算公式是:溶解度=溶度积/体积。
这个公式表明,溶解度和溶度积之
间的关系是相互依赖的,溶解度的增加会导致溶度积的增加,反之亦然。
溶解度和溶度积的换算公式可以用来计算溶解物在溶解剂中的溶解量,从而更好地控制溶解过程。
例如,在溶解某种物质时,可以根据溶解度和溶度积的换算公式,计算出溶解物在溶解剂
中的溶解量,从而更好地控制溶解过程。
此外,溶解度和溶度积的换算公式还可以用来计算溶解物在溶解剂中的溶解速率。
例如,可以
根据溶解度和溶度积的换算公式,计算出溶解物在溶解剂中的溶解速率,从而更好地控制溶解
过程。
总之,溶解度和溶度积的换算公式是溶解过程中的重要参数,它们可以用来计算溶解物在溶解
剂中的溶解量和溶解速率,从而更好地控制溶解过程。