高考化学复习知识讲解—氯(基础)
- 格式:doc
- 大小:794.00 KB
- 文档页数:8


高中化学氯知识点高中化学中,氯是一个非常重要的元素。
它是周期表中的第17个元素,化学符号为Cl,原子序数为17,原子量为35.5。
氯在天然界中存在于盐湖、海水和矿石中。
在化学中,氯是一种重要的卤素。
它广泛应用于医药、农业、印刷、染料和合成化学等方面。
在这篇文章中,我们将探讨关于氯的一些关键知识点。
1. 氯的物理和化学性质1.1 物理性质氯是一种淡黄色气体,有强烈的刺激味和刺激性。
它是一种二原子分子,具有呈双键的分子结构。
在常温常压下,氯是一种不稳定的气体,会液化于低温下,变成淡黄色透明液体。
氯有很高的电负性,能够与大多数元素发生化学反应。
1.2 化学性质氯是一种极为活泼的元素,具有强氧化性。
它可以与大多数金属、卤素和非金属元素反应。
在室温条件下,氯与铁和铜等金属直接反应生成对应的卤化物。
在制备过程中,由于氯化反应极其激烈,不得不采用一定的温度、压力和气体纯度等条件。
同时,在制备过程中必须格外注意安全,以防气体泄漏引发不良后果。
2. 氯的制备方法氯的主要制备方法是经过氯碱法加以制备。
这个过程是通过在电解池里电解食盐水制得的。
电解过程分解了食盐水中化学物质,造成氯气和钠氢氧化物的生成。
由于制备氯气的化学方法涉及电化学,所以很容易控制纯度。
制备过程为:2NaCl + 2H2O → Cl2↑ + H2↑ + 2NaOH实现上述反应需要在两个电极之间施加足够的电场。
电解质可能是饱和的食盐水溶液或氢氯酸水溶液。
制备过程还需要满足一定的机械加工和储存要求,避免制备中发生安全事故。
3. 氯与水的反应氯与水的反应产生了氢氧化物和氯气,反应为:Cl2 + H2O → HCl + HOCl氯气通过水的电离和氢氧化物的生成来反应,同时也生成了漂白水(次氯酸钠和氯气的化合物),由于次氯酸钠稳定性较高,可以在漂白剂中使用。
通常,漂白剂使用次氯酸盐,而非次氯酸氢钠,因为后者一旦加热或进入酸性条件下便会变得不稳定。
4. 氯的应用领域氯在纺织、造纸、食品加工、水处理、印刷和染料制备等方面具有广泛的应用。

2023高考化学一轮复习知识点-氯气的反应1500字氯气是一种常见的化学物质,它在化学反应中起着重要的作用。
下面是2023年高考化学一轮复习中的一些关于氯气反应的重要知识点。
1. 氯气的制备:氯气可以通过电解食盐水(NaCl溶液)来制备。
在电解过程中,溶液中的氯离子(Cl-)在阳极上接受电子,氧气气体(O2)被释放,同时,在阴极上,水分解产生氢气(H2)。
2. 氯气的性质:氯气是一种黄绿色的有毒气体,具有刺激性气味。
它具有较高的密度,比空气重多倍。
氯气无色,无味,不燃烧,但能支持燃烧。
当氯气与有机物反应时,会发生剧烈的燃烧并产生有毒的氯气。
3. 氯气与金属的反应:氯气与许多金属(如钠、钾、铝等)反应会产生相应的金属氯化物。
例如,氯气与钠反应会生成氯化钠(NaCl):2Na + Cl2 → 2NaCl这类反应属于氧化还原反应,氯气被还原为氯离子,而金属则被氯离子氧化。
4. 氯气与非金属的反应:氯气与非金属(如氢、硫、氮等)也能发生反应。
例如,氯气与氢气反应会生成氯化氢(HCl):H2 + Cl2 → 2HCl氯气还可以与硫反应生成二氯化硫(SCl2):S + Cl2 → SCl2这些反应也属于氧化还原反应。
在这些反应中,氯气被还原为氯离子,而非金属则被氯离子氧化。
5. 氯气与水的反应:氯气可以与水反应,生成一氧化氯(Cl2O)和盐酸(HCl)。
在这个反应中,氯气被还原为氯离子,并发生水的氧化反应,生成一氧化氯和氢离子。
Cl2 + H2O → HCl + Cl2O6. 氯气的漂白性:氯气是一种强氧化剂,具有良好的漂白性。
它能够氧化许多有色物质,如染料和色素,使其变为无色。
这一特性使氯气在漂白纸浆、纺织品等行业中得到广泛应用。
以上是关于2023年高考化学一轮复习中氯气反应的一些重要知识点。
掌握这些知识点,有助于理解氯气在化学反应中的作用和应用。

高三化学氯的知识点氯(化学符号Cl)是周期表中第17号元素,原子序数为17。
它是一种非金属元素,常见于自然界中的盐酸、氯化物等化合物中。
在本文中,我将介绍一些关于氯的基本知识点,包括其性质、化合物以及应用等方面。
一、氯的性质1. 物理性质:氯是一种黄绿色的气体,在常温常压下具有刺激性的气味。
它的密度大约为3.2 g/L,比空气重约2.5倍。
氯气在低温下可液化,并在-101.5℃时转变为液态。
在-34.6℃时,氯会固化为白色结晶。
2. 化学性质:氯是一种高度活泼的元素,易于与其他元素反应形成化合物。
它具有强氧化性,能与大多数金属产生反应,形成相应的氯化物。
氯还可与氢反应生成盐酸,与氧反应产生氯气。
此外,氯还参与了许多重要的化学反应,如水的电解和氯碱工业生产等。
二、氯的化合物1. 氯化物:氯化物是氯与其他元素形成的化合物,其离子式通常为Cl-。
氯化物广泛存在于大自然中,如盐湖和海水中的氯化钠(NaCl)、氯化钾(KCl)等。
氯化物在化学实验室和工业生产中有着重要的应用,可以作为催化剂、脱水剂、防腐剂等。
2. 氯酸盐:氯酸盐是含有氯元素与氧元素形成键的化合物。
常见的氯酸盐包括氯酸钠(NaClO3)、氯酸钡(Ba(ClO3)2)等。
氯酸盐在消毒剂、火药和烟花等方面有着重要的应用。
三、氯的应用1. 水处理:氯在水处理中被广泛使用,主要用于消毒。
由于其强氧化性和杀菌能力,氯能够有效地消除水中的细菌和病毒,确保水的卫生安全。
2. 化学工业:氯在化学工业中有广泛的用途。
它被用作溶剂、消毒剂、漂白剂等。
氯还是许多重要化学品的原材料,如氯乙烯用于生产PVC等塑料。
3. 医疗应用:氯化物在医疗领域中被用作盐水注射液和洗伤口的消毒用品。
氯化银则被用于皮肤病患者的治疗。
4. 环境保护:氯化物被用于污水处理厂中,能够去除污水中的重金属离子和有机化合物。
综上所述,氯是一种重要的元素,具有丰富的化学性质和应用。
了解氯的知识点对于理解化学原理和应用具有重要意义。

高三化学氯的知识点汇总氯(Cl)是我们日常生活中常见的元素之一,它在化学中有着重要的应用和作用。
在高三化学学习中,了解氯的性质、化合物以及相关的应用是必不可少的。
本文将对高三化学中关于氯的知识点进行汇总。
一、氯的性质1. 密度和颜色:氯是一种黄绿色的气体,具有强烈的刺激性气味。
其密度大约为3.2 g/L,比空气重。
2. 熔点和沸点:氯的熔点为-101.5℃,沸点为-34.04℃。
由于氯的低沸点,它在常温下以气体的形式存在。
3. 溶解性:氯具有较高的溶解性,可溶于水、醇类和酮类等有机溶剂。
4. 化合价:氯的化合价通常为-1,在某些化合物中也可以为+1、+3、+5或+7。
二、氯的化合物1. 氯化物:氯与其他元素形成的化合物称为氯化物。
常见的氯化物有氯化钠(NaCl)、氯化铵(NH4Cl)、氯化铜(CuCl2)等。
氯化物在化学反应和工业生产中有着广泛的应用。
2. 氯氧化物:氯与氧形成的化合物称为氯氧化物。
常见的氯氧化物有氯气(Cl2O)、二氧化氯(ClO2)等。
它们具有强氧化性,在消毒、漂白等方面有着重要的用途。
3. 酸性氯化物:氯与氢形成的化合物称为酸性氯化物。
常见的酸性氯化物有氯化氢(HCl)、氯化亚砜(SO2Cl2)等。
酸性氯化物具有酸性,可以与碱反应生成盐和水。
三、氯的应用1. 消毒剂:氯和氯化物广泛应用于消毒领域。
氯化池水、漂白剂等都含有氯,能有效地杀灭细菌和病毒。
2. 漂白剂:氯氧化物具有较强的漂白能力,常用于纺织品、纸张、食品加工等行业中。
3. 制造塑料:氯化物在合成聚氯乙烯(PVC)等塑料过程中起着重要的作用。
4. 制冷剂:氯化氟烃是一种常用的制冷剂,如氟利昂(Freon),但由于它对臭氧层的破坏,现已被逐步淘汰。
5. 制作化学试剂:氯化物和氯酸盐等化合物常用于实验室中制作化学试剂。
综上所述,氯作为一种常见的元素,在高三化学学习中具有重要的地位。
掌握氯的性质、化合物以及应用对于理解化学反应、化学方程式以及实际应用都非常重要。

高中化学氯的知识点总结氯是一种重要的元素,它也是自然界中最常见的元素之一。
氯广泛应用于工业生产、医疗服务、日常生活中,是一种重要的化学物质。
本文将介绍氯的各种知识点,以供高中化学的学习者参考。
首先,介绍氯的设计,它是一种坚硬的、暗绿色的有色非金属元素,在固体状态下它是一种碳和氧的化学混合物,其分子量约为2.2%。
氯的原子序数为17,其原子量为35.453。
当沸点低于132℃时,它会迅速从固体变成气体状态,然后被循环使用。
氯有六种不同的同位素,其中氯-35和氯-37是最常见的同位素,它们分别占氯总量的75%和25%。
氯-35被称为常见氯,它的质量数为35,核心由17个质子和18个中子组成;氯-37被称为放射性氯,它的质量数为37,核心由17个质子和20个中子组成。
氯可以用来制造一系列重要的化学物质,其中最常见的是氯化物。
氯化物是一类重要的化合物,它可以使氯原子与其他金属或非金属原子结合,生成一系列无机化合物。
常见的氯化物有氯酸、氯酸钠、氯酸钾等。
氯也可以与氢气反应,生成氢氯化物,如氯氢气和氯甲烷等。
此外,氯具有重要的生物学功能,它可以作为抗菌、抗病毒的药物,可以用来消毒水、食物,以及用作灭菌剂。
氯还可以用于医药、农业等,可以抑制腐烂物质的生长,以保护环境和人类健康。
最后,介绍氯的安全问题,氯有一定的毒性,如果长期过量接触可能会对身体造成危害。
当氯与其他有害物质结合时,可能会产生有毒的气体,所以在使用氯时应小心谨慎,以免造成危害。
总之,氯是一种重要的元素,它在工业生产、医疗服务、日常生活中有广泛的应用,它的知识点也正成为高中学生学习的重点。
今天介绍的氯的知识点只是氯的冰山一角,希望这些信息能够帮助高中生更好地学习化学,为学习化学奠定坚实的基础。

高中化学氯的知识点体系气态氯俗称氯气,液氯俗称液氯。
氯气在常温常压下为黄绿色气体,有强烈的刺激性气味,化学性质活跃,具有毒性。
以下是边肖整理的高中化学氯的知识点,仅供参考,希望对大家有所帮助高中化学氯的知识点0物理性质:一般为黄绿色,密度大于空的气体,有刺激性气味,溶于水,有毒@化学性质:氯原子容易获得电子,是活泼的非金属元素。
氯与金属和非金属发生反应,一般用作氧化剂。
它通过自氧化还原作用与水和碱溶液反应,同时起氧化剂和还原剂的作用。
1.氯水:氯水呈黄绿色,少量C12与水反应(CI2+H20==HCI+HCIO),大部分仍以分子形式存在公式存在,它的主要溶质是C12。
新鲜氯水中含有CI2、H20、HCIO、H+、CI、CIO-、OH-等颗粒2.次氯酸:次氯酸(HCIO)比H2CO3弱,在溶液中主要以HCIO分子的形式存在。
它是一种弱酸,具有强氧化性(杀菌、消毒、漂白),易分解(生成HCI和O2)。
3.漂白粉的发展次氯酸盐比次氯酸更稳定,所以容易保存。
工业上以C12和石灰到,为原料制备漂白粉它的主要成分是CaCl2和Ca(Cl0)2,有效成分是Ca(ClO)2。
它必须与酸(或气体中的空 CO2)反应生成次氯酸,才能起到漂白作用。
酒精灯的使用1.酒精灯火焰:分为外焰、内焰、焰心三层。
外焰温度最高,内焰温度最低,所以加热时,加热物质要放在外焰中。
2.酒精灯使用注意事项:A:酒精灯中的酒精不超过体积的2/3;b;酒精灯用完后,一定要用灯头熄灭,不能用嘴吹;c:绝对禁止在燃烧的酒精灯中添加酒精,d:绝对禁止用正在燃烧的酒精灯点燃另一盏酒精灯,以免引起火灾。
e:不用酒精灯的时候,盖上灯头,防止酒精蒸发3.可以直接加热的仪器有:试管、蒸发皿、烧勺、甘场等。
可以加热的仪器,但烧杯和烧瓶必须垫上石棉网;不能加热的仪器有:量筒、玻璃棒、气瓶4.加热药物时,先将仪器烘千,预热,然后固定在药物下加热,加热固体药物,药物要铺好,试管口要稍微向下倾斜,防止水回流到试管里把试管弄破,加热药液时,液体的体积不应超过试管体积的1/3。

第01讲氯及其重要化合物目录01 考情透视·目标导航 ..................................................................................................................02 知识导图·思维引航 .................................................................................................................. 03考点突破·考法探究 ................................................................................................................... 考点一氯气、氯水、含氯化合物 ..............................................................................................知识点1 氯气的性质 .................................................................................................................知识点2 氯水性质的多重性.......................................................................................................知识点3 次氯酸和次氯酸盐的性质 ............................................................................................考向1 氯气及其化合物的性质....................................................................................................考向2 氯水与次氯酸的性质及应用............................................................................................. 考点二氯气的实验室制法 ..............................................................................................................知识点1 制取原理...................................................................................................................知识点2 制取过程...................................................................................................................知识点3 实验装置...................................................................................................................考向1 氯气实验室制法的简单应用...........................................................................................考向2 氯气与其他含氯化合物制备的综合 ................................................................................ 考点三卤素的性质及X-的检验 ........................................................................................................................知识点1 卤素单质性质的相似性和递变性..............................................................................................知识点2 卤素离子的检验方法 .................................................................................................................考向1 卤素的性质 .....................................................................................................................................考向2 卤素离子的检验 ............................................................................................................................. 04真题练习·命题洞见 ...................................................................................................................考点要求考题统计考情分析氯及其化合物的性质2024浙江1月2题,3分;2024·安徽卷4题,3分;2023浙江1月4题,3分;2023湖北卷2题,2分;2022浙江6月9题,2分;2021广东卷6题,2分;2021浙江6月16题,2分;2021北京卷17题,14分;从近年高考试题来看,一般融合元素周期律和元素周期表考查氯及其化合物的制备和性质探究;融合化学实验考查氯及其化合物的制备和性质探究;融合化学反应原理,在化工生产中考查氯及其化合物的应用及绿色化学。
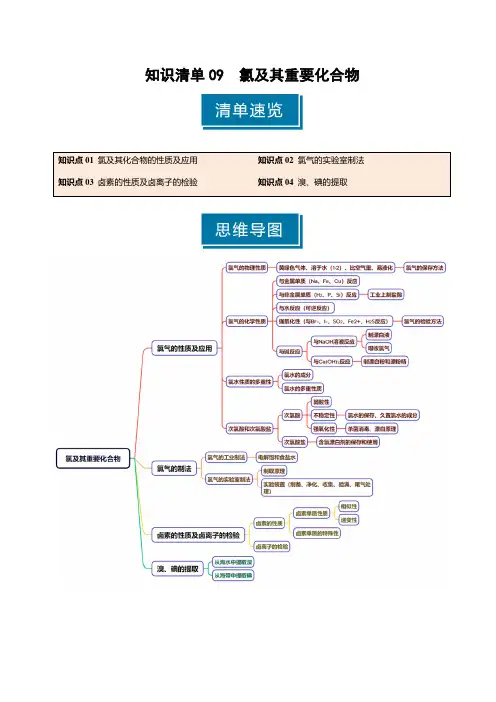
知识清单09 氯及其重要化合物知识点01 氯及其化合物的性质及应用一、氯气的性质1.氯气的物理性质氯气是一种黄绿色、有刺激性气味的气体,密度比空气大,可溶于水(1:2),易液化,有毒。
工业上通常将氯气液化后保存在钢瓶里。
实验室里闻有毒气体及未知气体气味的方法是:用手在瓶口轻轻扇动,仅使极少量气体飘进鼻孔。
2.氯气的化学性质 (1)氧化性①与金属单质反应:与铁反应:2Fe+3Cl 2=====点燃2FeCl 3,实验现象:生成棕色烟。
与铜反应:Cu+Cl 2=====点燃CuCl 2,实验现象:生成棕黄色烟。
②与非金属单质反应:a .与H 2反应:H 2+Cl 2=====点燃CuCl 2,实验现象:有苍白色火焰,出现白雾。
应用:工业上制盐酸。
H 2与Cl 2的混合物点燃或光照发生爆炸。
b .能将P 氧化为PCl 3、PCl 5,与Si 反应生成SiCl 4。
③与还原性物质反应:与KI 溶液反应:Cl 2+2KI===2KCl+I 2,实验室用湿润的淀粉碘化钾试纸检验Cl 2。
与SO 2水溶液反应:Cl 2+SO 2+2H 2O===H 2SO 4+2HCl 。
与FeCl 2溶液反应:Cl 2+ 2FeCl 2===2FeCl 3。
(2)Cl 2与水和碱反应——歧化反应 a .与水反应:Cl 2+H 2OHCl+HClO (可逆反应)b .与NaOH 溶液反应:Cl 2+2NaOH===NaCl+NaClO+H 2O 。
应用:实验室用NaOH 溶液吸收多余的氯气,工业上制取消毒液。
c .与石灰乳反应制取漂白粉:2Cl 2+2Ca(OH)2===CaCl 2+Ca(ClO)2+2H 2O漂白粉的主要成分是CaCl 2 、Ca(ClO)2,有效成分是Ca(ClO)2,漂粉精的主要成分是Ca(ClO)2。
3.氯水的成分和性质氯气的水溶液称为氯水,溶于水的氯气只有少量与水反应。
(1)氯水中存在三种平衡关系:①Cl 2+H 2O HCl +HClO ②HClO H ++ClO -③H 2OH ++OH -氯水中存在的微粒:(2)氯水性质的多重性新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。

高三化学氯的知识点归纳氯(符号Cl)是化学元素周期表中的一个卤素元素,具有原子序数17。
它在自然界中以盐的形式广泛存在,是地壳中第七丰度最高的元素,对人体和环境都具有重要的意义。
在高三化学学习中,氯及其化合物的知识点是学生需要重点掌握的内容之一。
本文将对氯的性质、制备、应用以及相关化合物进行归纳总结,以帮助高三学生系统地复习和理解氯相关的知识。
一、氯的性质1. 物理性质:氯是一种黄绿色气体,在常温下为二原子分子,具有刺激性气味。
它有较高的电负性和电离能,在自然界中主要以负离子的形式存在,如氯离子(Cl-)。
2. 化学性质:(1)氯是一种强氧化剂,在常温下可以与多种元素或化合物反应,如与金属反应生成氯化物、与非金属反应生成卤素化合物。
(2)氯与氢气在光照下反应会生成盐酸气体,这是一种常见的化学反应。
二、氯的制备氯的制备方法主要有以下几种:1. 直接电解法:将氯化钠(NaCl)溶解在水中,通过电解可以将氯离子还原为氯气,同时在阴极上生成氢气。
2. 氧化还原法:利用氧化剂将含氯化合物氧化释放出氯气。
例如,可以用氧气氧化氯化亚铜(CuCl)制备氯气。
3. 高温分解法:将含氯化合物加热至高温,使其分解放出氯气。
例如,将氯化钾(KCl)加热至高温可以得到氯气和氧化钾(K2O)。
三、氯的应用氯及其化合物在日常生活和工业生产中有广泛的应用,以下是其中几个重要的方面:1. 消毒剂:氯气和含氯溶液(如漂白粉、消毒水等)具有杀菌消毒的作用,常用于饮用水处理、游泳池消毒等领域。
2. 原料化学品:氯化钠是制取氯气和氢气的重要原料,也用于制备其他化学品,如氯化铵、氯化钡等。
3. 塑料制品:氯化聚乙烯(PVC)是一种重要的塑料材料,在建筑、电子、汽车等多个行业有广泛应用。
而聚四氟乙烯(PTFE)是一种耐高温、耐腐蚀的塑料,用于制造不粘锅等产品。
4. 溶剂和中间体:氯化碳和四氯化碳等氯代烃是一些有机合成反应中常用的溶剂和中间体。

氯的高中化学知识点总结有关氯的高中化学知识点总结一、物理性质1.在通常情况下:氯气是黄绿色的气体、氯气有毒、并有刺激性气味、密度比空气大、熔沸点较低能溶于水易溶于有机溶剂、在压强为101kPa、温度为-34.6℃时易液化。
如果将温度继续冷却到-101℃时,液氯变成固态氯。
1体积水在常温下可溶解2体积氯气.密度3.214克/升。
熔点-100.98℃,沸点-34.6℃。
化合价-1、+1、+3、+5和+7。
电离能12.967电子伏特,具有强的氧化能力,能与有机物和无机物进行取代和加成反应;同许多金属和非金属能直接起反应。
2 高中方法.氯气有毒,闻有毒气体气味的方法是(扇动法):用手轻轻在瓶口扇动,使极少量的气体飘进鼻孔二、化学性质1.与金属反应:氯气有强氧化性,几乎可氧化一切金属。
2Na+Cl2=2NaCl(有黄色火焰,形成白烟)2Fe+3Cl22FeCl3(发红热,形成棕褐色烟)2Na+Cl2=2NaCl (现象:剧烈燃烧,白烟)Cu+Cl2=CuCl2 (现象:剧烈燃烧,棕色烟)2Fe+3Cl2=2FeC2.2.与非金属反应:硅、磷、硫等单质都可在氯气中燃烧,磷在氯气中燃烧可形成白色烟雾。
2P+3Cl2 2PCl3(液)PCl3+Cl2=PCl5(固)燃烧:发光、发热的剧烈化学反应.3.与水反应在该反应中,氧化剂是Cl2,还原剂是Cl2,改写成离子反应方程式是:Cl2+H2OH++Cl-+HClO(1)氯气的水溶液叫氯水,饱和氯水呈现黄绿色,具有刺激性气味,主要含有的粒子有Cl2、H2O、HClO、H+、Cl-、ClO-.(2)次氯酸的性质①弱酸性:是一元弱酸,属弱电解质,酸性弱于碳酸.HClO+NaOH=NaClO+H2ONaClO+HCl=HClO+NaCl2NaClO+CO2+H2O=Na2CO3+2HClO②不稳定性:由于HClO的分解,使Cl2和水逐渐反应,直至氯水失效,因此氯水要现用现制,保存在棕色试剂瓶中.氯水久置将变成稀盐酸.③强氧化性:HClO能氧化许多物质.④杀菌漂白性:能使有色布条、品红试剂等有色物质褪色,其原理主要是利用其强的氧化性.说明:干燥Cl2本身没有漂白性,只有转化成HClO才有漂白性4.和氢气反应:纯氢气可在氯气中燃烧,有苍白色火焰将氢气和氯气混合后,用强光照射或点燃,会爆炸5. 和碱反应:Cl2+2NaOH=NaCl+NaClO+H2O(常温下生次氯酸盐)3Cl2+6KOH5KCl+KClO3+3H2O(加热时生氯酸盐)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O(生成混合物即漂面粉)6.和盐反应:Cl2+2Kl=2KCl+I2(氧化阴离子)Cl2+2FeCl2=2FeCl3(氧化阳离子)7.和烃反应:Cl2+CH4CH3Cl+HCl(取代)C6H6+3Cl2C6H6Cl6(加成)常见考点考法氯气的物理性质和化学性质,以及氯气的.化学反应时考查的高频考点.常见误区提醒危险性:不燃,但遇可燃物会燃烧、爆炸。
高考化学第一轮复习氯及其化合物知识点氯是自然界中广泛分布的一种元素,下面是查字典化学网整理的氯及其化合物知识点,希望考生可以及时了解详情。
一、氯元素位于第三周期第ⅦA族,原子结构:容易得到一个电子形成氯离子Cl-,为典型的非金属元素,在自然界中以化合态存在。
二、氯气物理性质:黄绿色气体,有刺激性气味、可溶于水、加压和降温条件下可变为液态(液氯)和固态。
制法:MnO2+4HCl (浓) MnCl2+2H2O+Cl2闻法:用手在瓶口轻轻扇动,使少量氯气进入鼻孔。
化学性质:很活泼,有毒,有氧化性,能与大多数金属化合生成金属氯化物(盐)。
也能与非金属反应:2Na+Cl2 ===(点燃) 2NaCl 2Fe+3Cl2===(点燃) 2FeCl3 Cu+Cl2===(点燃) CuCl2Cl2+H2 ===(点燃) 2HCl 现象:发出苍白色火焰,生成大量白雾。
燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。
燃烧的本质是剧烈的氧化还原反应,所有发光放热的剧烈化学反应都称为燃烧。
三、Cl2的用途①自来水杀菌消毒Cl2+H2O == HCl+HClO 2HClO ===(光照) 2HC l+O2 ↑1体积的水溶解2体积的氯气形成的溶液为氯水,为浅黄绿色。
其中次氯酸HClO有强氧化性和漂泊性,起主要的消毒漂白作用。
次氯酸有弱酸性,不稳定,光照或加热分解,因此久置氯水会失效。
②制漂白液、漂白粉和漂粉精制漂白液 Cl2+2NaOH=NaCl+NaClO+H2O ,其有效成分NaClO 比HClO稳定多,可长期存放制漂白粉(有效氯35%)和漂粉精(充分反应有效氯70%)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O③与有机物反应,是重要的化学工业物质。
④用于提纯Si、Ge、Ti等半导体和钛⑤有机化工:合成塑料、橡胶、人造纤维、农药、染料和药品四、氯离子的检验使用硝酸银溶液,并用稀硝酸排除干扰离子(CO32-、SO32-) HCl+AgNO3 == AgCl ↓+HNO3NaCl+AgNO3 == AgCl ↓+NaNO3Na2CO3+2AgNO3 ==Ag2CO?3 ↓+2NaNO3Ag2CO?3+2HNO3 == 2AgNO3+CO2 ↑+H2OCl-+Ag+ == AgCl ↓小编为大家提供的高考化学第一轮复习氯及其化合物知识点就到这里了,愿大家都能好好努力,丰富自己,锻炼自己。
高考化学知识点之氯及其化合物氯(Cl)是元素周期表中的一种非金属元素,原子序数为17,原子质量为35.453、氯在常温常压下为黄绿色气体,具有强烈的刺激性气味。
氯是地壳中含量较多的元素之一,广泛存在于自然界中的水体、海水、矿石、盐湖等中。
氯的化合价为-1,是一种典型的卤素,与多种元素发生化学反应。
氯与金属反应常生成氯化物,如氯化钠(NaCl)、氯化铁(FeCl3)等。
氯的化合物具有多样的性质和广泛的应用,涉及到许多重要的化学知识点。
首先,氯化钠是氯的最典型的化合物之一、氯化钠是一种白色结晶固体,常见的食盐就是氯化钠。
氯化钠是一种离子化合物,由Na+和Cl-两种离子组成。
在化学中,离子可以通过离解方程式表示,氯化钠的离解方程式可以写作NaCl(s)→Na+(aq)+Cl-(aq)。
氯化钠是一种重要的食品添加剂,具有调味、防腐、抑制微生物生长等功能,在日常生活中应用十分广泛。
除了氯化钠,氯化物还有氯化铁、氯化氢等。
氯化铁是一种黑色固体,可溶于水。
氯化铁在化学实验中常用作催化剂、氧化剂,可以进行氧化还原反应。
氯化氢是一种无色气体,有强烈的刺激性味道,可溶于水形成盐酸。
氯化氢是一种常用的实验室酸,可以与碱反应生成盐和水。
氯还可以形成各种其他化合物,如氯气、氯化氰、氯酸等。
氯气是氯的分子形式,由具有共价键的氯原子(Cl2)组成。
氯气具有强氧化性,可与许多物质反应,如与水反应生成盐酸,与金属反应生成对应的氯化物等。
氯气也可以被利用于消毒、漂白等工业过程中。
氯化氰(ClCN)是一种无色液体,常用作有机合成的试剂。
氯化氰可以与许多化合物发生取代反应,形成新的有机化合物。
氯酸(HClO3)是一种无色液体,是氯的酸性氧化物之一、氯酸可以与金属反应生成对应的氯酸盐,或与其他酸反应生成氯酸酯。
此外,氯还形成了一系列有机氯化合物,如氯仿(CHCl3)、多氯联苯等。
有机氯化合物在医药、农药、防腐等领域有广泛的应用,但部分有机氯化合物由于毒性大而受到关注。
氯的知识点归纳总结一、氯的性质1. 物理性质氯在常温下为黄绿色的气体,有刺激性气味。
它易溶于水,与水反应生成盐酸。
氯具有较强的腐蚀性,能与金属发生化学反应,并有一定毒性。
2. 化学性质氯是一种活泼的非金属元素,具有很强的氧化性和还原性。
它能与多种元素发生化学反应,形成各种氯化物。
二、氯的用途1. 工业上的应用氯在工业领域广泛应用,例如用于生产氢氯酸、氯乙烯、氯仿等化工原料,以及合成塑料、橡胶、合成纤维等材料。
2. 水处理氯被用作水处理剂,可杀灭水中的细菌和病毒,保障饮用水卫生安全。
3. 医疗卫生氯被用作消毒剂,可用于医疗设施、实验室、食品加工等领域,保障环境和物品的卫生。
4. 生活用品氯还被用于生活用品的生产,例如漂白剂、消毒液、防腐剂等产品。
三、氯的化合物1. 氯化物氯与金属元素形成的化合物称为氯化物,它们在化工、冶金等方面有着广泛的应用。
例如氯化钠在食品加工中用作调味剂、防腐剂;氯化铝在工业上用于金属表面处理等。
2. 氯酸盐氯酸盐是含有氯的酸根离子的化合物,常见的有氯化钾、氯化钙等。
它们在农业、医药、食品等领域有一定的用途。
四、氯的环境影响1. 环境污染氯化物在工业生产和生活用品消费过程中可能会引发环境污染,对土壤、水体和空气造成负面影响。
2. 生物毒性氯在一定条件下会对生物体产生毒性影响,例如氯气的吸入会对呼吸系统造成刺激和损害。
同时,氯离子对水生生物也具有一定的毒性。
总之,氯是一种重要的化学元素,具有广泛的应用价值,但同时也需要引起重视,避免对环境和生物体造成不可逆的影响。
希望以上内容对您有所帮助。
高考化学氯的知识点化学作为一门基础科学,既深奥又有实用性。
在高考化学考试中,氯是一个重要的知识点。
本文将从氯的性质、化合物以及应用等方面进行论述,帮助考生更好地掌握该知识点。
1. 氯的性质氯是一种常见的化学元素,其化学符号为Cl,在元素周期表中属于第17族。
氯是一种黄绿色的气体,呈刺激性气味,并具有强烈的氧化性。
其密度较大,不溶于水。
在常温下,氯以分子形式存在,即Cl2,它是一种强烈的光合作用剂。
2. 氯化物的形成氯化物是氯与其他元素形成的化合物。
氯化物通常采用氯离子(Cl-)的形式存在。
氯与钠反应形成氯化钠(NaCl)、氯与镁反应则形成氯化镁(MgCl2)。
氯化物具有很强的稳定性,广泛存在于自然界中。
3. 氯的应用氯在日常生活中有着广泛的应用。
其中,氯化钠是我们常见的食盐。
氯气在水处理中起着消毒的作用,广泛应用于水处理厂。
氯化铁在水中有着良好的净化效果,被广泛地应用于废水处理工业。
此外,氯化物还在杀菌剂、消毒液、漂白剂等方面发挥着重要的作用。
4. 氯的环境影响尽管氯在许多方面有着重要的应用,但其过度使用也会带来环境问题。
氯气的排放会对全球环境造成破坏,对臭氧层的破坏具有一定的影响。
此外,氯化物的过度使用会导致土壤盐碱化,影响农田的生产力。
5. 氯的有机化合物除了无机化合物之外,氯还与碳形成许多有机化合物,这些有机化合物在生活中有着广泛的应用。
例如,多氯联苯(PCB)曾被广泛用作冷冻剂、绝缘剂和润滑剂,但因其毒性而被逐渐淘汰。
三氯甲烷(CHCl3)则被用作溶剂和药物,但也由于其致癌性而受到限制。
6. 氯的放射性同位素氯还有一些放射性同位素,例如氯-36、氯-37等。
这些同位素在地球科学研究中有重要的应用。
氯-36常被用于测定地球上水资源的形成时间,对于研究气候变迁和地质活动有着重要的意义。
总结起来,氯作为一种常见的化学元素,在化学知识体系中占有重要的地位。
掌握氯的性质、化合物以及应用等知识点对于高考化学考试至关重要。
引言概述:氯是一种常见且重要的化学元素,它在高中化学教学中占有重要地位。
本文将从氯的性质、制备、应用、环境影响和安全使用等方面进行详细的阐述和总结。
一、氯的性质1.原子结构:介绍氯的原子结构和电子排布。
2.物理性质:包括氯的外观、状态、密度、熔点和沸点等。
3.化学性质:介绍氯的化学反应性和常见的化学反应,如与氢气反应、与金属反应等。
二、氯的制备1.盐酸法:详细介绍通过盐酸和过氧化铁制备氯气的过程。
2.氯化铵法:阐述利用氯化铵与氧化剂反应制备氯气的方法。
3.电解法:介绍通过电解食盐水制备氯气的步骤和原理。
三、氯的应用1.漂白剂:详细介绍氯的漂白剂应用,如漂白布料、造纸和食品加工等。
2.消毒剂:阐述氯的消毒剂应用,例如在水处理、游泳池消毒和医疗环境中的应用。
3.合成材料:介绍氯在合成材料制备中的应用,如聚氯乙烯(PVC)和聚氯丙烯(PC)的制备。
四、氯的环境影响1.氯化物的排放:阐述氯化物在工业生产和废物处理过程中的排放情况。
2.氯对环境的影响:详细介绍氯化物在水环境中的影响,包括富营养化、毒性和生态系统的破坏等。
3.氯的处理与减排:讨论氯化物的处理方法和减少氯化物排放的措施。
五、氯的安全使用1.氯的危害:介绍氯的危害,如氯气的毒性和刺激性。
2.安全储存:阐述储存氯的注意事项,如储存于通风良好的地方和避免与可燃物接触。
3.安全操作:详细介绍使用氯气时的安全操作,包括佩戴个人防护装备和避免氯气泄漏。
总结:本文全面总结了有关氯的高中化学知识点,包括氯的性质、制备、应用、环境影响和安全使用等方面。
通过阅读本文,可以更全面地了解和掌握氯的相关知识,为学生在高中化学学习过程中提供帮助。
同时,还强调了氯在环境中的影响和安全使用的重要性,提醒大家在处理氯化物和使用氯气时要格外注意安全。
高考化学复习氯气的反应知识点
氯气化学式为Cl。
常温常压下为黄绿色,有剧烈抚慰性气息的有毒气体,密度比空气大,可溶于水。
以下是氯气的反响知识点,请考生仔细学习。
(1)、氯气与大少数金属反响。
(与铁、铜等变价金属反响时,生成低价氯化物)
(2)、氯气与磷反响3Cl2+2P==2PCl3(扑
灭)PCl3+Cl2==PCl5(白色烟雾)
(3)、氯气与氢气反响(纯真氢气在氯气中安静熄灭收回惨白色火焰;混合气光照爆炸;卤素单质的生动水平比拟) (4)、氯气与水反响:氯水的多重性质(Cl2的强氧化性、次氯酸的强氧化性、次氯酸的不动摇性、
盐酸的酸性、次氯酸的酸性)
(5)、氯气与氢氧化钠溶液反响(用氢氧化钠溶液吸收剩余氯气)
(6)、氯气与氢氧化钙反响(工业制漂白粉)
(7)、氯气与溴化钠溶液反响
(8)、氯气与碘化钾溶液反响(卤素相互置换的规律如何?)
(9)、氯气与甲烷取代反响(条件?)
(10)、氯气与乙烯的反响(反响类别?)(乙烯通入溴水使溴水褪色)
(11)、氯气与氯化亚铁溶液反响
(12)、氯气与硫化氢溶液反响(现象?)
(13)、氯气与二氧化硫溶液反响(溶液酸性变化?漂白作用的变化?)
(14)、氯气的检验方法淀粉碘化钾试纸(单质碘的检验方法如何?)
氯气的反响知识点的全部内容就是这些,查字典化学网预祝考生可以取得更优秀的效果。
2021年高考第一轮温习备考专题曾经新颖出炉了,专题包括高考各科第一轮温习要点、温习方法、温习方案、温习试题,大家来一同看看吧~。
高考总复习《氯》
【考纲要求】
1.了解Cl2的分子结构和物理性质,掌握Cl2的制备和用途。
2.掌握Cl2与金属、非金属、水、碱等发生的反应。
3.掌握氯水的成分和性质,知道次氯酸及其盐的性质和用途。
4.以卤素为例了解在周期表中同一主族元素性质的递变规律。
5.通过实验掌握Cl―的检验方法。
【知识网络】
氯及其重要化合物间的转化关系
【考点梳理】
考点一:氯气的性质、用途
1.物理性质
通常氯气为黄绿色有刺激性气味、密度比空气大的有毒气体,易液化。
25℃时,1体积水约溶解2体积氯气,其水溶液俗称氯水,为淡黄绿色。
2.化学性质
2。