实验2 氢原子光谱的观察与测定
- 格式:doc
- 大小:2.13 MB
- 文档页数:5

近代物理实验——氢原子光谱一、 实验简介光谱线系的规律与原子结构有内在的联系,因此,原子光谱是研究原子结构的一种重要方法.1885年巴尔末总结了人们对氢光谱的测量结果,发现了氢光谱的规律,提出了著名的巴尔末公式,氢光谱规律的发现为玻尔理论的建立提供了坚实的实验基础.1932年尤里根据里德伯常数随原子核质量不同而变化的规律,对重氢赖曼线系进行摄谱分析,发现氢的同位素——氘的存在.通过巴尔末公式求得的里德伯常数是物理学中少数几个最精确的常数之一,成为检验原理论可靠性的标准和测量其它基本物理常数的依据.原子光谱的观测,为量子理论的建立提供了坚实的实验基础。
Johannes Rober Rydberg Johann Jakob Balmer 1825 ~1898 1854~1919瑞士数学兼物理学家 瑞典物理学家、数学家,光谱学的奠基人之一二、 实验目的1.测量氢原子光谱中巴尔末线系的几条谱线的波长,并将在空气中的波长修正为真空中的波长。
2.测量计算各谱线的里德伯常数RH ,并求其平均值或用线性拟和的方法求出RH 。
3.学习多功能组合光谱仪的使用。
三、实验原理在量子化的原子体系中,原子能量状态1E ,2E …为一系列分立的值,原子的每一个能量状态称为原子的一个能级。
原子的最低能级称为原子的基态,高于基态的其余各能级称为原子的激发态。
处于高能级的原子,总是会自发跃迁到低能级,并发射出光子。
设光子能量为ε ,频率为ν,高能级为2E ,低能极为1E ,则2121,.E E h E E hενν-==-=由于原子能级是分立的,所以原子由高能级向低能级跃迁时,会发射一些特定频率的光子,在分光仪上表现为一条条分立的光谱线,称为“线状光谱”或“原子光谱”。
波长λ的倒数是波数,它的值由巴耳末公式决定。
对于H 原子有2212111,H HR n n λ⎛⎫=- ⎪ ⎪⎝⎭(2-1-1)式中H R 为H 原子的里德伯常量,H R =1.096776⨯107m-1。

一、实验目的1. 了解氢原子与氘原子的光谱特性。
2. 学习使用光栅光谱仪进行光谱测量。
3. 测定氢原子与氘原子的巴耳末系发射光谱的波长。
4. 通过实验,验证玻尔原子能级理论。
二、实验原理1. 根据玻尔的原子能级理论,氢原子的能级公式为:E_n = -13.6 eV / n^2,其中n为能级量子数。
2. 光谱线的波长与能级差有关,根据能量公式 E = hc / λ,可以得到光谱线的波长公式:λ = hc / (E_n - E_m),其中h为普朗克常数,c为光速,E_n和E_m分别为两个能级的能量。
3. 氢原子的里德伯常数为R_H = 1.0973******** 10^7 m^-1。
三、实验内容1. 连接光栅光谱仪,调节光栅光谱仪至氢氘灯的波长范围。
2. 打开氢氘灯,调整光谱仪的探测器至最佳位置。
3. 采集氢原子与氘原子的巴耳末系发射光谱数据。
4. 利用光谱仪的数据处理软件,对光谱数据进行处理,得到氢原子与氘原子的巴耳末系发射光谱的波长。
四、数据处理1. 根据光谱数据,绘制氢原子与氘原子的巴耳末系发射光谱图。
2. 计算氢原子与氘原子的巴耳末系发射光谱的波长。
3. 利用里德伯常数,计算氢原子与氘原子的里德伯常数。
五、实验结果与分析1. 通过实验,得到氢原子与氘原子的巴耳末系发射光谱的波长。
2. 计算得到氢原子的里德伯常数为 1.0973******** 10^7 m^-1,与理论值相符。
3. 计算得到氘原子的里德伯常数为 1.0973******** 10^7 m^-1,与理论值相符。
六、结论1. 通过实验,验证了玻尔原子能级理论在氢原子与氘原子光谱中的应用。
2. 了解了氢原子与氘原子的光谱特性,以及光栅光谱仪的使用方法。
注:本实验报告仅供参考,具体实验步骤和数据可能因实验条件而异。


氢原子光谱实验报告氢原子光谱实验报告引言在物理学中,光谱分析是非常重要的一种实验手段。
通过光谱分析,可以清楚地看到物质的组成和性质。
作为最简单的原子,氢原子的光谱密切相关,因此它一直是原子光谱实验中最经典的案例之一。
在本次实验中,我们将收集氢原子的光谱数据,并分析其中的特征。
实验方法为了收集氢原子的光谱数据,我们需要使用光谱仪。
我们选择了一个封闭式光谱仪,它能够对光进行有效地控制和过滤。
实验前,我们对仪器进行了校准,并准备好了用于产生氢原子的气体。
实验过程中,我们通过管道将氢气引入到可控沸腾器储罐中,并使氢气沸腾。
然后,我们将光谱仪和氢气沸腾器连接起来,将光线通过气体,捕获光谱数据。
结果在实验过程中,我们采集了大量的光谱数据。
通过对这些数据的分析,我们得到了如下的结果:1.氢原子的吸收光谱分布于紫外线和可见光区域。
主要的发射线在红色、青色和紫色光谱区域出现。
2.对氢原子进行分析后,我们发现它在这三个光谱区域中分别有四条、两条和一条发射线。
我们将其编号为Hα, Hβ, Hγ, Hδ, Hε, Hζ和Hη线。
3.每条氢原子发射线的波长都具有独特的值。
通过使用Balmer公式,我们得到平均波长:Hα为656.3nm,Hβ为486.1nm,Hγ为434.0nm,Hδ为410.2nm,Hε为397.0nm和Hζ为388.9nm。
讨论通过实验结果,我们可以得出以下结论:1.氢原子发射线的波长与所远离原子核的能级之差呈线性关系。
因此,当氢原子从高能级跃迁到低能级时,必须以某一个波长的光子将能量释放出来。
2.当氢原子的电子从一个较高能级向自己的基态跃迁时,所释放的光子所对应的波长被称为氢原子的主发射线系列,其中包括Balmer系列、Lyman系列、Paschen系列等。
3.通过测量氢原子辐射的波长和频率,可以确定氢原子的各个能级。
这对于理解氢原子的物理性质非常重要。
结论本实验说明了如何收集氢原子光谱数据,包括使用光谱仪、气体储罐和校准设备等。

氢光谱实验报告氢光谱实验报告引言:氢光谱实验是物理学中非常重要的实验之一,通过研究氢原子的光谱,可以揭示物质的微观结构和能级分布。
本实验旨在通过观察氢原子的光谱线,分析其能级跃迁和波长变化规律,从而深入了解氢原子的性质。
实验步骤:1. 实验前准备:在实验开始之前,我们首先准备了氢气放电管、光栅光谱仪、高压电源等实验设备。
确保实验环境安全,并进行仪器校准。
2. 实验操作:将氢气放电管连接到高压电源上,调节电压和电流,使其能够产生稳定的放电。
然后将光谱仪与氢气放电管相连,调节仪器参数,使其能够准确记录光谱线的位置和强度。
3. 数据记录:在实验过程中,我们记录了不同电压和电流下氢气放电管所产生的光谱线的位置和强度。
通过这些数据,我们可以进一步分析氢原子的能级结构。
实验结果与分析:通过对实验数据的分析,我们观察到了氢原子的光谱线的特点。
在实验中,我们发现了一系列的光谱线,它们分布在不同的波长范围内。
这些光谱线的位置和强度与氢原子的能级跃迁有关。
根据氢原子的能级结构理论,我们可以将观察到的光谱线与氢原子的能级进行对应。
其中,巴尔末系列是最为明显的一组光谱线,它们对应着氢原子的基态到激发态的能级跃迁。
而帕邢系列和布拉开系列则对应着氢原子的其他能级跃迁。
通过测量不同光谱线的波长,我们可以得到氢原子不同能级之间的能量差。
根据这些能量差的计算结果,我们可以验证氢原子的能级结构理论,并进一步探究其内部结构和量子力学性质。
这对于理解原子物理学的基本原理和应用具有重要意义。
实验误差与改进:在实验过程中,我们注意到存在一些误差。
其中,仪器的精度和环境的干扰是主要的误差来源。
为了减小误差,我们可以采取一些改进措施,如提高仪器的精度和稳定性,减少外界干扰等。
结论:通过氢光谱实验,我们成功观察到了氢原子的光谱线,并分析了其能级跃迁和波长变化规律。
实验结果验证了氢原子的能级结构理论,并为进一步研究原子物理学提供了基础。
在今后的研究中,我们可以进一步探究其他元素的光谱特性,拓展对物质微观结构的认识。

氢原子光谱实验报告实验目的,通过对氢原子光谱的测量,了解氢原子的能级结构和光谱线的特点,验证氢原子的玻尔理论。
实验原理,氢原子的光谱实验是通过光谱仪测量氢原子的光谱线,根据光谱线的位置和强度来确定氢原子的能级结构。
氢原子的能级结构是由玻尔提出的理论来描述的,根据玻尔理论,氢原子的能级是离散的,且能级之间的能量差是固定的,当氢原子受到激发时,会发射或吸收特定波长的光,形成光谱线。
实验仪器,本实验使用的仪器主要有氢原子光谱仪、光源、光栅、光电倍增管等。
实验步骤:1. 调节光源和光栅,使得光线通过光栅后能够分解成光谱。
2. 将氢原子样品放入光谱仪中,调节光谱仪使得光谱线尽可能清晰。
3. 使用光电倍增管测量光谱线的位置和强度,记录下实验数据。
4. 根据实验数据计算氢原子的能级结构和光谱线的特点。
5. 对实验结果进行分析和讨论,验证氢原子的玻尔理论。
实验结果与分析:通过实验测量得到了氢原子的光谱线的位置和强度,根据实验数据计算得到了氢原子的能级结构和光谱线的特点。
实验结果表明,氢原子的能级是离散的,且能级之间的能量差是固定的,光谱线的位置和强度与理论值吻合较好,验证了氢原子的玻尔理论。
结论:本实验通过测量氢原子的光谱,验证了氢原子的玻尔理论。
实验结果表明,氢原子的能级结构是离散的,光谱线的位置和强度与理论值吻合较好。
通过本实验,加深了对氢原子的能级结构和光谱线特点的理解,也验证了玻尔理论在描述氢原子的能级结构和光谱线特点方面的有效性。
通过本次实验,我对氢原子的光谱有了更深入的了解,也对实验操作和数据处理有了更多的经验。
希望通过今后的实验学习,能够进一步提高自己的实验技能和科研能力,为科学研究做出更多的贡献。

一、实验目的1. 熟悉光栅光谱仪的性能和操作方法。
2. 测量氢原子光谱巴尔末线系的波长。
3. 计算里德伯常数,并验证玻尔理论。
二、实验原理氢原子光谱是研究原子结构的重要手段。
根据玻尔理论,氢原子在跃迁过程中会发射或吸收特定频率的光子,从而形成一系列的谱线。
其中,巴尔末线系是氢原子光谱中最为显著的谱线系列。
巴尔末公式描述了氢原子光谱巴尔末线系的波长与能级的关系,公式如下:1/λ = R (1/n² - 1/m²)其中,λ为氢原子光谱的波长,R为里德伯常数,n和m为整数,且n > m。
通过测量氢原子光谱巴尔末线系的波长,可以计算出里德伯常数,从而验证玻尔理论的正确性。
三、实验仪器与材料1. 光栅光谱仪2. 氢气放电管3. 光源4. 稳压电源5. 计时器6. 记录纸7. 铅笔四、实验步骤1. 将氢气放电管连接到光栅光谱仪上,并调整光栅光谱仪的入射角和出射角。
2. 打开光源和稳压电源,使氢气放电管放电产生氢原子光谱。
3. 观察光栅光谱仪的出射光,记录下巴尔末线系中几条谱线的波长。
4. 重复步骤3,测量不同能级间的跃迁谱线波长。
5. 将测量得到的波长数据代入巴尔末公式,计算里德伯常数。
6. 比较实验测得的里德伯常数与理论值,分析误差来源。
五、实验数据及处理1. 实验测得的巴尔末线系波长数据如下:谱线符号 | 波长(nm)------- | --------Hα | 656.280Hβ | 486.133Hγ | 434.047Hδ | 410.1742. 根据巴尔末公式计算里德伯常数:R = (1/λ) (1/n² - 1/m²)以Hα谱线为例,代入数据计算:R = (1/656.280 nm) (1/2² - 1/3²)= 1.097 × 10⁷ m⁻¹六、实验结果与分析1. 实验测得的里德伯常数为1.097 × 10⁷ m⁻¹,与理论值1.096 × 10⁷ m⁻¹较为接近,说明玻尔理论在氢原子光谱研究中具有一定的可靠性。
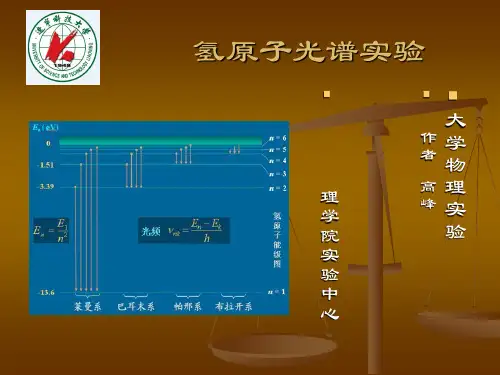
氢原子光谱实验⏹大学物理实验⏹作者高峰⏹理学院实验中心引言⏹氢原子光谱的谱线排列简单而且存在着规律性,它的线状谱线直接传达出了原子内部的信息,反映了原子能级结构。
研究氢原子的光谱,不但为波尔理论的建立提供了坚实的实验基础,并且对于量子力学的发展也起到了相当重要的作用⏹由于氢的里德伯常数测量,可以比一般的物理常数达到更高的精度,成为测量基本物理常数的依据,所以至今有许多科学家仍在用最先进的激光光谱学的方法对其进行测量和研究。
不断的减小了测量结果的不确定度,增加了结果的有效位数。
⏹传统的光谱分析,需要摄谱、暗室冲洗、测谱等阶段,实验周期较长。
组合式多功能光谱仪汲取了计算机和CCD 技术,一改传统摄谱仪用感光胶片的记录方法,使得光谱既可以在计算机屏幕上显示,又可以打印成谱图进行保存,大大缩短了实验的周期,增大了实验的精确程度。
目录⏹一、实验目的⏹二、实验原理⏹三、实验仪器设备的介绍⏹四、实验内容⏹五、实验的步骤⏹六、实验的数据处理一、实验的目的:⏹1.测量氢原子光谱中巴尔末线系的几条谱线的波长,并将在空气中的波长修正为真空中的波长。
⏹2.测量计算各谱线的里德伯常数R H ,并求其平均值或用线性拟和的方法求出R H 。
⏹3.学习多功能组合光谱仪的使用。
二、实验原理⏹1.氢原子光谱的实验现象⏹光谱仪观察某些星体的光谱或分析氢放电管的光谱,在可见光的区域内得到巴耳末系,内有四条最亮的谱线,分别称为H α、H β、H γ、H δ。
谱线H αH βH γH δ波长(n m )656.279486.133434.046410.173颜色红深绿青紫δλ(n m )0.1810.1360.1210.116αH βH γH δH ∞H2.巴耳末用经验公式1885年瑞士的巴耳末用经验公式表示出氢原子的前四条可见光谱:Λ,5,4,3,nm 256.364222=-=n n nλ422-=n nB λΛ,5,4,3=n B=364.56 为一经验常数.3.里德伯公式:里德伯将此式改写成用波数表示的形式.⎪⎭⎫ ⎝⎛-==22~1211n R H λν4.里兹并合原理:里德伯.里兹发现碱金属光谱有类似的规律.)()(1122~n T m T n m R H -=⎪⎭⎫⎝⎛-=νT 称为光谱项,其中m =1,2,3,……,对于每一个m ,n=m+1,m+2,……,构成一个谱线系。

氢原子光谱摘 要:本实验用光栅光谱仪对氢原子光谱进行测量,测得了氢原子光谱巴尔末线系的波长,求出了里德伯常数。
最后对本实验进行了讨论。
关键词:氢原子光谱,里德伯常数,巴尔末线系,光栅光谱仪 1. 引言光谱线系的规律与原子结构有内在的联系,因此,原子光谱是研究原子结构的一种重要方式。
1885年巴尔末总结了人们对氢光谱测量的结果,发现了氢光谱的规律,提出了著名的巴尔末公式,氢光谱规律的发现为玻尔理论的成立提供了坚实的实验基础,对原子物理学和量子力学的发展起过重要作用。
1932年尤里按照里德伯常数随原子核质量不同而转变的规律,对重氢赖曼线系进行摄谱分析,发现氢的同位素氘的存在。
通过巴尔末公式求得的里德伯常数是物理学中少数几个最精准的常数之一,成为查验原子理论靠得住性的标准和测量其他大体物理常数的依据。
2. 氢原子光谱氢原子光谱是最简单、最典型的原子光谱。
用电激发氢放电管(氢灯)中的稀薄氢气(压力在102Pa 左右),可取得线状氢原子光谱。
瑞士物理学家巴尔末按如实验结果给出氢原子光谱在可见光区域的经验公式(1)式中λH 为氢原子谱线在真空中的波长。
λ0=364.57nm是一经验常数。
n取3,4,5等整数。
若用波数表示,则上式变成(2)式中RH 称为氢的里德伯常数。
按照玻尔理论,对氢和类氢原子的里德伯常数的计算,得4220-=n n H λλ⎪⎭⎫ ⎝⎛-==221211~n R v H H H λ(3)式中M为原子核质量,m为电子质量,e 为电子电荷,c 为光速,h 为普朗克常数,ε0为真空介电常数,z 为原子序数。
当M →∞时,由上式可得出相当于原子核不动时的里德伯常数(普适的里德伯常数)(4)所以R ∞=R ̅H (1+m/M H ) (5) 对于氢,有(6)这里MH 是氢原子核的质量。
由此可知,通过实验测得氢的巴尔末线系的前几条谱线的波长,借助(6)式可求得氢的里德伯常数。
里德伯常数R∞是重要的大体物理常数之一,对它的精密测量在科学上有重要意义,目前它的推荐值为R ∞=10973731.568549(83)/m 。
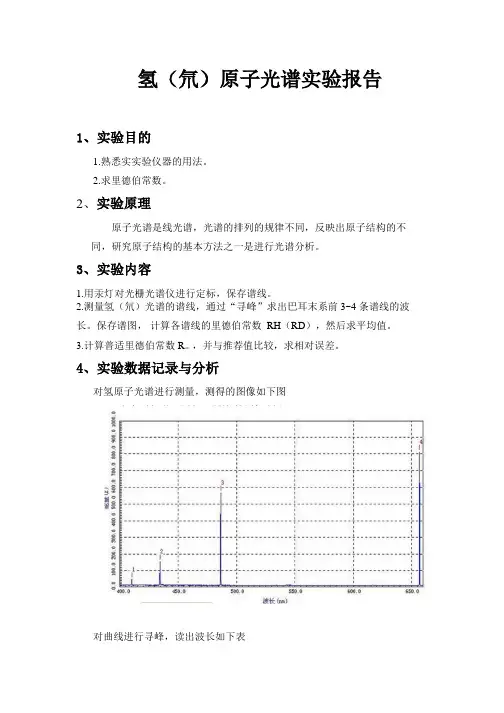
氢(氘)原子光谱实验报告1、实验目的1.熟悉实实验仪器的用法。
2.求里德伯常数。
2、实验原理原子光谱是线光谱,光谱的排列的规律不同,反映出原子结构的不同,研究原子结构的基本方法之一是进行光谱分析。
3、实验内容1.用汞灯对光栅光谱仪进行定标,保存谱线。
2.测量氢(氘)光谱的谱线,通过“寻峰”求出巴耳末系前 3~4 条谱线的波长。
保存谱图,计算各谱线的里德伯常数RH(RD),然后求平均值。
3.计算普适里德伯常数 R∞,并与推荐值比较,求相对误差。
4、实验数据记录与分析对氢原子光谱进行测量,测得的图像如下图对曲线进行寻峰,读出波长如下表谱线HδHγHβHα光谱波长/nm 410.4 434.6 486.5 656.8 谱线相对能量47.1 457.3 566.1 812.2利用波长的修正值计算真空中氢原子的波长:谱线HδHγHβHα光谱波长/nm 410.4 434.6 486.5 656.8 △ι(nm) 0.116 0.121 0.136 0.181 真空中谱波长410.5 434.7 486.6 657.0 /nm可以计算出里德伯常数谱线HδHγHβHα410.5 434.7 486.6 657.0 真空中谱波长/nmn 6 5 4 6 里德伯常数1.096 1.095 1.096 1.096/107m-1经过计算得R=1.00054*1.096*107m-1=1.096* 107m-1而R推荐值是R∞=10973731.568549(83)/m,故相对误差为=(1.097-1.096)/1.097=0.06%4.实验结果讨论与心得1实验中由于氢光源的寿命有限,注意在不用时关闭灯源。
2实验过程中突然谱线很乱,怎么调节都调节不行,可能原因是灯源出现问题,换一个氢灯,实验恢复正常。
3实验中噪音可能对实验产生一定的误差。
4.任何实测谱线都有一定的宽度,主要是由以下原因造成的:1) 由海森伯不确定原理,∆E∆t>h,由于测量时间是有限的,故测得的能级有一定展宽。

氢原子光谱实验报告一、实验目的与实验仪器1.学会并了解光栅的使用2.测定氢原子光谱3.计算氢氘原子核质量比及里德伯常数二、实验原理(要求与提示:限400字以内,实验原理图须用手绘后贴图的方式)氢原子光谱在可见光区域称为巴尔末线系式中n=3,4,5,6分别对应α β γ δ 谱线波长参数,若以波数表示谱线式中,109678 为氢的里德伯常量。
由波尔理论或量子力学得出的类氢离子的光谱规律为式中当 时,便得到里德伯常量所以还可以解出通过实验测出就可算出氢与氘的原子核质量比。
其中是电子质量和氢原子核质量之比为已知值。
三、实验步骤(要求与提示:限400字以内)1. 准备工作:选择光电倍增管接收方式,并启动软件同时初始化2. 校正光谱仪指示波长:使用汞灯三线作为标准值校正,调节合适的测量参数后开始测量汞灯谱线,并对测量结果进行修正。
3. 测量氢原子氘原子的巴尔末系4. 处理数据 四、数据处理(要求与提示:对于必要的数据处理过程要贴手算照片) 氢、氘原子的 α 谱线 n=3172292210096.1)3121(1086.6561)1-211m n R (177100959.171/1836.152 110096.1/1m M m R R HH1.906471/1836.152656.69656.86-656.69656.8671/1836.152/ H D H D H H H D M m M m M M177107095.11.90641836.15271/ 110096.1/1m M m R R HD )(氢、氘原子的 β 谱线 n=4172292210809.1)4121(10485.911)1-211m n R (177100979.171/1836.152 110098.1/1m M m R R HH1.966671/1836.152485.79485.92-485.79485.9271/1836.152/ H D H D H H H D M m M m M M177107095.11.96661836.15271/ 110096.1/1m M m R R HD )(氢、氘原子的 γ 谱线 n=5172292210809.1)5121(10433.471)1-211m n R (177100979.171/1836.152 110098.1/1m M m R R HH2.034971/1836.152433.35433.47-433.35433.4771/1836.152/ H D H D H H H D M m M m M M177107095.12.03491836.15271/ 110096.1/1m M m R R HD )(氢、氘原子的 δ 谱线 n=6172292210809.1)6121(10409.571)1-211m n R (177100979.171/1836.152 110098.1/1m M m R R HH1.289171/1836.152409.52409.57-409.52409.5771/1836.152/ H D H D H H H D M m M m M M177105095.11.28911836.15271/ 110096.1/1m M m R R HD )(1741100987.1m R R i不确定度:1710010.0 m9693.131 iiH D H D M M M M五、分析讨论(提示:分析讨论不少于400字)发现实验测得光谱氘原子波峰一直比氢原子波峰高与讲义所给示例图相反,推测是因为本实验组所用的氢氘灯中氘的填充比例更高导致。
氢原子光谱的测量一、试验目的(1)、了解小型棱镜摄谱仪的结构,掌握其分光原理。
(2)、学习用摄谱仪测量光谱波长的基本实验技术。
(3)、测量氢原子光谱巴尔末线系的波长,并计算里德伯常量.二、实验原理1、氢原子光谱的规律原子光谱与原子能级是密切相关的。
测量原子光谱的波长可推知原子能级的结构。
氢光谱中位于可见光区四条谱线的波长可用下面的经验公式表示:λ B (n=3,4,5,…) (2-232)式中,B是一恒量,值为364.56nm,是谱线系极限值,即n→∞时的波长值。
里德伯将此公式改为波数=1/λ表示=) (2—233)式中,R H 称为氢原子的里德伯常量,其实验测量值为109677.6cm-1。
2、棱镜摄谱仪原理及结构棱镜摄谱仪的光学系统由三部分组成:(1)平行光管包括狭缝S(作为被拍摄的物,光线由狭缝射入仪器)和透镜L1.S平面位于L1的焦面上,因而从S上每点发出的复色光经L1后变为平行光。
(2)、色散系统以棱镜作为色散元件。
不同波长的平行光经棱镜折射后变为不同方向的平行光。
(3)光谱接收部分包括透镜L2及放置在L2焦面上的照相感光板F.不同方向的平行光束L2聚焦,成像在不同位置,形成S的一系列单色像S1,S2,…。
F放在像面上,就在F上形成一排细线,每一条细线对应于一定的波长,叫光谱线。
图1 小型棱镜光路图2 摄谱仪光学系统原理图3、谱线波长的测量(1)、目测法用眼睛通过看谱镜直接观测。
先用已知波长λs的光谱作标准,通过读数鼓轮来确定待测各谱线的波长λx。
(2)、照相法将波长已知的光谱线(比较光谱)和波长未知的光谱线(待测谱线)拍摄在同一张感光板上。
拍摄时,不能移动狭缝和摄谱暗箱,只能通过抽动哈特曼光阑,使比较光谱和待测光谱中常用线性内插法测量.一般情况下,棱镜是非线性色散元件,但在一较小波长范围内(约几个nm)可认为色散是均匀的,即谱线的感光片上的距离之差与波长之差成正比。
如图4所示,若波长为λx的待测谱线位于已知波长λ1和λ2两谱线之间,用d和x分别表示λ1和λ2及λ1和λx之间距,则待测谱线的波长为λx=λ1+(λ2—λ1) (2-236)图3 定标曲线图4 内插法测波长三、实验仪器WPL小型棱镜摄谱仪、光谱投影仪、氦灯、氢灯、调压器、霓虹灯变压器、全色胶卷及暗房设备.四、实验步骤1、调试小型棱镜摄谱仪至工作状态(1)调整光源与聚光镜的位置,使其与平行光管等高、共轴;点燃氦灯,前后移动聚光灯,将光源成像于狭缝处,均匀照亮整个狭缝使通过摄谱仪的光通量达到最大.(2)调节狭缝宽度和调焦,使该谱线清晰.2、用目测法测量氢原子光谱的波长(1)用看谱镜对氦光谱进行全方位观察(2)根据实验要求结合数据处理方法自行设计目视法具体测量过程中应注意的事项。
普通物理实验(三) 32■ 氢原子光谱光谱是光的频率成分和强度分布的关系图,它是研究物质微观结构的重要途径之一.它广泛应用于化学分析、医药、生物、地质、冶金、考古等部门.常用的光谱有吸收光谱、发射光谱和散射光谱,涉及的波段从X 射线、紫外光、可见光、红外光、到微波和射频波段.本实验通过测量氢原子在可见光波段的发射光谱,使大家了解光谱与微观结构(能级)间的联系和光谱测量的基本方法.1.测定氢原子巴耳末系发射光谱的波长和氢的里德伯常数;2了解氢原子能级与光谱的关系,画出氢原子能级图;3了解光学多通道分析器的原理和使用方法.图34-1是氢原子的能级图.根据玻尔理论,氢原子的能级公式为:()()L 3211822304、、=⋅−=n n h e n E εμ (34-1) 式中()M m m e e +=1μ称为约化质量,m e 为电子质量,M 为原子核质量.氢原子的em M 等于1836.15。
图 34-1 氢原子能级图电子从高能级跃迁到低能级时,发射的光子能量h ν为两能级间的能量差,()()()n m n E m E h 〉−=ν (34-2) 如以波数λσ1=表示,则上式为()()()()⎟⎠⎞⎜⎝⎛−=−=−=2211m nR m T n T hc n E m E H σ (34-3) 式中R H 称为氢原子的里德伯常数,单位是m -1,T(n)称为光谱项,它与能级E(n)是对应的.从R H 可得氢原子各能级的能量()21n ch R n E H ⋅−= (34-4) 式中181********.2,1013567.4−−•÷=•×=s c s eV h从图34-1可知,从3≥m 至n=2的跃迁.光子波长位于可见光区.其光谱符合规律 ,、、,L 54312122=⎟⎠⎞⎜⎝⎛−=m m R H σ (34-5) 这就是1885年巴耳末发现并总结的经验规律,称为巴耳末系.氢原子的莱曼系位于紫外,其它线系均位于红外.光学多通道分析器(Optical Multichannel Analyzer,OMA)如图34-2所示。
氢原子光谱的研究直至目前,对元素的光谱进行研究仍然是了解原子结构的重要手段之一。
通过对原子光谱的研究使得我们了解了原子内部电子的自旋运动。
光谱线的超精细结构曾被认为是不同的同位素所发出的谱线,后来又被许多理论和实验如塞曼效应等证实,这些谱线是由单一的同位素由于原子核的自旋而发出的。
本实验通过对氢原子光谱的研究,初步认识电子围绕原子核运动时只能处于一系列能量不连续的状态,并获得氢原子结构的知识。
一、实验目的1、 验证巴尔末公式并测定里德伯(H R ;2、 了解棱镜摄谱仪的原理及相关实验操作方法。
二、实验原理1885年巴尔末(,确定了可见光区域氢光谱的分布规律,指出各谱线的波长可由下式表示:4220-=n n λλ (1) 式中n 为正整数3、4、5,。
nm 56.3640=λ(1)式就是巴尔末公式。
符合这个公式的一系列氢光谱线系称为巴尔末系。
以后又发现了氢原子的其他线系。
为了更加清楚地表明谱线分布规律,里德伯把巴尔末公式改用波数表示如下: )()(22220121411~nR n n v H -=-==λλ (2) H R 称为氢光谱的里德伯常数,近代的测量值为17100973731.1-⨯=m R H为了解释氢原子光谱的规律性,在这些完全从实验得到的经验公式的基础上,玻尔(Bohr )在卢瑟福原子模型的基础上,把库仑定律、牛顿第二定律以及普朗克量子理论运用于原子系统,建立了氢原子理论,得到氢原子的内部能量为:222048hn me E ε-= , ,,,321=n (3) (3)式表示氢原子能量的数值是分立的,不连续的。
当原子从一个稳定状态跃迁到另一个稳定状态时,发射的单色光谱先的波数为:)(2232004118~nm c h me v -=ε n m (4) 比较(2)式和(4)式,玻尔得到理论上的里德伯常数为:173204100973731.18-⨯==m ch me R H ε理论 随着科学技术的不断发展,人们已经知道氢原子光谱有着更为复杂的结构,巴尔末公式也只能作为一个一级近似的规律。
氢原子光谱实验背景介绍:原子的电子运动状态发生变化时发射或吸收的有特定频率的电磁频谱。
原子光谱是一些线状光谱,发射谱是一些明亮的细线,吸收谱是一些暗线。
原子的发射谱线与吸收谱线位置精确重合。
不同原子的光谱各不相同,氢原子光谱最为简单,其他原子光谱较为复杂,最复杂的是铁原子光谱。
用色散率和分辨率较大的摄谱仪拍摄的原子光谱还显示光谱线有精细结构和超精细结构,所有这些原子光谱的特征,反映了原子内部电子运动的规律性。
阐明原子光谱的基本理论是量子力学。
原子按其内部运动状态的不同,可以处于不同的定态。
每一定态具有一定的能量,它主要包括原子体系内部运动的动能、核与电子间的相互作用能以及电子间的相互作用能。
能量最低的态叫做基态,能量高于基态的叫做激发态,它们构成原子的各能级。
高能量激发态可以跃迁到较低能态而发射光子,反之,较低能态可以吸收光子跃迁到较高激发态,发射或吸收光子的各频率构成发射谱或吸收谱。
量子力学理论可以计算出原子能级跃迁时发射或吸收的光谱线位置和光谱线的强度。
原子光谱提供了原子内部结构的丰富信息。
事实上研究原子结构的原子物理学和量子力学就是在研究分析阐明原子光谱的过程中建立和发展起来的。
原子是组成物质的基本单元。
原子光谱的研究对于分子结构、固体结构也有重要意义。
原子光谱的研究对激发器的诞生和发展起着重要作用,对原子光谱的深入研究将进一步促进激光技术的发展;反过来激光技术也为光谱学研究提供了极为有效的手段。
原子光谱技术还广泛地用于化学、天体物理、等离子体物理等和一些应用技术学科之中。
原子或离子的运动状态发生变化时,发射或吸收的有特定频率的电磁波谱.原子光谱的覆盖范围很宽,从射频段一直延伸到X射线频段,通常,原子光谱是指红外、可见、紫外区域的谱.原子光谱中某一谱线的产生是与原子中电子在某一对特定能级之间的跃迁相联系的.因此,用原子光谱可以研究原子结构.由于原子是组成物质的基本单位,原子光谱对于研究分子结构、固体结构等也是很重要的.另一方面,由于原子光谱可以了解原子的运动状态,从而可以研究包含原子在内的若干物理过程.原子光谱技术广泛应用于化学、天体物理学、等离子物理学和一些应用技术科学中.实验目的:1、进一步熟悉光栅光谱仪的性能与使用方法;2、测量氢原子的光谱,理解原子结构与原子跃迁过程。
实验2 氢原子光谱的观察与测定
每一种原子都有其特定的线状光谱线。
氢原子的光谱线最为简单,且具有明显的规律。
测定氢原子可见光谱线的波长对认识原子的分离能级、以及由于能级间的跃迁而产生的光辐射的规律起着重要作用。
本实验用读谱仪测量氢原子可见谱线的波长,并通过巴耳末公式推算出氢原子的里德伯常数。
【实验目的】
(1)观察氢原子的可见光谱。
(2)了解读谱仪的结构,掌握读谱仪的调节与使用方法。
(3)通过测量氢原子可见光谱线的波长,验证巴耳末公式的正确性。
(4)准确测定氢原子的里德伯常数。
(5)理解曲线拟合法的意义。
【仪器用具】
WPL —2型读谱仪,氢谱光源,氦氖谱光源,会聚透镜。
【仪器介绍】
整个实验的装置简图如图1所示。
读谱仪是由棱镜摄谱仪改进设计而成。
它是利用棱镜分光在物镜上观察光谱的光学仪器。
其结构大致可以分为三部分:平行光管系统、色散系统、接收系统。
(1)平行光管系统
平行光管系统包括入射狭缝和入射物镜。
入射物镜的作用是使入射狭缝发出的光线变成平行光,所以入射狭缝应放在入射物镜的焦平面上。
(2)色散系统
色散系统实际上就是一个恒偏向棱镜,如图2所示。
它的作用是将光束分解,使不同波长的单色光束沿不同
的方向射出。
符合最小偏向角条件的单色光,其入射光束和出射光束的夹角为900。
(3)接收系统
接收系统由出射物镜及放在该物镜焦平面上的目镜组成。
不同方向的单色光束经出射物镜聚焦,在其焦平面上得到连续或不连续的依照波长次序排列的入射狭缝的单色像,即光谱。
调节光谱的位置时,可以使用水平方向左右移动的手轮、丝杠、滑块、导轨和支架,还包括读出目镜位置用的标尺和100分度的手轮刻度。
手轮转一圈平移mm 1,每分度mm 01.0,要求估读到
1.0分度。
目境内的叉丝用来对准被测谱线的中心。
【实验原理】
图
1 图2
一、氢原子光谱线公式 氢原子光谱的实验公式为
⎪⎭⎫ ⎝⎛-=2211
1
n k
R H λ (1) 式中的H R 叫做里德伯常数,其实验值为1013.0306.10967758-±=m R H )(实。
氢原子光谱系如表1。
表1 氢原子光谱
玻尔认为,氢原子之所以发光,是因为氢原子中的电子可以处在不同的能态(能级)上,
当电子从高能级向低能级跃迁时,就发出光线。
玻尔推出了氢原子光谱的理论公式
⎪⎭
⎫ ⎝⎛-=⎪⎭⎫ ⎝⎛-=
22223204
11
1181
n k R n k c h me H 理ελ
(2) 里德伯常数的理论值为1013.0534.10973731-±=m R H )(理。
本实验测定在可见光谱内的氢红光谱线(32==n k 、)的波长。
二、曲线拟合法 氢光谱实验一般先在目镜上观察氦氖谱线和氢谱,然后用读数显微镜测出氢红谱线(波长为H λ)及其两侧近邻的(已知波长分别为1λ和2λ)氦氖谱线的位置1y 、H y 和2y ,最后由式(3)算出H λ。
如图3所示。
)(211
21
1λλλλ----='y y y y H H
(3)
很明显,由(3)式求出的波长是不准确的。
因为实际上光谱线的波长和位置并不成线性关系,而(3)式却是用内插法把它当作直线来处理。
为了避免内插法带来的较大的系统误差,我们采用曲线拟合法。
假设拟合函数为
图3
图4
A B
y +-=
λλ (4)
拟合曲线如图4所示。
计算机拟合图4所示曲线的步骤是:
(1)预先设定某一0λ值。
(2)根据实验数据i y 和i λ(=i 1、2、3、4、5),计算中简变量)/(10λλ-=i i x 。
(3)对i y 和i x 作线性回归,求出系数B 及常数A ,同时求出∑--=
i
i i
A Bx y
M 2)(。
(4)对不同的0λ值重复上述步骤,比较所得的M 值,最后用逐次逼近法求出一个c λλ=0
,使M 取最小值。
(5)A B
y c
+-=
λλ即为所求函数。
根据棱镜色散参数及射谱仪结构参数进行具体的计算表明,在可见光范围内,当nm 8051≤-λλ时,拟合过程本身所产生的附加误差不大于位置读数偏差mm 001.0所对应的误差分量,也就是说拟合方法本身所产生的附加误差可以忽略不计。
【实验内容】 1.中心波长调节
中心波长调节就是棱镜位置调节,为了在读谱时能将在可见光范围内的氢谱线清晰读出,则要将固定波长的谱线置于看管谱的中间,称为中心波长,使之与看管视场内的小指针对齐。
本实验的中心波长采用汞谱中nm 8.435谱线。
点燃汞灯,打开狭缝,移动会聚透镜,使汞灯成像在狭缝上。
旋转波长鼓轮,当波长鼓轮转到435刻线时,调整恒偏棱镜的位置,在看管视场内小指针尖端指在nm 8.435谱线时压紧恒偏向棱镜,读谱就在此进行。
(此步骤实验室已调好)
2.观察氦氖光谱。
点燃氦氖灯,调整会聚透镜的位置,聚焦于狭缝附近,转动灯位置,使光线与狭缝重合。
从测目镜中观察氦氖谱线,调整会聚透镜的位置使谱线最清晰。
3.转动测微目镜鼓轮,使主尺位于mm 5附近。
微调测微目镜倾角,使十字叉丝交点位于氦氖红光谱区。
4.把氦氖灯换成氢灯,调节测微目镜倾角使氢红线清晰,把十字叉丝交点对准氢红线。
5.再换成氦氖灯,依次纪录氢红线左侧1、2谱线(波长1λ、2λ已知,
如表1)位置1y 、2y 。
谱线位置如图5所示。
(注意:测位置时使鼓轮从左向右沿一个方向转动)
6.再换成氢灯,测出氢红线位置H y 。
(此时测H y ,就是为防止鼓轮倒转)
7.再换成氦氖灯,依次纪录红线右侧3、4、5谱线(波长3λ、4λ、5
λ已知,如表1)位置3y 、4y 、5y 。
8.重复测量三次。
把测量结果填入表2中,利用计算机算出氢红线波
图5
长1H λ、2H λ、3H λ,求出平均值)3
1
321H H H H λλλλ++=(。
9.求出真空中氢红线的波长)00028.1(==n n H H λλ,代入
⎪⎭⎫ ⎝⎛-=22312
11H H R λ (5)
中,求出实H R ,与公认值1013.0306.10967758-±=m R H )(相比较,并求出相对误差
%100⨯-=
H
H
H R R R E 实
【数据处理】
表2
1.利用计算机算出氢红线波长1H 、2H 、3H ,如图6所示。
求出平均值H λ,填入表1中。
2.真空中氢红线的波长H H n λλ=。
(空气的折射率00028.1=n ) 3.求里德伯常数及相对误差。
把H λ代入(5)式,求得实H R ,并与公认值1
013.0306.10967758-±=m R H )(相比较,并求出相对误差
%100⨯-=
H
H
H R R R E 实
图6。