电子课文课题1原子的构成课后习题
- 格式:docx
- 大小:6.36 KB
- 文档页数:1

九年级化学- 原子的结构1.原子是由居于原子中心的原子核和__核外电子__构成的,原子核是由__质子__和__中子__构成的。
2.由于原子核内质子所带电荷与核外电子的电荷数量__相等__,电性__相反__,因此原子不显电性。
3.在原子中,核电荷数=核内__质子数__=核外__电子数__。
4.原子中的核外电子是分层排布的,可以用__原子结构示意图__表示。
5.相对原子质量是以__一种碳原子质量的1/12__作为标准,其他原子的__质量__与它相比较所得到的比。
6.原子结构示意图的含义:小圆圈和圈内的数字表示__原子核__和__核电荷数__,弧线表示__电子层__,弧线上的数字表示该电子层上的__电子数__。
7.稀有气体最外层有__8__个(除氦外)电子,形成相对稳定的结构;金属的原子最外层电子一般少于__4__个,在化学反应中易__失去__电子;非金属的原子最外层电子一般多于__4__个,在化学反应中易__得到__电子。
9.构成物质的的粒子除了原子、分子之外,还有__离子__,__带电__的原子叫做离子。
其中带正电的原子叫做__阳__离子,带负电的原子叫做__阴__离子。
9.原子的质量主要集中在__原子核__上,因此相对原子质量≈__质子数__+__中子数__。
小节练习题1.原子核中一定含有的粒子是(B)A.中子B.质子C.电子D.质子和中子2.锂电池可用作心脏起搏器的电源。
已知一种锂原子核内含有3个质子和4个中子,则该锂原子的核外电子数为(B)A.1 B.3C.4 D.73.下列粒子不显电性的是(D)A.质子B.电子C.原子核D.分子4. 氯化钠由什么粒子构成?四位同学分别给出以下答案,你认为正确的是(A)A.离子B.分子C.原子D.中子5. 下列关于原子结构的认识错误的是(C)A.原子内部有相对较大的空间B.原子由原子核和核外电子构成C.原子由质子和中子构成D.原子核带有正电荷6.下列有关离子的认识错误的是(D)A.原子失去电子,形成了阳离子B.原子得到电子,形成了阴离子C.离子也是构成物质的粒子D.原子失去电子后带负电荷7.下列结构示意图中,表示阴离子的是(D)8.下图为小明制作的原子模型,外圈上小球为电子,内圈为原子核。
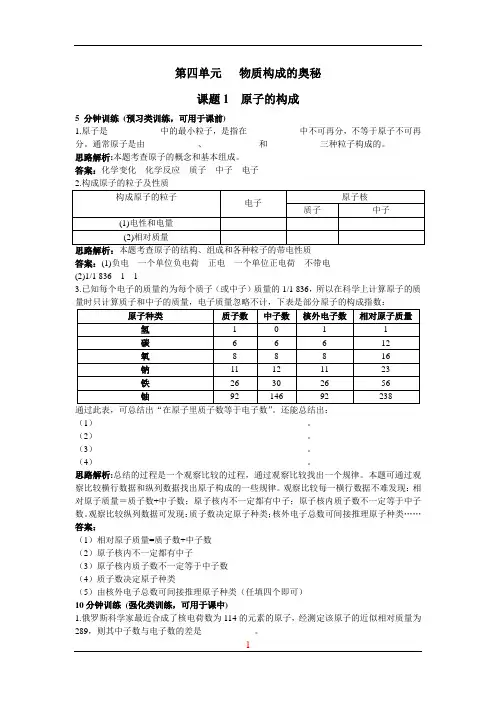
第四单元物质构成的奥秘课题1 原子的构成5 分钟训练(预习类训练,可用于课前)1.原子是____________中的最小粒子,是指在____________中不可再分,不等于原子不可再分。
通常原子是由____________、____________和____________三种粒子构成的。
思路解析:本题考查原子的概念和基本组成。
答案:化学变化化学反应质子中子电子思路解析:本题考查原子的结构、组成和各种粒子的带电性质答案:(1)负电一个单位负电荷正电一个单位正电荷不带电(2)1/1 8361 13.已知每个电子的质量约为每个质子(或中子)质量的1/1 836,所以在科学上计算原子的质量时只计算质子和中子的质量,电子质量忽略不计,下表是部分原子的构成指数:通过此表,可总结出“在原子里质子数等于电子数”。
还能总结出:(1)________________________________________________。
(2)________________________________________________。
(3)________________________________________________。
(4)________________________________________________。
思路解析:总结的过程是一个观察比较的过程,通过观察比较找出一个规律。
本题可通过观察比较横行数据和纵列数据找出原子构成的一些规律。
观察比较每一横行数据不难发现:相对原子质量=质子数+中子数;原子核内不一定都有中子;原子核内质子数不一定等于中子数。
观察比较纵列数据可发现:质子数决定原子种类;核外电子总数可间接推理原子种类……答案:(1)相对原子质量=质子数+中子数(2)原子核内不一定都有中子(3)原子核内质子数不一定等于中子数(4)质子数决定原子种类(5)由核外电子总数可间接推理原子种类(任填四个即可)10分钟训练(强化类训练,可用于课中)1.俄罗斯科学家最近合成了核电荷数为114的元素的原子,经测定该原子的近似相对质量为289,则其中子数与电子数的差是____________。


默认标题-2011年7月31日一、选择题(共30小题)1、下列说法中,错误的是()A、水是由氢元素和氧元素组成的B、原子是构成物质的一种基本微粒C、由同种元素组成的纯净物叫做单质D、含有氧元素的化合物就是氧化物2、液化石油气的燃料之一是丙烷(分子结构模型如图),下列关于丙烷的说法不正确的是()A、丙烷属于有机化合物B、丙烷由3个碳原子和8个氢原子构成C、丙烷中碳元素和氢元素的质量比为9:2D、一个丙烷分子中含有26个电子3、下列关于分子、原子的说法错误的是A、分子是构成物质的一种粒子B、原子是化学变化中的最小粒子C、分子都是由两个原子构成的D、原子是由原子核和核外电子构成的4、下列关于原子的叙述不正确的是()A、构成一切物质的微粒B、原子可以结合成分子C、原子的质量、体积都很小D、原子中原子核的体积极小,但所占原子的质量很大5、下列叙述中,正确的是()A、物质都是由分子构成的B、水分子是保持水的化学性质的最小粒子C、原子在化学变化中可以再分D、原子核是由质子和电子构成的6、关于分子、原子、离子的说法,其中正确的是()A、原子是最小的粒子,不可再分B、化学反应前后分子的数目一定不变C、分子、原子、离子都可以直接构成物质D、当二氧化碳气体变成干冰时,二氧化碳分子间不存在间隔7、(2011•滨州)乙醇的分子结构模型如图所示,则下列叙述正确的是()A、乙醇是由三种元素组成的无机物B、一个乙醇分子中含有28个质子C、乙醇中碳、氧元素的质量比为3:2D、乙醇中氧元素的质量分数最大8、(2009•)以下四位同学对分子和原子的认识正确的是()A、分子运动而原子不运动B、分子可分而原子不可分C、分子构成物质而原子不能构成物质D、原子由原子核和核外电子构成9、(2001•)1999年度诺贝尔化学奖获得者艾哈迈得•泽维尔(Ahmed H•Zewail),开创了“飞秒(10﹣15秒)化学”的新领域,使运用激光光谱技术观测化学反应时分子中原子的运动成为可能.你认为该技术不能观察到的现象()A、化学变化中反应物分子的分解B、反应中原子的运动C、化学反应中生成物分子的形成D、原子核的部结构10、如图为丙氨酸分子结构模型,下列关于丙氨酸说法不正确的是()A、丙氨酸是由碳原子、氢原子、氧原子和氮原子多原子分子构成的化合物B、丙氨酸分子中碳、氢、氧、氮原子的质量比为36:7:32:14C、丙氨酸是形成蛋白质的一种氨基酸,分子中含有13个原子D、丙氨酸分子中的质子数和电子数比为1:l11、(2011•)钛和钛合金被认为是21世纪的重要金属材料,它们具有熔点高、密度小、抗腐蚀性能好等优良性能,因此被广泛用于火箭、航天飞机、船舶和化工等.已知钛原子的质子数为22,中子数为26,则钛原子的核外电子数为()A、48B、26C、22D、412、(2011•)下表列出了几种原子中的粒子数:原子质子数中子数核外电子数氢 1 0 1碳 6 6 6氧8 8 8钾19 20 19分析表息,下列说确的是()A、原子核质子数等于中子数B、原子核都由质子和中子构成C、原子只有质子和电子构成D、原子中质子数等于核外电子数13、(2011•)2011年3月,日本近海强震引发的海啸,造成福岛核电站发生核泄漏事件,导致环境出现碘131超标,碘131原子的核电荷数为53,相对原子质量为131,碘原子的核外电子数为()A、131B、127C、78D、5314、(2011•)2011年3月,受里氏9.0级地震影响,日本福岛县第一核电站反应堆震后发生异常导致核蒸气泄漏.其中放射性元素碘﹣131数月后才会完全消失,通过受污染食品在甲状腺聚集,引发甲状腺疾病甚至甲状腺癌.已知碘﹣131的原子核质子数为53,质子数与中子数之和为131,则下列关于该原子的说确的是()A、中子数为88B、核外电子数为53C、核电荷数为131D、1个该原子的质量为131g15、(2010•)核能已经成为一种重要的能源,氘和氚都是未来生产核能的燃料.氚是氢元素的一种原子,氚原子的核电荷数是()A、1B、2C、3D、416、(2010•)最近科学家发现了一种与天体中的中子星构成类似的,只由四个中子构成的粒子,这种粒子称为“四中子”,也称为“零号元素”.有关这种粒子的说确的是()A、易失去电子B、相当于一个氢分子的质量C、不显电性D、在周期表中可与氢元素占同一位17、(2010•)下列关于原子的叙述正确的是()A、原子由原子核和核外电子构成B、原子由原子核和中子构成C、原子由质子和电子构成D、原子由质子和中子构成18、(2010•)硒是人体必需的一种微量元素,严重缺硒有可能诱发皮肤疾病.已知硒的原子序数为34,质子数与中子数之和为79.下列有关硒原子的说法中,不正确的是()A、核外电子数为34B、核电荷数为79C、质子数为34D、中子数为4519、(2010•)著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子.一种元素的原子经过放射变后变成了另一种元素的原子,据此推断放射出的粒子一定是()A、电子B、中子C、原子核D、质子20、(2010•)下列关于原子的叙述中,错误的是()A、原子呈电中性B、原子是实心球体C、原子由原子核与核外电子构成D、原子可以构成分子21、(2009•)原子序数为94的钚(Pu)是一种核原料,该元素一种原子的质子数和中子数之和为239,下列关于该原子的说法不正确的是()A、中子数为145B、核外电子数为94C、质子数为94D、核电荷数为23922、(2008•)我市桃花江核电站已获得国家发改委正式批准开展前期工作.核电站常用的某种核原料的原子中含一个质子二个中子.对于该原子,下列说确的是()A、该原子核电荷数为2B、该原子是一种氢原子C、该原子核外有2个电子D、该原子核带3个单位正电荷23、(2008•)1911年著名物理学家卢瑟福为探索原子的部结构进行了实验.在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:(1)大多数α粒子能穿透金箔而不改变原来的运动方向;(2)一小部分α粒子改变了原来的运动方向;(3)有极少部分α粒子被弹了回来.下列对原子结构的认识错误的是()A、原子核体积很小B、原子核带正电C、原子部有很大的空间D、原子是实心的球体24、(2008•)绝大多数原子的原子核中含有()A、质子、中子、电子B、质子、电子C、中子、电子D、质子、中子25、(2008•来宾)锂电池具有质量轻、容量大、不含有毒物质等优点,因而得到了广泛应用.已知某种锂原子中含有3个质子和4个中子,则该锂原子的核外电子数是()A、3B、4C、5D、726、(2008•)在原子的原子核里,质子数等于()A、核外电子数B、中子数C、中子数和电子数之差D、中子数和电子数之和27、(2007•)1934年,卢瑟福等科学家通过核反应发现氢的同位素原子﹣﹣氚.氚可用“表示(其中“l”表示核电荷数),氚原子的模型如图所示,图中“●”表示的粒子是()A、原子核B、质子C、中子D、核外电子28、(2007•)化合物MCl2中,M元素原子核的质子数可能为()A、1B、10C、11D、1229、(2004•)1991年,我国化学家青莲与另一位科学家合作,测定了铟(In)元素的相对原子质量新值.铟元素的核电荷数为49,相对原子质量为115.铟原子的核外电子数为()A、115B、49C、66D、16430、正电子、负质子都是反粒子,它们跟通常所说的电子、质子相比较,质量相等但电性相反.科学家设想在宇宙中可能存在完全由反粒子构成的物质﹣﹣反物质;物质与反物质相遇会产生“湮灭”现象,释放出巨大的能量,在能源研究领域中前景可观.请你推测,反氢原子的结构可能是()A、由一个带正电荷的质子和一个带负电荷的电子构成的B、由一个带负电荷的质子和一个带正电荷的电子构成的C、由一个带正电荷的质子和一个带正电荷的电子构成的D、由一个带负电荷的质子和一个带负电荷的电子构成的答案与评分标准一、选择题(共30小题)1、下列说法中,错误的是()A、水是由氢元素和氧元素组成的B、原子是构成物质的一种基本微粒C、由同种元素组成的纯净物叫做单质D、含有氧元素的化合物就是氧化物考点:单质和化合物的概念;水的组成;氧化物、酸、碱和盐的概念;原子的定义与构成。

鲁教版九年级化学第二单元第三节原子的构成同步练习含答案第1课时 原子的结构01 知识管理 1.原子的结构结 构:原子〔不显电性〕⎩⎪⎨⎪⎧〔带正电〕⎩⎪⎨⎪⎧ 〔1个质子带1个单位正电荷〕〔不带电〕 〔1个电子带1个单位 电荷〕构成规律:在原子中,①核电荷数=________=__________;②________不一定等于质子数和电子数;③不是一切的原子核中都有________,如氢原子;④________的多少决议原子的种类;⑤整个原子________电性。
质 量:原子的质量简直全部集中在________上。
2.原子及其性质概 念:是________的一种基本粒子,如金、金刚石都是由________直接构成的。
性 质:质量和体积________,原子之间________和相互作用、总在________。
02 基础题1.以下物质由原子直接构成的是〔 〕 A .氧气 B .金 C .水 D .空气2.(重庆A 卷)同一原子中,以下说法错误的选项是〔 〕 A .质子和电子的数目相反 B .原子和中子的电性不同 C .原子核和电子的质量不同 D .原子核和原子的体积不同3.(荆州中考)原子核中一定含有的粒子是〔 〕 A .中子 B .质子C .电子D .质子和中子4.(南宁中考)以下关于分子和原子的说法,错误的选项是〔 〕 A .分子和原子都可以直接构成物质B .由分子构成的物质,分子是坚持其化学性质的最小粒子C .在化学变化中,分子可以分红原子,原子又可以结分解新的分子D .分子和原子之间都有距离,分子之间距离较大,原子之间距离较小5.知识梳理有助于我们对已学知识的稳固,如图是某同窗学习物质结构层次后以氧气为例停止的梳理,以下选项中与a 、b 、c 对应的是〔 〕A .原子、原子核、核外电子B .原子核、原子、核外电子C .原子、核外电子、原子核D .核外电子、原子核、原子6.(郴州中考)原子的质量主要决议于原子的〔 〕 A .质子数 B .中子数C .中子数和核外电子数D .质子数和中子数7.(威海中考)如图为某原子结构模型的表示图,其中a 、b 、c 是构成该原子的三种不同粒子。

原子结构一、选择题1.核电荷数小于或等于18的元素中,原子的最外层电子数是其余电子总数一半的元素种类有( )。
A.1种B.2种C.3种D.4种2.1~18号元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素原子最外层电子数是其内层电子总数的3倍;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与B的阴离子电子层结构相同,则4种元素核电荷数关系中正确的是( )。
A.C>D>B>AB.D>B>A>CC.A>D>C>BD.B>A>C>D3.1~18号元素的其中一种原子最外层电子数是次外层电子数的3倍,那么该原子( ) A.有3个电子层B.有2个电子层C.最外层电子数是8 D.核电荷数是104.具有12个质子和10个电子的微粒是( )。
A.O2-B.Na+C.Mg2+D.S2-5.核电荷数为16的元素和核电荷数为4的元素的原子相比较,下列数据中前者是后者4倍的是( )。
①核外电子数②最外层电子数③电子层数④次外层电子数A.①④B.①③④C.①②④D.②③6.硫的原子结构示意图为( )。
7.某元素的离子A m -核内有n 个中子,核外有x 个电子。
该原子的质量数是( )。
A.x-m+n B.x+m+n C.m+n-xD.x-n+m8.下列粒子中,各电子层电子数都达到2n 2(n 为电子层序数)的是( )。
A.Ne 、Ar B.Al 3+、S 2-C.F -、Na +D.Ne 、Cl -9.下列粒子中,各电子层电子数都达到2n 2(n 为电子层序数)的是( )。
A.Ne 、ArB.Al 3+、S 2-C.F -、Na +D.Ne 、Cl -10.溴原子结构示意图如右下图,下列有关说法错误的是( )A .溴是非金属元素B .溴原子易失电子C .溴的核电荷数为35D .溴化镁的化学式为MgBr 211.已知R 2-的核内有n 个中子,R 原子的质量数为M ,则m g R 2-含有电子的物质的量为( ) A .m (M -n )M mol B .M -n -2Mm mol C .m (M -n -2)Mmol D .m (M -n +2)Mmol 12.原子序数为1~18的三种元素X 、Y 、Z ,已知X 元素的原子最外层只有一个电子;Y 元素原子的M 电子层上的电子数是它K 层和L 层电子总数的一半;Z 元素原子的L 电子层上电子数比Y 元素原子的L 电子层上电子数少2个。

第三单元物质构成的奥秘课题2 原子的结构(第1课时)1.已知原子的核电荷数,可以确定它的()A.原子质量 B.质子数C.中子数 D.电子数与中子数之和2.原子核()A.由电子和质子构成 B.由质子和中子构成C.由电子和中子构成 D.由质子、中子和电子构成3.构成氧原子的微粒有()A.8个质子,8个中子,16个电子B.8个质子,8个电子C.8个质子,8个中子,8个电子D.8个原子核,8个中子,8个电子4.在原子里质子数等于()A.中子数 B.电子数C.中子数和电子数之和 D.中子数和电子数之差5.构成原子的粒子是()A.原子核和质子 B.质子和中子C.原子核和电子 D.质子和电子6.关于原子的叙述错误的是()A.原子还能再分B.原子均由质子、中子和电子构成C.原子在不断运动D.原子之间存在间隔7.如图是原子的构成示意图。
下列有关叙述正确的是()A.原子是实心球体B.质子、中子、电子均匀分布在原子中C.质子与电子的质量相等D.整个原子的质量主要集中在原子核上8.我国著名化学家张青莲教授与另一位科学家合作,测定了铟元素的相对原子质量新值。
铟元素的核电荷数为49,相对原子质量为115。
铟原子的核外电子数为()A. 115B. 49C. 66D. 164 9.绝大多数原子的原子核中含有 ( )A.质子、中子、电子B.质子、电子C.中子、电子D.质子、中子10.下列是关于原子的叙述:①原子是不可分割的实心球体;②原子一定比分子小;③原子都是由原子核和核外电子构成的;④原子是化学变化中的最小粒子;⑤在原子中质子数等于电子数,质子带负电荷,电子带正电荷;⑥原子的质量约等于质子和中子的质量之和;⑦分子可以构成物质,原子不能直接构成物质。
其中正确的是()A.②③④⑤ B.②④⑤⑥⑦ C.③④⑥ D.全部11.下列关于原子的叙述中,正确的是()A.原子是不能再分的粒子B.一切物质都是由原子直接构成的C.一切原子的原子核都是由质子和中子构成的D.原子核内的质子数一定等于核外的电子数12.在①分子、②原子、③质子、④中子、⑤电子、⑥原子核这些粒子中选择填空(填序号):(1)能保持物质化学性质的粒子是;(2)化学变化中的最小微粒是(3)能直接构成物质的粒子是;(4)构成原子核的粒子是;(5)带正电的粒子是;(6)带负电的粒子是;(7)质量最小的的粒子是;(8)在同一原子中数目相等的是。

课题2原子的构成5 分钟训练(预习类训练,可用于课前)____________中的最小粒子,是指在____________中不可再分,不等于原子不可再分。
通常原子是由____________、____________和____________三种粒子构成的。
思路解析:本题考查原子的概念和根本组成。
答案:化学变化化学反响质子中子电子思路解析:本题考查原子的结构、组成和各种粒子的带电性质答案:(1)负电一个单位负电荷正电一个单位正电荷不带电(2)1/1 8361 13.每个电子的质量约为每个质子〔或中子〕质量的1/1 836,所以在科学上计算原子的质量时只计算质子和中子的质量,电子质量忽略不计,下表是局部原子的构成指数:通过此表,可总结出“在原子里质子数等于电子数〞。
还能总结出:〔1〕________________________________________________。
〔2〕________________________________________________。
〔3〕________________________________________________。
〔4〕________________________________________________。
思路解析:总结的过程是一个观察比较的过程,通过观察比较找出一个规律。
本题可通过观察比较横行数据和纵列数据找出原子构成的一些规律。
观察比较每一横行数据不难发现:相对原子质量=质子数+中子数;原子核内不一定都有中子;原子核内质子数不一定等于中子数。
观察比较纵列数据可发现:质子数决定原子种类;核外电子总数可间接推理原子种类……答案:〔1〕相对原子质量=质子数+中子数〔2〕原子核内不一定都有中子〔3〕原子核内质子数不一定等于中子数〔4〕质子数决定原子种类〔5〕由核外电子总数可间接推理原子种类〔任填四个即可〕10分钟训练(强化类训练,可用于课中)1.俄罗斯科学家最近合成了核电荷数为114的元素的原子,经测定该原子的近似相对质量为289,那么其中子数与电子数的差是____________。

新人教版九年级上册《3.2 原子的构成》同步练习卷一、填空题(共5小题,每小题3分,满分15分)1.原子很小,原子核更小,电子在原子核外很大的空间里作的运动.科学研究表明,在含有多个电子的原子中,核外电子具有不同的,离核近的电子,离核越远,电子.2.核外电子的分层运动又叫做.到目前为止,人们发现元素原子核外电子的排布中,最少的只有层,最多的有层.最外层电子数最多不超过个(只有1层的,电子不超过个).3.原子结构示意图表示的意义:以镁原子为例:表示镁原子的核电荷数(质子数)为,核外共有个电子层,第一层上有个电子,最外层上有个电子.4.稀有气体的原子最外层有个电子(氦为个电子),是一种的结构,氦、氩等化学性质比较;钠、镁等金属的原子最外层电子数一般都于4个,在化学反应中易电子;氯、氧等非金属原子的最外层电子数一般都4个,在化学反应中易电子,都趋于达到的结构.5.叫做离子,原子失去电子会带上电,叫做离子,原子得到电子会带上电,叫做离子.像氯化钠这种由阴、阳离子相互作用形成的化合物叫做离子化合物.二、基础训练6.某原子的结构示意图为:,下列说法正确的是()A.该原子中所含的质子数为16B.该原子属于金属元素的原子C.该原子属于非金属元素的原子D.该原子的核外电子数为67.根据钠原子结构示意图不能确定的是()A.质子数B.电子层数C.相对原子质量D.元素种类8.下列陈述不正确的是()A.分子可以分解成原子B.原子由原子核和电子构成C.阳离子得到电子变成原子D.原子失去电子变成阴离子9.某元素负二价阴离子的结构示意图为,则该元素原子所含的质子数为()A.6 B.8 C.10 D.1210.下表列出了一些生活中常见元素的原子结构示意图.下列叙述错误的是()A.上表中,8种元素原子的核外电子层数相同B.S、Cl、Ar的原子在化学反应中都易得到电子,形成带负电荷的阴离子C.上表中,非金属元素原子的最外层电子数都大于4个D.从Na到Ar,随着核电荷数的递增,原子核外最外层电子数从1个递增到8个三、能力训练11.据科学家预测,月球的土壤中吸附着百万吨的氦(He﹣3),其原子核中质子数为2、中子数为1,每百吨氦(He﹣3)核聚变所释放出的能量相当于目前人类一年消耗的能量.下列关于氦(He﹣3)元素的说法正确的是()A.原子核外电子数为3 B.相对原子质量为2C .原子结构示意图为D .原子结构示意图为12.某粒子结构示意图为,下列对该粒子的说法中不正确的是( )A .核内一定有10个质子B .核外电子是分层排布的C .具有稳定结构D .可能是阳离子或阴离子或稀有气体原子13.下列结构示意图,表示阴离子的是( )A .B .C .D .14.下列结构示意图中表示阳离子的是( )A .B .C .D .15.原子失去最外层电子或最外层得到电子之后,一定不会引起的改变是( )①核外电子总数 ②化学性质③相对原子质量④粒子的电性 ⑤原子核 ⑥电子层数 ⑦最外层电子数.A .①⑤B .②⑤C .③⑤D .②④⑥16.对于Fe 、Fe 2+、Fe 3+三种粒子的判断正确的是( )①核电荷数相同 ②核外电子数相同 ③电子层结构完全相同 ④相对原子质量几乎相等.A .①②③④B .①③C .①④D .②③四、解答题(共3小题,满分0分)17.(1)用数字和化学符号表示:2个氧原子 ,3个钠离子 .(2)镁的原子结构示意图为.Mg原子再化学反应中容易(填“得到”或“失去”)2个电子.18.Na与Na+的比较:(1)Na与Na+的化学性质不同,是因为;(2)Na与Na+的质量几乎相等,是因为;(3)Na与Na+属于粒子,是因为.19.在一个水分子中(H2O),共有个质子,个电子.在一个氢氧根离子中(OH﹣),共有个质子,个电子.五、迁移拓展20.根据下列几种粒子的结构示意图,回答问题:(1)其中属于阴离子的是.(填序号,下同)(2)属于金属原子的是.(3)具有相似化学性质的粒子是.21.(2016•湘桥区模拟)如图1为某粒子的结构示意图,则(1)该粒子有个电子层,X的值为;(2)该粒子的化学性质与下列(如图2)(填序号)元素的化学性质最相似.。


第四单元物质构成的奥妙课题1 原子的组成例题精讲【例题1】已知每个电子的质量约为每个质子或中子质量的1/1836。
根据下表的内容。
可总结出“在原子里质子数等于电子数”。
还能总结出:(1)________________________________________;(2)________________________________________;(3)______________________________________ ;(4)________________________________________。
原子种类质子数中子数核外电子数相对原子质量氢 1 0 1 1碳 6 6 6 12氧8 8 8 16钠11 12 11 23铁26 30 26 56【解析】解题时首先掌握原子结构中各种量之间的等量关系,然后对照表中所给的一组信息,分析上下左右之间的关系(本题中质子数、核外电子数、中子数及相对原子质量的相互关系;各元素的质子数或中子数或相对原子质量等数据的规律),从中总结出规律性的结论。
步骤如下:(1)由每一纵行以及纵行间对比、分析数据,整理后发现规律:由第二纵行:不同的原子质子数不同。
即质子数不同,元素种类不同。
由第三纵行:氢原子没有中子,其他原子的中子数也不一定相同。
即原子核内中子数≧0,或不是所有的原子都有中子。
由纵行对比看:原子核内质子数不一定等于中子数(或原子核外电子数不一定等于中子数。
一般来说,相对原子质量随质子数的增加而增大。
(2)由每一横行以及横行间对比、分析数据,整理后发现规律:原子核内质子数等于核外电子数;相对原子质量=质子数+中子数。
解答这一类题目时避免出现以下几种错误:(1)对表中某一数据或某一组数据未经分析、整理就下结论。
(2)对某一规律性的结论进行反复变式,变成另一规律性结论,尽管正确,是重复结论。
(3)不从所给信息出发,违背题意答题。
(4)违背科学事实,臆造结论。
3.2.1原子的结构1.某些花岗岩石材中含有放射性元素氡。
一种氡原子的质子数为86,中子数为136,这种氡原子核外电子数为()A.50B.86C.136D.2222.下列说法正确的是()A.原子不能再分B.原子核都是由质子和中子构成的C.相对原子质量只是一个比,没有单位D.原子可以构成分子,也可以直接构成物质3.有两种原子,一种原子核内有17个质子和18个中子,另一种原子核内有17个质子和19个中子,则它们不相等的是()A.核电荷数B.核外电子数C.原子质量D.原子的带电荷量4.“神舟”五号不仅将杨利伟送上太空,实现了亿万中国人的梦想,同时还承担着其他的科研任务。
比如探索宇宙中可能存在完全由反粒子构成的物质——反物质。
物质与反物质相遇会发生“湮灭”现象,释放出巨大的能量,在能源研究领域中前景可观。
正电子、负质子等都是反粒子。
它们与通常所说的电子、质子相比较,质量相等但电性相反。
请你推测,反氢原子的结构可能是()A.由一个带正电荷的质子与一个带负电荷的电子构成B.由一个带负电荷的质子与一个带正电荷的电子构成C.由一个带正电荷的质子与一个带正电荷的电子构成D.由一个带负电荷的质子与一个带负电荷的电子构成5.居里夫人是著名科学家,两次获得诺贝尔奖。
她首先发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子。
一种元素的原子经过放射变成了另一种元素的原子,据此可推断放射出的粒子是()A.电子B.中子C.质子D.原子核6.英国科学家道尔顿最先确立了原子学说,他的中心论点主要有:①原子是不能再分的粒子;②原子是微小的实心球;③同种元素的原子,其性质和质量都相同。
而现代科学实验表明:同种元素的原子内部有相同的质子数和不一定相同的中子数。
从现代的观点看,你认为道尔顿的三个论点中,不确切的是()A.①B.①③C.②③D.①②③7.科学研究发现:氮气不活泼,在3000 ℃时仅有0.1%的分子分裂。
在0 ℃常压条件下,向密闭容器M中充入一定量氮气,而后升高温度(不超过300 ℃,压强不变),若该密闭容器的体积增大了一倍,几位同学设想了四种M内分子变化示意图,你认为合理的是哪一种?图4-18.(经典回放)为形象展示水分解的微观过程,某同学制作了一些模型,表示相应的微观粒子。
第7章习题解答①一、是非题1.幼能级对应的量子数为«=4, /=3o ()解:对2.3d能级对应的量子数为心3, 1=3o()解:错3.p原了轨道的角度分布图是两个外切的等径関,图中的正、负号代表电荷符号。
.()解:错4.原子的s轨道角度分布图是球形对称的。
()解:对5.在多电子原子中,核外电子的能级只与主量子数八有关,八越大,能级越高。
()解:错6.对任何原子核外某一电了来说,只冇四个量子数完全确定后,其能量才冇一定值。
()解:错7.原子轨道就是原子核外电子运动的轨道,这与宏观物体运动轨道的含义相同。
()o解:错8.以电子概率(几率)密度表示的空间图象即为原子轨道,波函数的空间图象即为电子云。
()解:错9.电了云是核外电了分布概率(几率)密度的空间图象。
.()解:对10.波函数咸明微观粒子运动的波动性,其数值可大于零也可小于零,丨胡2表示电子在原子核外空间出现的概率(儿率)密度。
.()解:对二、选择题1.所谓某原子轨道是指.()。
(A)—定的电子云;(B)核外电子出现的概率(几率);(C)一定的波函数;(D)某个径向分布函数。
解:C2.与波函数视为同义语的是()。
(A)概率(儿率)密度;(B)电了云;(C)原子轨道;(D)原子轨道的角度分布图。
解:C3.氢原子的原子轨道能量取决于量子数()。
(A)n;(B)n 和Z;(C)/;(D>o解:A4.下列有关电子云的叙述中,错误的是()。
(A)电子云形象地表示了电子在核外某处单位微体积内出现的概率(儿率);(B)电子云形彖化地表示了电子在核外空间某处出现的概率(几率)密度;(C) 15电子云界面图是一个球面,表示在这个球面以外,电了出现的概率(儿率)为 零;(D) 电子云是电子运动的统计结果,它好象形成了一团带负电荷的云,包围在原子 核的外边。
解:C5. 某原子轨道用波函数表示时,下列表示小正确的是()。
(A) 炸(B)%』;(C) %亦(D) %,伽冲。
原子的结构习题一、单选题(本大题共25小题,共50.0分)1.等电子体具有原子数目相同、电子数目相同的特征。
下列各组属于等电子体的是()A. NO和O22−B. CO和N2 C. NO2和CO2 D. SO2和ClO22.镨(Pr)是一种稀土元素,已知镨原子的核电荷数为59,相对原子质量为141,该原子的质子数是()A. 141B. 92C. 59D. 823.汤姆森和卢瑟福都对现代原子结构理论做出了巨大贡献。
下列关于原子构成的论述中,不属于他们两人共同观点的是()A. 原子是可分的B. 原子呈球形C. 带正电荷的原子核居于原子的中心D. 电子带负电4.某原子R的原子核带x个正电荷,则R2+离子的核外电子总数()A. x−2B. x+2C. xD. 无法确定5.下表列出了几种原子中的粒子数:原子质子数中子数核外电子数氢101碳666氧888钾192019分析表中信息,下列说法正确的是()A. 原子核内质子数等于中子数B. 原子核都由质子和中子构成C. 原子只有质子和电子构成D. 原子中质子数等于核外电子数6.1934年,卢瑟福等科学家通过核反应发现氢的同位素原子−氚.氚可用“ 13H”表示(其中“1”表示核电荷数),氚原子的模型如图所示,图中“”表示的粒子是()A. 原子核B. 质子C. 中子D. 核外电子7.下列关于原子的叙述不正确的是()A. 原子可以构成物质的分子,有的原子能直接构成物质B. 相对于原子来说,原子核的体积很小,但原子的质量却主要集中在原子核上C. 在化学变化中分子发生变化,原子不发生变化D. 原子核都是由质子和中子构成的8.下列各种微粒,不带电的是()A. 原子B. 电子C. 质子D. 原子核9.已知两种不同的原子,一种原子核内有10个质子、10个中子,另一种原子核内有10个质子,9个中子,则它们不相等的是()A. 核外电子数B. 原子的核电荷数C. 原子的质量D. 原子核的带电量10.下列关于原子核的说法中,错误的是()A. 原子核位于原子的中心,带正电荷B. 原子核位于原子的中心,带负电荷C. 原子核在原子中所占的体积非常小D. 原子的质量主要集中在原子核上11.关于相对原子质量,下列说法正确的是()A. 相对原子质量约等于质子数加电子数B. 相对原子质量就是原子质量C. 两种元素原子质量之比等于它们的相对原子质量之比D. 通常情况下,相对原子质量是以“千克”为单位12.碳的相对原子质量是()A. 12gB. 12C. 1.66×10−27kgD. 1/12g13.下列说法正确的是()A. 由分子构成的物质在发生化学变化时,分子种类改变,原子种类不变B. 离子是带电的原子或原子团,所以带电的微粒一定是离子C. 构成固体物质的微粒都是静止不动的D. 与元素化学性质关系最密切的是原子的核外电子数14.原子、分子、离子都是构成物质的微粒,下列物质由阴、阳离子构成的是()A. 二氧化碳B. 金刚石C. 氯化钠D. 黄金15.下列物质由离子构成的是()A. 二氧化碳B. 水C. 金刚石D. 氯化钠16.下列关于四种粒子的结构示意图说法正确的是()A. ①、②的化学性质相似B. ②所示的粒子符号为NaC. ③在化学反应中易失去电子D. ④中x可能为817.铁元素是人体必需的元素.已知铁原子的核电荷数为26,中子数为30,则铁原子的核外电子数为()A. 56B. 30C. 26D. 418.根据下列各组元素的原子结构示意图分析,化学性质相似的一组是()A. B.C. D.19.如图是某原子的核外电子排布图,以下说法正确的是()A. 该原子的化学性质和氯原子相似B. 该粒子的相对原子质量是35C. 该粒子容易失去电子D. X的数值为520.图是Na和Na+两种粒子结构示意图,小明观察示意图后,作出以下判断.①核电荷数相同②核外电子数相等③Na+比Na稳定 ④质量几乎相等⑤质子数相等其中正确的是()A. ①③④⑤B. ②④C. ①②⑤D. 全部21.下列关于分子和原子的说法,正确的是()A. 由分子构成的物质,分子是保持物质性质的最小粒子B. 最外层电子数为8的粒子一定是稀有气体的原子C. 最外层电子数决定原子的种类D. 同种原子可以构成不同种分子22.原子的构成示意图如图,下列叙述正确的是()A. 原子是实心球体B. 质子、中子、电子均匀分散在原子中C. 质子与电子质量相等D. 整个原子的质量主要集中在原子核上23.下列粒子结构示意图中,表示阳离子是A. B.C. D.24.下列对原子、分子、离子的认识,错误的是()A. 原子的核内质子数等于核外电子数B. 相同元素的原子其核外电子数一定比相应离子的核外电子数多C. 相同原子可以构成不同的分子D. 分子、原子、离子都是构成物质的粒子25.下列说法正确的是()A. 相对原子质量就是原子的实际质量B. 湿衣服在阳光下比阴凉处干得快,原因是水分子受热后运动速率加快C. 气体比液体容易被压缩,原因是物质的气态分子小而液态分子大D. 过氧化氢分子能分解成水分子和氧分子,说明分子是化学变化中的最小微粒二、填空题(本大题共5小题,共5.0分)26.图为某粒子结构示意图(其中y不等于零),按下列要求回答各问题:(1)当x=10+y时,该粒子为__________(填原子或阳离子、阴离子)。
电子课文•课题1•原子的构成•课后习题
1.选择题
(1)原子核
[ ] A•由电子和质子构成
B•由质子和中子构成
C.由电子和中子构成
D•由质子、中子和电子构成
(2)在原子里质子数等于
[ ]
A •中子数
B •电子数
C.中子数和电子数之和
D•中子数和电子数之差
(3)碳的相对原子质量是
[ ]
A • 12g
B .12
-27
C. 1.66 X 10 27kg
D .1/12g 2.以氧原子为例,说明构成原子的粒子有哪几种。
它们是怎样构成原子的?为什么整个原子不显电性?
3 •从附录n中查出氮、氯、钠、铁的相对原子质量(取4位有效数字)。
4.现有质量相同的钠、镁、铝三块金属,问哪一种金属含的原子最多,哪一种金属含的原子最少?为什么?
课题1 •原子的构成•部分习题参考答案及说明
1 .(1)B (2)B (3)B
3.N 14.01 ,Cl 35.45,Na 22.99,Fe 55.85
4.钠最多,铝最少。
因钠的相对原子质量最小,铝最大。