初中化学常见化合物相对分子质量
- 格式:doc
- 大小:38.50 KB
- 文档页数:3
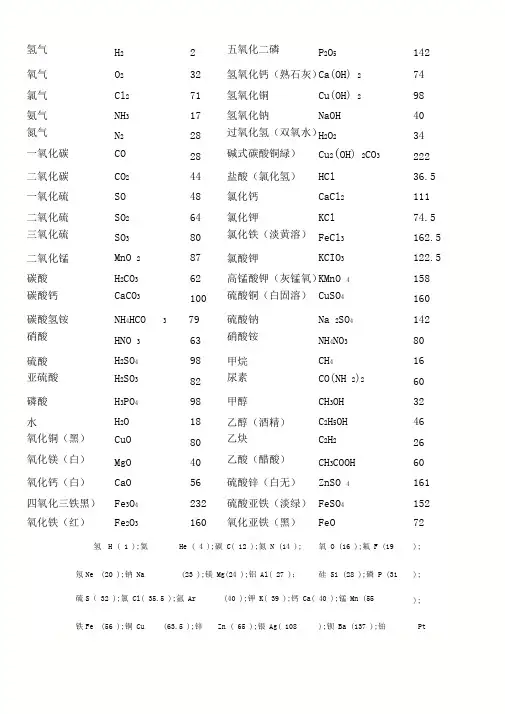
氢气H2 2 五氧化二磷P2O5 142氧气O2 32 氢氧化钙(熟石灰)C a(OH) 2 74 氯气Cl2 71 氢氧化铜Cu(OH) 2 98 氨气NH3 17 氢氧化钠NaOH 40氮气N2 28 过氧化氢(双氧水)H2O2 34一氧化碳CO 28 碱式碳酸铜緑)Cu2(OH) 2CO3 222 二氧化碳CO2 44 盐酸(氯化氢)HCl 36.5 一氧化硫SO 48 氯化钙CaCl2 111 二氧化硫SO2 64 氯化钾KCl 74.5三氧化硫SO3 80 氯化铁(淡黄溶)FeCl3 162.5二氧化锰MnO 2 87 氯酸钾KCIO3 122.5 碳酸H2CO3 62 高锰酸钾(灰锰氧)K MnO 4 158 碳酸钙CaCO3 100 硫酸铜(白固溶)CuSO4 160 碳酸氢铵NH4HCO 3 79 硫酸钠Na 2SO4 142硝酸HNO3 63 硝酸铵NH4NO3 80硫酸H2SO4 98 甲烷CH4 16 亚硫酸H2SO3 82 尿素CO(NH 2)2 60磷酸H3PO4 98 甲醇CH3OH 32 水H2O 18 乙醇(酒精)C2H5OH 46 氧化铜(黑)CuO 80 乙炔C2H2 26 氧化镁(白)MgO 40 乙酸(醋酸)CH3COOH 60 氧化钙(白)CaO 56 硫酸锌(白无)ZnSO 4 161 四氧化三铁黑)Fe3O4 232 硫酸亚铁(淡绿)FeSO4 152 氧化铁(红)Fe2O3 160 氧化亚铁(黑)FeO 72 氢H ( 1 );氦He ( 4 );碳 C( 12 );氮 N (14 ); 氧 O (16 );氟 F (19 );氖Ne (20 );钠 Na (23 );镁 Mg(24 );铝 Al( 27 );硅 Si (28 );磷 P (31 );硫S(32 );氯 Cl( 35.5 );氩 Ar (40 );钾 K( 39 );钙 Ca( 40 );锰 Mn (55 );铁Fe (56 );铜 Cu (63.5 );锌Zn ( 65 );银 Ag( 108 );钡 Ba (137 );铂Pt(195 );金 Au (197 );汞 Hg (201 );碘 I (127 )钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金•K、Ca、Na、Mg、AI,Zn、Fe、Sn、Pb、( H) ,Cu、Hg、Ag、Pt、Au.钾钙钠可以与水剧烈反应,镁与水反应不剧烈,铝可以与热水反应(要加热)初中化学反应常见基本的化学方程式:(1)单质与氧气的反应:(化合反应)点燃1.镁在空气中燃烧:2Mg+O 2= ==== 2MgO2.铁在氧气中燃烧:3Fe+2O 2 点燃==== Fe3O43.铜在空气中受热:2Cu+O 2= 加热==== 2CuO4.铝在空气中燃烧:4Al+3O 2:点燃==== 2AI2O3点燃5. 氢气中空气中燃烧:2出+02====2日2。
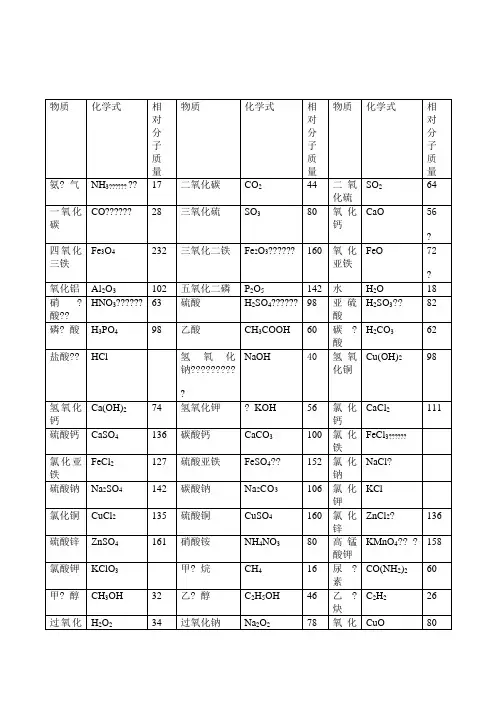
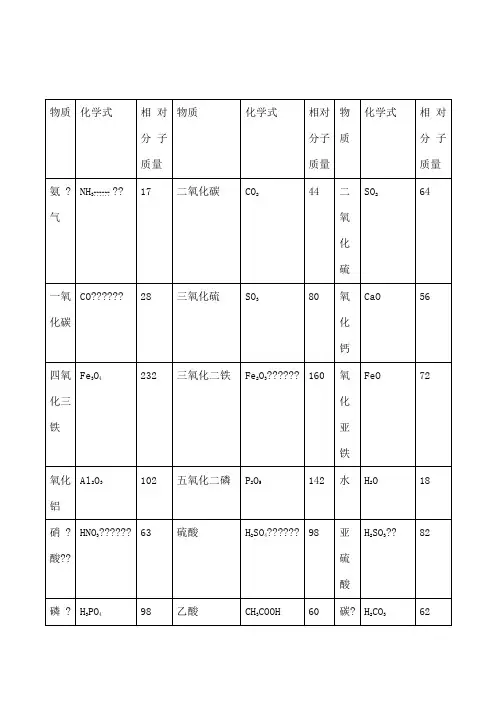

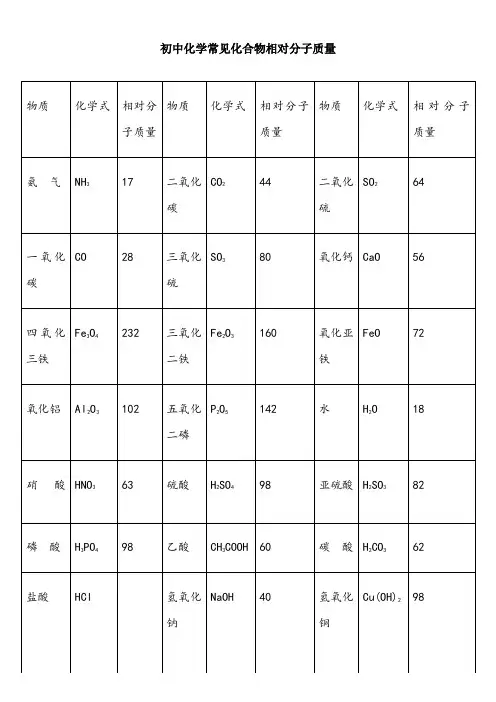

初中化学常见化合物相对分子质量初中化学常见化合物的相对分子质量如下:1.氨气:NH3,相对分子质量为17.2.一氧化碳:CO,相对分子质量为28.3.四氧化三铁:Fe3O4,相对分子质量为232.4.氧化铝:Al2O3,相对分子质量为102.5.硝酸:HNO3,相对分子质量为63.6.磷酸:H3PO4,相对分子质量为98.7.盐酸:HCl,相对分子质量为36.5.8.氢氧化钙:Ca(OH)2,相对分子质量为74.9.硫酸钙:CaSO4,相对分子质量为136.10.氯化亚铁:FeCl2,相对分子质量为127.11.硫酸钠:Na2SO4,相对分子质量为142.12.氯化铜:CuCl2,相对分子质量为135.13.硫酸锌:ZnSO4,相对分子质量为161.14.氯酸钾:KClO3,相对分子质量为122.5.15.甲醇:CH3OH,相对分子质量为32.16.氧化镁:MgO,相对分子质量为40.除此之外,还有:1.二氧化碳:CO2,相对分子质量为44.2.三氧化硫:SO3,相对分子质量为80.3.三氧化二铁:Fe2O3,相对分子质量为160.4.五氧化二磷:P2O5,相对分子质量为142.5.硫酸:H2SO4,相对分子质量为98.6.乙酸:CH3COOH,相对分子质量为60.7.氢氧化钠:NaOH,相对分子质量为40.8.氢氧化钾:KOH,相对分子质量为56.9.碳酸钙:CaCO3,相对分子质量为100.10.碳酸钠:Na2CO3,相对分子质量为106.11.硫酸铜:CuSO4,相对分子质量为160.12.硝酸铵:NH4NO3,相对分子质量为80.13.甲烷:CH4,相对分子质量为16.14.硫酸亚铁:FeSO4,相对分子质量为78.15.氢氧化铜:Cu(OH)2,相对分子质量为97.5.16.氯化钙:CaCl2,相对分子质量为111.17.氯化铁:FeCl3,相对分子质量为162.5.18.氯化钠:NaCl,相对分子质量为58.5.19.氯化钾:KCl,相对分子质量为74.5.20.氯化锌:ZnCl2,相对分子质量为136.21.尿素:CO(NH2)2,相对分子质量为60.22.乙炔:C2H2,相对分子质量为26.23.氧化铜:CuO,相对分子质量为80.24.过氧化氢:H2O2,相对分子质量为34.25.氧化镁:MgO,相对分子质量为40.26.高锰酸钾:KMnO4,相对分子质量为158.27.尿素:CO(NH2)2,相对分子质量为60.。

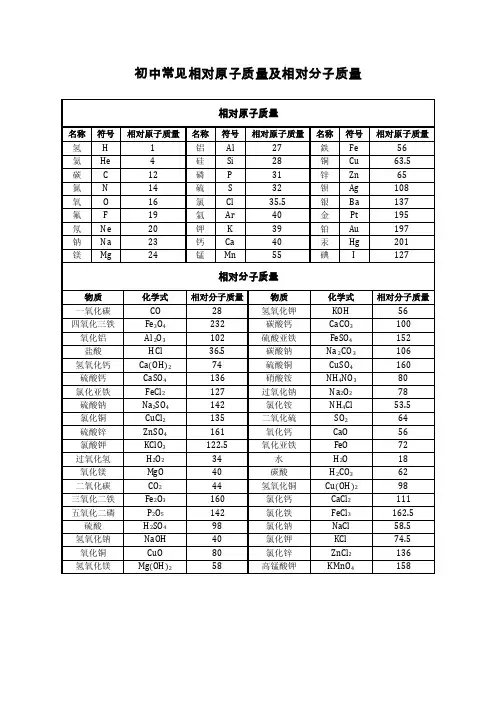


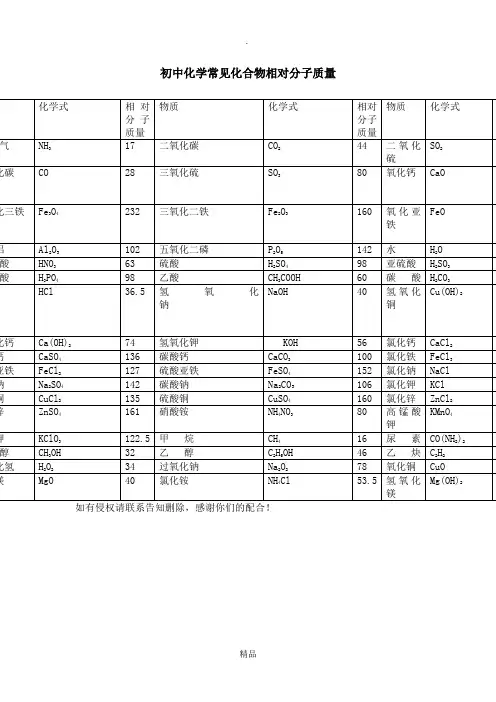
氢气H22五氧化二磷P2O5142氧气O232氢氧化钙(熟石灰)Ca(OH)274氯气Cl271氢氧化铜Cu(OH)298氨气NH317氢氧化钠NaOH4氮气N228过氧化氢(双氧水)H2O234一氧化碳CO28碱式碳酸铜(绿)Cu2(OH)2CO3222二氧化碳CO244盐酸(氯化氢)HCl36.5一氧化硫SO48氯化钙CaCl2111二氧化硫SO264氯化钾KCl74.5三氧化硫SO380氯化铁(淡黄溶)FeCl3162.5二氧化锰Mn8氯酸钾KClO31O2722.5碳酸H2CO362高锰酸钾(灰锰氧)KMnO4158碳酸钙CaCO31硫酸铜(白固蓝溶)CuSO4160碳酸氢铵NH4HCO379硫酸钠Na2SO4142硝酸HNO363硝酸铵NH4NO38硫酸H2SO498甲烷CH416亚硫酸H2SO382尿素CO(NH2)26磷酸H3PO498甲醇CH3OH32水H2O18乙醇(酒精)C2H5OH46氧化铜(黑)CuO8乙炔C2H226氧化镁Mg4乙酸(醋酸)CH3C6(白)OOOH氧化钙(白)Ca O56硫酸锌(白/无) ZnSO4161四氧化三铁(黑)Fe 3O 4232 硫酸亚铁(淡绿)FeSO4152氧化铁(红)Fe 2O 3160氧化亚铁(黑) FeO72氢 H (1);氦 He (4);碳C (12);氮N (14);氧O (16); 氟F (19);氖Ne (20);钠Na (23);镁Mg(24);铝Al (27);硅Si (28);磷P (31);硫S (32);氯Cl (35.5);氩Ar (40);钾K (39);钙Ca (40);锰Mn (55);铁Fe (56);铜Cu (63.5);锌Zn (65);银Ag (108);钡Ba (137);铂Pt (195);金Au (197);汞Hg (201);碘I (127).钾钙钠镁铝,锌铁锡铅(氢),铜汞银铂金.K 、Ca 、Na 、Mg 、Al,Zn 、Fe 、Sn 、Pb 、(H ),Cu 、Hg 、Ag 、Pt 、Au.钾钙钠可以与水剧烈反应,镁与水反应不剧烈,铝可以与热水反应(要加热). 初中化学反应常见基本的化学方程式: (1)单质与氧气的反应:(化合反应)1.镁在空气中燃烧:2Mg+O 2====点燃2MgO 2.铁在氧气中燃烧:3Fe+2O 2====点燃Fe 3O 4 3.铜在空气中受热:2Cu+O 2====加热2CuO 4.铝在空气中燃烧:4Al+3O 2====点燃2Al 2O 3 5.氢气中空气中燃烧:2H 2+O 2====点燃2H 2O6.红磷在空气中燃烧(研究空气组成的实验):4P+5O 2====点燃2P 2O 5 7.硫粉在空气中燃烧:S+O 2====点燃SO 2 8.碳在氧气中充分燃烧:C+O 2====点燃CO 2 9.碳在氧气中不充分燃烧:2C+O 2====点燃2CO (2)化合物与氧气的反应:10.一氧化碳在氧气中燃烧:2CO+O 2====点燃2CO 2 11.甲烷在空气中燃烧:CH 4+2O 2====点燃CO 2+2H 2O12.酒精在空气中燃烧:C 2H 5OH+3O 2====点燃2CO 2+3H 2O (3)氧气的来源:13.玻义耳研究空气的成分实验2HgO ====加热2Hg+O 2↑14.加热高锰酸钾:2KMnO 4====加热K 2MnO 4+MnO 2+O 2↑(实验室制氧气原理1)15.过氧化氢在二氧化锰作催化剂条件下分解反应:H 2O 2=====MnO22H 2O+O 2↑(实验室制氧气原理2)二、自然界中的水:16.水在直流电的作用下分解(研究水的组成实验):2H 2O ====通电2H 2↑+O 2↑ 17.生石灰溶于水:CaO+H 2O==Ca(OH)2 18.二氧化碳可溶于水:H 2O+CO 2==H 2CO 3 三、质量守恒定律:19.镁在空气中燃烧:2Mg+O 2====点燃2MgO20.铁和硫酸铜溶液反应:Fe+CuSO 4===F e SO 4+Cu 21.氢气还原氧化铜:H 2+CuO ====加热Cu+H 2O 22.镁还原氧化铜:Mg+CuO ====加热Cu+MgO 四、碳和碳的氧化物: (1)碳的化学性质23.碳在氧气中充分燃烧:C+O 2====点燃CO 224.木炭还原氧化铜:C+2CuO ====高温2Cu+CO 2↑ 25.焦炭还原氧化铁:3C+2Fe 2O 3====高温4Fe+3CO 2↑ (2)煤炉中发生的三个反应:(几个化合反应) 26.煤炉的底层:C+O 2====点燃CO 2 27.煤炉的中层:CO 2+C ====高温2CO28.煤炉的上部蓝色火焰的产生:2CO+O 2====点燃2CO 2 (3)二氧化碳的制法与性质:29.大理石与稀盐酸反应(实验室制二氧化碳): CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑ 30.碳酸不稳定而分解:H 2CO 3==H 2O+CO 2↑ 31.二氧化碳可溶于水:H 2O+CO 2==H 2CO 332.高温煅烧石灰石(工业制二氧化碳):CaCO 3====高温CaO+CO 2↑ 33.石灰水与二氧化碳反应(鉴别二氧化碳): Ca(OH)2+CO 2===CaCO 3↓+H 2O (4)一氧化碳的性质:34.一氧化碳还原氧化铜:CO+CuO ====加热Cu+CO 2 35.一氧化碳的可燃性:2CO+O 2====点燃2CO 2 其它反应:36.碳酸钠与稀盐酸反应(灭火器的原理):Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ 五、燃料及其利用:37.甲烷在空气中燃烧:CH 4+2O 2====点燃CO 2+2H 2O38.酒精在空气中燃烧:C 2H 5OH+3O 2====点燃2CO 2+3H 2O 39.氢气中空气中燃烧:2H 2+O 2====点燃2H 2O 六、金属(1)金属与氧气反应:40.镁在空气中燃烧:2Mg+O 2====点燃2MgO 41.铁在氧气中燃烧:3Fe+2O 2====点燃Fe 3O 442.铜在空气中受热:2Cu+O 2====加热2CuO 43.铝在空气中形成氧化膜:4Al+3O2=2Al 2O 3 (2)金属单质+酸--------盐+氢气(置换反应) 44.锌和稀硫酸Zn+H 2SO 4=ZnSO 4+H 2↑ 45.铁和稀硫酸Fe+H 2SO 4=FeSO 4+H 2↑ 46.镁和稀硫酸Mg+H2SO 4=MgSO 4+H 2↑ 47.铝和稀硫酸2Al+3H 2SO 4=Al 2(SO 4)3+3H 2↑ 48.锌和稀盐酸Zn+2HCl==ZnCl 2+H 2↑ 49.铁和稀盐酸Fe+2HCl==FeCl 2+H 2↑ 50.镁和稀盐酸Mg+2HCl==MgCl 2+H 2↑ 51.铝和稀盐酸2Al+6HCl==2AlCl 3+3H 2↑ (3)金属单质+盐(溶液)-------新金属+新盐52.铁和硫酸铜溶液反应:Fe+CuSO 4==FeSO 4+Cu 53.锌和硫酸铜溶液反应:Zn+CuSO 4==ZnSO 4+Cu54.铜和硝酸汞溶液反应:Cu+Hg(NO 3)2==Cu(NO 3)2+Hg (3)金属铁的治炼原理:55.3CO+2Fe 2O 3====高温4Fe+3CO 2↑ 七、酸、碱、盐 1、酸的化学性质(1)酸+金属--------盐+氢气(见上) (2)酸+金属氧化物--------盐+水56.氧化铁和稀盐酸反应:Fe 2O 3+6HCl==2FeCl 3+3H 2O 57.氧化铁和稀硫酸反应:Fe 2O 3+3H 2SO 4==Fe 2(SO 4)3+3H 2O 58.氧化铜和稀盐酸反应:CuO+2HCl==CuCl 2+H 2O 59.氧化铜和稀硫酸反应:CuO+H 2SO 4==CuSO 4+H 2O (3)酸+碱--------盐+水(中和反应)60.盐酸和烧碱起反应:HCl+NaOH==NaCl+H 2O61.盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl 2+2H 2O 62.氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl 3+3H 2O 63.硫酸和烧碱反应:H 2SO 4+2NaOH==Na 2SO 4+2H 2O (4)酸+盐--------另一种酸+另一种盐64.大理石与稀盐酸反应:CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑ 65.碳酸钠与稀盐酸反应:Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑66.碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑67.硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl2、碱的化学性质(1)碱+非金属氧化物--------盐+水68.苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O 69.苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O 70.苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O 71.消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3↓+H2O72.消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O(2)碱+酸--------盐+水(中和反应,方程式见上)(3)碱+盐--------另一种碱+另一种盐73.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH3、盐的化学性质(1)盐(溶液)+金属单质-------另一种金属+另一种盐74.铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu(2)盐+酸--------另一种酸+另一种盐75.碳酸钠与稀盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑碳酸氢钠与稀盐酸反应:NaHCO3+HCl==NaCl+H2O+CO2↑(3)盐+碱--------另一种碱+另一种盐76.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH(4)盐+盐-----两种新盐77.氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO3 78.硫酸钠和氯化钡:Na+SO4+BaCl2==BaSO4↓+2NaCl【力学部分】1、速度:V=S/t2、重力:G=mg3、密度:ρ=m/V4、压强:p=F/S5、液体压强:p=ρgh6、浮力:(1)、F浮=F’-F (压力差) (3)、F浮=G (漂浮、悬浮)(4)、阿基米德原理:F浮=G排=ρ液gV排7、杠杆平衡条件:F1 L1=F2 L2 8、理想斜面:F/G=h/L9、理想滑轮:F=G/n 10、实际滑轮:F=(G +G动)/ n (竖直方向)11、功:W=FS=Gh (把物体举高) 12、功率:P=W/t =FV13、功的原理:W手=W机14、实际机械:W总=W有+W额外15、机械效率:η=W有/W总16、滑轮组效率:(1)、η=G/ nF(竖直方向)(2)、η=G/(G+G动) (竖直方向不计摩擦)(3)、η=f / nF (水平方向)【热学部分】1、吸热:Q吸=Cm(t-t0)=CmΔt2、放热:Q放=Cm(t0-t)=CmΔt3、热值:q=Q/m4、炉子和热机的效率:η=Q有效利用/Q燃料5、热平衡方程:Q放=Q吸6、热力学温度:T =t+273K【电学部分】1、电流强度:I=Q电量/t2、电阻:R=ρL/S3、欧姆定律:I=U/R4、焦耳定律:(1)、Q=I2Rt普适公式)(2)、Q=UIt=Pt=UQ电量=U2t/R (纯电阻公式)5、串联电路:(1)、I=I1=I2 (2)、U=U1+U2 (3)、R=R1+R2 (1)、W=UIt=Pt=UQ (普适公式)(2)、W=I2Rt=U2t/R (纯电阻公式)9电功率:(1)、P=W/t=UI (普适公式) (2)、P=I2R=U2/R (纯电阻公式)【常用物理量】1、光速:C=3×108m/s (真空中)2、声速:V=340m/s (15℃)3、人耳区分回声:≥0.1s4、重力加速度:g=9.8N/kg≈10N/kg5、标准大气压值:760毫米水银柱高=1.01×105Pa6、水的密度:ρ=1.0×103kg/m37、水的凝固点:0℃8、水的沸点:100℃9、水的比热容:C=4.2×103J/(kg•℃)10、元电荷:e=1.6×10-19C 11、一节干电池电压:1.5V 12、一节铅蓄电池电压:2V。
初中常见分子量总结(根据颜色和可溶性,可以组合分离和除杂题自测)氢气(无无)H2 2 硝酸HNO363氧气(无无)O232 硝酸根离子团NO3—62氨气(刺透)NH317 硝酸铵(白/无)NH4NO380硝酸银Ag NO3170水H2O 18 盐酸(氯化氢)HCl 36。
5 二氧化碳(无无)CO244 两个氯化氢分子 2 HCl73氧化钙(生石灰)白CaO 56 氯离子Cl1—35。
5 一氧化碳(无无)CO 28 氯化钠(食盐)白NaCl 58.5 氧化镁(白)MgO 40 氯化铁(淡黄溶)FeCl3162。
5 氧化铁(红)Fe2O3160 氯化钙(白/无)CaCl2111氧化铜(黑)CuO 80 氯化钡(白/无)BaCl2208四氧化三铁(黑) Fe3O4232 氯化银AgCl 143.5 氧化亚铁(黑)FeO 72二氧化锰(黑)MnO287二氧化硫(刺透)SO264硫酸H2SO498硫酸根离子团SO42—96碳酸H2CO362 硫酸铜(白固蓝溶)CuSO4160碳酸根CO32—60 硫酸钠(白/无)Na2SO4142碳酸钙(白沉酸溶)CaCO3100 硫酸钡(白不溶沉)BaSO4233碳酸钠(白/无)Na2CO3106 硫酸镁(白/无)MgSO4120碳酸钡(白沉酸溶) BaCO3197 硫酸亚铁(淡绿)FeSO4152碳酸氢铵(白/无)NH4HCO379 硫酸锌(白/无)ZnSO4161碱式碳酸铜(绿)Cu2(OH)2CO3222 五水硫酸铜(蓝固蓝溶)Cu SO45H2O 250•氯酸钾KClO3122.5 氢氧化钠NaOH 40 高锰酸钾(灰锰氧)KMnO4158氢氧化钙(熟石灰微溶)Ca(OH)274 甲烷CH416氢氧根17 尿素CO(NH2)260氢氧化镁(白/无)Mg(OH)258 乙醇(酒精)C2H5OH 46氢氧化铜(蓝沉酸溶)Cu(OH)298 乙酸(醋酸)CH3COOH 60氨水NH3H2O35 蔗糖C6H12O6180•初中化学常用计算公式(1)相对原子质量=== 某元素一个原子的质量 / 一个碳原子质量的1/12(2)设某化合物化学式为A m B n①它的相对分子质量==A的相对原子质量×m+B的相对原子质量×n②A元素与B元素的质量比==A的相对原子质量×m:B的相对原子质量×n③A元素的质量分数ω===A的相对原子质量×m /A m B n的相对分子质量(3)混合物中含某物质的质量分数(纯度)===纯物质的质量/混合物的总质量 ×100%(4)标准状况下气体密度(g/L)===气体质量(g)/气体体积(L)(5)纯度===纯物质的质量/混合物的总质量 × 100%===纯物质的质量/(纯物质的质量+杂质的质量)×100%===1- 杂质的质量分数(6)溶质的质量分数===溶质质量/溶液质量 × 100%===溶质质量/(溶质质量+溶剂质量) × 100%(7)溶液的稀释与浓缩M浓 × a%浓===M稀 × b%稀=== (M浓+增加的溶剂质量) × b%稀(8)相对溶质不同质量分数的两种溶液混合M浓 × a%浓+M稀 × b%稀=== (M浓+M稀) × c%(9)溶液中溶质的质量==溶液的质量×溶液中溶质的质量分数==溶液的体积×溶液的密度钾、钠、铵、硝个个溶,钾、钠、钡、钙四碱溶,红铁蓝铜白镁锌,“白铝治酸"沉水中。
初中常见元素符号、化学式一、常见元素符号元素符号相对原子质量符号符号相对原子质量元素符号相对原子质量氢H 1 铝Al 27 铁Fe 56氦He 4 硅Si 28 铜Cu 63.5碳 C 12 磷P 31 锌Zn 65氮N 14 硫S 32 银Ag 108氧O 16 氯Cl 35.5 钡Ba 137氟 F 19 氩Ar 40 铂Pt 195氖Ne 20 钾K 39 金Au 197钠Na 23 钙Ca 40 汞Hg 201镁Mg 24 锰Mn 55 碘I 127二、常见的化学式1、常见单质氢气H2氮气N2氯气Cl2氧气O2臭氧O3氦气He 氖气Ne氩气Ar碳C硅Si硫S磷P碘I2钾K钙Ca钠Na镁Mg铝Al锌Zn 铁Fe铜Cu汞Hg银Ag2、化合物(1)氧化物水H2O三氧化硫SO3一氧化碳CO二氧化碳CO2五氧化二磷P2O5过氧化氢H2O2二氧化氮NO2二氧化硫SO2氧化钙CaO氧化亚铁FeO氧化铁Fe2O3四氧化三铁Fe3O4氧化镁MgO氧化锌ZnO二氧化锰MnO2氧化汞HgO氧化铝Al2O3氧化铜CuO (2)其他化合物硝酸HNO3硫酸H2SO4盐酸HCl碳酸H2CO3硫化氢H2S氢氧化钠NaOH氢氧化钾KOH氢氧化钙Ca(OH)2氢氧化镁Mg(OH)2氢氧化铝Al(OH)3氢氧化锌Zn(OH)2氢氧化铁Fe(OH)3氢氧化亚铁Fe(OH)2氢氧化铜Cu(OH)2氢氧化钡Ba(OH)2氨水NH3·H2O氯化钠NaCl氯化铜CuCl2氯化铝AlCl3氯化钾KCl氯化亚铁FeCl2氯化铁FeCl3氯化银AgCl氯化钙CaCl2氯化镁MgCl2氯化钡BaCl2氯化锌ZnCl2硫酸铜CuSO4高锰酸钾KMnO4锰酸钾K2MnO4氯酸钾KClO3碳酸钙CaCO3硝酸钾KNO3 硝酸钠NaNO3硝酸铁Fe(NO3)3硝酸亚铁Fe(NO3)2硝酸铝Al(NO3)3碳酸钠Na2CO3碳酸钙CaCO3碳酸铵(NH4)2CO3碳酸氢钠NaHCO3硫酸铁Fe2(SO4)3硫酸亚铁FeSO4硝酸银AgNO3硝酸钡Ba(NO3)2硝酸铵NH4NO3硫酸钡BaSO43、常见有机化合物甲烷CH4乙醇C2H5OH 葡萄糖C6H12O6氢氧根OH负一价正一价负一价 铵根NH4正一价负二价碳酸根CO3负二价负二价 硫酸根SO4负二价负一价硝酸根NO3负一价。