(广东专版)2019高考化学二轮复习 第一部分 专题二 化学常用计量及其应用 考点二 物质的量浓度及
- 格式:ppt
- 大小:329.00 KB
- 文档页数:15


专题二化学常用计量及其应用专题强化练1.(2018·全国卷Ⅲ)下列叙述正确的是( )A.24 g镁与27 g铝中,含有相同的质子数B.同等质量的氧气和臭氧中,电子数相同C.1 mol重水与1 mol水中,中子数比为2∶1D.1 mol乙烷和1 mol乙烯中,化学键数相同解析:1个Mg原子中有12个质子,1个Al原子中有13个质子。
24 g镁和27 g铝各自的物质的量都是1 mol,所以24 g镁含有的质子数为12 mol,27 g铝含有的质子的物质的量为13 mol,选项A错误。
设氧气和臭氧的质量都是x g,则氧气(O2)的物质的量为x32mol,臭氧(O3)的物质的量为x48mol,所以两者含有的氧原子分别为x32×2=x16mol和x48×3=x16mol,即此时氧气和臭氧中含有的氧原子是一样多的,而每个氧原子都含有8个电子,所以同等质量的氧气和臭氧中一定含有相同的电子数,选项B正确。
重水为21H162 8O,其中21H含有1个中子,16 8O含有8个中子,所以1个重水分子含有10个中子。
水为11H162 8O,其中11H没有中子,16 8O含有8个中子,所以1个水分子含有8个中子,1 mol水含有8 mol中子。
两者的中子数之比为10∶8=5∶4,选项C错误。
乙烷(C2H6)分子中有6个C—H键和1个C—C 键,所以1 mol乙烷有7 mol共价键。
乙烯(C2H4)分子中有4个C—H键和1个C===C,所以1 mol乙烯有6 mol共价键,选项D错误。
答案:B2.设N A表示阿伏加德罗常数的值。
下列说法正确的是( )A.1 mol Cl2与足量的Fe充分反应,转移电子的数目为3N AB.常温下,1 L pH=1的H2SO4溶液中,由水电离出的H+数目为0.1N AC.常温下,21 g乙烯和丁烯的混合气体中含有的碳原子数目为1.5N AD.1 mol 14 6C原子中所含中子数目为6N A解析:氯气与铁反应后变为-1价,则1 mol氯气与铁反应会转移2 mol电子,即2N A 个,A错误;在硫酸溶液中,水的电离被抑制,氢离子几乎全部来自于酸的电离,OH-全部来自于水的电离,故水电离出的n(H+)=n(OH-)=10-13mol·L-1×1 L=10-13mol,故水电离出的氢离子的个数为10-13N A,B错误;乙烯和丁烯的最简式均为CH2,故21 g混合物中含有的CH2的物质的量n=21 g14 g·mol-1=1.5 mol,故含有的碳原子的物质的量为1.5 mol,即1.5N A个,C正确;1 mol 14 6C原子中所含中子数目为8N A,D错误。



2019年高考化学二轮专题:化学中的常用计量一、单选题1. 下列说法正确的是:()A. 1摩尔任何物质在标准状况下都是22.4升B. 同温同压下,相同体积气体所含原子个数相同C. 标准状况下1摩尔的水的体积约为22.4升D. 同温同压下,相同体积的H2、O2,其质量比为1:16【答案】 D【解析】 A、标准状况下1摩尔任何物质的体积都约为22.4升,该物质必须为气体,选项A不符合题意;B.气体分子中含有原子数不一定相等,则同温同压下,相同体积气体所含原子个数不一定相同,选项B不符合题意;C.标准状况下,水不是气体,不能使用标准状况下的气体摩尔体积计算,选项C不符合题意;C.同温同压下,相同体积的H2、O2具有相同的物质的量,则其质量比=摩尔质量成正比=2g/mol:32g/mol=1:16,选项D符合题意;故答案为:D。
2. 标准状况下,①6.72L NH3②1.204×1023个CO2 ③6.4g CH4④0.5mol HCl,下列关系错误的是()A. 体积大小:④>③>①>②B. 原子数目:③>①>④>②C. 密度大小:②>④>①>③D. 质量大小:④>③>②>①【答案】D【解析】①氨气的物质的量为6.72L/22.4L·mol-1=0.3mol,②CO2的物质的量为1.204×1023/6.02×1023=0.2mol,③甲烷的物质的量为6.4g/16g·mol-1=0.4mol,④HCl的物质的量为0.5mol,A、标准状况下,Vm相同,物质的量越大,体积越大,则体积大小为④>③>①>②,故A不符合题意;B、①中原子的物质的量为0.3mol×4=1.2mol,②中原子的物质的量为0.2mol×3=0.6mol,③中原子的物质的量为0.4mol×5=2mol,④中原子的物质的量为0.5mol×2=1mol,则原子数目③>①>④>②,故B不符合题意;C、由ρ=M/Vm可知,标准状况下,Vm相同,摩尔质量越大,则密度越大,密度大小为②>④>①>③,故C不符合题意;D、①中质量为0.3mol×17g·mol-1=5.1g,②中质量为0.2mol×44g·mol-1=8.8g,③中质量为6.4g,④中质量为0.5mol×36.5g·mol-1=18.25g,则质量大小为④>②>③>①,故D符合题意;故答案为:D。

2019-2020年高考化学二轮复习全套教学案详细解析化学常用计量新课标教学目标知识技能:掌握物质的量及其单位——摩尔、摩尔质量、气体摩尔体积的涵义。
掌握物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状态下)之间的相互关系。
能力培养:通过基本计算问题的讨论,培养学生的计算思维能力。
科学思想:在阿伏加德罗定律的应用上,着重掌握有关比例的数学思想。
科学方法:演绎推理法。
重点、难点物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系是重点,气体摩尔体积的应用条件是难点。
教学过程设计教师活动【引入】今天我们复习化学常用计量。
【提问】科学家引入物质的量这个物理量的意义是什么?【再问】谁来说说物质的量是怎样联系宏观和微观的?学生活动回答:把质量、体积等宏观物理量和微观的微粒个数联系起来。
回答:主要通过以物质的量为核心物理量建立的下列关系图,把微粒数、物质质量、气体标准状况下的体积、溶液的物质的量浓度等相互关联起来。
归纳:小结:物质的量及其单位摩尔的作用实际是联系宏观和微观的桥梁。
提问】下列叙述是否正确?(1)摩尔是物质的量的单位,1mol任何物质都含有6.02 X 102个分子。
(2)1mol氢的质量为1g,它含有阿伏加德罗常数个氢分子。
(3)氧气的摩尔质量为32g,氧气的分子量也为32g。
( 4) 12g 碳-12 所含的碳原子数是阿伏加德罗常数,每摩物质含有阿伏加德罗常数个微粒。
思考,回答:( 1 )不正确,并非所有物质均含有分子。
( 2)不正确,不能说1mol 氢,应指明微粒名称。
(3)不正确,摩尔质量的单位为gmol-1,分子量没有单位。
( 4)正确【提问】在应用摩尔这个单位时,应注意什么?回答:( 1 )摩尔只能用来表示微粒的集体数目;( 2)必须指明微粒的具体名称。
【讲解】微粒可以是真实的,如:1mol 水分子;也可以是假想的,如:ImolNaCI,表示1molNa+和ImolCI-的特定组合。

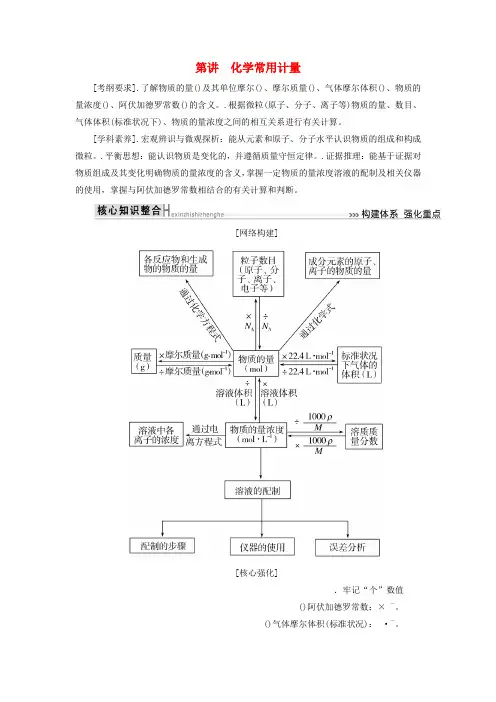
第讲化学常用计量[考纲要求].了解物质的量()及其单位摩尔()、摩尔质量()、气体摩尔体积()、物质的量浓度()、阿伏加德罗常数()的含义。
.根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)、物质的量浓度之间的相互关系进行有关计算。
[学科素养].宏观辨识与微观探析:能从元素和原子、分子水平认识物质的组成和构成微粒。
.平衡思想:能认识物质是变化的,并遵循质量守恒定律。
.证据推理:能基于证据对物质组成及其变化明确物质的量浓度的含义,掌握一定物质的量浓度溶液的配制及相关仪器的使用,掌握与阿伏加德罗常数相结合的有关计算和判断。
[网络构建][核心强化].牢记“个”数值()阿伏加德罗常数:× -。
()气体摩尔体积(标准状况):·-。
.理解“大”规律()质量守恒定律。
①化学反应前后,反应物和生成物的质量相等。
②稀释前后,溶质的物质的量不变。
()阿伏加德罗定律。
同温同压下,相同体积的任何气体都含有相同数目的分子。
()电荷守恒规律。
溶液中阳离子所带的正电荷总数等于阴离子所带的负电荷总数。
.牢记“个”基本公式()=()=()=()()=()ω=×()=(或ω=).明确溶液配制过程中的“个数据”()记录质量或体积的数据小数点后保留一位数字。
()选择合适规格的容量瓶,作答时要标明容量瓶规格。
()转移溶液时要洗涤烧杯~次。
()定容时液面距刻度线~处,改用胶头滴管滴加。
考点一阿伏加德罗常数的应用[解析]氯化铁的摩尔质量为·-的物质的量为,铁离子水解生成的氢氧化铁胶体粒子是大量氢氧化铁微粒的聚集体,故氢氧化铁胶体粒子数小于,错误;标准状况下,氩气(氩气分子为单原子分子)的物质的量为,是号元素,氩气分子含有质子,即质子数为,正确;甘油的摩尔质量为·-甘油的物质的量为,甘油(丙三醇)的结构简式为——个丙三醇分子中含有个羟基,故甘油中含有羟基数为,错误;甲烷与氯气在光照下反应生成的有机产物有一氯甲烷()、二氯甲烷、三氯甲烷和四氯化碳,故与氯气在光照下反应生成的分子数小于,错误。

专题二化学计量在实验中的应用考纲展示考情汇总备考指导1.理解物质的量的单位——摩尔(mol ),摩尔质量、气体摩尔体积的含义。
2.理解物质的量浓度、阿伏加德罗常数的含义。
3.了解相对原子质量、相对分子质量的定义,并能进行有关计算。
2020年1月:112019年6月:26,362019年1月:9,24,26,462018年6月:14,29,36,37,402018年1月:24,26本专题侧重于计算,应从微观粒子的组成数量及反应方程式进行相关计算;有关物质的量浓度溶液配制,熟悉流程及正确操作,从错误操作对n或V的影响角度分析误差。
物质的量的单位——摩尔1.质量守恒定律在化学反应中,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和,这就是质量守恒定律。
化学反应的过程就是参加反应的各物质的原子重新组合而生成其他物质的过程,反应前后原子的种类没有改变,数目没有增减。
2.物质的量的概念用0.012 kg 12C中所含的碳原子数目作为标准来衡量其他粒子集合体所含粒子数多少的物理量,符号为n。
单位:摩尔,简称摩,符号:mol。
3.阿伏加德罗常数概念:1 mol任何粒子的粒子数或0.012 kg 12C所含的碳原子数,符号为N A,近似值为6.02×1023。
4.摩尔质量的概念单位物质的量的物质所具有的质量;单位为g/mol(或g·mol-1),符号为M。
5.气体摩尔体积(1)概念:在一定的温度和压强下,单位物质的量的气体所占的体积。
(2)符号:V m,单位:L/mol(或L·mol-1)。
标准状况下V m=22.4_L/mol。
[学考真题对练]1.(2020·1月广东学考)阿伏加德罗常数的命名是为了纪念意大利科学家阿伏加德罗,用N A代表阿伏加德罗常数的值,下列说法正确的是() A.28 g N2含有的分子数为2N AB.1 mol Na含有的电子数为N AC.标准状况下,22.4 L O2含有的氧原子为2N AD.1 L 2 mol·L-1 KCl溶液中含有的离子数为2N AC2.(2019·1月广东学考)关于标准状况下11.2 L CO2的说法正确的是() A.质量为44 gB.CO2物质的量为1 molC.含有1 mol氧原子D.CO2分子数为3.01×1021C3.(2019·1月广东学考)某医用氧气瓶中储有0.5 mol氧气,该氧气在标准状况下的体积为()A.0.5 L B.11.2 LC.22.4 L D.44.8 LB4.(2017·广东学业水平考试)酸奶中含有乳酸(C3H6O3),2 mol 乳酸分子中含有()A.3 mol氧原子B.12 mol氢原子C.6.02×1023个O3D.6.02×1023个乳酸分子B[2 mol乳酸分子中含6 mol氧原子,12 mol氢原子,1.2×1024个乳酸分子,但无O3。
