化学反应速率和化学平衡图像
- 格式:docx
- 大小:615.18 KB
- 文档页数:10








化学反应速率和化学平衡的图像
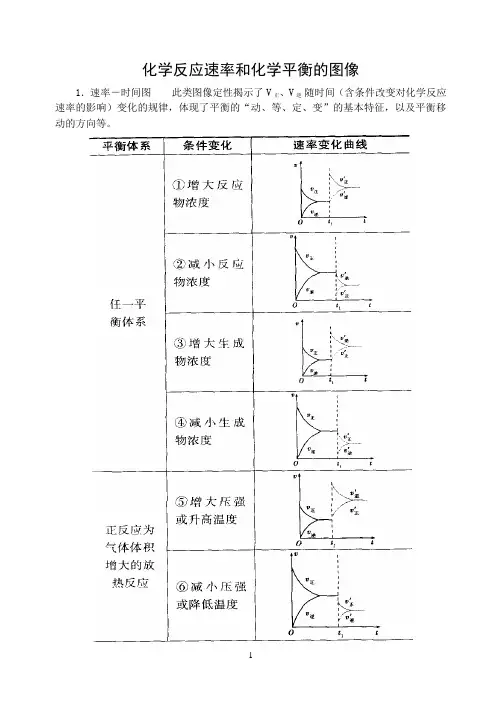
1.速率-时间图此类图像定性揭示了V正、V逆随时间(含条件改变对化学反应速率的影响)变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
2.含量―时间―温度(压强)图常见的形式有下图所示的几种(C%指某产物百分含量,B%指某反应物百分含量),这些图像的折点表示达到平衡的时间,曲线的斜率反映了反应速率的大小,可以确定T(p)的高低(大小),水平线高低反映平衡移动的方向。
3.恒压(温)线该类图像的纵坐标为物质的平衡浓度(c)或反应物的转化率( ),横坐标为温度(T)或压强(p),常见类型如下图:
小结
1.图像分析应注意“三看”
(1)看两轴:认清两坐标轴所表示的含义。
(2)看起点:从图像纵轴上的起点,一般可判断谁为反应物,谁为生成物以及平衡前反应进行的方向。
(3)看拐点:一般图像在拐点后平行于横轴则表示反应达平衡,如横轴为时间,由拐点可判断反应速率。
2.图像分析中,对于温度、浓度、压强三个因素,一般采用“定一议二”的方式进行分析。

化学反应速率和化学平衡图像图像分析要领2SO2(g)+O2(g)2SO3(g) t随后逐渐增加,说明改变的条件是增加反应物的浓度。
CH4(g)+H2O(g)CO(g)+3H2(g)ΔH>0tmA(g)+nB(g)qC(g)+pD(g) “定一议二”。
m+n>q+p时2NO(g) + 2CO(g)N2(g)+2CO2(g) 先拐先平,先平者高。
T投料比图2SO2(g)+O2(g)2SO3(g) △H<01.b应对应物质的化学计量数之n2.T3.平衡向右移动,分数先增大后减小定位题组1.对于可逆反应:2SO 2(g)+O 2(g)2SO 3(g)△H<0,下列研究目的和示意图相符的是2.工业上可利用CH 4(g)+H 2O(g)CO(g)+3H 2(g)反应生产合成氨原料气H 2。
已知温度、压强和水碳比[)()(42CH n O H n ]对甲烷蒸汽转化反应的影响如下图:图1(水碳比为3) 图2(水碳比为3) 图3(800℃)(1)降低反应的水碳比平衡常数K__________(选填“增大”、“减小”或“不变”);升高温度,平衡向____________方向移动(选正反应或逆反应)。
(2)图2中,两条曲线所示温度的关系是:t 1_____t 2(选填>、=或<);图1中,在800℃、2MPa 比1MPa 时的甲烷含量_______(选填高、低或不变),3.甲醇被称为21世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH 4和H 2O 为原料来制备甲醇。
(1)将1.0 mol CH 4和2.0 mol H 2O(g)通入反应室(容积为100 L),在一定条件下发生反应:CH 4(g)+H 2O(g) CO(g)+3H 2(g)……Ⅰ,CH 4的转化率与温度、压强的关系如图。
①已知100 ℃时达到平衡所需的时间为5 min 。
则用H 2表示的平均反应速率为________。
②图中的p 1________p 2(选填“<”、“>”或“=”),100 ℃时平衡常数为________。
③在其他条件不变的情况下降低温度,逆反应速率将________(填“增大”、“减小”或“不变”)。
(2)在压强为0.1 MPa 条件下,将a mol CO 与3a mol H 2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H 2(g) CH 3OH(g)……Ⅱ。
①该反应的ΔH ________0,ΔS________0(填“<”、“>”或“=”)。
②若容器容积不变,下列措施可增加甲醇产率的是______。
A.升高温度 B.将CH 3OH(g)从体系中分离 C.充入He ,使体系总压强增大 D.再充入1 mol CO 和3 mol H 2③为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
A.请在上表空格中填入剩余的实验条件、数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1 MPa和5 MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明每条曲线的压强。
4.(2015·北京·26部分)反应:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550kJ/mol。
它由两步反应组成:i.H2SO4(l)=SO3(g) +H2O(g) △H=+177kJ/mol ii.SO3(g)分解。
L(L1、L2),X可分别代表压强或温度。
下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。
(1)X代表的物理量是。
(2)判断L1、L2的大小关系,并简述理由:。
5.已知2A2(g)+B2(g) 2C3(g);△H=-Q1 kJ/mol(Q1>0),在一个有催化剂的固定容积的容器中加入2 molA2和1 molB2,在500℃时充分反应,达平衡后C3的浓度为w mol/L,放出热量Q2 kJ。
(1)若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量Q3 kJ,C3浓度(填>、=、<)w mol/L,Q1、Q2、Q3之间满足何种关系(用代数式表示).。
(2)改变某一条件,得到如图的变化规律(图中T表示温度,n表示物质的量),可得出的结论正确的是;A.反应速率c>b>aB.达到平衡时A2的转化率大小为:b>a>cC.T2>T1D.b点时,平衡体系中A、B原子数之比接近2∶16.(2016全国丙,27节选)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压p c如图所示。
由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均______________(填“增大”、“不变”或“减小”)。
7.(2016全国27节选)丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产。
主要副产物有丙烯醛(CH2=CHCHO)和乙腈(CH3CN)的热化学方程式如下:①C3H6(g) + NH3(g) + 32O2(g) =C3H3N(g) +3H2O(g) ΔH= −515 kJ·mol−1②C3H6(g) +O2(g) = C3H4O(g) +H2O(g) ΔH= −353 kJ·mol−1丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图所示。
由图可知,最佳n(氨)/n(丙烯)约为__________,理由是____________;进料气氨、空气、丙烯的理论体积比约为______________。
8.(2009广东,)甲酸甲酯水解反应方程式为:HCOOCH3(l)+H2O(l)HCOOH(l)+CH3OH(l);△H>0。
甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:其他条件不变,仅改变温度为T2(T2大于T1),画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图。
9.(2014天津,10节选)合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)2NH3(g)∆H=—92.4kJ•mol‾1一种工业合成氨的简易流程图如下:源:Z*xx*](1)步骤II中制氢气原理如下:①CH4(g)+H2O(g)CO2(g)+3H2(g)△H=+206.4 kJ·mol-1②CO(g)+H2O(g)CO2(g)+H2(g)△H=-41.2 kJ·mol-1对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是。
a.升高温度b.增大水蒸气浓度c.加入催化剂d.降低压强利用反应②,将CO进一步转化,可提高H2产量。
若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为。
(2)图2表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。
根据图中a 点数据计算N2的平衡体积分数:。
(3)依据温度对合成氨反应的影响,在图3坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
参考答案1.C2.(1)不变;正反应(2)<;高。
3.(1)①0.003 0 mol·L-1·min-1②<,2.25×10-4③减小(2)①<,<②BD③A.B.4.(1)压强(2)L2>L1 2SO3(g)= 2SO2(g)+O2(g)△H=+196kJ·mol,-1;压强一定时,温度升高,平衡转化率增大。
5.(1)=,Q1=Q2+Q3(2)AD6.减小。
解析:根据图像b可知,当n(氨)/n(丙烯)约为1时,该比例下丙烯腈产率最高,而副产物丙烯醛产率最低;根据化学反应C3H6(g)+NH3(g)+ 3/2O2(g)=C3H3N(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,而空气中氧气约占20%,所以进料氨、空气、丙烯的理论体积约为1:7.5:1。
7.该比例下丙烯腈产率最高,而副产物丙烯醛产率最低1:7.5:18.解析:因为升高温度,反应速率增大,达到平衡所需时间减小,所以绘图时要注意到达平衡前,T2状态时的斜率要比T1大(过程斜率),达到平衡时间要小于T1(“拐弯”早晚);又因该反应为吸热反应,升高温度平衡向正反应方向移动,甲酸甲酯的转化率要大,所以绘图时要注意T2状态下达到平衡时的平台要高于T1(平衡高度)。
9.(1)a90%(2)14.5%(3)解析:对(3)问:N2和H2需要一定的温度才能发生反应,反应开始后,随着温度升高,反应速率增大,至达到平衡前NH3的物质的量增加,达到平衡后,温度升高,由于正反应放热,平衡逆向移动,NH3的物质的量将减少。
影响化学反应速率和化学平衡的因素1、浓度:某温度时,在一体积固定的密闭容器中加入2molSO2和1molO2发生反应:2SO 2(g)+O2(g)2SO3(g)并达到平衡状态,若t1时增加O的物质的量,t时达到新的平(双突(双突变、同倍数)(双突变、不同倍)某温度时,在一体积固定的密闭容器中加入2molSO 2和1molO 2发生反应:2A(g)+B(g)2C (g)并达到平衡状态,若t 1时 使用催化剂(双突变、同倍数) (增大反应过程的转化率,但不改变平衡转化率)1.(2012天津,10节选)钨丝灯管中的W 在使用过程中缓慢挥发, 使灯丝变细, 加入I 2可延长灯管的使用寿命, 其工作原理为: W(s)+2I 2(g)WI 4(g)。
下列说法正确的有 (填字母)。
a. 灯管内的I 2可循环使用b. WI 4在灯丝上分解, 产生的W 又沉积在灯丝上c. WI 4在灯管壁上分解, 使灯管的寿命延长d. 温度升高时, WI 4的分解速率加快, W 和I 2的化合速率减慢2.汽车尾气净化的主要原理为2NO(g)+2CO(g)N 2(g)+2CO 2(g) ΔH <0,在一定温度下,在一容积固定的密闭容器中充入一定量的NO 和CO ,在t 1时刻达到平衡状态。
(1)能判断该反应达到平衡状态的标志是________。
A .在单位时间内生成1 mol CO 2的同时消耗了1 mol CO B .混合气体的密度不再改变 C .混合气体的平均相对分子质量不再改变 D .混合气体的压强不再变化(2)在t 2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t 3时刻达到新的平衡状态,之后不再改变条件。
请在下图中补画出从t 2到t 4时刻正反应速率随时间的变化曲线;(3)若要同时提高该反应的速率和NO 的转化率,采取的措施有________、________。