配位化合物的立体构型与同分异构体
- 格式:docx
- 大小:37.14 KB
- 文档页数:3
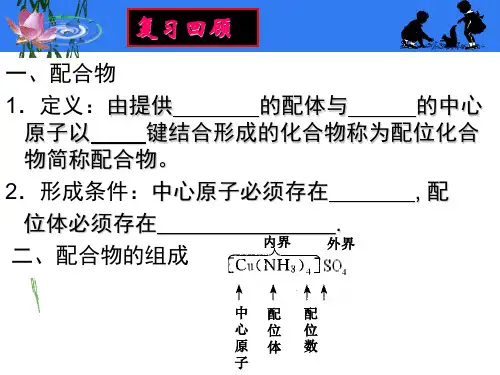

配位化合物第一节配位化合物的基本概念一、配位化合物的定义在CuSO4溶液中加少量氨水,生成浅蓝色Cu(OH)2↓,再加入氨水,沉淀溶解变成深蓝色溶液,加入乙醇,降低溶解度,得到深蓝色晶体,该晶体经元素分析,得知含Cu、SO42-、4NH3、H2O;取深蓝色溶液,加BaCl2,生成白色BaSO4↓,说明存在SO42-,加少量NaOH,无Cu(OH)2↓和NH3产生,说明溶液中不存在Cu2+和NH3分子,从而分析其结构为:[Cu(NH3)4]SO4·H2OCu和NH3之间的加合,既无氧化数的变化,也没有提供单电子配对而形成共价键,不符合经典的化合价理论。
这类化合物就是配合物。
二、配位化合物的组成1893年,维尔纳(A. Werner)提出配位理论。
1、配离子可以是阴或阳离子2、中心离子:简单阳离子,特别是过渡金属离子,也有金属原子。
位于配离子的中心。
3、配体:位于中心离子周围,可以是中性分子,也可以是负离子。
其特点是配位原子含有孤对电子。
能作为配位原子的元素主要有:N、O、C、S及卤素等。
4、配位数:配合物中,配位原子的总数。
决定于中心离子和配位体的性质,其电荷、体积、电子层结构及它们之间相互影响,形成时的条件(T、C)中心离子的电荷:+1 +2 +3 +4特征配位数: 2 4(或6) 6(或4) 6(或8)三、配位化合物的命名服从一般无机化合物的命名原则。
如果化合物的负离子是一个简单离子,叫某"化"某;如果化合物的负离子是一个复杂离子,叫某"酸"某。
络合物内界命名次序为:配位数(一、二、三、四)-配位体名称-"合"(表示配位结合)-中心离子名称-中心离子氧化数(Ⅰ、Ⅱ、Ⅲ、Ⅳ)例:[Co(NH3)6]Cl3[Pt(NH3)4](OH)2K2[PtCl6] H2[PtCl6]氯化六氨合钴(Ⅲ)氢氧化四氨合铂(Ⅱ)六氯合铂(Ⅳ)酸钾六氯合铂(Ⅳ)酸不止一种配体:先列阴离子,后列中性分子,若配体同是阴离子或中性分子,则按配位原子元素符号的英文次序排列。
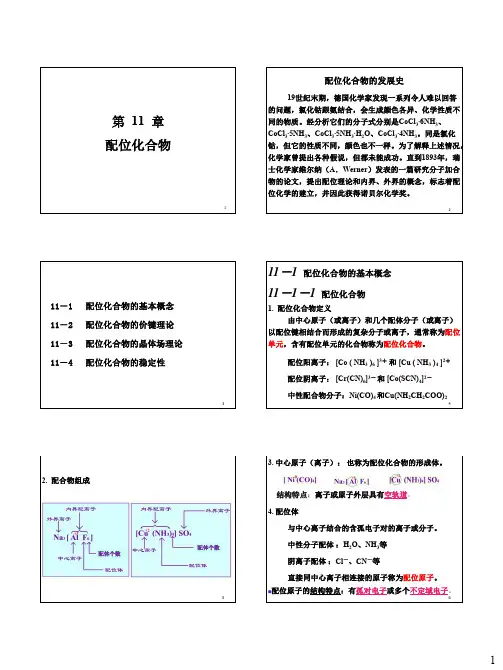
1第 11 章 配位化合物2配位化合物的发展史19世纪末期,德国化学家发现一系列令人难以回答的问题,氯化钴跟氨结合,会生成颜色各异、化学性质不同的物质。
经分析它们的分子式分别是CoCl 3∙6NH 3、CoCl 3∙5NH 3、CoCl 3∙5NH 3∙H 2O 、CoCl 3∙4NH 3。
同是氯化钴,但它的性质不同,颜色也不一样。
为了解释上述情况,化学家曾提出各种假说,但都未能成功。
直到1893年,瑞士化学家维尔纳(A .Werner )发表的一篇研究分子加合物的论文,提出配位理论和内界、外界的概念,标志着配位化学的建立,并因此获得诺贝尔化学奖。
311-1 配位化合物的基本概念11-2 配位化合物的价键理论 11-3 配位化合物的晶体场理论 11-4 配位化合物的稳定性411-1 配位化合物的基本概念 11-1-1 配位化合物1. 配位化合物定义由中心原子(或离子)和几个配体分子(或离子)以配位键相结合而形成的复杂分子或离子,通常称为配位单元,含有配位单元的化合物称为配位化合物。
配位阳离子: [Co ( NH 3 )6 ]3+ 和 [Cu ( NH 3 )4 ]2+ 配位阴离子: [Cr(CN)6]3- 和 [Co(SCN)4]2-中性配合物分子:Ni(CO)4 和Cu(NH 2CH 2COO)252. 配合物组成配体个数配体个数63. 中心原子(离子): 也称为配位化合物的形成体。
4. 配位体与中心离子结合的含孤电子对的离子或分子。
中性分子配体 :H 2O 、NH 3等 阴离子配体 :Cl -、CN -等直接同中心离子相连接的原子称为配位原子。
结构特点:离子或原子外层具有空轨道。
配位原子的结构特点:有孤对电子或多个不定域电子。
75 配位数在配位个体中与一个中心离子(原子)成键的配位原子的总数称为该形成体的配位数。
例如[Cu(NH 3)4]2+中,Cu 2+的配位数为4; [CoCl 3(NH 3)3]中Co 3+的配位数为6。

高三化学配位化合物的配位数与立体构型化学配位化合物是由中心金属离子和周围配体离子或分子组成的。
在配位化合物中,中心金属离子能够与不同数目的配体形成不同配位数的配合物,并且配位数的不同还可以导致配合物的立体构型发生变化。
本文将探讨高三化学中配位化合物的配位数与立体构型的关系。
一、配位数的定义和影响因素配位数指的是中心金属离子所配位的配体数目。
常见的配位数包括2、4、6以及8等。
而影响配位数的主要因素有以下几个方面。
1. 配体的种类和性质:不同的配体具有不同的配位能力,一些配体能够给予中心金属离子更多的电子密度,使得中心金属离子更容易接受更多的配位。
2. 配体的空间构型:一些配体本身的空间构型限制了其与中心金属离子的配位方式,从而影响了配位数的大小。
3. 中心金属离子的电子排布:中心金属离子的电子排布也会影响其对配位数的选择,一些电子排布不利于接受多个配位。
二、配位数与立体构型的关系配位数的不同将导致配位化合物的立体构型发生变化。
根据配位数的不同,配合物的立体构型分为以下几类。
1. 配位数为2的立体构型:配位数为2的立体构型形式上类似于线性结构,中心金属离子和配体排列在一条直线上。
常见的例子是[Ni(CO)4],其中镍离子与4个一氧化碳分子形成配位键。
2. 配位数为4的立体构型:配位数为4的立体构型形式上类似于四面体结构或平面方形结构。
四面体结构中,中心金属离子和4个配体形成四面体的形状,常见的例子是[TiCl4]。
平面方形结构中,中心金属离子和4个配体形成平面方形的形状,常见的例子是[Ni(CN)4]2-。
3. 配位数为6的立体构型:配位数为6的立体构型常见的是八面体结构或正八面体结构。
八面体结构中,中心金属离子和6个配体构成八面体的形状,常见的例子是[Co(NH3)6]3+。
正八面体结构中,中心金属离子和6个配体构成正八面体的形状,常见的例子是[Cr(H2O)6]3+。
4. 配位数为8的立体构型:配位数为8的立体构型常见的是双四面体结构或正二十面体结构。

配位化合物的结构和性质特征配位化合物是由中心金属离子与周围的配体结合形成的化合物。
它们具有独特的结构和性质特征,这些特征决定了它们在许多领域的广泛应用。
结构特征配位化合物的结构由中心金属离子以及配体之间的化学键决定。
其中,中心金属离子通过配位键与配体结合。
这些化学键可以是金属与配体的共价键或离子键,具体取决于配合物的性质和配体的性质。
配位化合物的结构也受到配体的环境影响。
配体的化学性质和空间取向可以影响配位化合物的几何构型,如线型、平面和立体构型。
此外,配位化合物常常存在不同的立体异构体,其中配体或配位数的变化会产生不同的空间结构。
这些结构特征对于配位化合物的性质和反应活性具有重要意义。
性质特征配位化合物的性质和特征可以分为以下几个方面:1. 稳定性:配位化合物通常比相应的金属离子更稳定,这是由于配体的共价键或离子键使得整个配位体更加稳定。
配位化合物的稳定性取决于中心金属离子和配体之间的相互作用。
2. 反应活性:配位化合物可以通过与其他化合物发生反应来改变其结构和性质。
例如,配位化合物可以与其他配体交换,形成新的配位体结构。
这种反应活性使得配位化合物在催化、药物和材料等领域具有广泛的应用。
3. 光谱特征:配位化合物在光谱学中表现出独特的吸收和发射特征。
它们可以通过紫外-可见光谱、红外光谱、核磁共振光谱等技术进行表征。
这些光谱特征可以用于确定配位化合物的结构和配位键的性质。
4. 磁性:一些配位化合物具有磁性。
这是由于金属离子和配体之间的相互作用导致了磁性的产生。
磁性配位化合物在材料科学和医药领域具有重要的应用价值。
总结起来,配位化合物的结构和性质特征对于理解其化学性质和应用具有重要意义。
通过研究和分析配位化合物的结构和性质,我们可以更好地应用它们在催化、药物和材料等领域,并进一步探索其潜在的应用价值。



配位化合物的结构与性质
配位化合物是由中心金属离子与周围的配体离子共同构成的。
它们的结构和性质对于理解和应用这些化合物具有重要意义。
结构
配位化合物的结构由中心金属离子和配体离子之间的配位键连接模式所决定。
常见的配位键连接模式包括线性、平面和立体等。
- 线性配位键连接模式:配体离子在平衡位置排列,形成一条直线连接中心金属离子。
- 平面配位键连接模式:配体离子在平衡位置排列,形成一个平面与中心金属离子相连接。
- 立体配位键连接模式:配体离子在平衡位置排列,形成一个立体结构与中心金属离子相连接。
性质
配位化合物具有一系列独特的性质,包括磁性、光学性质和化
学活性。
- 磁性:配位化合物中的中心金属离子通过与配体离子之间的
电子转移产生磁性。
它们可以表现出顺磁性或反磁性,这取决于中
心金属离子和配体离子之间的电子排列方式。
- 光学性质:一些配位化合物具有特殊的光学吸收和发射性质,可以用于制备染料、荧光标记物等。
- 化学活性:由于中心金属离子和配体离子之间的配位键的特
殊性质,配位化合物在化学反应中表现出不同的活性。
它们可以参
与配位交换反应、氧化还原反应等。
结构和性质的研究对于配位化合物的设计和合成具有重要意义。
通过了解配位化合物的结构和性质,我们可以合理设计新型配位化
合物以满足不同的应用需求。

化学配位化合物的结构与性质化学配位化合物是由中心金属离子和周围的配位基团(分子或离子)通过配位键形成的化合物。
它们在化学、生物学和材料科学等领域中具有重要的应用价值。
本文将讨论化学配位化合物的结构和性质,并探讨它们在不同领域中的应用。
一、结构与配位键化学配位化合物的结构通常由中心金属离子、配位基团以及配位键构成。
配位基团通常是具有孤对电子的原子或者原子团,例如氨、水、氯等。
配位键是由配位基团的孤对电子与中心金属离子的空轨道形成的共价键。
这种键被称为配位键,通过配位键,配位基团与中心金属离子相互连接,形成立体构型各异的化学配位化合物。
二、性质与应用1. 形状与结构多样性:化学配位化合物由于中心金属离子和配位基团的多样性,可以形成各种不同结构和形状的化合物。
这些化合物可以具有线性、平面和立体等不同的几何构型,从而对其性质和应用产生重要影响。
2. 稳定性和反应性:化学配位化合物通常具有较高的稳定性,能够在一定条件下保持其结构和性质。
但同时,也具有一定的反应性,在适当的条件下可以与其他物质进行反应,形成新的化合物。
这种反应性使得化学配位化合物在催化和分析等领域中得到广泛应用。
3. 光电性质:部分化学配位化合物具有良好的光学和电学性质。
例如,一些过渡金属配合物能够吸收可见光,显示出丰富的颜色,并且具有荧光和磷光现象。
这些性质使得它们在光催化、光敏材料和显示技术等领域有重要应用。
4. 生物活性:化学配位化合物在生物学领域中具有广泛的应用。
一些金属配合物具有抗菌、抗肿瘤和抗炎等生物活性,被广泛研究用于药物开发和生物标志物检测。
结论化学配位化合物由中心金属离子和配位基团通过配位键形成,具有多样的结构和性质。
它们在化学、生物学和材料科学等领域中具有重要的应用价值。
通过研究和了解化学配位化合物的结构与性质,可以为其在不同领域的应用提供有益的指导和启示。
注:以上内容基于化学配位化合物的普遍性质,具体化合物的结构和性质可能会有所不同,请在具体研究和实验中进行进一步的深入探索。


化学配位化合物的立体构型化学配位化合物是由中心金属离子与一或多个配位体形成的化合物。
在配位化学中,研究和了解配位化合物的立体构型对于理解其性质和反应机制至关重要。
本文将介绍配位化合物的立体构型以及相关的分子几何形状。
一、线性型构型线性型构型是指配位体以直线方式与中心金属离子配位形成的构型。
例如,一价阳离子氯离子(Cl-)可以以线性方式配位到两个一价阳离子银离子(Ag+)上,形成Ag-Cl-Ag的线性链状结构。
此外,双原子分子中的配位体,如一氧化碳(CO)和氰化物(CN-),也可形成线性型构型。
二、四面体型构型四面体型构型是指四个配位体环绕着中心金属离子呈四面体形状排列而成的构型。
在这种构型中,配位体通常位于四面体的四个顶点位置。
例如,四个一价阴离子氯离子(Cl-)可以与一个四价阳离子钛离子(Ti4+)形成四面体型构型,其中氯离子位于四面体的四个顶点。
三、正方形平面型构型正方形平面型构型是指四个配位体环绕着中心金属离子呈正方形平面形状排列而成的构型。
在这种构型中,配位体位于正方形平面的四个角位置。
例如,四个一价阴离子氰化物离子(CN-)可以与一个二价阳离子镍离子(Ni2+)形成正方形平面型构型,其中氰化物离子位于正方形平面的四个角。
四、八面体型构型八面体型构型是指八个配位体环绕着中心金属离子呈八面体形状排列而成的构型。
在这种构型中,配位体通常位于八面体的八个顶点位置。
例如,八个二价阴离子氟离子(F-)可以与一个二价阳离子镍离子(Ni2+)形成八面体型构型,其中氟离子位于八面体的八个顶点。
五、扭曲型构型扭曲型构型是指配位体与中心金属离子配位形成的构型具有非常规形状的情况。
在某些情况下,配位体之间的相互作用会导致立体构型偏离理想的几何形状。
例如,五个一价阴离子溴离子(Br-)和一个一价阳离子铜离子(Cu+)形成的配位化合物呈扭曲型构型。
结论化学配位化合物的立体构型对其性质和反应机制有着重要影响。
不同的立体构型决定了配位化合物的形状以及与其他分子的相互作用方式。
配位化合物的结构化合物的结构是化学领域的一个重要概念。
它描述了化学物质中不同原子之间的连接方式和空间排列。
通过了解化合物的结构,我们可以深入理解化学反应的机理和物质的性质。
化合物的结构可以通过多种方法来研究和确定。
其中最常用的是X射线晶体学、核磁共振和质谱等技术。
这些技术能够提供有关原子之间距离、键角和分子的对称性等信息。
通过这些数据,化学家们可以绘制分子的平面和立体结构。
化合物分子的平面结构是指原子在一个平面内的排列方式。
原子之间的键长、键角以及整个分子的几何形状都能直接从平面结构中得到。
例如,苯环由六个碳原子和六个氢原子组成,所有碳-碳键的长度相等。
通过实验测得的键角值,我们可以知道苯环的立体构型是平面的。
另一方面,化合物分子的立体结构描述的是空间中原子的排列方式。
它包含有关键长、键角、立体位阻和手性中心等信息。
例如,葡萄糖分子是一种手性分子,它有多个手性中心。
每个手性中心上的原子可以取两种对映异构体中的一种。
因此,葡萄糖分子有多个立体异构体。
通过确定葡萄糖的立体结构,我们可以了解到它与生物体内酶的相互作用机制。
除了平面和立体结构,还有一些特殊的结构类型在化学中起着重要的作用。
例如,配合物是由一个中心金属离子和周围配体组成的。
金属离子通常会与配体之间通过配位键形成配合物。
配合物的结构不仅仅取决于金属离子和配体之间的化学键,还取决于它们的空间排列。
通过配合物的结构研究,我们可以了解到过渡金属离子与配体的相互作用和其在催化、磁性以及医学等领域的应用。
化合物结构的研究在很多领域都发挥着重要作用。
例如,有机化合物的结构研究对药物设计和新材料的开发起着关键作用。
药物的活性通常与分子的结构密切相关。
通过了解药物分子的立体构型和与靶标的相互作用,我们可以有效地设计出具有更高活性和选择性的药物。
另外,新材料的设计也需要对化合物结构的研究。
例如,蓝光发光二极管(LED)的研发需要深入理解有机分子的结构。
通过调控有机分子的结构,可以提高LED的效率和稳定性。
第九讲配位化合物简介一、配合物简介1.配合物定义配合物是由具有接受孤对电子或多个不定域电子的空位原子或离子(中心体)与可以给出孤对电子或多个不定域电子的一定数目的离子或分子(配体)按一定的组成和空间构型所形成的物种称为配位个体,含有配位个体的化合物为配合物。
[FeF6]3-, Fe(NCS)3, [Fe(CN)6]3-, [Cu(NH3)4]2+, [AlF6]3-, [Ag(NH3)2]+等K3 [ Fe ( C N )6](中央体)中心离子配位原子2.配合物的组成从溶液中析出配合物时,配离子经常与带有相反电荷的其他离子结合成盐,这类盐称为配盐。
配盐的组成可以划分为内界和外界。
配离子属于内界,配离子以外的其他离子属于外界。
内、外界之间以离子键结合。
外界离子所带电荷总数等于配离子的电荷数。
如:K3 [Fe( C N )6] 外界:K+; 内界:[ Fe( CN )6]3—。
中央体(形成体)通常是金属离子和原子,少数是非金属元素,例如:Cu2+,Ag+,Fe3+,Fe,Ni,B(Ⅲ),PⅤ……配位体含孤电子对或离域电子的分子和离子。
如:F-,Cl-,Br-,I-,OH-,H2O,NH3,CO,CN -……配位原子具有孤电子对的原子。
如:C、N、O、F、Cl、S等。
3、配体的分类按配体所含配位原子的数目分:单齿配体:只含一个配位原子的配体(NH、Cl-、H2O、F-, NH3, H2O等)。
3多齿配体:含有两个或两个以上的配位原子的配体。
160161en 、EDTA 、OX 、bipy 等4-4. 配合物的分类:按中央体的个数分:单核: [Co(NH 3)6]Cl 3 、 Na[AlF 6]. etc 多核: K 2[Re 2Cl 8]、 [ Cr 2O(NH 3)10 ] Cl 4. etc按配体与中央体之间成环情况分:简单[Co(NH 3)5H 2O]Cl 3 、 Pt (NH 3)2 Cl 2, etc螯合物[Cr(en)3]Cl 3, etc按配位个体是否带电荷分:离子 [Cu(NH 3)4]2+ [Ag(CN)2]- . etc分子 Fe(CO)5、[Co(NH 3)3Cl 3]. etc二、配合物的价键理论1.理论要点:(1). 中央体(中心离子或原子)(M):有空轨道 配位体(L):有孤对电子OCOCHC H OC O NCH CH N O COCH C HOC O 222222162二者形成配位键M L(2). 中央体(中心离子或原子)采用杂化轨道成键. (3). 杂化方式与空间构型有关[Fe(H 2O)6]2+sp 3d 2杂化, 八面体构型,外轨型配合物[Fe(CN)6]4-d 2sp 3杂化, 八面体构型,内轨型配合物2. 内、外轨型配合物:(1) 中心原子d1 ~ d3型, 有空(n-1)d轨道,d2s p3杂化形成内轨型(2) 中心原子d4 ~ d7型,视配体的强弱:强场配体,如CN – , CO, NO2–等,易形成内轨型;弱场配体,如X –、H2O易形成外轨型中心原子d8~ d10型, 无空(n-1)d轨道,sp3 d2杂化形成外轨型外轨型配合物:sp3d2杂化,轨道能量高,配合物较不稳定,中心原子的电子结构不发生改变,未成对电子数多,µ较大,一般为高自旋。
化合物fac构型配位化合物的构型由配位数所决定,也就是化合物中心原子周围的配位原子个数。
配位数与金属离子和配体的半径、电荷数和电子构型有关,一般在2-9之间,镧系元素和锕系元素的配合物中常会出现10以上的配位数。
把围绕中心原子的配位原子看作点,以线连接各点,就得到配位多面体。
五配位中,常常涉及到三角双锥和四方锥两种构型的互变,因此,很大一部分五配位化合物的结构是介于这两个结构之间的一种中间结构。
六配位的化合物除极其常见的八面体外,也有可能是三角棱柱结构,例如单核配合物[Re(S2C2Ph2)3]即属于这一类。
七配位中,配合物还可能是单帽八面体或单帽三角棱柱体结构。
更高配位数的化合物中,八配位的可以是四方反棱柱体、十二面体、立方体、双帽三角棱柱体或六角双锥结构;九配位的可以是三帽三角棱柱体或单帽四方反棱柱体结构;十配位的可以是双帽四方反棱柱体或双帽十二面体结构;十一配位的化合物很少,可能是单帽五角棱柱体或单帽五角反棱柱体;十二配位的如[Ce(NO3)6],为理想的二十面体;十四配位的为双帽六角反棱柱体。
再高的配位数非常罕见,如PbHe15,该离子中铅的配位数至少为15。
异构现象异构现象是配合物具有的重要性质之一。
它不仅影响配合物的物理和化学性质,而且与其稳定性、反应性和生物活性也有密切关系。
重要的配合物异构现象包括立体异构和结构异构。
立体异构立体异构是化学式和原子排列次序都相同,仅原子在空间排列不同的异构现象。
立体异构主要分为几何异构和光学异构。
几何异构几何异构是组成相同的配合物的不同配体在空间几何排列不同而致的异构现象,主要出现在配位数为4的平面正方形和配位数为6的八面体结构中,以顺式-反式异构体与面式-经式异构体的形式存在。
从空间关系上考虑,顺式(cis-)是指相同的配体处于邻位,反式(trans-)是指相同的配体处于对位。
八面体[MA3B3]的两种异构体中,面式(fac-)或顺-顺式指3个A和3个B各占八面体的三角面的顶点,经式(mer-)或顺-反式是指3个A和3个B在八面体外接球的子午线上并列。
配位化合物的立体构型与同分异构体配位化合物是由一个中心金属离子与周围的配体形成的,其中配体可以是各种无机或有机分子。
这些配位化合物具有不同的立体构型,这取决于金属离子的电子构型和配体的性质。
在化学领域中,研究配位化合物的立体构型和同分异构体对于理解其性质和应用具有重要意义。
一、正方形配位
正方形配位是一种常见的配位构型,其中中心金属离子周围的配体分别位于配位面的四个顶点上。
当配体是单原子配体时,正方形配位通常是以四个相同的配体环绕金属离子形成的。
例如,在[Co(NH3)4]2+离子中,四个氨分子以正方形构型周围环绕着钴离子。
正方形配位也可以由配体的两个双电子对形成,使配位化合物的电子构型更为稳定。
二、八面体配位
八面体配位是另一种常见的配位构型,其中中心金属离子周围的配体形成一个八面体的结构。
八面体配位通常由六个配位点环绕金属离子而成,配位点位于八个顶点上。
例如,[Co(NH3)6]3+离子以八面体构型形成,其中六个氨配体分别位于八个顶点上。
三、四面体配位
四面体配位是一种较少见的配位构型,其中中心金属离子周围的配体形成一个四面体的结构。
四面体配位通常由四个配位点环绕金属离子而成,配位点位于四个顶点上。
四面体配位对于d0和d10电子构型的金属离子特别常见。
例子包括[Ni(CN)4]2-离子,其中四个氰根离子形成四面体构型周围包围着镍离子。
同分异构体是一类化合物,它们具有相同的化学式但不同的结构。
在配位化合物中,同分异构体的存在可以由立体构型的差异导致。
具有完全相同的化学式的同分异构体可以显示出不同的物理和化学性质,因为它们的立体构型影响了它们的分子形状和空间排列。
以[CoCl2(en)2]+离子为例,它是由一个钴离子和两个氯化物配体以及两个乙二胺配体构成的。
该离子可以有两种同分异构体:光学异构体和构效异构体。
光学异构体是由于手性中心存在而产生的异构体。
在
[CoCl2(en)2]+离子中,乙二胺配体具有两个官能团,因此该离子
可以形成两个非对映体。
这两个非对映体在化学性质,例如光学
活性和反应性上可能会有差异。
构效异构体是由于配位物在配位方式上的差异而产生的异构体。
在[CoCl2(en)2]+离子中,氯化物和乙二胺可以分别连接到钴离子
的两个不同的配位点。
这两种不同的配位方式导致离子空间构型
的差异,从而可能导致其在物理性质和化学性质上的差异。
总之,配位化合物的立体构型和同分异构体对于理解其性质和
应用具有重要意义。
正方形配位、八面体配位和四面体配位是常
见的立体构型,其稳定性和性质取决于金属离子的电子构型和配
体的性质。
同分异构体的存在使得具有相同化学式的化合物具有
不同的立体构型和性质,这对于研究和应用配位化合物具有重要
意义。