土壤微生物量测定方法现状及其在红壤上的应用_1
- 格式:pdf
- 大小:129.36 KB
- 文档页数:4

土壤微生物生物量的测定方法1土壤微生物碳的测定方法(熏蒸提取----仪器分析法)基本原理新鲜土样经氯仿熏蒸后(24h),土壤微生物死亡细胞发生裂解,释放出微生物生物量碳,用一定体积的LK2SO4溶液提取土壤,借用有机碳自动分析仪测定微生物生物量碳含量。
根据熏蒸土壤与未熏蒸土壤测定有机碳的差值及转换系数(K EC),从而计算土壤微生物生物量碳。
实验仪器自动总有机碳(TOC)分析仪(Shimadzu Model TOC—500,JANPAN)、真空干燥器、烧杯、三角瓶、聚乙烯熟料管、离心管、滤纸、漏斗等。
实验试剂1)无乙醇氯仿(CHCL3);2)L硫酸钾溶液:称取87g K2SO4溶于1L蒸馏水中3)工作曲线的配制:用L硫酸钾溶液配制10ugC/L、30ugC/L、50ugC/L、70ugC/L、100ugC/L系列标准碳溶液。
(其实一般情况下,仪器会自带的标曲,一般不用自己做的)操作步骤土壤的前处理(过筛和水分调节略)熏蒸称取新鲜(相当于干土,这个可以根据自己土样的情况而定)3份分别放入25ml小烧杯中。
将烧杯放入真空干燥器中,并放置盛有无乙醇氯仿(约2/3)的15ml烧杯2或3只,烧杯内放入少量防暴沸玻璃珠,同时放入一盛有NaOH溶液的小烧杯,以吸收熏蒸过程中释放出来的CO2,干燥器底部加入少量水以保持容器湿度。
盖上真空干燥器盖子,用真空泵抽真空,使氯仿沸腾5分钟。
关闭真空干燥器阀门,于25℃黑暗条件下培养24小时。
抽真空处理熏蒸结束后,打开真空干燥器阀门(应听到空气进入的声音,否则熏蒸不完全,重做),取出盛有氯仿(可重复利用)和稀NaOH溶液的小烧杯,清洁干燥器,反复抽真空(5或6次,每次3min,每次抽真空后最好完全打开干燥器盖子),直到土壤无氯仿味道为止。
同时,另称等量的3份土壤,置于另一干燥器中为不熏蒸对照处理。
(注意:熏蒸后不可久放,应该快速浸提)※浸提过滤从干燥器中取出熏蒸和未熏蒸土样,将土样完全转移到80ml聚乙烯离心管中,加入40ml L硫酸钾溶液(土水比为1:4,考虑到土样的原因,此部分熏蒸和不熏蒸土均为4g,即,4g土:16ml的硫酸钾溶液,当然这个加入量要根据TOC仪器的进入量决定)300r/min振荡30min,用中速定量滤纸过滤。

土壤微生物测定土壤微生物活性表示土壤中整个微生物群落或其中的一些特殊种群状态,可以反映自然或农田生态系统的微小变化。
土壤微生物活性的表征量有:微生物量、C/N、土壤呼吸强度和纤维呼吸强度、微生物区系、磷酸酶活性、酶活性等。
测定指标:1、土壤微生物量(MierobialBiomass,MB)能代表参与调控土壤能量和养分循环以及有机物质转化相对应微生物的数量,一般指土壤中体积小于5Χ103um3的生物总量。
它与土壤有机质含量密切相关。
目前,熏蒸法是使用最广泛的一种测定土壤微生物量的方法阎,它是将待测土壤经药剂熏蒸后,土壤中微生物被杀死,被杀死的微生物体被新加人原土样的微生物分解(矿化)而放出CO2,根据释放出的CO2:的量和微生物体矿化率常数Kc可计算出该土样微生物中的碳量。
因此碳量的大小就反映了微生物量的大小。
此外,还有平板计(通过显微镜直接计数)、成份分析法、底物诱导呼吸法、熏蒸培养法(测定油污染土壤中的微生物量—碳。
受土壤水分状况影响较大,不适用强酸性土壤及刚施用过大量有机肥的土壤等)、熏蒸提取法等,均可用来测定土壤微生物量。
熏蒸提取-容量分析法操作步骤:(1)土壤前处理和熏蒸(2)提取-1K2SO4(图将熏蒸土壤无损地转移到200mL聚乙烯塑料瓶中,加入100mL0.5mol·L水比为1:4;w:v),振荡30min(300rev·min-1),用中速定量滤纸过滤于125mL塑料瓶中。
熏蒸开始的同时,另称取等量的3份土壤于200mL聚乙烯塑料瓶中,直接加入100mlL0.5mol·L -1K2SO4提取;另作3个无土壤空白。
提取液应立即分析。
(3)测定吸取10mL上述土壤提取液于150mL消化管(24mmх295mm)中,准确加入10mL0.018 mol·L -1K2Cr2O7—12mol·L-1H2SO4溶液,加入2~3玻璃珠或瓷片,混匀后置于175±1℃磷酸浴中煮沸10min(放入消化管前,磷酸浴温度应调至179℃,放入后温度恰好为175℃)。
土壤微生物监测常规测定指标的分析方法和适用范围其他方法:一、土壤DNA提取和纯化:方案1,参考(1, 2)1.称取样品土样5g, 加入灭菌的石英砂,液氮研磨;不要液氮研磨,这样子对DNA伤害很大,几乎全部片段化了。
可以加上PBS洗涤下土壤,一是能够去除些杂质,二是能够使得土壤处于悬浮状态,然后可以在涡旋仪上剧烈涡旋2-3min,使得土壤颗粒破碎。
然后12000rpm离心5min,弃上清。
2.加入13.5mL的DNA提取Buffer,100微升20mg/mL蛋白酶K,37℃225rpm摇30min-2h3.加入700微升20%SDS,65℃水浴2h,间隔15min颠倒摇匀数次;4.6000rpm室温离心15min,收集中间液相层;向沉淀中加入3mLDNA提取液,300微升20%SDS,65℃水浴30min,同上离心,收集中间液相层,合并;重复一次;可考虑再增加抽提一次。
或者用5mL而不是3mL。
最后实在装不下了可以分在两个50mL离心管里面离心。
5.向收集的液相层中加入等体积氯仿:异戊醇(24:1)抽提一次,8000rpm离心10min,收集上部液相层;6.第5步收集液相层中加入0.1倍体积的乙酸钠,0.6倍体积的异丙醇,4℃过夜沉淀;这个千万不要4度过夜啊,四度过夜你会发现很多的絮状悬浮物,我之前犯过类似错误,这个是SDS和高浓度的盐在低温条件下析出来了。
室温放置1-2h就好。
7.过夜沉淀物12000rpm离心15min,弃上清;向沉淀中加入10mL冷乙醇洗涤,12000rpm离心5min,弃上清;12000rpm离心30sec,移液枪析出残留液体;8.室温自然干燥沉淀,干燥后向沉淀中加入400微升TE溶解。
方案2:购买DNA提取试剂盒,如SoilMaster DNA Extraction Kit (Epicenter) 或UltraClean Soil DNA Isolation Kit (MO BIO)二、DNA定量和质量检测:提取后的DNA使用紫外分光光度法进行浓度和纯度检测。

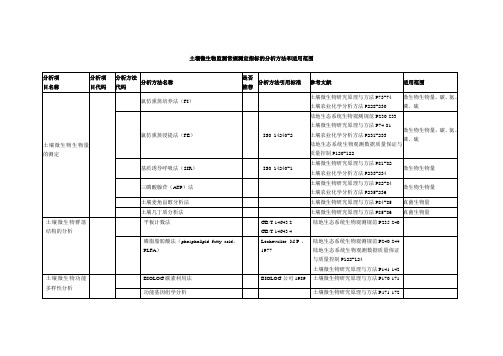
1. 土壤微生物生物量的测定(滴定法)一、实验目的和内容土壤微生物生物量是指土壤中体积小于5~10μm3活的微生物总量,是土壤有机质中最活跃的和最易变化的部分。
耕地表层土壤中,土壤微生物量碳(Bc)一般占土壤有机碳总量的3%左右,其变化可直接或间接地反映土壤耕作制度和微生物肥力的变化,并可以反映土壤污染的程度。
近30年来,国外许多学者对土壤微生物生物量的测定方法进行了比较系统的研究,但由于土壤微生物的多样性和复杂性,还没有发现一种简单、快速、准确、适应性广的方法。
目前广泛应用的方法包括:氯仿熏蒸培养法(FI)、氯仿熏蒸浸提法(FE)、基质诱导呼吸法(SIR)、精氨酸诱导氨化法和三磷酸腺苷(A TP)法。
氯仿熏蒸浸提法(FE)的原理是:土壤经氯仿熏蒸处理,微生物被杀死,细胞破裂后,细胞内容物释放到土壤中,导致土壤中的可提取碳、氨基酸、氮、磷和硫等大幅度增加。
通过测定浸提液中全碳的含量可以计算土壤微生物生物量碳。
二、实验材料和用具仪器:培养箱;真空干燥器;真空泵;往复式振荡机(速率200次每min);1L广口玻璃瓶;定量滤纸;紫外分光光度计;LNK-872型消煮炉(江苏省宜兴市科教仪器研究所)试剂:1.无乙醇氯仿:市售的氯仿都含有乙醇(作为稳定剂),使用前必须除去乙醇。
方法为:量取500ml氯仿于1000ml分液漏斗中,加入50ml硫酸溶液[ρ(H2SO4)=5%],充分摇匀,弃除下层硫酸溶液,如此进行3次。
再加入50ml去离子水,同上摇匀,弃去上部的水分,如此进行5次。
将下层的氯仿转移存放在棕色瓶中,并加入约20g无水K2CO3,在冰箱的冷藏室中保存备用。
2.硫酸钾溶液[c(K2SO4)=0.5mol·L-1]称取硫酸钾(K2SO4,化学纯)87.10g,先溶于300ml去离子水中,加热,转移溶液至容器中,再加少量去离子水溶解余下的部分,转移溶液至同一容器中,如此反复多次。
最后定容至1L;3.重铬酸钾[c(1/6 K2Cr2O7)=0.4000mol·L-1]:称取经130℃烘干2~3h的重铬酸钾(K2Cr2O7,分析纯)19.622g,溶于1000ml去离子水中;4.邻啡罗啉亚铁指示剂:称取邻啡罗啉(C12H8N2H2O,分析纯)1.49g,溶于含有0.70gFeSO4·7H2O的100ml 去离子水中,密闭保存于棕色瓶中;5.硫酸亚铁溶液[c(FeSO4·7H2O)=0.0667mol·L-1]:称取硫酸亚铁(FeSO4·7H2O,化学纯)18.52g,溶解于600ml~800ml去离子水中,加浓硫酸(化学纯)15ml,搅拌均匀,定容至1000ml,于棕色瓶中保存。

土壤微生物数量测定方法土壤微生物是指生活在土壤中的微小生物,包括细菌、真菌、放线菌、古菌等。
土壤微生物在土壤的生物地球化学循环、有机质分解、养分转换和植物健康等过程中起着重要的作用。
因此,对土壤微生物数量的准确测定具有重要意义。
本文将介绍一些常用的土壤微生物数量测定方法。
1.瓶培法:将适量的土壤样品与适量的培养基混合,在37°C下培养约24小时,然后通过平板计数法或最凼稀释法进行测定。
2.膜过滤法:将土壤提取液通过特定孔径的膜过滤器滤过,然后将膜放置在培养基上进行细菌的生长,最后进行计数。
3.间接法:通过测定土壤样品的可培养细菌指标,如氧化还原酶、脱氢酶等的活性,从而推算出土壤中的细菌数量。
4.分子生物学方法:通过PCR扩增土壤DNA中的细菌基因,如16SrRNA基因,再通过测定PCR产物进行细菌数量的测定。
1.直接镜检法:直接在显微镜下观察土壤样品中的真菌,通过计数来估算真菌的数量。
2.平板计数法:将土壤样品均匀撒在培养基上,通过培养方法使真菌生长形成菌落,最后进行计数。
3.膜过滤法:与细菌数量测定相似,将土壤提取液通过膜过滤器滤过,然后将膜放置在适当的培养基上进行真菌的生长,最后进行计数。
4.分子生物学方法:通过PCR扩增土壤DNA中的真菌基因,如18SrRNA基因,再通过测定PCR产物进行真菌数量的测定。
1.直接镜检法:直接在显微镜下观察土壤样品中的放线菌,通过计数来估算放线菌的数量。
2.平板计数法:将土壤样品均匀撒在培养基上,通过培养方法使放线菌生长形成菌落,最后进行计数。
3.膜过滤法:与细菌和真菌数量测定类似,将土壤提取液通过膜过滤器滤过,然后将膜放置在适当的培养基上进行放线菌的生长,最后进行计数。
4.分子生物学方法:通过PCR扩增土壤DNA中的放线菌基因,如16SrRNA基因,再通过测定PCR产物进行放线菌数量的测定。
通过上述方法测定土壤中微生物的数量,可以了解土壤微生物对土壤生态系统功能的影响,并为土壤质量评价和科学合理利用提供依据。

第期土壤徽生量的测定方法现状和展望。
及空间分布特性都与原土壤微生物一致而外加微生物则无论在组成上还是分布是都存在人为因素二裂取 , 土壤微生物盆硫的测定〔土壤微生物所含的硫是土壤有效硫的重要来源 , 土壤熏蒸以后 , , 微生物细胞破释出的硫化合物可为一‘ 幻其中以用 , 尹或等试剂所提材对提取时的测定结果最为理想其它几种提取剂因对照样品测定全硫 , 、的背景值太高翔影响测定结果的准确性和重现性〔提取液先经消化消化液经微孔膜过滤后用离子色谱仪测定其硫酸根含量计算二允 , 土壤微生物量硫砂含量按下式 , 式中数为熏蒸土样与对照样品测定方法不同’ 。
, 未经熏蒸〕 , 可提取硫之差 , 为转换系一值略有差异等人哪采用纯培养微生物加人法测得 , 提取的值为用土壤稀释液接种微生物采提取法的 , 为在培养基上培养一定时间后材提取的和 , 加人到土壤中去的” 方法测得去 , 值为目前文献上引用较多的〔 , 提取液中的硫常用 , 射线荧光分光光度计法用 , 值仍然是或还原蒸馏法测定〔’ , 过鉴于提取液中硫的浓度一般都不高而用还原蒸馏法则不仅费时射线荧光光度计法精度达不到要求 , 方法卿〔由于被且分析误差较大所以只有离子交换色谱法是比较理想的以上以有机硫的形态存在一般的土壤可以取的生物硫柱提省略硫酸根吸附校正的步骤五熏蒸法的问世和微生物量硫 , 、问题和展望熏蒸一提取法的提出、为定量测定土壤微生物量提供了简便的技术 , , 不仅克报了熏蒸一培养法的某些局限性用时 , 而且可应用于测定土壤微生物盆氮微生物盆磷这些方法在土壤科学和球境科学等领域均有广泛的应用前景 , 但在具体应 , 应注意以下几个问题这些方法的测定值受土壤水分状况影响很大〔蒸前湿润土壤则使测定值增大柳增大〔因此 , 采用风干土测定值显著降低熏在一定含水量范围内土壤微生物盆随含水量增加而 , , 比较不同土壤间土壤微生物量时必须考虑试样水分状况的可比性 , 若非研究土壤微生物量的季节性变化土壤之含水量应调节在在这种情况下 , 试样水分状况应与田间一致 , , 供试田间持水量左右直接应用文献报道的转换系数试土壤性质及测定条件的可比性‘ , 。
土壤微生物的分离鉴定及数量测定(一)培养基的制备Ⅰ测定微生物总量培养基:1. 细菌培养基(牛肉膏蛋白胨琼脂培养基)牛肉膏Beefextract5.0g蛋白胨Peptone10.0gNaCI5.0g蒸馏水H201000m1琼脂15~20gPH7.2~7.4制备步骤:⑴在100 mL小烧杯中称取牛肉膏5.0g,蛋白胨10.0g,加50 mL蒸馏水,置电炉搅拌加热至牛肉膏,蛋白胨完全溶解.⑵向小铝锅中加入500 mL蒸馏水,将溶解的牛肉膏,蛋白胨倒入铝锅中并用自来水洗2~3次.加入5.0gNaC1,在电炉上边加热边搅拌.⑶加入洗净的琼脂条,继续搅拌,加热至琼脂完全熔化,补足水量至1000 mL.⑷用NaOH或HC1调至pH7.0. 用酸度计或用玻棒沾少许液体用精密pH试纸测定其pH值,并用10%NaOH 调至所需pH值,必要时用滤纸或脱脂棉过滤。
一般比要求的pH高出0.2,因为高压蒸汽灭菌后,pH常降低。
⑸根据不同需要,可将配好的培养基分装入配有棉塞的试管或三角瓶内。
注意分装时避免培养基挂在瓶口或管口上引起杂菌污染。
如液体培养基,应装试管高度的1/4左右;固体培养基装试管高度的1/5左右;装入三角瓶的量以三角瓶容量的一半为限。
,塞好棉塞,装入小铁丝筐,然后用旧报纸将棉塞部分包好. 标签表明培养基的名称、配制日期等。
⑹高压蒸汽灭菌,用0.1Mpa(15lb/in2)121℃灭菌(15-20)30min.2.放线菌培养基(改良高氏1号琼脂培养基)可溶性淀粉20gKNO3 1gK2HPO40.5gMgSO4• 7H2O 0.5gNaCl 0.5g原0.05gFeSO4• 7H2O 0.01gpH 7.2-7.4制备步骤:(1)计算根据配方计算各种药品所需要的量,然后再分别称量。
(2)称量准确称量各种成分。
(3)溶化配制时,先用少量冷水将淀粉调成糊状,倒入少许沸水中,在火上加热,边搅拌边依次逐一溶化其他成分,溶化后,补足水分到1000ml,调PH(可不调)。
2 土壤微生物量测定土壤微生物量(MB)是指土壤中体积小于5x103叩3的生物总量,但活的植物体如植物根系等不包括在内]。
它通过调控土壤中能量和养分循环以及有机物转化,来反映土壤同化和矿化能力。
土壤微生物生物量包括土壤微生物生物量碳、土壤微生物生物量氮、土壤微生物生物量磷和土壤微生物生物量硫,但一般情况下土壤微生物生物量的大小以土壤微生物生物量碳来表示。
2.1熏蒸浸提法2.1.1原理利用不同的浸提剂,通过氧化滴定法来测定土壤浸提液中有机C、N和P提取的可溶性有机碳含量和微生物量C之间存在较稳定的比例关系。
2.1.2则定步骤1.根据土壤样品含水量,调节土壤含水量为田间持水量的50%,25 ℃下密封培养10 d,以保持土壤均匀和不同地方所得结果的可比性。
2.氯仿熏蒸24 h后,用真空泵反复抽气,直到土壤闻不到氯仿气味为止。
根据所测对象不同选择不同的提取剂浸提,振荡浸提30 min后,立即分析浸提液中所测对象的含量或放入-15 ℃下保存。
表1指出氯仿熏蒸浸提法测定不同土壤微生物量所选用的浸提剂及其条件。
表1姓熏薪髓喉土就生帽条件Table I F'E fcrdieneasuirm aitcondiocnsof soilm riobialbmass土情即鄢Detemiia血cfhdicaMr Eitatnt土觥生醯K(=D,3S 或D.45土觥物1小K国加士躺蜘M恻般注®拓牖腌雄魂航觥刎楠融脑机装痴螭定雕耐帕帆小麒眼3 土壤酶活性测定土壤酶活性均用风干土壤。
土壤转化酶活性和过氧化氢酶活性、脲酶活性、磷酸酶活性依次用硫代硫酸钠滴定法、高锰酸钾滴定法、靛酚蓝比色法和磷酸苯二钠比色法测定(关松荫,1986)3.1脲酶一一靛酚蓝比色法脲酶的活性可以用来表示土壤供氮能力(一)方法原理土壤中脲酶活性的测定是以尿素为基质,酶促水解生成的氨与酚类化合物起反应生成蓝色的靛酚,颜色深度与氨含量相关,因而用于脲酶活性的测定。
土壤微生物生物量的测定方法1.直接计数法:直接计数法是通过显微镜观察土壤样品中微生物数量来测定土壤微生物生物量。
常用的直接计数法包括滴定法、薄层计数法和电镜计数法。
滴定法是将土壤样品溶解后,通过滴定法来计数微生物细胞的数量。
滴定法主要包括用荧光假单胞菌(Pseudomonas fluorescens)作为参比菌,将细菌与土壤样品混合,经一系列稀释后进行滴定。
通过观察滴定液中菌落的数量,可以推算出原始土壤样品中微生物的生物量。
薄层计数法是将土壤样品制成薄层,然后在显微镜下进行计数。
这种方法可以直接观察微生物的形态特征,通过计算单位面积上微生物的数量来估算微生物生物量。
电镜计数法是利用电镜的高分辨率特性,观察土壤样品中微生物的形态和数量。
这种方法可以观察到更小的微生物和微生物的形态细节,但是操作复杂,成本较高。
2.间接测定法:间接测定法通过测定土壤中微生物活性代谢产物来估算微生物生物量。
常用的间接测定法包括ATP测定法、细胞膜脂肪酸测定法和氮素代谢产物测定法等。
ATP测定法是通过测定土壤中的三磷酸腺苷(ATP)含量来估算微生物生物量。
微生物的ATP含量与其生物量有一定的关系,因此可以通过测定ATP含量来间接估算土壤微生物生物量。
细胞膜脂肪酸测定法是通过测定土壤样品中微生物细胞膜中的脂肪酸含量来估算微生物生物量。
微生物细胞膜中的脂肪酸种类和含量与微生物群落的组成和数量有关,因此可以通过测定脂肪酸的含量来间接估算微生物生物量。
氮素代谢产物测定法是通过测定土壤样品中微生物氮素代谢产物的含量来估算微生物生物量。
微生物的氮素代谢活动与其生物量有关,因此可以通过测定氮素代谢产物的含量来间接估算微生物生物量。
3.分子生物学方法:分子生物学方法是利用PCR技术对土壤样品中微生物的DNA或RNA进行扩增和测定来估算微生物生物量。
常用的分子生物学方法包括引物扩增法、荧光原位杂交法和高通量测序法等。
引物扩增法是通过设计特定的引物对微生物的DNA或RNA进行扩增,并通过PCR反应的产物数量来估算微生物生物量。
红壤微生物生物量C 周转及其研究*陈国潮 何振立 黄昌勇(浙江大学华家池校区土化系,杭州 310029)摘 要 采用14C 底物标记技术测定了三种不同质地(红砂土菜地、黄筋泥桔园和茶籽园)的红壤微生物生物量C 的周转期。
结果表明,在25e 、50%田间持水量培养条件下,三种红壤微生物生物量C 的周转期分别为80天、139天和170天。
周转期与粘粒含量关系较为密切,砂质土壤的周转期较粘粒土壤短,提示砂质土壤有机质易被微生物降解,有利于养分的迅速释放,而粘粒土壤则更有利于养分的持留。
周转期与利用方式、p H 以及有机质含量无明显相关。
红壤微生物生物量C 周转期总体上较报道的其他类型土壤微生物生物量C 周转期短,表明热带)亚热带地区酸性红壤有机质和养分周转相对较快,这有可能是造成红壤养分贫瘠的一个原因。
根据周转期估算,通过微生物年周转的C 量(即年流通量)为微生物生物量C 的2倍以上。
关键词 红壤,微生物生物量C,周转期中图分类号 S154.36土壤微生物是土壤有机质和土壤养分转化、循环的动力。
作为能源物质的有机C 通过微生物作用产生二氧化碳、C 代谢物或形成新的微生物生物量C 的一部分。
新形成的代谢产物和死亡的有机体又可作为新的底物被微生物利用。
同时,微生物体自身C 素也在不断更新替换,微生物完成自身C 素更新的过程,称为微生物生物量C 的周转。
在一定条件下,微生物生物量C 周转处于相对平衡状态,即单位时间内合成的微生物量与分解的微生物量相等,此时的微生物量可视为基础微生物量。
如果说微生物生物量C 反映的是微生物量的大小,则微生物生物量C 周转反映的是微生物的活性。
研究微生物生物量C 的周转可以了解土壤有机质和土壤养分转化和循环的状况。
高度风化的酸性红壤,从矿物释放的养料十分有限,植物生长所需的养料主要靠肥料的投入和有机质的微生物转化。
因而,红壤微生物生物量C 周转的研究具有特别重要的意义。
研究土壤微生物生物量C 周转主要是测定微生物生物量C 的周转期。
文章编号:0564-3945(1999)06-0284-04文献综述土壤微生物量测定方法现状及其在红壤上的应用陈国潮(浙江大学环境与资源学院,浙江杭州310029)摘要:本文在阐述了现存土壤微生物量测定方法特点和局限性的基础上,分析了目前最为广泛应用的熏蒸提取法在红壤微生物量碳、氮、磷和硫测定上的适用性以及应用注意的一些问题.关键词:土壤微生物量;红壤;熏蒸提取法中图分类号:S154.3 文献标识码:A土壤微生物量是土壤有机质的活性部分,也是土壤中最活跃的因子192.主要表现为两方面的作用:一是土壤微生物是土壤有机质和土壤养分(N 、P 、S 等)转化和循环的动力,它参与有机质的分解、腐殖质的形成、土壤养分转化和循环等各个生化过程1102;二是土壤微生物量本身是土壤养分(N 、P 、S)的储备库,是植物生长可利用养分的一个重要来源1112.研究土壤微生物量对了解土壤肥力、土壤养分植物有效性以及土壤养分转化、循环具有重要意义.热带和亚热带地区广泛分布的高度风化的酸性红壤,从矿物释放的养料十分有限,植物生长所需的养料主要靠肥料的投入和有机质的矿化.因此,微生物量对红壤中N 、P 、S 的植物有效性及循环的影响就更大.我国红黄壤遍及南方15个省区,面积达218万平方公里,约占国土面积的2217%,是我国粮食以及经济作物和林业、畜牧业发展的重要基地,研究红壤微生物量具有深远的意义.而建立一套适用于红壤微生物量测定的方法是开展这方面研究的前提.1 土壤微生物量测定方法回顾在过去的近百年里,由于缺乏有效的测试技术,土壤微生物的研究主要局限于对微生物区系的组成及作用过程的定性探讨112.随着研究的深入和发展,特别是70年代中期以来,土壤学者相继发展了一系列的土壤微生物量测定方法.现有的测定方法主要有:直接镜检法、成份分析法、底物诱导呼吸法,熏蒸培养法和熏蒸提取法.111 直接镜检法该法较为原始,但不失为一种最直接的土壤微生物量测定方法.其基本操作过程为:土壤样品加水制成悬液后,在显微镜下计数,并测定各类微生物的个体大小.根据一定观察面积上的微生物个数、体积及比重(一般采用1118g/cm 3),计算出单位干土所含的微生物量;或根据微生物体的干物质含量(一般采用25%)及干物质含C 量(一般采用47%),进一步计算出单位干土所含微生物C 量.该法的主要缺陷:一是技术难度大,特别是在测定微生物个体大小时很容易产生大的误差,不太适宜常规分析.二是操作复杂,一方面要对各类微生物的个体大小进行测定;另一方面由于同类微生物个体之间存在大小差异,需对其抽样测定,算出平均值,而土壤中往往存在种类不同的微生物,因此不适宜大批量样品的测定.112 成份分析法成份分析法常采用的是AT P 分析法,是由Jen -kinson 等1979年提出的1122。
其基本过程是将微生物细胞破坏,使其释放所含的AT P,经适当的提取剂浸提,浸提液经过滤,用荧光素-荧光素酶法测定其中的AT P 量,然后将A T P 量换算成土壤微生物量,土壤微生物的AT P 含量一般采用612L mol/g 微生物干物质,相当于Cmic/AT P 比值约为1381132.该法的不足之处:(1)AT P 的提取效率不理想,目前较为常用的是T CA 提取法1142;(2)质地差异较大的土壤,其微生物AT P 含量差异可能较大,因此,AT P收稿日期:1998-07-02作者简介:陈国潮(1969)),男,浙江绍兴人,浙江大学环境与资源学院硕士,主要从事微生物学,土壤生物和生物化学方面的教学和科研工作.第30卷第6期1999年12月 土 壤 通 报Chinese Journal of Soil ScienceVol.30,No.6Dec.,1999与土壤微生物量的转换系数需重新测定113,15,162;(3)土壤P素状况也可能影响AT P测定;(4)A T P测定所需的荧光素-荧光素酶试剂较为昂贵,以及测定过程的复杂性一定程度上影响了该法的普及1142.113底物诱导呼吸法该法首先是由Anderson和Domsch于1978年提出的1172.其基本原理是通过加入足够量的底物(葡萄糖),诱导土壤微生物达到最大呼吸速率.根据土壤最大呼吸速率与土壤微生物量之间存在线性相关,可以快速测定土壤微生物量.Anderson等测得土壤微生物量与呼吸释放的CO2量之间的相关性可以方程C mic (L g#g-1)=40192(L lCO2#g-1h-1)+1219表示1172.该法的特点及注意事项:(1)该法适用的土壤范围较广,但测定值受土壤pH及含水量的影响.由于碱性土壤对产生的CO2吸收较多,常使测定结果偏低118,192,Chen和Colemn建议采用气体连续流动系统来减少CO2的损失1192;土壤培养期间的含水量调整到120%田间持水量被认为是比较合适的192.(2)土壤呼吸速率必须在加入葡萄糖之后1~2小时内测定,时间过长,微生物增殖,会使结果偏高.(3)对每个待测土壤必须先做一个预备试验,以确定达到最大呼吸速率所需的最少葡萄糖量.114熏蒸培养法该法是由Jenkinson和Powlson于1976年提出的1202.其基本过程为:调节新鲜土样含水量至50%田间持水量,25e预培养7~10天,经氯仿熏蒸24小时后,抽尽氯仿,接种少量新鲜土样,进行好气培养10天,收集、测定培养期间释放的CO2.根据熏蒸和未熏蒸土样释放CO2量的差值,计算出土壤微生物量C (C mic).采用计算公式:C mic=F c/K c,F c为熏蒸和未熏蒸土样释放CO2量之差;K c为F c y C mic的转换系数,可通过纯培养试验获得117,202,也可通过同位素标记法测得1212.不同试验测得的K c不尽相同117,20,212,但根据大部分测定结果,K c为0145较合宜,应用于不同土壤不致于出现大的误差.熏蒸培养法不仅可以测定微生物量C,还可测定微生物量N.操作步骤类同,只是在好气培养10天后,用015mol/L K2SO4浸提,测定提取液中N量.计算公式为N mic=F N/K N,F N为熏蒸与未熏蒸土样提取液含N量之差,K N为转换系数,常采用01681222.该法局限性主要是不适于风干土样土壤微生物量测定1232;对游离CaCO3含量高的土壤1242、淹水土壤、pH<415的土壤以及新近施过有机肥或绿肥的土壤125-272,其测定结果均不可靠.115熏蒸提取法该法首先是由Brookes等于1982年和1985年提出并用于土壤微生物量P和N的测定128,292.之后, V ance等于1987年首次将该法用土壤微生物量C的测定,并表明该法与熏蒸培养法测定值之间有良好的线性相关1302.熏蒸提取法的基本过程为:调节新鲜土样含水量至50%田间持水量,25e下培养10天,氯仿熏蒸24小时后,抽尽氯仿,根据所测对象不同选择不同的提取剂浸提,测定浸提液中成份含量.表1显示测定不同土壤微生物物质所采用的条件及计算公式.表1熏蒸提取法测定土壤微生物物质常用提取条件及计算公式128-362测定指标提取剂土/液比计算公式**K(转换系数)微生物量C0.5mol/L K2SO41B4C mic=E C/K EC0.45或0.38*微生物量N0.5mol/L K2SO41B4N m ic=E N/K EN0.54微生物量P0.5mol/L NaHCO31B4P mic=E P/K EP0.40微生物量S10mm ol/L CaCl21B2S0m ic=E S/K ES0.35*若用氧化滴定法测定提取液中有机C,K EC采用01381252;若用自动分析仪测定,KE C采用01451322.**E i(i代表C、N、P或S)表示熏蒸与未熏蒸土样提取液中所测成份含量之差熏蒸提取法与熏蒸培养法相比有以下优点:(1)测定周期短,无需进行熏蒸后的10天好气培养,适宜大批量样品的快速测定;(2)一次提取可同时测定微生物C和微生物N;(3)不仅可测土壤微生物C和N,还可测定土壤微生物量P和S;(4)适用土壤范围广,可以测定酸性、中性、渍水土壤以及新近施过有机肥土壤的微生物量1272.综上五种测定方法,直接镜检法、A T P分析法和底物诱导呼吸法实质是可用来测定土壤微生物量C;熏蒸培养法则不仅可测定土壤微生物量C,还可测定土壤微生物量N;而熏蒸提法除了可测土壤微生物量C和N外,还可测定土壤微生物量P和S.2熏蒸提取法在红壤上的应用前景熏蒸提取法的问世为土壤微生物量测定提供了一种简便、快速、可靠的方法,该法克服了熏蒸培养法及其它几种方法的局限,在今后土壤生物科学的研究领域中具有广泛的应用前景.然而,该法毕竟是国外学者在温带中性土壤上建立起来的,并非十分完善,要将它应用到质地与温带中性土壤差异较大的热带-亚热带酸性红壤上,还有待进一步的验证或改进.由于我国研究土壤微生物量起步较晚,对测定方法的研究更是落后于国外,目前有关这方面的报道很少,几乎可以说是一块空白.近几年来,有关土壤微生物量的报道相对较2856期陈国潮土壤微生物量测定方法现状及其在红壤上的应用多12-62,但红壤微生物量研究报道则很少,而且,作者很少考虑测定方法的适用性,其测定基本参照国外的方法,数据的可靠性和可比性值得怀疑.为此,笔者主要就熏蒸提取法测定红壤微生物量C、N、P和S作一分析和探讨.211微生物量C的测定熏蒸提取法测定红壤微生物量C基本参照Vance 等人的方法.即通过氯仿熏蒸24小时后,抽尽氯仿,用015mol/L K2SO4抽提,测定提取液中总C量.比较熏蒸与未熏蒸土样提取液含C量的差异,来估算土壤微生物量C.计算公式采用C mic=E C/K EC.E C为熏蒸与未熏蒸土样提取液中含C量之差;K EC为E C y C mic的转换系数,K EC可通过间接或直接的方法测定130,32,37-412.这里还特别值得一提的是熏蒸后的氯仿必须被抽尽,否则,氯仿本身的C素将被作为微生物C提取,使结果偏高.为了验证熏蒸提取法在红壤微生物量C测定上的适用性,笔者认为,可通过采用两种以上的方法测定红壤微生物量C,比较这些测定值之间的相关性来判断.譬如,在采用熏蒸提取法的同时可采用熏蒸培养法和底物诱导呼吸法,比较熏蒸提取法和这两种方法测定值之间的相关性.如果相关性较好,说明熏蒸提取法可以应用于红壤微生物量C的测定;反之,该法须作进一步改进.此外,由于酸性红壤与温带中性土壤在质地上存在较大差异,转换系数K EC需重新测定137-392.212红壤微生物量N的测定熏蒸提取法测定红壤微生物量N基本参照Brookes等人的方法1292.其熏蒸和提取过程同于微生物量C的测定.只是最后测定的是K2SO4提取液中的全N,可通过蒸馏法测得.熏蒸提取法测定红壤微生物量N的适用性可通过微生物量C/N比加以判断.目前,Shen1222等人测得的微生物量C/N比617较为普遍接受.由于以往测定土壤微生物量N时,很少考虑微生物释放铵态N的固定,有可能造成微生物量N测定值的偏低.为此,Y in S.X.等做了这方面研究工作,结果表明,在试验的土壤中存在不同程度的铵的固定,在对土壤微生物量N的估算时应加以校正142.同样,对于热带-亚热带酸性红壤微生物量N的测定,我们也应考虑红壤对微生物释放铵的固定,为此笔者作了研究,发现在试验的中性土壤上存在不同程度的铵的固定,而在酸性红壤中,不存在铵的固定.由此,可以认为在估算红壤微生物量N时,不需考虑铵的固定校正172.此外,转换系数K EN同样需加以重新测定142-432.213红壤微生物量P的测定熏蒸提取法测定红壤微生物量P基本参照Brookes等人的方法1282.其方法的适用性目前没有一个理想的指标加以判断.因为土壤微生物P素不象N 素那样在微生物体内稳定,常常受到环境因素的影响,如土壤本身P素状况,从已报道的文献中土壤微生物量C/P比值范围较大可以看出这一点18,33,442.因此,我们不能通过土壤微生物量C/P比来判断该法在红壤上的适用性.事实上,在验证了熏蒸提取法在测定红壤微生物C和N上的适用性之后,再来验证该法在测定红壤微生物量P的适用性,已显得不是很重要.倒是在采用熏蒸提取法测定红壤微生物量P的过程中,某些环节值得注意和改进:首先,在提取剂的选择问题上,He Z.L.等发现,现在的熏蒸提取法应用于有效P 含量高的土壤及某些酸性土壤时,其测得的土壤微生物量P明显偏低,认为采用0103mol/L N H4F-01025mol/L HCl作为提取剂比传统的015mol/L N aH-CO3更好182.其次,由于高度风化的酸性红壤具有较强的P固定能力182,在测定和估算红壤微生物量P时,应加以P的回收校正.此外,转换系数K EP也应加以重新测定.214红壤微生物量S的测定熏蒸提取法测定红壤微生物量S基本参照Sagg ar 等的方法1352.其方法的适用性同样因S素在微生物体内的易变性而不能以微生物量C/S比加以判断135,362. Wu J.等人在对土壤pH范围在317-611的土壤微生物S测定时,将提取时的土液比由过去的1B5改为1B2,提取液中的S用H2O2消化、离子色谱仪测定,证明了熏蒸提取法在这些酸性土壤上的适用性1362.由于热带-亚热带酸性红壤pH大多在上述范围内,我们可以参照其方法来测定红壤微生物量S;同时,由于酸性红壤对硫酸根有较强的吸附能力,传统的10mmol/L CaCl2作为提取剂是否合适值得进一步研究.我们可采用几种不同提取剂加以比较,选出理想的提取剂.同样,由于土壤质地的不同或提取剂的改变,转换系数K ES也应重新测定.参考文献[1]林先贵.土壤微生物学的研究进展和研究方向[J].土壤,1991,23(4):210~213.[2]刘生浩,丸本卓哉.熏蒸直接提取法测定生物量C的研究[J].土壤,1993,25:220~222.[3]王昕,黄天素.土壤微生物生物量抽提检定法的研究)土壤微生物生物C的烘杀抽提容量法检定[J].土壤学报,1991,28(4):434~438.[4]YIN S X,QIN C M et al.Pedosphere[J],1994,4(4):321~329.[5]YIN S X,TANG Y et al.Pedosphere[J],1997,7(2):127~132.[6]WANG YAN,SHEN QIRONG et al.Pedosphere[J],286土壤通报30卷1996,6(3):265~272.[7]CHEN GUOCHAO,HE ZHENLI et al.Pedosphere[J],1997,7(1):87~91.[8]HE Z L,ODONNEIL A G et al.Soil Biology[J],&Bio-chemistry(i n press),1998.[9]JENKINSON D S,LADD J N.,Soi l Biochemistry[M],V.3Paul E. A.&Ladd J.N.(eds),M arcel Kckker INC,New York,1981.[10]ST EVENSON.Cycles of soil carbon,nitrogen,phospho-rus,sulfur,micronutrients[M].Johm W iley&Sons,INC,New Ycrk,1985.[11]SM ITH J L,PAU L E A.T he significance of soil micro-bial biomass estimations[M],In Soi l Biochemistry V.6,JeanM arc Bollag&G Stotzky(eds)M arcel Dekker,INC.New York,1991,359~396.[12]JE NHINSON D S,DAVIDSON S A et al.Soil Biology&Biochemistry[J],1979,11B521~527.[13]OADES J M and JENKINSON D S,Soil Biology&Bio-chemistry[J],1979,11:201~204.[14]JE NKINSON D S and OADES J M,Soil Biology&Bio-chemistry[J],1979,11:193~199.[15]VERS TRACTE W,VAN DE WERF H et al,S oil Biolo-gy&Biochemistry[J],1983,15:391~396.[16]VERSTRACTE L M J,DE CONINCK K et al,Soil B-iology&Biochemistry[J],1983,15:397~402. [17]ANDERSON J P E and DOM SCH K H.Soil Biology&Biochemistry[J],1978,10:215~221.[18]M ARTENS R.Soil Biology&Biochmistry[J],1987,19:77~81.[19]CHENG W EIXIN and DAVID C COLEM AN.Soil Bio-logy&Biochemistry[J],1989,21:385~388.[20]JENKINSON D S and POW IS ON D S.Soil Biology&Biochemistry[J],1976,8:209~213.[21]VORONEY R P and PAUL E A.Soi l Biology&Bio-chemistry[J],1984,16:9~14.[22]SHEN S M,PRUDEN G et al.Soil Bi ology&Biochem-istry[J],1984,16:437~444.[23]SHEN S M,BROOKES P C et al.Soil Biology&Bio-chemistry[J],1987,19:153~158.[24]BROOKES D C,OCIO T A et al.Soil M icroorganisms[J],1990,35:39~51.[25]VANCE E D,BROOKES P C et al.Soil Bi ology&Bio-chem i stry[J],1987,19:689~696.[26]VANCE E D,BROOKES P C et al.Soil Bi ology&Bio-chem i stry[J],1987,19:697~702.[27]OCIO J A and BROOKES P C.Soil Biology&Bio-chemisty[J],1990,22:685~694.[28]BROOKES P C,POW ISON et al.Soil Biol ogy&Bio-chemistry[J],1982,14:319~329.[29]BROOKES P C,LANDM AN A et al.S oil Biology&Biochemistry[J],1985,17:837~842.[30]VANCE E D,BROOKES P C et al.Soil Bi ology&Bio-chem i stry[J],1987,19:703~707.[31]TAKE K R,ROSS K J et al.Soil Biology&Biochem-i stry[J],1988,20:329~335.[32]WU J,JOERGENSEN R G et al.Soil Biol ogy&Bio-chem i stry[J],1990,22:1167~1169.[33]HEDLEY M J and S TEWART J W B.Soil Biology&Biochemistry[J],1982,14:377~385.[34]M CLAUGHLIN M J,AIST ON A M et al.Soil Biology&Bioch emistry[J],1986,18:437~443.[35]SAGGAR S,BET TANY J R et al.S oil Biology&Bio-chemistry[J],1981,13:493~498.[36]WU J,O.DONNELL A G et al.Soil Biology&Bio-chemistry[J],1994,26:117~125.[37]SPARLING G P and WEST A W.Soil Biology&Bio-chemistry[J],1988,20:337~343.[38]ROSS D J.Soil Biology&Biochemistry[J],1989,21:767~772.[39]SPARLING G P and WEST A W.Soil Biology&Bio-chemistry[J],1989,21:245~253.[40]SPARLING G P,FELTHAM C W et al.Soi l Biology&Bioch emistry[J].1990,22:301~307.[41]JOERGENSEN R G.Soil Biology&Biochemistry[J],1996,28:25~31.[42]DAVIDSON E A,ECKERT R W et al.Soil Biology&Biochem i stry[J],1989,21:773~778.[43]JOERGENSEN R G,POWLSON D S et al.S oil Biology&Biochemistry[J],1996,28:33~37.[44]BROOKES P C,POW LSON D S et al.Soil Bi ology&Biochem i stry[J],1984,16:169~175.2876期陈国潮土壤微生物量测定方法现状及其在红壤上的应用。