山东省烟台市2016-2017学年高二6月月考化学试题word版有答案AqwAHK
- 格式:doc
- 大小:297.50 KB
- 文档页数:9
山东省烟台第十四中学2015-2016学年高二下期6月月考化学试卷(解析版)1.能说明常温下二氧化硅是很坚硬的固体而二氧化碳是气体的原因是()A.硅的非金属性比碳的活泼B.二氧化硅中硅氧键的类型和二氧化碳中碳氧键不同C.硅氧键的键能比碳氧键的键能大得多D.二氧化硅晶体类型和二氧化碳晶体不同【答案】D【解析】本题比较两种晶体的物理性质,应该从晶体所属类别入手。
由于SiO2是一种空间网状结构的原子晶体,而CO2是靠分子间作用力结合在一起的分子晶体,因此SiO2晶体的熔沸点高、硬度大,而二氧化碳的熔沸点低。
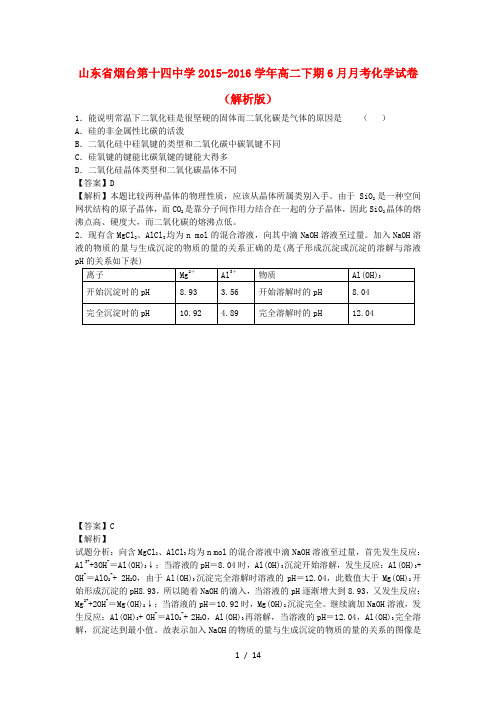
2.现有含MgCl2、AlCl3均为n mol的混合溶液,向其中滴NaOH溶液至过量。
加入NaOH溶液的物质的量与生成沉淀的物质的量的关系正确的是(离子形成沉淀或沉淀的溶解与溶液pH的关系如下表)离子Mg2+Al3+物质Al(OH)3开始沉淀时的pH 8.93 3.56 开始溶解时的pH 8.04完全沉淀时的pH 10.92 4.89 完全溶解时的pH 12.04【答案】C【解析】试题分析:向含MgCl2、AlCl3均为n mol的混合溶液中滴NaOH溶液至过量,首先发生反应:Al3++3OH-=Al(OH)3↓;当溶液的pH=8.04时,Al(OH)3沉淀开始溶解,发生反应:Al(OH)3+ OH-=AlO2-+ 2H2O,由于Al(OH)3沉淀完全溶解时溶液的pH=12.04,此数值大于Mg(OH)2开始形成沉淀的pH8.93,所以随着NaOH的滴入,当溶液的pH逐渐增大到8.93,又发生反应:Mg2++2OH-=Mg(OH)2↓;当溶液的pH=10.92时,Mg(OH)2沉淀完全。
继续滴加NaOH溶液,发生反应:Al(OH)3+ OH-=AlO2-+ 2H2O,Al(OH)3再溶解,当溶液的pH=12.04,Al(OH)3完全溶解,沉淀达到最小值。
故表示加入NaOH的物质的量与生成沉淀的物质的量的关系的图像是C。

可能用到的相对原子质量:H l C 12 N 14 O 16 S 32 C135.5 Na 23 Mg 24 Al 27 Si 28 Fe 56 Cu 64 Pb 207第I卷(选择题,共48分)1~16小题为选择题,每小题3分,共48分。
每小题只有一个选项符合题意。
1.化学与生活密切相关。
下列有关说法错误的是A.木材纤维和土豆淀粉遇碘水均显蓝色B.食用油反复加热会产生稠环芳烃等有害物质C.误食铜、铅或汞等重金属盐中毒后应立即服用大量的牛奶D.食用花生油和鸡蛋清都能发生水解反应【答案】A【解析】A.木材纤维是纤维素遇碘不不反应,而土豆淀粉遇碘水蓝色,故A错误;B.食用油反复加热会生成苯并芘等稠环芳香烃物质,可致癌,故B正确;C.重金属盐可以是蛋白质变性,所以误食后会中毒,服用大量的蛋清和牛奶后,可以和重金属反应,变为不被吸收的物质,减弱对肠胃的影响,故C正确;D.食用花生油成分是油脂,鸡蛋清成分是蛋白质,油脂水解生成高级脂肪酸和甘油,蛋白质水解生成氨基酸,故D正确;故选A。
2.下列物质全部属于纯净物的是A.甘油、氯仿、乙醇钠 B.福尔马林、葡萄糖、乙酸乙酯C.苯、汽油、乙二酸 D.甘氨酸、聚氯乙烯、苯酚【答案】A3.右图是某有机物分子的比例模型,有关该物质的推断不正确的是A.该有机物的分子式为C3H6O3 B.该有机物分子中含有羟基和羧基C.该有机物可以发生消去反应 D.该有机物可以发生加成反应【答案】D4.下列说法正确的是A.蛋白质溶液中加入Na2SO4可使其变性B.蔗糖水解生成互为闻分异构体的葡萄糖和果糖C.顺—2一丁烯和反—2—丁烯的加氢产物不同D.石油的分馏和煤的于馏均属于化学变化【答案】B【解析】A.蛋白质溶液中加入Na2SO4饱和溶液,发生盐析,不是变性,故A错误;B.蔗糖和麦芽糖是二糖水解生成的葡萄糖和果糖,分子式都可用C6H12O6表示,它们互为同分异构体,故B正确;C.顺-2-丁烯和反-2-丁烯加氢的产物都是正丁烷,为同一种物质,故C错误;D.石油的分馏是物理变化,而煤的于馏属于化学变化,故D错误;答案为B。

高中化学学习材料唐玲出品山东省烟台第三中学2015-2016学年高二下期6月月考化学试卷(解析版)1.下列热化学方程式书写正确的是( )A.2SO 2+O 22SO 3 ΔH=-196.6 kJ ·mol -1 B.H 2(g)+21O 2(g)====H 2O(l) ΔH=-285.8 kJ ·mol -1 C.2H 2(g)+O 2(g)====2H 2O(l) ΔH=-571.6 kJD.C(s)+O 2(g)====CO 2(g)ΔH=+393.5 kJ ·mol -1【答案】B【解析】根据热化学方程式的书写规则,反应热单位为kJ ·mol -1。
2.下列物质中,属于纯净物的是( )A .漂白粉B .汽油C .硫酸铜D .矿泉水【答案】C【解析】漂白粉是氯化钙与次氯酸钙的混合物;汽油是各种烃的混合物;矿泉水中含多种可溶性物质,属于混合物。
3.下列离子方程式书写正确的是A.氢氧化钡溶液与稀硫酸反应 SO 42- + Ba 2+ = BaSO 4↓B.氢氧化钠溶液与稀硫酸反应 OH - + H += H 2OC.铁与氯化铁溶液反应 Fe + Fe 3+ = 2Fe 2+D.碳酸钙溶于稀盐酸中 CO 32- + 2H + = H 2O + CO 2↑【答案】B【解析】4.N A 代表阿伏加德罗常数,下列说法正确的是A .23gNa 在空气中加热完全变成Na 2O 2时失去2N A 个电子B .标准状况下,22.4LH 2含有N A 个H 2分子C .1mol/L 的硝酸钠溶液中含有的硝酸根离子数为N AD .0.5molKClO 3中含有ClO 3-的数目为N A【答案】B【解析】试题分析:A、23gNa物质的量为1mol,完全反应失去1mol电子,即N A个电子,A错误;B、标准状况下,22.4LH2物质的量是1mol,含有N A个H2分子,B正确;C、1mol/L的硝酸钠溶液,体积未知,无法求得物质的量,C错误;D、0.5molKClO3中含有ClO3-的数目为0.5N A,D 错误。

2016-2017学年度高二第二学期第三次化学月考试卷答案和解析【答案】1.C2.A3.C4.A5.B6.B7.B8.C9.B 10.D 11.C 12.D 13.D 14.B 15.A 16.2-甲基戊烷;CH2=CHCH=CH2;1,3-二甲苯;2,3-二甲基-1,3-戊二烯;CH3C(CH3)CH(CH3)CH3;CH3CH(CH3)CH2 CH(CH2CH3)CH2CH2CH32 l2=CH2;BCD;2CH3OH+2N a→2CH3ON a+H2↑;氨基酸;取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解18.;取代反应;催化剂和吸水剂;乙醇,浓硫酸,乙酸;防止暴沸;饱和碳酸钠溶液;BC;不能;防止倒吸;分液;难19.CH2=C(CH3)CH2CH3;-CHO;消去反应;C为CH3CH2C(OH)(CH3)CHO++2N a OH+C u (OH)2CH3CH2C(OH)(CH3)COON a+C u2O↓+3H2O;CH3CH=C(CH3)COOH+CH3CH2OH浓硫酸CH3CH=C(CH3)COOCH2CH3+H2O;;HCOOCH2CH2CH=CH2、20.42;3;C9H8O4;;;【解析】1. 解:根据此化合物的结构简式可知,此化学物中除了C、H两元素外,还含S元素,故不属于烃类,即既不属于烷烃,也不是烯烃,而由于此化合物中含有碳元素,故属于有机物,故选C.含有碳碳双键的烃类称为烯烃;不含碳的化合物为无机物;含碳元素的化合物绝大多数为有机物;碳原子之间均由单键相连的饱和烃为烷烃.据此分析.本题考查学生有机物和无机物的区别,可以根据所学知识进行回答,较简单,注意有机物为含碳化合物(一氧化碳、二氧化碳、碳酸、碳酸盐、金属碳化物、氰化物除外)或碳氢化合物及其衍生物的总称.2. 解:纯棉制品属于纤维素,羊毛的主要成分为蛋白质,最简单的检验方法是在火中灼热,有烧焦羽毛的气味的是蛋白质,其它方法不能鉴别或方法复杂,故选A.纯棉制品属于纤维素,羊毛的主要成分为蛋白质,根据二者的性质进行区别.本题考查常见有机物的鉴别,为高频考点,把握蛋白质的性质及检验方法为解答的关键,题目难度不大.3. 解:由结构可知,分子中含-COOC-、-OH、羰基,具有酯、酚、酮的官能团,含3种,故选C.由结构可知,分子中含-COOC-、-OH、羰基,以此来解答.本题考查有机物的官能团,为高频考点,把握有机物的结构、官能团为解答的关键,侧重分析与应用能力的考查,注意有机物的分类,题目难度不大.4. 解:有该物质中各原子个数比=N(C):N(H):N(N):N(O)=:::=6.11:3.8:0.76:0.76=8:5:1:1,实验式为C8H5NO,故选A.根据质量分数计算出原子个数比,即可写出实验式.本题考查学生利用元素的质量分数来计算得出物质的实验式,计算较复杂.5. 解:羧酸和醇反应发生酯化反应,醇提供羟基氢原子,结合生成水,其余部分互相结合成酯,向平衡CH3COOH+HOCH2CH3CH3COOCH2CH3+H2O中加入CH3CH218OH,由于酯化反应是可逆反应,反应方程式为CH3COOH+CH3CH218OH浓硫酸CH3CO18OCH2CH3+H2O,则平衡时,含有18O的物质为乙醇和乙酸乙酯中.故选B.羧酸和醇反应发生酯化反应,反应的实质是酸脱羟基醇脱氢,依据反应实质分析产物种类.本题考查了酯化反应的反应实质和反应历程,分析结构断键位置掌握物质性质是解题关键,题目难度不大.6. 解:①苯不能使酸性高锰酸钾溶液褪色,说明苯分子中不含碳碳双键,可以证明苯环结构中不存在C-C单键与C=C双键的交替结构,故①正确;②与氢气加成是苯和双键都有的性质,因此苯能在一定条件下跟H2加成生成环己烷,不能证明苯环中存在单双键交替结构,故②错误;③苯不因化学变化而使溴水褪色,说明苯分子中不含碳碳双键,可以证明苯环结构中不存在C-C单键与C=C双键的交替结构,故③正确;④苯环上碳碳键的键长相等,说明苯环结构中的化学键只有一种,不存在C-C单键与C=C 双键的交替结构,故④正确;⑤如果是单双键交替结构,邻二甲苯的结构有两种,一种是两个甲基夹C-C,另一种是两个甲基夹C=C,邻二甲苯只有一种结构,说明苯环结构中的化学键只有一种,不存在C-C单键与C=C双键的交替结构,故⑤正确;⑥无论苯的结构中是否有碳碳双键和碳碳单键,苯的间位二元取代物都无同分异构体,所以不能说明苯不是单双键交替结构,故⑥错误;⑦无论苯的结构中是否有碳碳双键和碳碳单键,苯的对位二元取代物都无同分异构体,所以不能说明苯不是单双键交替结构,故⑦错误;根据分析可知,能够证明苯环结构中不存在单双键交替结构的为:①③④⑤,故选B.①苯不能使酸性高锰酸钾溶液褪色,说明苯分子中不含碳碳双键;②与氢气加成是苯和双键都有的性质,不能证明苯环中存在单双键交替结构;③苯不因化学变化而使溴水褪色,说明苯分子中不含碳碳双键;④苯环上碳碳键的键长相等,则说明苯环结构中的化学键只有一种;⑤若苯单双键交替结构,邻二甲苯的结构有两种,一种是两个甲基夹C-C,另一种是两个甲基夹C=C;⑥根据无论苯的结构中是否有碳碳双键和碳碳单键,苯的间位二元取代物都无同分异构体来分析;⑦根据苯的结构中是否有碳碳双键和碳碳单键,苯的对位二元取代物都无同分异构体来分析.本题考查苯的结构与性质,题目难度不大,综合性较大,要求学生知识掌握全面,能运用基础知识知识分析和解决问题,明确苯的结构与性质为解答关键.7. 解:由甲烷的结构可知,四个氢原子的空间位置只有一种,则只有一种结构,中含有C-F键和C-C l键,均为极性键,所以A、C、D错误,故选B.该化合物是甲烷的取代产物,甲烷是正四面体型结构,运用知识迁移的方法,与CH4的分子构型对比回答;同种非金属之间形成非极性共价键,不同非金属元素之间形成极性共价键.本题以甲烷的正四面体型结构为载体,考查学生对知识的迁移和空间想象能力,同时考查极性键非极性键区别,难度适中.8. 解:①CH3C l只含有1个碳原子,只能发生水解反应,不能发生消去反应,故①不符合;②能发生消去反应生成丙烯,发生水解反应生成2-丙醇,故②符合;③能发生消去反应,但不能发生水解反应,故③不符合;④能发生水解反应,但与B r原子相连的碳原子的相邻碳原子上没有氢原子,所以不能发生消去反应,故④不符合;故选C.卤代烃发生消去反应的条件是:与-X相连碳的相邻碳上有氢原子的才能发生消去反应,形成不饱和键;醇发生消去反应的条件是:与-OH相连碳的相邻碳上有氢原子的才能发生消去反应,形成不饱和键;所有卤代烃均能发生水解反应,反应实质为-X被-OH取代.醇不能发生水解反应.本题考查卤代烃和醇的性质,注意发生消去反应时有机物结构上的特点为解答的关键,侧重反应类型的考查,题目难度不大.9. 解:图示中发生的化学反应可以表述为2C u+O2═2C u O,红变黑,C u O+CH3CH2OH→CH3CHO+C u+H2O,黑变红,总反应为醇的催化氧化,乙醇发生了氧化反应,产物为乙醛,催化剂为铜,因此只有B错误,故选B.图示中发生的化学反应可以表述为2C u+O2═2C u O,C u O+CH3CH2OH-→CH3CHO+C u+H2O,总反应为醇的催化氧化.本题考查醇类的催化氧化反应,难度不大.注意图中箭头指向,从图中正确获取信息.10. 解:用盛有5m L饱和N a2CO3溶液的试管收集1m L 乙酸乙酯后,沿器壁加入0.5m L紫色石蕊试液(整个过程不振荡试管),由上而下,上层乙酸乙酯中混有乙酸,可使石蕊呈红色,中层为紫色石蕊试液,下层为碳酸钠溶液,水解呈碱性,应呈蓝色,所以石蕊层为三层,由上而下呈红、紫、蓝色,故选:D.实验室用乙酸和乙醇在浓硫酸作用下发生反应制取乙酸乙酯,浓硫酸在反应中起到催化剂和吸水剂的作用,由于乙酸和乙醇易挥发,且二者与乙酸乙酯混溶,蒸汽中往往含有乙醇和乙酸,可用饱和碳酸钠吸收并分离生成物,碳酸钠溶液呈碱性,以此解答该题.本题考查乙酸乙酯的制备,题目难度不大,注意物质密度大小与酸碱性,注意乙酸和碳酸钠的性质.11. 解:A.饱和N a2SO4溶液可使蛋白质发生盐析,而在紫外线、C u SO4溶液、福尔马林等作用下,蛋白质均会发生变性,故A错误;B.油脂相对分子质量较小,不属于高分子化合物,故B错误;C.氨基酸含有氨基、羧基,可发生取代、缩聚反应,可生成二肽、多肽或蛋白质,故C正确;D.淀粉是在酸性条件下水解,葡萄糖和新制C u(OH)2悬浊液反应必须在碱性条件下,所以要用新制氢氧化铜悬浊液检验葡萄糖时要先中和酸,否则无法成功,故D错误;故选C.A.饱和N a2SO4溶液可使蛋白质发生盐析;B.相对分子质量在10000以上的有机化合物为高分子化合物;C.氨基酸含有氨基、羧基,可发生取代、缩聚反应;D.葡萄糖和新制C u(OH)2悬浊液反应必须在碱性条件下.本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意高分子的判断,题目难度不大.12. 解:取淀粉液在稀硫酸中加热后的水解液,分成两份,一份在加入银氨溶液之前加入了碱将溶液的酸性中和掉,加入银氨溶液后出现的银镜现象说明有葡萄糖存在,可以得出淀粉已经水解的结纶,淀粉在稀硫酸作用下完全水解生成葡萄糖,水解方程式为(C6H10O5)n+n H2O稀硫酸n C6H12O6,葡萄糖与银氨溶液在水浴加热条件下发生氧化还原反应,反应的方程式为CH2OH(CHOH)4CHO+2A g(NH3)2OH CH2OH(CHOH)COONH4+H2O+2A g+3NH3↑;淀粉和碘作用显示蓝色,因加入过量的氢氧化钠,碘单质能4和氢氧化钠发生氧化还原反应,所以另一份滴加碘水,发现不变蓝色,所以不知是否完全水解,故选D.取淀粉液在稀硫酸中加热后的水解液,分成两份,一份滴加碘水,发现不变蓝色,说明无淀粉,另一份先加入氢氧化钠溶液,调PH至碱性,再加银氨溶液,最后再加热,有银镜生成,说明有葡萄糖,注意加入过量的氢氧化钠,碘单质能和氢氧化钠发生氧化还原反应,据此解答.本题考查了淀粉的检验,考查了葡萄糖的检验,解答时需注意的是检验生成葡萄糖需和银氨溶液反应,但该反应必须在碱性条件下进行,题目较简单.13. 解:烷基组成通式为C n H2n+1,烷基式量为43,所以14n+1=43,解得n=3.所以烷基为-C3H7.当为正丙基,甲苯苯环上的H原子种类有3种,所以有3种同分异构体.当为异丙基,甲苯苯环上的H原子种类有3种,所以有3种同分异构体.故该芳香烃产物的种类数为6种.故选:D.根据烷基式量为43的确定烷基,再判断可能的烷基异构情况,利用等效H判断甲苯苯环上的H原子种类有3种,据此判断.考查同分异构体的书写,难度中等,关键根据烷基式量为43的确定烷基,判断可能的烷基异构情况.14. 解:A.1mol与氢气发生加成反应,消耗氢气3mol;B.1mol中含有1mol苯环、1mol C=C双键,与氢气完全加成反应消耗氢气3mol+1mol=4mol;C.1mol CH3-CH2-C≡CH含有1mol C≡C三键,与氢气完全加成反应消耗2mol氢气;D.1mol CH3(CH=CH)3CH3含有3mol C=C双键,与氢气完全加成反应消耗3mol氢气;故1mol与氢气完全加成反应消耗的氢气最多,故选B.苯环、C=C双键、C≡C三键与氢气可以发生加成反应,1mol苯环消耗3mol氢气、1mol C=C 双键消耗1mol氢气、1mol C≡C三键消耗2mol氢气,据此结合选项解答.本题考查有机物的结构与性质,涉及苯、烯、炔的加成反应,比较基础,注意理解加成反应.15. 解:C6H12O2能发生水解反应生成A和B,所以C6H12O2是酯,且只含一个酯基,B能氧化成C,B是醇,C不能发生银镜反应,则不含有醛基,B与羟基相连的碳原子上只含有1个氢原子,A能发生银镜反应,则A为甲酸,所以C6H12O2是甲酸某酯,该酯的可能结构种数取决于醇的结构,因为C5H12O属于醇的结构中,与羟基相连的碳原子上只含有1个氢原子式为结构有三种:2-戊醇、3-戊醇、3-甲基-2-丁醇,所以该酯的可能结构有3种.故选A.某有机物C6H12O2能发生水解反应生成A和B,所以C6H12O2是酯,且只含一个酯基,B能氧化成C,C不能发生银镜反应,则不含有醛基,A能发生银镜反应,则A为甲酸,B与羟基相连的碳原子上只含有1个氢原子,据此回答判断.本题是一道关于酯的水解反应的简单推断题,涉及酯、醇、和醛类物质的性质,属于综合知识的考查,难度不大.16. 解:(1):该有机物分子中最长碳链含有5个C,主链为戊烷,在2号C含有1个甲基,该有机物命名为:2-甲基戊烷,故答案为:2-甲基戊烷;(2)1,3-丁二烯,该有机物结构简式中含有2个碳碳双键,碳碳双键分别在1、3号C,其结构简式为:CH2=CHCH=CH2,故答案为:CH2=CHCH=CH2;(3)为二甲苯,在苯环的1,3号C原子上各含有1个甲基,该有机物名称为:1,3-二甲苯,故答案为:1,3-二甲苯;(4):该有机物主链为1,3-戊二烯,在2、3号C各含有一个一个甲基,该有机物命名为:2,3-二甲基-1,3-戊二烯,故答案为:2,3-二甲基-1,3-戊二烯;(5)2,2,3-三甲基丁烷,主链为丁烷,在2、3、4号C各含有一个甲基,该有机物结构简式为:CH3C(CH3)2CH(CH3)CH3,故答案为:CH3C(CH3)2CH(CH3)CH3;(6)2-二甲基-4-乙基庚烷,最长的主链含有7个C原子,甲基处于2号碳原子上,乙基处于4号碳原子上,其结构简式为:CH3CH(CH3)CH2CH(CH2CH3)CH2CH2CH3,故答案为:CH3CH(CH3)CH2CH(CH2CH3)CH2CH2CH3.(1)该有机物为烷烃,最长碳链含有5个C,主链为戊烷,在2号C含有1个甲基;(2)该有机物为二烯烃,分子中含有两个碳碳双键,碳碳双键位于1,3号C;(3)该有机物为二甲苯,甲基位于苯环的1,3号C;(4)该有机物为二烯烃,碳碳双键在1,3号C,两个甲基分别在2、3号C;(5)主链为丁烷,在2号C含有2个甲基,在3号C含有1个甲基,据此写出其结构简式;(6)该有机物主链为庚烷,在2号C含有1个甲基,在4号C含有1个乙基,据此写出结构简式.本题考查了有机物的命名及有机物结构简式的书写,题目难度中等,注意掌握常见的有机物命名原则,明确有机物结构简式的方法,试题有利于培养学生规范答题的能力.17. 解:(1)链节的主链上只有两个碳原子(无其它原子),将两半链闭合即可其单体为CC l2=CH2.故答案为:CC l2=CH2(2)由结构式可知分子式为C18H32O2,含有羧基能与甘油发生酯化反应,与氢氧化钠发生中和反应;含有碳碳双键能使酸性KM n O4溶液退色,故A错误,BCD正确.故选:BCD(3)N a和甲醇反应生成甲醇钠和氢气,反应方程式为2CH3OH+2N a→2CH3ON a+H2↑.故答案为:2CH3OH+2N a→2CH3ON a+H2↑(4)蛋白质是氨基酸通过缩聚反应形成的高分子化合物,水解得到相应的氨基酸.故答案为:氨基酸(5)淀粉若完全水解,加入碘水溶液不变蓝色,可设计方案为:取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解.故答案为:取水解后溶液加入碘水,若溶液不变蓝,证明淀粉已完全水解(1)链节上都是碳原子,一般是加聚反应得到的产物,链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半链闭合即可.(2)根据结构简式写出分子式判断,分子中含有碳碳双键决定具有烯的性质,含有羧基决定具有羧酸的性质.(3)根据乙醇与N a的反应可知,N a和甲醇反应生成甲醇钠和氢气.(4)蛋白质是氨基酸通过缩聚反应形成的高分子化合物,水解得到相应的氨基酸.(5)根据碘遇淀粉变蓝色设计.考查高聚物、官能团性质、蛋白质性质、淀粉性质等,难度不大,注意基础知识的掌握与知识的类比迁移运用.18. 解:(1)实验室用乙酸和乙醇反应制取乙酸乙酯,发生反应的方程式为:,反应类型为取代反应,浓硫酸的作用是催化剂和吸水剂;故答案为:;取代反应;催化剂和吸水剂;(2)浓硫酸的稀释是将浓硫酸加入水中,边加边搅拌,迁移到此处,即先在大试管中加入乙醇,然后慢慢向其中注入硫酸,并不断搅拌,最后向装有乙醇和浓硫酸的混合物的大试管中加入乙酸,故答案为:乙醇,浓硫酸,乙酸;(3)加入沸石的原因是防止暴沸,故答案为:防止暴沸;(4)①制备乙酸乙酯时常用饱和碳酸钠溶液吸收乙酸乙酯,目的是除去乙醇和乙酸、降低乙酸乙酯的溶解度,产物便于分层,故答案为:饱和碳酸钠溶液;BC;②导管不能插入溶液中,防止饱和碳酸钠溶液吸入反应试管中,故答案为:不能;防止倒吸;③乙酸乙酯难溶于水,可以采用分液操作,分离乙酸乙酯;故答案为:分液;难.(1)实验室用乙酸和乙醇反应制取乙酸乙酯,依据酯化反应的反应历程是羧酸脱羟基醇脱氢书写;浓硫酸的作用是催化剂和吸水剂;(2)醋酸易挥发,乙醇的密度比浓硫酸的小,类比浓硫酸的稀释进行解答;(3)加入沸石的原因是防止暴沸;(4)①饱和碳酸钠降低了乙酸乙酯的溶解度,同时还能除去混有的乙醇和乙酸;②根据导管伸入液面下可能发生倒吸分析;③分离互不相溶的液体的操作是分液.本题考查乙酸乙酯的制备,题目难度中等,涉及的题量较大,注意实验混合液的配制、饱和碳酸钠溶液的作用以及酯化反应的机理,试题培养了学生分析、理解能力及灵活应用所学知识解决实际问题的能力.19. 解:A和溴发生反应生成2-甲基-1,2-二溴丁烷,结合A的分子式知,该反应为加成反应且A结构简式为CH2=C(CH3)CH2CH3,2-甲基-1,2-二溴丁烷发生水解反应生成B,B 为HOCH2C(OH)(CH3)CH2CH3,B发生催化氧化反应生成C为CH3CH2C(OH)(CH3)CHO,C发生氧化反应生成D为CH3CH2C(OH)(CH3)COON a,D酸化得到E为CH3CH2C(OH)(CH3)COOH,F 的核磁共振氢谱有四个峰,峰的面积比为1:1:3:3,说明E发生消去反应生成F,F结构简式为CH3CH=C(CH3)COOH,溴乙烷发生水解反应生成G为CH3CH2OH,G和F发生酯化反应生成H,H结构简式为CH3CH=C(CH3)COOCH2CH3,(1)A结构简式为CH2=C(CH3)CH2CH3,A的名称(系统命名)为2-甲基-1-丁烯,故答案为:CH2=C(CH3)CH2CH3;(2)C为CH3CH2C(OH)(CH3)CHO,C中官能团的结构简式为-CHO,E→F的反应类型为消去反应,故答案为:-CHO;消去反应;(3)C为CH3CH2C(OH)(CH3)CHO,C发生氧化反应生成D为CH3CH2C(OH)(CH3)COON a,C→D的化学方程式为C为CH3CH2C(OH)(CH3)CHO++2N a OH+C u(OH)2CH3CH2C(OH)(CH3)COON a+C u2O↓+3H2O,故答案为:C为CH3CH2C(OH)(CH3)CHO++2N a OH+C u(OH)2CH3CH2C(OH)(CH3)COON a+C u2O↓+3H2O;(4)F结构简式为CH3CH=C(CH3)COOH,溴乙烷发生水解反应生成G为CH3CH2OH,G 和F发生酯化反应生成H,H结构简式为CH3CH=C(CH3)COOCH2CH3,CH3CH=C(CH3)COOH+CH3CH2OH浓硫酸CH3CH=C(CH3)COOCH2CH3+H2O,故答案为:CH3CH=CH(CH3)COOH+CH3CH2OH浓硫酸CH3CH=C(CH3)COOCH2CH3+H2O;(5)H结构简式为CH3CH=C(CH3)COOCH2CH3,H在一定条件下生成的高分子化合物的结构简式为,故答案为:;(6)F结构简式为CH3CH=C(CH3)COOH,X是F的同分异构体,它同时符合下列3个条件:①能发生水解反应,说明含有酯基;②不含甲基;③能发生银镜反应,说明含有醛基,应该为甲酸酯,则X可能的结构简式为HCOOCH2CH2CH=CH2、(写出两种),故答案为:HCOOCH2CH2CH=CH2、(写出两种).A和溴发生反应生成2-甲基-1,2-二溴丁烷,结合A的分子式知,该反应为加成反应且A 结构简式为CH2=C(CH3)CH2CH3,2-甲基-1,2-二溴丁烷发生水解反应生成B,B为HOCH2C (OH)(CH3)CH2CH3,B发生催化氧化反应生成C为CH3CH2C(OH)(CH3)CHO,C发生氧化反应生成D为CH3CH2C(OH)(CH3)COON a,D酸化得到E为CH3CH2C(OH)(CH3)COOH,F 的核磁共振氢谱有四个峰,峰的面积比为1:1:3:3,说明E发生消去反应生成F,F结构简式为CH3CH=C(CH3)COOH,溴乙烷发生水解反应生成G为CH3CH2OH,G 和F发生酯化反应生成H,H结构简式为CH3CH=C(CH3)COOCH2CH3,结合题目分析解答.本题考查有机物推断及有机合成,为高频考点,侧重考查学生分析推断及知识综合运用能力,明确物质官能团结构及其性质、物质之间的转化、反应条件、基本概念等知识点是解本题关键,采用正逆结合的方法进行推断,难点是限制性条件同分异构体结构简式确定,题目难度中等.20. 解:(1)因“1mol A水解得到1mol B和1mol醋酸”可表示为“A+H2O→B+CH3COOH”,M(A)18M(B)60质量守恒知:M(A)+18=M(B)+60,得M(A)-M(B)=42,故答案为:42;(2)从所给信息推导出A、B有如下特点:①化合物A为醋酸酯且含有羧基(A不是酚类);②化合物B的相对分子质量不超过158(200-42),氧元素的质量分数为34.8%,B分子中除有羧基外还有1个羟基(根据A推出),这样B分子至少有3个氧原子(1个羧基和1个羟基).因B分子中至少有3个氧原子,因此,其可能的最小相对分子质量为M r(B)=(16×3)/0.348,如果B分子中含4个氧原子,则M r(B)为(16×4)/0.348=184>158,结果与题意相悖,从而确定B是含有3个氧原子的羟基苯甲酸(C7H803),故答案为:3;(3)B是含有3个氧原子的羟基苯甲酸(C7H803),B的羟基与CH3COOH化合生成酯,即化合物A分子式为C9H8O4,故答案为:C9H8O4;(4)由(3)的分析可知B应为苯环上连接有-OH和-COOH的结构,则按苯环上两个取代基相对位置为邻、间、对的情况,可写出B的三种结构简式为:故答案为:.(1)根据“1mol A水解得到1mol B和1mol醋酸”可表示为“A+H2O→B+CH3COOH”,运用质量守恒来解;(2)根据所给信息推导出A、B具有的特点来解:(3)根据酯化反应的特点;(4)根据位置异构体来写结构简式.本题主要考查了有机物分子式的确定,难度中等,在解题中要注意假设法的运用.。

中学高二年级第一学期第三次月考化学试题(时间:100分钟,满分:100分)可能用到的相对原子质量:第Ⅰ卷(选择题共48分)一、选择题(本题包括16小题,每小题3分,共48分)1.下列有关化学反应能量变化的理解正确的是( )A.反应物的总能量与生成物的总能量的关系可以为前者大,后者大,或者相等B.化学反应达到平衡状态后,若不改变条件,能量不再发生变化C.盖斯定律只能计算部分化学反应的焓变,但实验可测得所有反应的焓变D.等量的钠在空气中点燃和在空气中久置两个不同条件下的焓变相等2.下列有关反应速率的说法中正确的是( )A.氢气与氮气能够缓慢反应生成氨,使用合适催化剂可以提高反应速率B.等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等C.用铁片与硫酸制备氢气时,浓硫酸可以加快产生氢气的速率D.二氧化硫催化氧化反应的ΔH<0,所以升高温度,反应速率减小3.某物质溶于水能导电,且该物质属于非电解质,溶于水时化学键被破坏的是( ) A.液溴 B.干冰 C.蔗糖 D.硫酸钡4.下列各种情况下能大量共存的离子组为( )A.pH=7的溶液中:Fe3+、Cl-、Na+、NO-3B.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、CO2-3、Cl-、K+C.pH=1的溶液中:NH+4、Cl-、Mg2+、SO2-4D.Al3+、HCO-3、I-、Ca2+5.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( ) A.电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=== Cl2↑B.氢氧燃料电池的负极反应式:O2+2H2O+4e-=== 4OH-C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=== Cu2+D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+6.可逆反应:2HI(g)H2(g)+I2(g) ΔH>0,在密闭容器中进行,当达到平衡时欲使混合气体的颜色加深,应采取的措施是( )A.减小容器体积 B.降低温度 C.加入催化剂 D.充入H27.已知氟化氢气体中有平衡关系:①2H3F3(g)===3H2F2(g) ΔH1=a kJ·mol-1②H2F2(g)===2HF(g) ΔH2=b kJ·mol-1已知a、b均大于0,则可推测反应:H3F3(g)===3HF(g)的ΔH3=( )A.(a+b) kJ·mol-1 B.(a-b) kJ·mol-1C.(a+3b) kJ·mol-1 D.(0.5a+1.5b) kJ·mol-18.某烃的结构简式如下:,该烃的正确命名是( )A.2甲基4异丙基戊烷 B.2,4,5三甲基己烷C.2,3,5甲基己烷D.2,3,5三甲基己烷9.下列说法中正确的是( )A.芳香烃的通式为C n H2n-6(n≥6)B.苯的同系物是分子中只含一个苯环的所有烃类化合物C.苯和甲苯都不能使酸性高锰酸钾溶液退色D.苯和甲苯都能与卤素单质、硝酸等发生取代反应10.下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )①溴水中存在化学平衡:Br2+H2O HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅②铁在潮湿的空气中易生锈③二氧化氮与四氧化二氮的平衡体系,增大压强后颜色加深④合成氨反应,为提高氨的产率,理论上应采取降低温度的措施⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)K(g)+NaCl(l)⑥反应CO(g)+NO2(g)CO2(g)+NO(g)(正反应为放热反应),达到化学平衡后,升高温度体系的颜色加深A.①④ B.②③ C.②⑥ D.②③⑥11.分子式为C4HCl9的同分异构体共有(不考虑立体异构)( )A.2种 B.3种 C.4种 D.5种12.用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作会引起测量结果偏高的是( )①用天平称量NaOH固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡②在配制烧碱溶液时,将称量后的NaOH固体溶于水,立即移入容量瓶,将洗涤烧杯的液体注入容量瓶后,加蒸馏水至刻度线③中和滴定时,锥形瓶内有少量水④酸式滴定管用蒸馏水洗后,未用标准液润洗⑤读取滴定管终点读数时,仰视刻度线A.①②③ B.②④⑤ C.③④⑤ D.①②③④⑤13.1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。

山东高二高中化学月考试卷班级:___________ 姓名:___________ 分数:___________一、选择题1.有机物的正确命名为A .2-乙基-3,3-二甲基-4-乙基戊烷B .3,3-二甲基-4-乙基戊烷C .3,3,4-三甲基己烷D .2,3,3-三甲基己烷2.在下列各组物质中,属于同系物的一组是 A .1,1-二氯乙烷和1,2-二氯乙烷 B .苯和甲苯 C .乙二醇和丙三醇D .乙烯和丙炔3.有关物质的分类,下列说法正确的是 A .CH 3CH (CH 3)2属于链状化合物 B .属于芳香族化合物 C .属于脂环化合物D .属于芳香烃4.下列各组物质不属于同分异构体的是 A .2,2-二甲基丙醇和2-甲基丁醇 B .邻氯甲苯和对氯甲苯 C .2-甲基丁烷和戊烷 D .乙醇和乙醚5.分子式为C 5H 11Cl 的同分异构体共有(不考虑立体异构) A .6种 B .7种 C .8种D .9种6.下列表达式错误的是 A .甲烷的电子式:B .乙烯的结构简式为:CH 2CH 2C .丙烷的球棍模型为:D .苯的比例模型为:7.下列说法中错误的是A .1mol CH 2=CH 2可以与Br 2发生加成反应,消耗1 mol Br 2B .苯的邻位二元取代物只有一种,可以说明苯分子不具有碳碳单键和碳碳双键的交替结构C .甲苯中所有原子都在同一平面内D .苯乙烯与立方烷()互为同分异构体8.下列反应不属于消去反应的是A .CH 3CH 2OHCH 2=CH 2↑+H 2OB .CH 3CHBrCH 3+NaOH CH 3CH =CH 2↑+NaBr+H 2OC .D .2CH 3OHCH 3-O-CH 3+H 2O9.在分子中,位于同一平面上的原子数最多可能是 A .17个B .18个C .19个D .20个10.下列各组化合物中,不论二者以何种比例混合,只要总质量一定,则完全燃烧时消耗O 2和生成的H 2O 的质量不变的是 A .C 2H 2 C 6H 6 B .C 2H 6 C 3H 6 C .C 2H 4 C 3H 4 D .C 2H 4 C 2H 5OH11.为了鉴定卤代烃中所含有的卤素原子,现有下列实验操作步骤。
山东高二高中化学月考试卷班级:___________ 姓名:___________ 分数:___________一、选择题1.下列物质中,不属于醇类的是() A .C 4H 9OH B .C 6H 5CH 2OHC .C 6H 5OHD .甘油2.等质量的下列有机物完全燃烧,消耗O 2最多的是 A .CH 4 B .C 2H 4C .C 2H 5OHD .CH 3CHO3.某烃不与溴水反应,能使酸性高锰酸钾溶液褪色,在Fe 存在下与Cl 2反应,能生成两种一氯代物,该烃是() A .CH≡C -CH 3 B .对二甲苯 C .D .4.某有机物其结构简式如下图,关于该有机物下列叙述不正确的是A .能与NaOH 的醇溶液共热发生消去反应B .能使溴水褪色C .一定条件下,能发生加聚反应D .一定条件下,能发生取代反应5.某芳香烃的分子式为C 10H 14,不能使溴水褪色,但可使酸性高锰酸钾溶液褪色,分子结构中只含有一个侧链烃基,则此侧链烃基的结构共有() A .2种 B .3种 C .4种 D .5种6.有机物分子中原子(或原子团)之间的相互影响会导致他们化学性质的改变。
下列叙述能说明上述观点的是() A .等物质的最的乙二醇和乙醇分别与足量金属钠反应,乙二醇产生的氢气多 B .乙烯和苯都能和氢气发生加成反应 C .乙烯可发生加成反应,而乙烷不能D .苯酚能与氢氧化钠溶液反应,而乙醇不能7.某烃与氢气发生反应后能生成(CH 3)2CHCH 2CH 3,则该烃不可能是() A .2 -甲基-2-丁烯 B .3-甲基-1-丁烯 C .2,3–二甲基-1-丁烯 D .3-甲基-1-丁炔8.某有机化合物的结构简式如下,此有机化合物属于()①烯烃②多官能团有机化合物③芳香烃④烃的衍生物⑤高分子化合物 A .①②③④ B .②④ C .②④⑤D .①③⑤9.某气态烃0.5mol 恰好与1 molHC1加成,1 mol 生成物又可与3 mol Cl 2发生取代反应,则此烃可能是() A .C 2H 2 B .CH 2=CHCH=CH 2 C .CH≡C -CH 3 D .CH≡C -CH 2-CH 310.某烃的分子式为C 11H 20,lmol 该烃在催化剂作用下可以吸收2molH 2;用酸性KMnO 4溶液氧化,得到丁酮()、丙酮()和琥珀酸()三者的混合物,该烃的结构简式为11.两种气态烃的混合物共2.24L(标准状况),完全燃烧后得3.36L 〔标准状况)二氧化碳和2.7g 的水,下列说法中正确的是()A .混合气体中一定含有乙烯B .混合气体中一定含有甲烷C .混合气体中一定含有乙炔D .混合气体一定是由烷烃和烯烃构成的混合物12.一种形状像布袋结构的烯烃分子Bowtiediene ,其形状和结构如图所示,有关该分子的说法不正确的是A .该烯烃的分子式为C 5H 4B .该分子所有碳原子在同一平面C .1mol 该有机物最多可与2molBr 2发生加成反应D .与其互为同分异构体且只含叁健的链烃不止一种13.有A 、B 两种烃,所含碳元素的质量分数相同,关于A 和B 叙述中正确的是 A .二者不可能是同系物 B .二者一定是同分异构体 C .二者最简式相同D .各1mol 的A 和B 分别燃烧生成CO 2的质量一定相等14.卤代烃RCH 2CH 2X 分子中的化学键如图所示,则下列说法正确的是A .当该卤代烃发生水解反应时,被破坏的键是①和③B .当该卤代烃发生水解反应时.被破坏的键是①C .当该卤代烃发生消去反应时,被破坏的键是①和④D .当该卤代烃发生消去反应时,被破坏的键是①和②15.下列有机物的命名正确的是 A .2一甲基-3一丁烯 B .乙苯 C .2一甲基丁烷D .1一甲基乙醇16.己知C—C键可以绕键轴自由旋转,结构简式为的烃,下列说法中正确的是A.分子中至少有9个碳原子处于同一平面上B.分子中至多有26个原子处于同一平面上C.该烃能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色D.该烃属于苯的同系物17.对于有机物,下列说法中正确的是A.它是苯酚的同系物B.1mol该有机物能与溴水反应消耗2molBr2发生取代反应C.1mol该有机物能与金属钠反应产生0.5molH2D.1mol该有机物能与2molNaOH反应二、填空题1.如图是由4个碳原子结合成的6种有机物(氢原子没有画出)。
2016-2017学年第二学期6月高二化学测试卷一.选择题(本题包括20小题,每小题2分,共40分;每个小题只有一个选项符合题意,请将答案填入答题卡)1.官能团是决定有机物性质的原子或原子团。
下列物质的类别与所含官能团都正确的是( )D .CH 3—O —CH 3 醚类2.下列各组物质不.属于同分异构体的是( )A .2,2二甲基丙醇和2甲基丁醇B .邻氯甲苯和对氯甲苯C .2甲基丁烷和环戊烷D .乙醇和甲醚 3. 下列有机物命名正确的是( )A . 1,3,4-三甲苯B . 2-甲基-2-氯丙烷C . 2-甲基-1-丙醇D . 2-甲基-3-丁炔4.某烃的一种同分异构体只能生成一种一氯代物,该烃的分子式可以是( )A .C 3H 8B .C 4H 10C .C 5H 12D .C 6H 14 5.四联苯的一氯代物有( )A .3种B .4种C .5种D .6种6.分子式为C 5H 10O 2并能与饱和NaHCO 3溶液反应放出气体的有机物有(不含量立体异构)( )A .3种 B .4种 C .5种 D .6种7、某烯烃与H 2加成后的产物是, 则该烯烃的结构式可能有( ) A .1种B .2种C .3种D .4种8.下列物质中各含有少量的杂质,能用饱和碳酸钠溶液并借助于分液漏斗除去杂质的是( )A .苯中含有少量甲苯B .乙醇中含有少量乙酸C .溴苯中含有少量苯D .乙酸乙酯中含有少量乙酸9.下列物质:①乙烷②苯③聚乙烯④聚氯乙烯⑤2-丁炔⑥环己烷⑦邻二甲苯⑧3-甲基-1-戊烯,其中能使KMnO4酸性溶液褪色,也能与溴水发生化学反应而褪色的是()A.⑤⑧ B.⑤⑦⑧ C. ③⑤⑦ D.④⑤⑦10.有一种新合成的烃称为立方烷,它的碳架结构如图所示,关于它的说法不正确的是( )A.它的分子式是C8H8B.它与苯乙烯是同分异构体C.它不能发生加成反应D.它的二氯取代物共有4种11.某含氧有机化合物,它的相对分子质量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,经红外光谱测定含有一个羟基,核磁共振氢谱显示该分子中有3个甲基。
山东高二高中化学月考试卷班级:___________ 姓名:___________ 分数:___________一、选择题1.从海水中提取的溴占世界产溴量的1/3。
已知溴水呈橙色,将SO 2气体通入溴水时,可以观察到溴水褪色。
则下列有关叙述中正确的是( )A .SO 2使溴水褪色,显示了SO 2的漂白性B .SO 2是形成酸雨的唯一原因C .从溴水中提取单质溴,可以用乙醇进行萃取D .SO 2使溴水褪色,显示了SO 2的还原性2.某些化学试剂可用于净水。
水处理中使用的一种无机高分子混凝剂的化学式可表示为[Al 2(OH)n Cl m ·yH 2O]X ,式中m 等于( ) A .6-n B .3-n C .6+n D .3+n3.下列冶炼金属的对应关系中错误的是( )4.从植物花中可提取一种简写为HIn 的有机物,它在水溶液中因存在下列平衡:HIn(溶液,红色) H +(溶液)+In -(溶液,黄色) 而用作酸碱指示剂。
往该溶液中加入Na 2O 2粉末,则溶液颜色为( ) A .黄色变浅 B .红色变深 C .褪为无色 D .黄色变深5.某反应的反应过程中能量变化如右图所示(图中E 1表示正反应的活化能,E 2表示逆反应的活化能)。
下列有关叙述正确的是( )A .该反应为放热反应B .催化剂能降低反应的活化能C .催化剂能改变反应的焓变D .逆反应的活化能大于正反应的活化能6.已知氢气在氯气中燃烧时产生苍白色火焰。
在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q 1KJ ,破坏1 mol 氯气中的化学键消耗的能量为Q 2KJ ,形成1 mol 氯化氢中的化学键释放的能量为Q 3KJ ,则下列关系式中一定正确的是( ) A .Q 1+Q 2<2Q 3 B .Q 1+Q 2>2Q 3 C .Q 1+Q 2<Q 3 D .Q 1+Q 2=Q 37.一种“即食即热型快餐”适合外出旅行时使用。
山东高二高中化学月考试卷班级:___________ 姓名:___________ 分数:___________一、选择题1.甲烷中混有乙烯,欲除去乙烯得到纯净的甲烷,最好依次通过盛有哪些试剂的洗气瓶A.澄清石灰水、浓H2SO4B.酸性KMnO4溶液、浓H2SO4C.溴水、浓H2SO4D.浓H2SO4、酸性KMnO4溶液2.下列有机物的命名正确的是A.4, 4, 3-三甲基己烷B.2-甲基-4-乙基-1-戊烯C.3-甲基-2-戊烯D.2, 2-二甲基-3-戊炔3.下列说法不正确的是A.C2H6和C4H10一定是同系物B.C2H4和C4H8一定是同系物C.C3H6不只表示一种物质D.烯烃中各同系物中碳的质量分数相同4.以下物质;①甲烷;②苯;③聚乙烯;④聚乙炔;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧苯乙烯,既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是A.③④⑤⑧B.④⑤⑦⑧C.④⑤⑧D.③④⑤⑦⑧5.已知某炔烃与卤素按物质的量为1:2发生加成反应后,生成的有机物至少需6mol的卤素单质才能把生成的有机物中的氢全部取代,则该炔烃可能是A.丙炔B.1-丁炔C.3-己炔D.2-庚炔6.下列各组有机物中,只需加入溴水就能鉴别的是A.甲苯、苯、己烯B.己炔、己烯、四氯化碳C.己烷、苯、乙醇D.己烯、苯、四氯化碳7.苯环结构中不存在C-C单键与C=C双键的交替结构,可以作为证据的是①苯不能使溴水褪色②苯不能使酸性高锰酸钾溶液褪色③苯在一定条件下既能发生取代反应,又能发生加成反应④经测定,邻二甲苯只有一种结构⑤经测定,苯环上碳碳键的键长相等,都是1.40×10-10mA.①②④⑤B.①②③⑤C.①②③D.①②8.某烃结构式如下:-C≡C-CH=CH-CH3,有关其结构说法正确的是A.所有原子可能在同一平面上B.所有原子可能在同一条直线上C.所有碳原子可能在同一平面上D.所有氢原子可能在同一平面上9.为检验某卤代烃(R—X)中的X元素,有下列实验操作:①加热煮沸;②加入AgNO3溶液;③取少量卤代烃;④加入稀硝酸酸化;⑤加入NaOH溶液;⑥冷却。
保密★启用前高二测试化学试题可能用到的相对原子质量有:H-1 C-12 N-14 O-16 Na-23 S-32 Fe-56第Ⅰ卷一、选择题(每小题只有一个正确答案,每小题3分,共45分)1.下列有机化合物的分类正确的是ABC DCH 2CH 3CH 3C H 3Cl ClCH 3COCH 3苯的同系物烃的衍生物醛醚①和互为同系物②蛋白质水解和油脂皂化都是高分子生成小分子的过程③高分子材料是由三种单体聚合而成的,该高分子材料是体型结构高分子,具有热固性④C 2H 2 和C 6H 6不论二者以何种比例混合,只要总质量一定,则完全燃烧时消耗O 2和生成的H 2O 的质量不变⑤塑料、合成橡胶和合成纤维都是合成高分子材料注意事项: 1.本试卷分第Ⅰ卷和第Ⅱ卷两部分。
第Ⅰ卷为选择题,共45分;第Ⅱ卷为非选择题,共55分,满分100分,考试时间为90分钟。
2.第Ⅰ卷共5页,请按照题目要求将选出的答案标号(A 、B 、C 、D )涂在答题卡上。
第Ⅱ卷共4页,将答案用黑色签字笔(0.5mm )写在答题卡上。
⑥棉花、蚕丝、人造丝的主要成分都是纤维素A.②③④⑤B.①③⑤C.④⑤D.①③④⑤⑥3.常温下,下列各组离子一定能在指定溶液中大量共存的是A.中性溶液中:K+、Fe3+、SO42—、Cl—B.水电离的c(H+)=1×10—13mol/L的溶液中:K+、Na+、[Al(OH)4]—、CO32—C.与Al反应能放出H2的溶液中:Fe2+、Na+、NO3—、SO42—D.+(H)wKc= 1×10—13mol/L的溶液中:K+、Cu2+、Cl—、NO3—4.下列物质中,既能与盐酸反应,又能与KOH溶液反应的是①NaHCO3②AgNO3 ③(NH4)2S ④HOOC-COONa ⑤⑥A.全部B.①②③⑤C.①③④⑤⑥D.①④⑤⑥5.迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为,以邻苯二酚为原料合成迷迭香酸的路线为下列说法正确的是A.有机物A分子中所有原子一定在同一平面上B.有机物C在浓硫酸催化下水解的一种产物是BC.有机物B可以发生取代、加成、消去、氧化反应D.1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH6.某化合物的结构式(键线式)及球棍模型如下:该有机分子的核磁共振氢谱图如下(单位是ppm)。
下列关于该有机物的叙述正确的是A.该有机物不同化学环境的氢原子有8种B.该有机物属于芳香族化合物C.键线式中的Et代表的基团为—CH3D.该有机物可以与1mol H2发生加成反应7.设N A为阿伏加德罗常数的值,下列叙述正确的是A.标准状况下,22.4 L乙烯含有的共用电子对数为5N AB.3.36 L NO2与水充分反应转移的电子数目为0.1N AC.常温常压下,5.6g环丙烷和聚乙炔的混合物中含有的碳原子数为0.4N AD.2.0gH218O与D2O的混合物中所含中子数为N A8.下列说法正确的是A.图1为实验室制备硝基苯的装置B.图2装置可以达到验证溴乙烷发生消去反应生成烯烃的目的C.图3装置可以达到验证酸性:CH3COOH > H2CO3 > C6H5OH的目的D.图4中振荡后下层为无色9.钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。
下列说法错误的是A.反应中PdCl2作氧化剂,被还原B.每转移2 mol e-时,生成1 mol XC.未知物质X为CO2,属于还原产物D.还原性:CO>Pd10.下列离子方程式的书写及评价均合理的是选项离子方程式评价A 将2 mol Cl2通入到含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2 = 2Fe3++4Cl-+I2正确;Cl2过量,可将Fe2+、I-均氧化B Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3—+OH-= BaCO3↓+H2O正确;酸式盐与碱反应生成正盐和水C 1 mol·L-1的Na[Al(OH)4]溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合:2[Al(OH)4]—+5H+= Al3++Al(OH)3↓+5H2O正确;[Al(OH)4]—与Al(OH)3消耗的H+的物质的量之比为2∶3D 过量SO2通入到NaClO溶液中:SO2+H2O+ClO-= HClO+HSO3—正确;说明酸性:H2SO3强于HClOA.B.C.D.12.用下列实验装置进行相应实验,能达到实验目的是A.用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒B.用图2所示装置蒸发掉CuCl2溶液中大部分水制得CuCl2·2H2O晶体C.用图3所示装置从乙酸和乙酸乙酯的混合液中分离得到纯净的乙酸乙酯D.用图4所示装置,用块状大理石与稀盐酸反应制取CO2气体13.实验室回收废水中苯酚的过程如右图所示。
下列分析错误的是A.操作I中苯作萃取剂B.苯酚钠在苯中的溶解度比在水中的大C.通过操作II苯可循环使用D.三步操作均需要分液漏斗14.着色剂是使食品着色的物质,可增加对食品的嗜好及刺激食欲。
红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构如图所示。
下列说法正确的是A.红斑素和红曲素互为同分异构体B.一定条件下红斑素和红曲素都能发生加聚和缩聚反应C.红斑素中含有醚键、羰基、酯基这三种含氧官能团D. 1 mol红曲素最多能与6 mol H2发生加成反应15.萤火虫发光原理如图:关于荧光素及氧化荧光素的叙述,正确的是A.均可与溴水发生取代,且均消耗3mol Br2B.荧光素有酸性、氧化荧光素无酸性C.均可与碳酸钠溶液反应D.均最多有7个碳原子共平面第Ⅱ卷二、非选择题16.(8分)高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00mL0.1000mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、。
②配制过程中玻璃棒所起的作用是。
③下列操作对实验结果的影响偏小的是(填序号)。
a.加水定容时俯视刻度线b.容量瓶内壁附有水珠而未干燥处理c.颠倒摇匀后发现凹液面低于刻度线又加水补上(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。
利用的原理为:10FeSO4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O实验时应测定的数据有:量取FeSO4溶液的体积和。
17.(13分)高分子材料M在光聚合物和金属涂料方面有重要用途,已知①磷酸的结构简式为②M的结构简式为:工业上合成M的过程可表示如下:已知:A完全燃烧只生成CO2和H2O,其蒸气密度是相同状况下氢气密度的43倍,分子中H、O原子个数比为3:1。
它与Na或Na2CO3都能反应产生无色气体。
(1)A中含有的官能团的名称是。
(2)下列说法正确的是(填字母序号)。
a.工业上,B主要通过石油分馏获得b.C的同分异构体有2种(不包括C)c.D易溶于水d.E→M的反应是缩聚反应(3)写出A+D+H3PO4→E反应的化学方程式:。
(4)F是A 的一种同分异构体,F的核磁共振氢谱显示分子中有两种不同的氢原子。
F存在下列转化关系:B(C3H6)Br2/CCl4CNaOH/水△ADH3PO4E M一定条件写出F、N的结构简式F:,N:。
写出反应①的化学方程式。
18.(8分)高锰酸钾是一种典型的强氧化剂。
完成下列填空:(1)在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:①MnO4-+Cu2S+H+―→Cu2++SO2↑+Mn2++H2O(未配平)②MnO4-+CuS +H+―→Cu2++SO2↑+Mn2++H2O(未配平)下列关于反应①的说法中正确的是______________(填字母序号)。
a.被氧化的元素是Cu和Sb.氧化剂与还原剂的物质的量之比为8∶5c.生成2.24 L (标况下)SO2,反应转移电子的物质的量是0.8 mold.还原性的强弱关系是:Mn2+>Cu2S(2)在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应。
已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被2 mol KMnO4氧化的H2O2是____________mol。
(3)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色退去。
现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:①写出一个包含上述七种物质的氧化还原反应方程式(需配平)_______________ _。
②高锰酸钾溶液与硫化亚铁固体有如下反应:10FeS+6KMnO4+24H2SO4===3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为________。
19. (14分)硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。
有关物质的部分性质如下表:物质熔点/℃沸点/℃其它性质SO2Cl2-54.1 69.1 ①易水解,产生大量白雾②易分解:SO2Cl2 SO2↑+Cl2↑H2SO410.4 338 吸水性且不易分解回答有关问题:(1)仪器A冷却水的进水口为(填“a”或“b”)。
(2)仪器B中盛放的药品是。
(3)实验时,装置丁中发生反应的离子方程式为。
(4)装置丙的作用为,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):。
20.(12分)非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:请回答下列问题:(1)非诺洛芬中的含氧官能团为(填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为。
(3)在上述五步反应中,属于取代反应的是(填序号)。
(4)B的一种同分异构体满足下列条件:Ⅰ能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:。
(5)根据已有知识并结合相关信息,写出以为原料制备的合成路线流程图(无机试剂任用)。