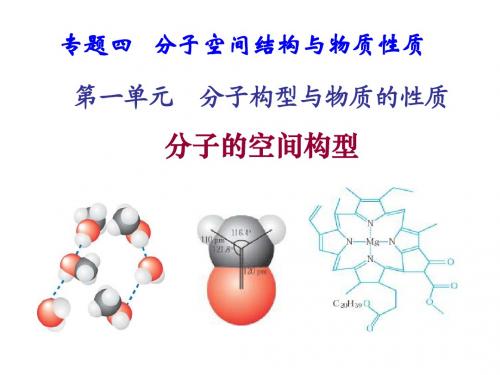
第一单元 分子的空间构型
- 格式:doc
- 大小:800.50 KB
- 文档页数:4



《分子的空间结构》说课稿尊敬的各位评委老师:大家好!今天我说课的题目是《分子的空间结构》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教学方法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析“分子的空间结构”是高中化学选修三《物质结构与性质》模块中的重要内容。
在此之前,学生已经学习了原子结构、共价键等知识,为本节内容的学习奠定了基础。
这部分内容不仅是对前面知识的深化和拓展,也为后续学习晶体结构等知识做好铺垫。
本节课主要介绍了分子的空间结构的相关概念,包括价层电子对互斥理论、杂化轨道理论等,通过这些理论来解释和预测分子的空间构型,帮助学生从微观角度理解物质的结构和性质之间的关系。
二、学情分析学生在之前的学习中已经具备了一定的原子结构和化学键的知识,但对于分子的空间结构的认识还比较模糊。
高二的学生思维活跃,具有较强的好奇心和求知欲,但抽象思维能力和空间想象力还有待提高。
因此,在教学中需要通过形象直观的方式引导学生理解抽象的概念,激发学生的学习兴趣,培养学生的思维能力。
1、知识与技能目标(1)了解价层电子对互斥理论和杂化轨道理论的基本内容。
(2)能够运用价层电子对互斥理论和杂化轨道理论解释和预测简单分子的空间构型。
2、过程与方法目标(1)通过对分子空间构型的探究,培养学生的观察能力、分析能力和归纳总结能力。
(2)通过模型构建和小组讨论,培养学生的合作学习能力和创新思维能力。
3、情感态度与价值观目标(1)让学生感受化学世界的奇妙,激发学生学习化学的兴趣。
(2)培养学生严谨的科学态度和勇于探索的精神。
四、教学重难点1、教学重点(1)价层电子对互斥理论和杂化轨道理论的基本内容。
(2)运用价层电子对互斥理论和杂化轨道理论解释和预测分子的空间构型。
(1)杂化轨道理论的理解和应用。
(2)准确判断分子的中心原子的价层电子对数。
五、教学方法为了突出重点,突破难点,实现教学目标,我将采用以下教学方法:1、讲授法:讲解价层电子对互斥理论和杂化轨道理论的基本概念和原理,使学生对新知识有初步的了解。
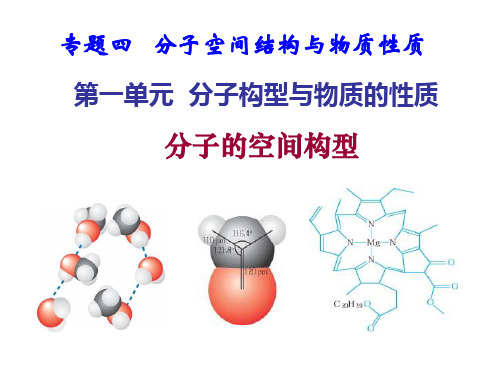
专题四分子空间结构与物质性质第一单元分子构型与物质的性质思考、分析两个问题:1.S原子与H原子结合为什么形成H2S分子,而不是H3S或H4S?答案:共价键具有饱和性,S原子最外层有两个未成对电子,故只可与两个H原子结合形成两对共用电子对,形成H2S分子,而不会形成H3S或H4S2.C原子与H原子结合形成的是CH4分子?而不是CH2或CH3?CH4 分子为什么具有正四面体的空间构型?(1)杂化轨道的形成碳原子的1个2s轨道上的电子进入2p空轨道,1个2s轨道和3个2p轨道“混合”起来,形成能量相同的4个sp3杂化轨道,可表示为(2)共价键的形成碳原子的4个sp3杂化轨道分别与四4个H原子的1s轨道重叠形成4个相同的σ键。
(3)CH4分子的空间构型甲烷分子中的4个C—H是等同的,C—H之间的夹角——键角是109.5°,形成正四面体型分子。
sp3杂化同一个原子中能量相近的一个ns轨道与三个np轨道进行混合组成四个新的原子轨道称为sp3 杂化轨道。
一、杂化轨道及其理论要点1.杂化:原子内部能量相近的原子轨道,在外界条件影响下重新组合的过程2.杂化轨道:原子轨道组合杂化后形成的一组新轨道3.轨道杂化的过程:激发→杂化→轨道重叠。
4.杂化结果①变化:轨道的能量(降低)和方向发生改变;不变:轨道数目不变②杂化轨道的电子云形状一头大,一头小。
杂化轨道增强了成键能力。
例如一个ns轨道与三个np轨道进行混合杂化后得到4个sp3 杂化轨道③常见杂化类型:sp、sp2、sp3④杂化轨道成键时应满足化学键间最小排斥,最大夹角如两个杂化轨道夹角理论上应为180°,三个杂化轨道为120°,四个为109°28′⑤杂化轨道一般用于形成σ键或容纳孤电子对。
未参与杂化的轨道上的电子可形成π键二、用杂化轨道理论解释分子的形成及分子中的成键情况1.用杂化轨道理论解释BeCl2、BF3分子的形成BF3是平面三角形构型,分子中键角均为120o;气态BeCl2是直线型分子构型,分子中键角为180o。
分子的空间构型教学案
【学习目标】
1、理解杂化轨道理论的主要内容,掌握三种主要的杂化轨道类型;
2、学会用杂化轨道原理解释常见分子的成键情况与空间构型;
3、掌握价层电子对互斥理论,知道确定分子空间构型的简易方法;
【学习重点】杂化轨道理论、价层电子对互斥理论、分子空间构型的简易方法
【学习难点】杂化轨道理论、价层电子对互斥理论
【学习方法】讲解法、归纳法
【课时安排】1课时
【教学过程】
〖你知道吗〗1、C原子与H原子结合形成的分子为什么是CH4,而不是CH2?CH4分子为什么具有正四面体结构?
2、为什么H2O分子是“V”型、键角是104.5°,而不是“直线型”或键角是“90°”?
一、杂化轨道理论(1931年,美国化学家鲍林L.Pauling提出)
基本要点:
①.成键时能级相近的价电子轨道混合杂化,形成新的价电子轨道—杂化轨道。
②.杂化前后轨道数目不变。
③.杂化后轨道伸展方向,形状发生改变。
1、CH4——sp3杂化
轨道排布式:
电子云示意图:
(1)能量相近的原子轨道才能参与杂化;
(2)杂化后的轨道一头大,一头小,电子云密度大的一端与成键原子的原子轨道沿键轴方向重叠,形成σ键;由于杂化后原子轨道重叠更大,形成的共价键比原有原子轨道形成的共价键稳定,所以C原子与H原子结合成稳定的CH4,而不是CH2。
2、BF 3 —— sp 2杂化型
用轨道排布式表示B 原子采取sp 2杂化轨道成键的形成过程:
电子云示意图:
3、气态BeCl 2—— sp 杂化型
用轨道排布式表示Be 原子采取sp 杂化轨道成键的形成过程:
电子云示意图:
【例题选讲】
例1:根据乙烯、乙炔分子的结构,试用杂化轨道理论分析乙烯和乙炔分子的成键情况。
例2:试用杂化轨理论解释石墨、苯的结构
例2:试用杂化轨理论解释石墨、苯的结构
石墨晶体
4.小结:请填写下表
表1 杂化轨道类型与杂化轨道
空间构型
二、确定分子空间构型的简易方法
价层电子对互斥理论(1941年西奇威克、吉来斯比等提出)
共价分子的几何外形取决于分子价层电子对数目和类型。
分子的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,而趋向尽可能远离以减小斥力而采取对称的空间构型。
1、推断分子空间构型的具体步骤:
对于ABm 型分子或离子,其中心原子A 的杂化轨道数恰好与A 的价电子对数相等。
对于 ABm 型分子或离子,其中心原子A 的价电子对数可依如下公式算得: 2、确定分子空间构型的简易方法
(1)对于主族元素,中心原子价电子数=最外层电子数,配位原子按提供的价电子数计算,
如:PCl 5 中52
5
15=⨯+=
n (2)O 、S 作为配位原子时按不提供价电子计算,作中心原子时价电子数为6; (3)离子的价电子对数计算 如:NH 4+ : 421415=-⨯+=
n ; SO 42- :42
2
06=++=n
例3:计算下列分子或离子中的价电子对数,并根据已学填写下表
1、NH3、H2O分子中键角分别为107°18′、104.5°,与109°28′相差不大,由此可推测,N、O原子的原子轨道可能采取何种类型杂化?原子轨道间夹角小于109°28′,可能说明了什么问题?
2、下列分子或离子中,空间构型为V型的是()
A、CS2
B、H2Se
C、HCN
D、ICl
3、下列分子中哪一个分子的空间构型为正四面体
()
A、CHCl3
B、CH3Cl
C、BBr3
D、SnCl4
4、下列分子和离子中,中心原子的价电子对几何构型
为四面体,且分子(离子)空间构型为V形的是()
A、NH4+
B、SO2
C、H3O+
D、OF2
5、下列分子中,结构构成平面三角形的是()
A、HgCl2
B、BF3
C、TeCl4
D、SF6
6、下列分子中,键角最大的是()
*A、H2S B、H2O C、CCl4D、NH3
7、下列分子中的碳原子不采取sp2杂化的是()
A、C6H6
B、石墨
C、C2H4
D、C3H8
8、下列分子的键角均是109°28′的是()
A、P4
B、NH3
C、CCl4
D、CH2Cl2
9、下列判断正确的是()
A、BF3是三角锥形分子
B、铵根离子呈平面形结构
C、甲烷分子中的4个C-H键都是氢原子的1s轨道与碳原子的p轨道形成的s-pσ键
D、甲烷分子中的4个C-H键都是氢原子的1s轨道与碳原子的4个sp3杂化轨道重叠形成的σ键
10、下列分子结构中,原子的最外层电子不能都满足8电子稳定结构的是()
A、CO2
B、PCl3
C、SiH4
D、NO2。