高一化学铝的重要化合物
- 格式:pdf
- 大小:1.29 MB
- 文档页数:9

高一铝的重要化合物知识点铝是一种重要的金属元素,广泛应用于工业生产和日常生活中。
在高一化学学习中,了解铝及其重要化合物的性质、制备方法和应用是必要的。
下面将介绍铝的重要化合物知识点。
一、氢氧化铝(Al(OH)3)氢氧化铝是一种重要的铝化合物,它具有白色固体状,是一种弱碱性物质。
氢氧化铝是通过将铝金属与氢氧化钠或氢氧化铵反应得到的。
它可作为中和剂和絮凝剂在水处理、制造纸张和药品等工业中广泛应用。
二、硫酸铝(Al2(SO4)3)硫酸铝是一种无机酸盐,也是铝的重要化合物之一。
它是无色结晶体,可溶于水。
硫酸铝可以通过将铝与硫酸反应制得。
硫酸铝广泛用于制造调味品、颜料、纸张和防腐材料等。
三、铝酸盐(如铝石和伊利石)铝酸盐是铝和硅酸根离子组成的化合物,具有各种各样的结构和性质。
其中,铝石是一种常见的铝酸盐矿石,主要由三个氧化铝和两个硅酸盐组成。
伊利石则是一种含有铝的层状硅酸盐矿物,其结构稳定,常用于陶瓷工业和建筑材料中。
四、氯化铝(AlCl3)氯化铝是一种无机化合物,是由铝和氯原子组成的化合物。
它是无色结晶体,可溶于水和有机溶剂。
氯化铝是一种重要的催化剂,在有机合成和石油加工中有着广泛应用。
五、铝氧化物(Al2O3)铝氧化物是一种无机化合物,也被称为氧化铝。
它是铝的最常见的化合物,具有白色结晶体的外观。
铝氧化物具有较高的熔点和硬度,广泛用于制备陶瓷、磨料和电子器件等。
六、铝硅酸盐纤维铝硅酸盐纤维是一种由铝和硅酸盐组成的纤维材料。
它具有轻质、高强度和耐高温性能,常用于制造隔热材料、耐火材料和复合材料等。
综上所述,铝的重要化合物包括氢氧化铝、硫酸铝、铝酸盐、氯化铝、铝氧化物和铝硅酸盐纤维等。
这些化合物在工业和日常生活中发挥着重要的作用,对于高一化学学习是必要的知识点。
通过了解它们的性质、制备方法和应用,可以更好地理解铝及其化合物的特性和用途。

高一化学必修一铝知识点归纳总结化学是一门探索物质组成、性质以及变化规律的科学,而铝作为重要的金属元素之一,在化学中扮演着重要的角色。
本文将对高一化学必修一中关于铝的知识点进行归纳总结。
一、铝的基本性质1. 原子结构:铝的原子序数为13,原子结构为2, 8, 3。
2. 物理性质:铝是一种银白色的轻金属,在常温下具有良好的延展性和导电性。
3. 化学性质:铝与氧气反应生成三氧化二铝,与非金属元素如硫、碳等反应生成相应的硫化物和碳化物等。
二、铝的制备与加工1. 制备方法:铝的主要制备方法有金属铝的电解法、熔融法和气相还原法等。
2. 加工工艺:铝可通过挤压、拉伸、锻造等加工工艺进行成型,可制备成各种形状的铝材。
三、铝的化合物1. 氧化物:铝的氧化物为三氧化二铝(Al2O3),是一种无机化合物,常见的矿石为矾土。
2. 盐类:铝与酸反应可生成相应的铝盐类化合物,如硫酸铝(Al2(SO4)3)等。
3. 氢氧化物:铝的氢氧化物为氢氧化铝(Al(OH)3),常见的形式为白色胶状物。
四、铝的应用1. 金属铝:铝是一种重要的金属材料,广泛应用于航空航天、汽车制造、建筑等领域,具有轻质、强度高、耐腐蚀等优点。
2. 铝合金:铝合金是将铝与其他金属元素进行合金化制备而成,具有较高的强度和热性能,常用于制造飞机、火箭等。
3. 铝的化合物:铝的氧化物与硅、氧化镁等化合可制备陶瓷材料,氢氧化铝则常用于药物制剂和消化剂等领域。
综上所述,铝作为一种重要的金属元素,在化学中扮演着重要的角色。
它的基本性质、制备与加工方法、化合物以及应用领域等知识点对于高一化学学习至关重要。
我们应该深入学习铝的相关知识,加深对其性质和应用的理解,为今后的学习打下坚实的基础。


第三章第二节第二课时铝的重要化合物课时跟踪训练一、选择题1.(2019•黑龙江伊春期末)下列有关铝及其氧化物与强碱溶液反应的说法中,正确的是()A.都有氢气生成B.都表现出了两性C.反应后铝元素主要以AlO了的形式存在D.反应后铝元素主要以A13+的形式存在解析:选C A12O3与强碱溶液反应产生偏铝酸盐和水,不能产生氢气,选项A不符合题意;A1与NaOH反应生成偏铝酸钠和氢气,是因为A1与溶液中的水先反应产生氢氧化铝和氢气,溶液中含有碱NaOH,再与两性物质氢氧化铝反应,产生偏铝酸钠和水,使反应进一步发生,不能说A1有两性,选项B不符合题意;A1与NaOH反应生成偏铝酸钠和氢气,氧化铝与NaOH反应生成偏铝酸钠和水,均生成偏铝酸盐,则二者反应后铝元素以A1O了的形式存在,选项C符合题意;选项D不符合题意。
故选C。
2.(2019•广西南宁期末)下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是()①C与O2②Na与O2③A1与NaOH溶液④A1C13溶液与氨水⑤CO2 与NaOH 溶液A.除③外B.除③⑤外C.除③④外D.除②外解析:选C 碳与氧气反应,氧气少量生成一氧化碳,氧气过量生成二氧化碳,反应产物与反应用量有关,①符合题意;钠与氧气反应,常温下生成氧化钠,加热生成过氧化钠,反应产物与反应条件有关,②符合题意;A1与NaOH溶液反应生成偏铝酸钠和氢气,反应产物与反应条件或用量无关,③不符合题意;氯化铝与氨水反应生成氢氧化铝沉淀和氯化铵,反应产物与反应条件或用量无关,④不符合题意;二氧化碳与氢氧化钠反应,二氧化碳少量生成碳酸钠,二氧化碳过量生成碳酸氢钠,反应产物与反应用量有关,⑤符合题意。
故选C 。
3 .(2019・陕西城固期末)下列各组中的两种物质作用时,反应物用量改变,不 会引起产物改变的是()B.Al 2(SO 4)3 和 NaOHD.Al 2O 3 和 NaOH解析:选D 足量NaOH 和CO 2反应生成碳酸钠和水,少量氢氧化钠和二 氧化碳反应生成碳酸氢钠,A 不符合;Al 2(SO 4)3和足量NaOH 反应生成偏铝酸 钠、硫酸钠和水,Al 2(SO 4)3和少量NaOH 反应生成氢氧化铝、硫酸钠,B 不符 合;Na 2CO 3和足量HCl 反应生成氯化钠、水和二氧化碳,Na 2CO 3和少量HCl 反应生成氯化钠、碳酸氢钠,C 不符合;Al 2O 3和NaOH 反应只能生成偏铝酸钠 和水,与用量无关系,D 符合。
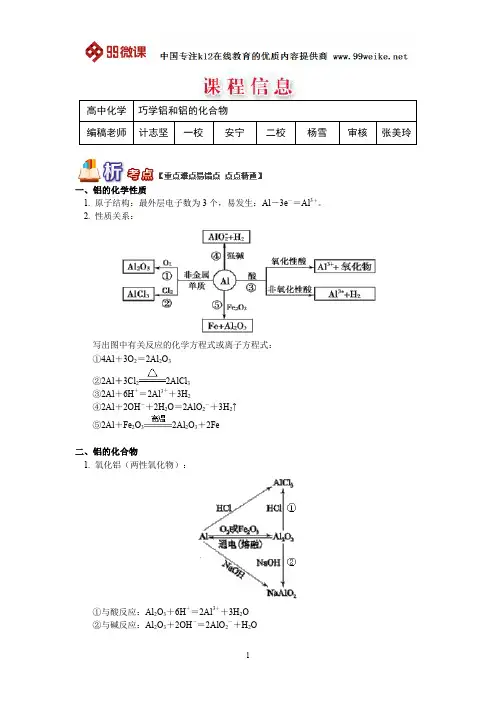
一、铝的化学性质1. 原子结构:最外层电子数为3个,易发生:Al-3e-=Al3+。
2. 性质关系:写出图中有关反应的化学方程式或离子方程式:①4Al+3O2=2Al2O3②2Al+3Cl22AlCl3③2Al+6H+=2Al3++3H2④2Al+2OH-+2H2O=2AlO2-+3H2↑⑤2Al+Fe2O32Al2O3+2Fe二、铝的化合物1. 氧化铝(两性氧化物):①与酸反应:Al2O3+6H+=2Al3++3H2O②与碱反应:Al2O3+2OH-=2AlO2-+H2O2. 氢氧化铝(两性氢氧化物)写出图中有关反应的化学方程式或离子方程式:①O H 3AlH 3)OH (Al 233+=+++ ②O H 2AlO OH )OH (Al 223+=+-- ③O H 3O Al )OH (Al 22323+∆3. 氢氧化铝的制备方法:①铝盐与氨水混合:Al 3++3NH 3·H 2O =Al (OH )3↓+3NH 4+②偏铝酸盐溶液中通入CO 2:2AlO 2-+CO 2+3H 2O =2Al (OH )3↓+CO 32-例题1 (北京理综)下列有关说法正确..的是( ) A. 用CO 2鉴别NaAlO 2溶液和CH 3COONa 溶液B. AlCl 3溶液中加入过量稀氨水:Al 3++4NH 3·H 2O =AlO 2-+4NH 4++2H 2O C. 铝罐可久盛食醋D. Al 片溶于NaOH 溶液中,产生气体:2Al +2OH -+2H 2O =2AlO 2-+3H 2↑ 解析:NaAlO 2+CO 2+2H 2O =A l (O H )3↓+NaHCO 3,而通入CH 3COONa 溶液中无现象,A 项正确;A l (O H )3只能与强碱反应,不能与弱碱反应,故B 不正确;酸性物质可腐蚀铝及铝的氧化物,故C 不正确;D 项是一个很重要的反应,正确。
答案:AD例题2 (大纲卷改编)铝是一种应用广泛的金属,工业上用Al 2O 3和冰晶石(Na 3AlF 6)混合熔融电解制得。

点燃 铝及其化合物 知识点一. 铝单质的性质1.物理性质:银白色金属,硬度和密度小,具有良好的导电导热性和延展性。
在空气中具有很好的耐腐蚀性。
2.化学性质:(1)与非金属单质反应:A 、2Al+3Cl 2====2AlCl 3B 、铝在空气中缓慢氧化,在氧气中点燃剧烈燃烧。
4Al+3O 2 ========= 2Al 2O 3铝与空气中的氧气反应生成致密的氧化膜并牢固地覆盖在铝表面,阻止了内部的铝与空气接触。
(2)与盐溶液反应:2Al+3CuSO 4 =3Cu+Al 2(SO 4)3(3)与某些氧化物反应—铝热反应:2Al + Fe 2O 3 == 2Fe + Al 2O 3 铝热剂是Al 和 Fe 2O 3(4)与沸水微弱反应:2Al+6H 2O Δ 2Al (OH )3 + 3H 2↑(5)与酸反应::2Al+6HCl ====== 2AlCl 3+H2↑2Al+3H 2SO 4 ====== Al 2(SO 4)3+ 3H2↑注意:铝在冷的浓硫酸、浓硝酸中钝化。
某些金属在常温下遇强氧化性酸如浓硫酸、浓硝酸时在表面生成致密的氧化膜,从而阻止内部金属进一步发生反应,这种现象称为钝化。
(6)与碱反应: 2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑反应的实质:分两步进行:②Al(OH)3+NaOH ======== NaAlO 2+2H 2O知识点二. 铝的重要化合物1. 氧化铝(Al 2O 3)化合价降低,被还原,得6e —①2Al+6H 2O ====== 2Al(OH)3 + 3H 2↑化合价升高,被氧化,失6e —2Al+6H 2O+2NaOH = 2NaAlO 2+3H 2↑+4H 2O失2×3 e —得6×e —(1)物理性质:白色固体、熔点高(2054℃) 、不溶于水,不与水化合。
常作耐火材料。
刚玉的主要成分是Al 2O 3 ,其中把含少量铬元素的刚玉称为红宝石;含少量的铁和钛元素的刚玉称为蓝宝石。



高一化学al的相关知识点高一化学:关于铝(Al)的相关知识点铝(Al)是我们生活中广泛应用的一种金属元素。
它的轻巧、强度高、耐腐蚀等特性,使得它在航空、建筑、包装等领域有着广泛的应用。
本文将从铝的性质、制备、化合物以及环境问题等方面,来探讨关于铝的相关知识点。
一、铝的性质1. 密度:铝的密度较低,仅为2.7 g/cm³,是一种轻金属。
因此,铝制品通常都比较轻便,适用于制作飞机零部件、轻型汽车等。
2. 导电性:铝是良好的导电材料,其电导率在金属中属于中等水平。
因此,铝制电线非常常见。
3. 耐腐蚀性:铝具有良好的耐腐蚀性,可以在空气中迅速产生一层致密的氧化铝膜,该膜可以防止物质进一步腐蚀铝本体。
4. 反射性:铝具有高反射率,特别是对于紫外线和红外线的反射性极佳。
因此,在制造反光镜、太阳能集热板等方面有着广泛应用。
二、铝的制备铝的制备主要有电解法和热还原法两种方法。
1. 电解法:通过电解铝矾土(Al2O3)的熔融物质制得铝。
铝矾土经过煅烧后转化为氧化铝,然后与熔融的氟铝狂反应,经过电解,析出纯铝。
2. 热还原法:将铝矾土与焦炭在高温下反应,生成气相的三氯化铝,然后通过金属铝与氯化铝反应,得到纯铝。
三、铝的化合物1. 氧化铝(Al2O3):氧化铝是铝最常见的氧化物,常见于铝矾土。
氧化铝是陶瓷的主要原料,也是制备金属铝的重要中间体。
2. 氯化铝(AlCl3):氯化铝是一种具有较强脱水能力的无机盐,广泛应用于有机合成反应和催化剂制备中。
3. 硫酸铝(Al2(SO4)3):硫酸铝是一种重要的工业化学品,广泛用于水处理、纺织工业和制备其他铝盐等领域。
四、铝的环境问题尽管铝在工业和生活中有着广泛的应用,但其排放和处理也会对环境造成一定的影响。
1. 铝的污染:铝制造过程中,主要会产生废气和废水,其中含有一定的氧化铝和有害金属离子。
这些废物的排放会对空气、土壤和水体造成污染。
2. 铝对生物的影响:铝离子对大多数植物和动物生命不产生直接的有害影响,但在过量暴露的情况下,铝会对一些生物体造成毒性和生长发育异常等问题。

铭叔精华品牌系列の告别版★-----高一化学方程式汇总必修1一、金属的化学性质1.钠在空气中变暗:4Na + O 2 = 2Na 2O (常温)2.钠在空气中燃烧(黄色火焰):2Na + O 2△ Na 2O 2 (艳色反应)3.钠与水反应(浮、熔、游、响、红):2Na+ 2H 2O= 2NaOH+ H 2↑4.钠与盐酸反应:2Na+2HCl = 2NaCl+H 2↑5.钠与CuSO 4溶液反应: 2Na + 2H 2O+ CuSO 4= Na 2SO 4+Cu(OH)2↓+ H 2↑6.钠在氯气中燃烧(产生白烟):2Na+Cl 2 ===== 2NaCl7.钠与硫的反应(爆炸):2Na+S ===== Na 2S 8.铝箔在氧气中剧烈燃烧: 4Al+3O 2====2Al 2O 39.铝与盐酸反应: 2Al+6HCl=2AlCl 3+3H 2↑ 10.铝与氢氧化钠溶液反应:2Al+ 2NaOH+ 2H 2O=2NaAlO 2+ 3H 2↑11.铁在氧气中燃烧: 3Fe +2O 2==== Fe 3O 412.高温下铁与水蒸气反应: 3Fe + 4H 2O(g) △ Fe 3O 4 + 4H 2二、钠的重要化合物13.氧化钠与水反应:Na 2O +H 2O =2NaOH14.氧化钠与二氧化碳反应:Na 2O+ CO 2= Na 2CO 315.氧化钠与盐酸反应:Na 2O+ 2HCl= 2NaCl+ H 2O16.过氧化钠与水反应:2Na 2O 2+ 2H 2O= 4NaOH+ O 2↑17. 过氧化钠与二氧化碳反应:2Na 2O 2+ 2CO 2=2Na 2CO 3+ O 218. 过氧化钠与盐酸反应:2Na 2O 2+4HCl= 4NaCl+2H 2O+O 2↑19. 碳酸钠与足量盐酸反应:Na 2CO 3+2HCl =2NaCl +H 2O +CO 2↑20.碳酸钠与少量盐酸反应:Na 2CO 3 + HCl =NaHCO 3 + NaCl点燃研磨点燃点燃21.碳酸氢钠与盐酸反应:NaHCO3+HCl=NaCl+H2O+CO2↑22.碳酸氢钠与氢氧化钠反应:NaHCO3+NaOH = Na2CO3+ H2O23.向饱和碳酸钠溶液中通入CO2气体会析出晶体: Na2CO3+ CO2+ H2O = 2NaHCO3 24.碳酸氢钠受热分解:2NaHCO3△Na2CO3+H2O +CO2 ↑三、铝的重要化合物25.氧化铝是两性氧化物:(1)与盐酸反应:Al2O3+6HCl= 2AlCl3+3 H2O(2)与NaOH溶液反应:Al2O3+ 2NaOH= 2NaAlO2+H2O26.氢氧化铝是两性氢氧化物:(1)与盐酸反应:Al(OH)3+3HCl=AlCl3+3H2O(1)与NaOH溶液反应:Al(OH)3+ NaOH=NaAlO2+2H2O27.实验室制A l(O H)3:Al2(SO4)3+6NH3·H2O=2Al(OH)3↓+3(NH4)2SO4 28.氢氧化铝加热分解:2Al (OH)3△Al2O3+ 3H2O29.往AlCl3溶液中逐滴加入NaOH溶液至刚好生成沉淀:3NaOH+ AlCl3=Al (OH)3↓+3NaCl继续加入NaOH溶液至沉淀溶解:NaOH +Al (OH)3=NaAlO2+2H2O30.往NaAlO2溶液中加入稀盐酸至刚好生成沉淀:HCl+NaAlO2+H2O= Al (OH)3↓+ NaCl继续加入稀盐酸至沉淀溶解:3HCl+ Al (OH)3= AlCl3+3H2O31. 向偏铝酸盐溶液中通入过量CO2:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-四、铁的重要化合物加热附加:氢氧化铁胶体的制备:FeCl3 + H2O(沸水) == Fe(OH)3 + HCl32.氯化铁与氢氧化钠溶液反应:FeCl3+3NaOH =Fe(OH)3↓+3NaCl33.硫酸亚铁与氢氧化钠溶液反应:2NaOH+ FeSO4=Fe(OH)2↓+ Na2SO434.氢氧化亚铁在空气中变质:4Fe(OH)2+O2+2H2O=4Fe(OH)335.氢氧化铁受热分解:2Fe(OH)△Fe2O3+3H2O36.氯化铁溶液中加入铁粉:Fe+ 2FeCl 3=3 FeCl 237.氯化亚铁溶液中加入氯水:Cl 2+2FeCl 2=2FeCl 338. 氧化铁与盐酸反应:Fe 2O 3+ 6HCl= 2FeCl 3+3H 2O39. 氧化亚铁与盐酸反应:FeO+2HCl=FeCl 2+H 2O40. 氢氧化铁与盐酸反应:Fe(OH)3+ 3HCl= FeCl 3+3H 2O41. 氢氧化亚铁与盐酸反应:Fe(OH)2+ 2HCl= FeCl 2+2H 2O42.氯化铁溶液中加入铜粉:Cu+2FeCl 3 =2FeCl 2 +CuCl 2第四章43. 二氧化硅与氢氟酸反应(雕刻玻璃) SiO 2 + 4HF = SiF 4↑ + 2H 2O44. 硅单质与氢氟酸反应:Si + 4HF = SiF 4 + 2H2↑ 45. 二氧化硅与氧化钙高温反应 SiO 2+ CaO == CaSiO 346. 二氧化硅与氢氧化钠溶液反应:SiO 2 + 2NaOH = Na 2SiO 3 + H 2O47. 单质硅与氢氧化钠溶液反应: Si + 2NaOH + H 2O = Na 2SiO 3 +2H 2↑48. 硅酸的制备 Na 2SiO 3 + 2HCl == H 2SiO 3(胶体) + 2NaCl49. 硅酸钠溶液通入CO 2制得胶体 Na 2SiO 3 + CO 2 + H 2O == H 2SiO 3(胶体)+Na 2CO 350. 高纯硅的制备:①二氧化硅与碳高温下反应制粗硅: SiO 2 + 2C == Si + 2CO ↑②粗硅的提纯:Si + 2Cl 2 == SiCl 4 ;SiCl 4 + 2H 2 == Si + 4HCl51. 金属铁在氯气中燃烧 3Cl 2 + 2Fe == 2FeCl 352. 金属钠在氯气中燃烧: 2Na + Cl 2 点燃 2NaCl 53. 养金鱼晒水两条方程式 H 2O + Cl 2 == HCl + HClO 2HClO ==== 2HCl + O 2↑54. 氯气的实验室制法 MnO 2 + 4HCl(浓) △ MnCl 2 + 2H 2O + C12 ↑55. 氯气通入澄清石灰水 2Cl 2 + 2Ca(OH)2 = Ca(ClO)2 + CaCl 2 + 2H 2O56. 漂白粉原理(失效原因): Ca(ClO)2 + CO 2 + H 2O = CaCO 3↓ + HClO57. 二氧化硫与水反应 SO 2+H 2OH 2SO 358. 二氧化硫与氢氧化钙溶液反应 SO 2 + Ca(OH)2 ==CaSO 3↓+ H 2O高温光照催化剂高温 点燃59. 工业制硫酸: ①二氧化硫与氧气反应 2SO 2+O 2 2SO 3 ②三氧化硫与水反应 SO 3+H 2O == H 2SO 460. 等体积的SO 2和Cl 2通入水中 Cl 2+SO 2+2H 2O == H 2SO 4 +2HCl61. SO 2通入氢硫酸溶液中 2H 2S +SO 2 == 2H 2O + 3S ↓62. 实验室制备SO 2 Na 2SO 3 + H 2SO 4 == Na 2SO 4 + H 2O + SO 2↑63. “雷雨发庄稼”涉及到的三条方程式 N 2 + O 2 ==== 2NO2NO + O 2 == 2NO 2 3 NO 2 + H 2O ==2HNO 3 + NO64. NO 2和氧气4:1比例通入水中完全变成硝酸:4NO 2 + O 2 + 2H 2O = 4HNO 365. NO 和氧气4:3比例通入水中完全变成硝酸: 4NO + 3O 2 + 2H 2O = 4HNO 366. 氨气与水反应 NH 3 + H 2ONH 3·H 2O67. 氨水受热分解:NH 3·H 2O △ NH 3↑ + H 2O 68. 氨气催化氧化(工业制硝酸) 4NH 3 + 5O 2 == 4NO + 6H 2O69. 工业合成氨 N 2 + 3H 2 2NH 3 70. 氨气实验室制法 2NH 422 + 2NH 3↑+ 2H 2O71. 氨气与氯化氢反应产生白烟:NH 3 + HCl = NH 4Cl72. 碳酸氢氨受热分解:NH 4HCO 3 △ NH 3↑ + H 2O ↑ + CO 2↑73. 硝酸铵与氢氧化钠反应:NH 4△ NH 3↑ + NaNO 3 + H2O74. 氯化铵受热分解 NH 43↑+ HCl ↑75. 氯气与氢气反应:Cl 2 + H 2 点燃 2HCl76. 硫酸铵与氢氧化钠反应:(NH 4)2SO 4 + 2NaOH △ 2NH 3↑ + Na 2SO 4 + 2H 2O77. 浓硫酸与铜反应:Cu + 2H 2SO 4(浓) △ CuSO 4 + 2H 2O + SO 2↑78. 浓硫酸与木炭反应:C + 2H 2SO 4(浓) △ CO 2 ↑+ 2SO 2↑ + 2H 2O79. 浓硝酸与铜反应:Cu + 4HNO 3(浓) = Cu(NO 3)2 + 2H 2O + 2NO 2↑80. 稀硝酸与铜反应:3Cu + 8HNO 3(稀) △ 3Cu(NO 3)2 + 4H 2O + 2NO ↑△放电或高温催化剂高温高压必修2第一章1. 锂在空气中燃烧:4Li + O 2 △2Li 2O2. 钠在空气中燃烧:2Na + O 2 △Na 2O 2 3. 钠与水反应:2Na + 2H 2O = 2NaOH + H 2↑4. 钾与水反应:2K + 2H 2O = 2KOH + H 2↑5. 镁与沸水反应:Mg+2H 2O(沸水) △Mg(OH)2+H 2↑Al 与HCl 反应: 2Al+6HCl===2AlCl 3+3H 2↑Mg 与HCl 反应: Mg+2 HCl 错误!未找到引用源。
高一化学必修一第三章知识点总结归纳高一化学必修一(一)金属的化学性质一金属的通性1.金属的存在(1)金属元素的存在绝大多数金属以化合态的形式存在于自然界中,如Al、Fe等,极少数化学性质不活泼的金属以游离态的形式存在于自然界中,如Au。
在地壳中的含量较多的为O、Si、Al、Fe、Ca。
2.金属单质的物理通性①状态:常温下,大部分为固体,唯一呈液态的是汞。
②色泽:除Cu、Au外,大多数金属为银白色,有金属光泽。
③三性:良好的导电性、导热性、延展性。
3.单质的化学性质(1)与非金属的反应常温下,镁在空气中跟氧气反应,生成一层致密的氧化物薄膜,能够阻止内部金属继续被氧化。
镁在空气中燃烧,产生耀眼的白光,生成白色固体,反应的化学方程式为:2Mg+O2点燃=====2MgO。
镁还可以和氮气点燃,反应方程式为:3Mg+N2点燃=====Mg3N2。
(2)与酸的反应Fe与稀H2SO4反应的离子方程式:Fe+2H+===Fe2++H2↑。
(3)与盐溶液的反应Cu与AgNO3溶液反应的离子方程式:Cu+2Ag+===Cu2++2Ag。
归纳金属的通性(1)金属化学性质特点(2)金属还原性的强弱取决于其失去电子的难易程度,而不是失去电子个数的多少。
【活学活用】1.判断下列说法是否正确,正确的划“√”,错误的划“×”(1)金属具有良好的导热、导电性()(2)金属单质在氧化还原反应中总是作还原剂()(3)钠原子在氧化还原反应中失去1个电子,而铝原子失去3个电子,所以铝比钠活泼()(4)金属在加热条件下均易与O2反应()答案(1)√(2)√(3)×(4)×解析(3)错误,金属的活泼性与原子失去电子个数无关,与失电子能力有关,钠比铝易失电子,钠比铝活泼;(4)错误,Au、Pt等金属不与O2反应。
二钠与氧气的反应按表中要求完成实验,并将观察到的实验现象及其原因解释填入表中。
[归纳总结]钠与氧气的反应(1)钠的性质及其保存钠是一种硬度小、熔点低的银白色的金属,具有金属光泽。
课时作业16铝的重要化合物时间:45分钟满分:100分一、选择题(每小题4分,共48分)1.(双选题)将一定量的镁铝合金放入一定量的盐酸中,合金恰好全部溶解,向所得溶液中滴加一定浓度的NaOH溶液,加入的NaOH溶液的体积(V)与沉淀质量(m)的关系如图所示。
下面说法正确的是()A.A点的沉淀是Mg(OH)2、Al(OH)3B.B点的沉淀是Mg(OH)2、Al(OH)3C.A点的沉淀是Al(OH)3D.B点的沉淀是Mg(OH)2解析:A点产生最大沉淀量。
Mg2++2OH-===Mg(OH)2↓,Al3++3OH-===Al(OH)3↓,之后再加入NaOH溶液,Al(OH)3溶解,Al(OH)3+OH-===AlO-2+2H2O,至B点时Al(OH)3溶解完全,只剩下Mg(OH)2。
答案:AD2.下列各组离子中,在强碱性溶液中能共存,且在加入盐酸过程中会产生气体和沉淀的是()A.Na+、NO-3、AlO-2、SO2-4B.Na+、Al3+、NO-3、SO2-4C.K+、Cl-、AlO-2、CO2-3D.Na+、Mg2+、Cl-、HCO-3解析:在强碱性溶液中不能共存的离子有B中的Al3+,D中的Mg2+和HCO-3,故先排除B、D;A中在加入HCl过程中不会产生气体,故A错误;C中加入HCl过程中将会有CO2气体和Al(OH)3沉淀生成。
答案:C3.甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则淀淀消失;若将丁溶液滴入甲溶液中,无明显现象发生,据此可推断丙物质是()A.Al2(SO4)3B.NaOHC.BaCl2D.FeSO4解析:由“将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失”这一现象可知,丁为NaOH,乙为Al2(SO4)3,BaCl2和FeSO4两溶液中与NaOH溶液不反应的是BaCl2溶液,所以甲为BaCl2,则丙为FeSO4。
高一化学铝篇知识点铝是一种常见的金属元素,化学符号为Al,原子序数13。
它是地壳中含量第三多的元素,仅次于氧和硅。
铝具有轻质、导电、导热、耐腐蚀等优良性质,在工业和日常生活中具有广泛的应用。
本文将为大家介绍高一化学中关于铝的知识点。
一、铝的性质1. 物理性质:铝是一种银白色金属,质轻且具有良好的延展性、导电性和导热性。
它的熔点较低,约为660°C,沸点约为2467°C。
此外,铝的密度较低,在所有常见金属中属于轻金属。
2. 化学性质:铝具有良好的耐腐蚀性,可以形成一层致密的氧化膜,防止进一步氧化。
然而,铝在酸性介质中容易被腐蚀。
铝与氧化剂反应活泼,如与氧气反应生成氧化铝。
二、铝的制取和加工1. 制取方法:铝的主要制取方法是通过电解氧化铝熔融体来制取。
工业上常用的铝电解槽通常由氟化钠和氧化铝等物质构成。
在电解槽中,通过直流电流通入,氧化铝被还原成铝金属。
2. 加工方式:铝的加工方式主要有挤压、拉伸、滚轧等。
铝可以通过这些加工方式制成各种形状,如板材、型材和线材等。
这也是铝能在工业和建筑领域得到广泛应用的原因之一。
三、铝及其化合物的应用1. 铝的应用:铝在工业制造中有广泛的应用,如飞机、汽车、船舶等交通工具制造中的结构材料。
此外,铝也用于制造厨具、建筑材料、包装材料等。
2. 氧化铝的应用:氧化铝是铝及其化合物中常见的一种。
由于氧化铝具有高熔点和耐高温性,它在耐火材料、陶瓷材料以及制造催化剂等方面有重要应用。
3. 氢氧化铝的应用:氢氧化铝是一种碱性物质,常用于制备铝盐和药品,同时也可以用作防腐剂和酸中和剂。
四、铝与环境1. 环境问题:铝是地壳中丰富的元素,但大量的铝排放会对环境造成一定的影响。
例如,酸性雨水中的铝离子对水生生物造成威胁,同时过量的铝对植物的生长也有一定的不利影响。
2. 回收利用:铝具有良好的可再生性,通过回收利用铝制品可以减少对自然资源的消耗,并减少对环境的负面影响。