第四章 免疫球蛋白共95页文档
- 格式:ppt
- 大小:2.98 MB
- 文档页数:95

第四章免疫球蛋白第一节基本概念1、抗体:B淋巴细胞在有效的抗原刺激下分化为浆细胞,产生具有与相应抗原发生特异性结合功能的免疫球蛋白,这类免疫球蛋白称为抗体。
1937年,Tiselius用电泳方法将血清蛋白分为白蛋白、α1、α2、β及γ球蛋白等组分,其后又证明抗体的活性部分是在γ球蛋白部分。
因此,相当长一段时间内,抗体又被称为γ球蛋白(丙种球蛋白)。
实际上,抗体的活性除γ球蛋白外,还存在于α和β球蛋白处。
20世纪40年代初期,Tiselius和Kabat用肺炎球菌多糖免疫家兔,证实了抗体活性与血清丙种球蛋白组分相关。
肺炎球菌多糖免疫家兔后可获得高效价免疫血清。
然后加入相应抗原吸收以除去抗体,将除去抗体的血清进行电泳图谱分析,发现丙种球蛋白(γ-G)组分明显减少,从而证明了抗体活性是存在于丙种球蛋白内。
2、免疫球蛋白:具有抗体活性或化学结构与抗体相似的球蛋白统称为免疫球蛋白(immunoglobulin,Ig)。
区别:抗体都是免疫球蛋白,而免疫球蛋白并不都是抗体。
如骨髓瘤蛋白,巨球蛋白血症、冷球蛋白血症等患者血清中存在的异常免疫球蛋白结构与抗体相似,但无抗体活性。
免疫球蛋白可分为分泌型(secreted Ig,SIg)和膜型(membrane Ig, mIg)。
前者主要存在于血清及其他体液或外分泌液中,具有抗体的各种功能;后者是B细胞表面的抗原识别受体。
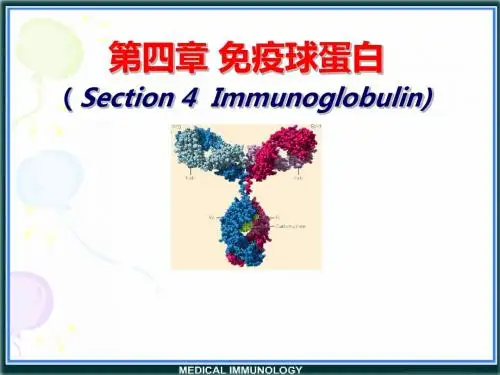
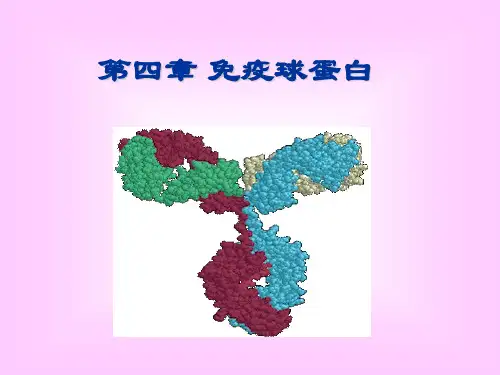
第二节免疫球蛋白结构一、免疫球蛋白的基本结构(一)重链和轻链免疫球蛋白分子是由两条相同的重链(heavy chain,H链)和两条相同的轻链(light chain,L链)通过链间二硫键连接而成的四肽链结构。
X 射线晶体结构分析发现,IgG分子由3个相同大小的节段组成。
1. 重链分子量约为50~75kD,由450~550个氨基酸残基组成。
免疫球蛋白重链恒定区由于氨基酸的组成和排列顺序不同,故其抗原性也不同。
据此,可将免疫球蛋白分为五类,即IgM、IgD、IgG、IgA和IgE,其相应的重链分别为μ链、δ链、γ链、α链和ε链。





第三章免疫球蛋白(immunoglobulin,Ig)1.免疫球蛋白Ig:具有抗体活性或化学结构与抗体相似的球蛋白统称为免疫球蛋白。
分为分泌型免疫球蛋白sIg、膜型免疫球蛋白mIg2.抗体(antibody,Ab)①概念:B细胞在抗原的刺激下分化为浆细胞,产生具有与相应抗原发生特异性结合反应的免疫球蛋白,称为抗体。
②存在部位:血清、其他体液或外分泌液中。
将抗体介导的免疫称为体液免疫。
将含有抗体的血清称为抗血清或免疫血清。
③电泳区带:抗体活性大部分在γ区带,故抗体曾有γ球蛋白(或丙种球蛋白)之称。
第一节免疫球蛋白的分子结构一、免疫球蛋白的基本结构:由二硫键相连的四条对称的多肽链构成的单体。
形成一“Y”字形结构。
重链、轻链四肽链结构:所有Ig的基本单位都是四条肽链的对称结构。
两条重链(H)和两条轻链(L)。
每条重链和轻链分为氨基端和羧基端。
(一)重链与轻链(天然的Ig单体结构中,两条重链同类,两条轻链同型。
)1.重链(heavy chain,H链)450~550个氨基酸残基,分子量约55~75kD。
根据Ig重链恒定区的分子结构和抗原特异性的不同,Ig可分为五类:即IgG、IgM、IgA、IgD、IgE,相应H链为γ、μ、α、δ及ε链。
2. 轻链轻链为重链的1/2,约由214个氨基酸组成。
根据轻链的不同,分为κ、λ两型。
正常人血清Ig的κ:λ=2 :1(二)可变区和恒定区1.可变区(variable region,V区)近N端的1/2 L链和1/4(或1/5)H链,氨基酸的组成及序列变化较大,而得名。
⑴超变区(hypervariable region,HVR):V区内变化最为剧烈的特定部位。
L链3个,H链3个。
因其在空间结构上可与抗原决定簇形成精密的互补,故又称互补性决定区(complementarity determing region,CDR)。
不同Ig分子在超变区结构上各自具有独特的氨基酸排序和构型特点,也称为Ig分子的独特型或独特型决定簇。