第四章免疫球蛋白
- 格式:ppt
- 大小:1.23 MB
- 文档页数:47

第四章免疫球蛋白第一节基本概念1、抗体:B淋巴细胞在有效的抗原刺激下分化为浆细胞,产生具有与相应抗原发生特异性结合功能的免疫球蛋白,这类免疫球蛋白称为抗体。
1937年,Tiselius用电泳方法将血清蛋白分为白蛋白、α1、α2、β及γ球蛋白等组分,其后又证明抗体的活性部分是在γ球蛋白部分。
因此,相当长一段时间内,抗体又被称为γ球蛋白(丙种球蛋白)。
实际上,抗体的活性除γ球蛋白外,还存在于α和β球蛋白处。
20世纪40年代初期,Tiselius和Kabat用肺炎球菌多糖免疫家兔,证实了抗体活性与血清丙种球蛋白组分相关。
肺炎球菌多糖免疫家兔后可获得高效价免疫血清。
然后加入相应抗原吸收以除去抗体,将除去抗体的血清进行电泳图谱分析,发现丙种球蛋白(γ-G)组分明显减少,从而证明了抗体活性是存在于丙种球蛋白内。
2、免疫球蛋白:具有抗体活性或化学结构与抗体相似的球蛋白统称为免疫球蛋白(immunoglobulin,Ig)。
区别:抗体都是免疫球蛋白,而免疫球蛋白并不都是抗体。
如骨髓瘤蛋白,巨球蛋白血症、冷球蛋白血症等患者血清中存在的异常免疫球蛋白结构与抗体相似,但无抗体活性。
免疫球蛋白可分为分泌型(secreted Ig,SIg)和膜型(membrane Ig, mIg)。
前者主要存在于血清及其他体液或外分泌液中,具有抗体的各种功能;后者是B细胞表面的抗原识别受体。
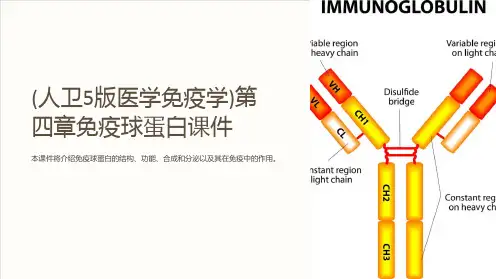
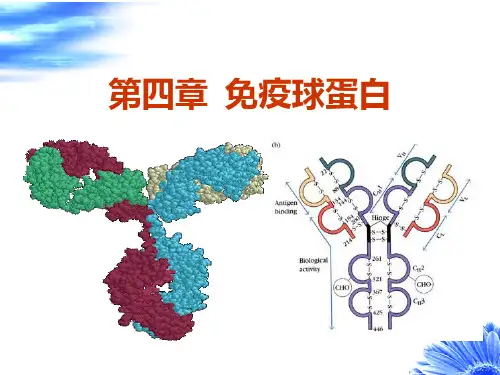
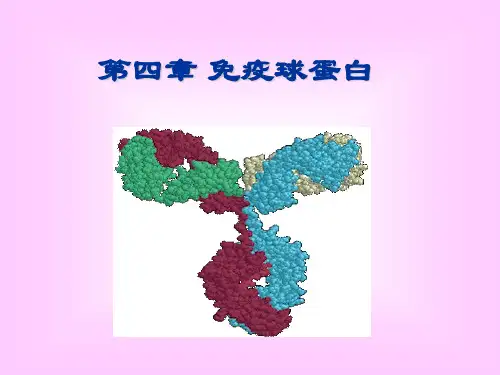
第二节免疫球蛋白结构一、免疫球蛋白的基本结构(一)重链和轻链免疫球蛋白分子是由两条相同的重链(heavy chain,H链)和两条相同的轻链(light chain,L链)通过链间二硫键连接而成的四肽链结构。
X 射线晶体结构分析发现,IgG分子由3个相同大小的节段组成。
1. 重链分子量约为50~75kD,由450~550个氨基酸残基组成。
免疫球蛋白重链恒定区由于氨基酸的组成和排列顺序不同,故其抗原性也不同。
据此,可将免疫球蛋白分为五类,即IgM、IgD、IgG、IgA和IgE,其相应的重链分别为μ链、δ链、γ链、α链和ε链。






第四章免疫球蛋白抗体与免疫球蛋白的概念抗体(antibody,Ab)分子是能与抗原特异结合的大分子球蛋白。
包括可溶性抗体分子和和膜性抗体分子。
免疫球蛋白分子(immunoglobulin,Ig)具有抗体活性或化学结构与抗体相似的的球蛋白。
抗体的发现及其特性一、发现:1890年德国学者Behring和日本学者北里用白喉杆菌外毒素免疫动物,在其血清中发现一种能中和这种外毒素的组分称为抗毒素。
这是在血清中发现的第一种抗体。
二、抗体的理化性质1、抗体是球蛋白(Globulin)通过电泳证明抗体是两种球蛋白后又经电泳分析,超速离心分析和分子量测定等方法,发现大部分抗体是r球蛋白,小部分是β球蛋白。
所以早期对抗体性质的研究证明抗体不是由均质性球蛋白(γ??β)组成,是异均性的。
2、免疫球蛋白(lmmunoglobulin, Ig)为了准确描述抗体球蛋白的性质,在60年代初提出将具有抗体活性的球蛋白称为免疫球蛋白。
从此r球蛋白则改称为IgG,BIM 称为IgM,而BIA称为IgA,其后又发现IgD和IgE。
抗体主要存在于血清中,但也存在于体液和外分泌液中,所以含有抗体的血清称为免疫血清。
B细胞表面上也存在免疫球蛋白,称为膜表面免疫球蛋白Surface membrane Ig,SmIg。
第一节、免疫球蛋白的结构(一)免疫球蛋白的基本结构Ig分子基本结构是由四个肽链组成的,包括二条较小的轻链和二条较大的重链,轻链与重链之间是由二硫键连接形成Ig分子单体,分为氨基端(N端),羧基端(C端)。
1、重链和轻链(1)重链(heavy chain,H链)450-550个氨基酸残基组成,分子量50-75KD,含糖数量不同,4-5个链内二硫键,可分为5类,μ、γ、α、δ、ε链,不同的H链与L链(κ或λ)组成完整的Ig分子。
分别称为:IgM,IgG,IgA,IgD 和IgE。
(2)轻链(light chain,L链)214个氨基酸残基组成,通常不含碳水化合物,分子量为24KD,有两个由链内二硫键组成的环肽,L链可分为:Kappa(κ)与lambda(λ)2个亚型。