电池基本知识
- 格式:ppt
- 大小:273.05 KB
- 文档页数:19

电池知识大全电池是一种能够将化学能转化为电能的装置,被广泛应用于各种电子设备、交通工具和能源储备系统中。
下面是关于电池的综合知识大全,涵盖了电池的种类、工作原理、应用领域以及相关的环保和安全问题。
一、电池的种类1. 干电池:干电池是一种不可充电的电池,内部使用干态电解质。
最常见的干电池包括碱性电池(如碱性锰电池)、锌碳电池和银氧化锌电池。
2. 镍镉电池(Ni-Cd电池):镍镉电池是一种可充电电池,由金属镍、金属镉和碱性电解液构成。
它具有较高的能量密度和较长的寿命,但含有有毒的重金属镉,对环境造成污染。
3. 镍氢电池(Ni-MH电池):镍氢电池是一种可充电电池,使用金属氢化物作为负极材料,金属镍作为正极材料,碱性电解液导电。
相较于镍镉电池,镍氢电池具有更高的能量密度和较少的环境污染。
4. 锂离子电池(Li-ion电池):锂离子电池是一种常见的可充电电池,使用锂离子在正负极之间的迁移实现电荷和放电。
它具有高能量密度、轻量化和无记忆效应等优点,在移动设备、电动汽车等领域得到广泛应用。
5. 钠离子电池(Na-ion电池):钠离子电池类似于锂离子电池,但使用钠离子作为电荷的传输媒介。
相较于锂离子电池,钠离子电池有较低的成本和更广泛的资源供应,但能量密度稍低。
6. 燃料电池:燃料电池将化学能直接转化为电能,通常使用氢气作为燃料和氧气作为氧化剂。
燃料电池具有高效率、无污染排放和可持续性等优点,适用于电动汽车和能源储备系统。
二、电池的工作原理电池的工作原理基于电化学反应。
它由两个电极(正极和负极)以及介于两者之间的电解质组成。
当电池连接外部电路时,化学反应发生,产生电流。
1. 非可充电电池工作原理:- 正极反应:正极材料中的化学物质氧化,释放出电子和金属离子。
例如,在碱性锰电池中,正极材料为二氧化锰(MnO2),反应为:MnO2 + H2O + e- → MnO(OH) + OH-- 负极反应:负极材料中的化学物质还原,吸收电子。
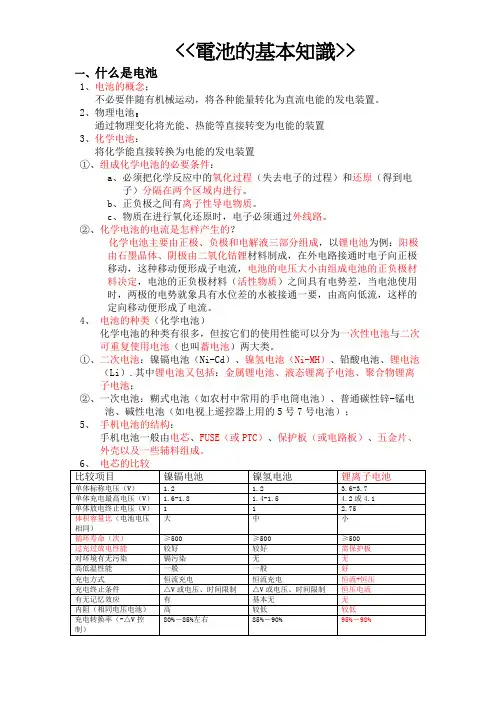
<<電池的基本知識>>一、什么是电池1、电池的概念;不必要伴随有机械运动,将各种能量转化为直流电能的发电装置。
2、物理电池:通过物理变化将光能、热能等直接转变为电能的装置3、化学电池:将化学能直接转换为电能的发电装置①、组成化学电池的必要条件:a、必须把化学反应中的氧化过程(失去电子的过程)和还原(得到电子)分隔在两个区域内进行。
b、正负极之间有离子性导电物质。
c、物质在进行氧化还原时,电子必须通过外线路。
②、化学电池的电流是怎样产生的?化学电池主要由正极、负极和电解液三部分组成,以锂电池为例:阳极由石墨晶体、阴极由二氧化钴锂材料制成,在外电路接通时电子向正极移动,这种移动便形成子电流,电池的电压大小由组成电池的正负极材料决定,电池的正负极材料(活性物质)之间具有电势差,当电池使用时,两极的电势就象具有水位差的水被接通一要,由高向低流,这样的定向移动便形成了电流。
4、电池的种类(化学电池)化学电池的种类有很多,但按它们的使用性能可以分为一次性电池与二次可重复使用电池(也叫蓄电池)两大类。
①、二次电池:镍镉电池(Ni-Cd)、镍氢电池(Ni-MH)、铅酸电池、锂电池(Li).其中锂电池又包括:金属锂电池、液态锂离子电池、聚合物锂离子电池;②、一次电池:糊式电池(如农村中常用的手电筒电池)、普通碳性锌-锰电池、碱性电池(如电视上遥控器上用的5号7号电池);5、手机电池的结构:手机电池一般由电芯、FUSE(或PTC)、保护板(或电路板)、五金片、外壳以及一些辅料组成。
从上表我们可以得出结论:①、锂离子电芯具有工作电压高、体积小、重量轻、比能量高及优良的高低温性能,它的缺点就是需保护电路,防止电芯过充过放,现已大量用于工作电压为3.6V的手机电池中;②、镍氢电池优点:它无污染以及比能量高于镍镉电而取代镍镉电用于许多手机电池中;③、镍镉电池的优点就是具有优良过充、过放及大电流充/放电特征,但由于比能量低及有污染而被淘汰(不用于手机)。




电池业务入门知识点总结导言随着全球能源问题的日益严重和环境保护的迫切需求,电池行业备受关注。
作为能源存储和释放的关键设备,电池的应用范围几乎涵盖了所有的领域,从小型电子产品到交通工具,从家庭储能系统到工业和商业用途。
在电池行业,不仅涉及到研发、生产和销售等方面,还包括了环保政策、资源开发、供应链管理等多个领域。
本文旨在从电池的基础知识、市场现状、技术发展趋势、产业链分析和商业模式等多个方面,对电池业务入门的关键知识点进行总结。
一、电池的基础知识1. 电池的定义和分类电池是一种化学能转换为电能的装置,主要由正极、负极和电解液组成。
依据电解液种类、工作原理和应用场景的不同,电池可分为干电池、蓄电池、锂电池、铅酸电池、镍氢电池等多种类型。
2. 电池的工作原理电池通过化学反应将化学能转换为电能,以电子流动的方式实现能量的传输。
其基本工作原理包括电化学反应、电子流动和离子传输等过程。
二、电池市场现状1. 电池产业链电池产业链主要包括原材料采购、电池生产、电池组装、电池应用和回收利用等环节。
其中,原材料的供应和新能源汽车、储能等领域的发展是电池产业链中的重要环节。
2. 电池市场规模随着新能源汽车市场的快速发展和储能市场的增长,电池市场规模不断扩大。
据统计,全球电动汽车销量迅速增长,新能源汽车的充电桩需求也在快速增加,这将推动电池市场的进一步发展。
三、电池技术发展趋势1. 锂电池技术的发展近年来,锂电池作为最有潜力的电池技术之一,得到了广泛应用。
通过不断的技术创新和研发,锂电池在能量密度、安全性和循环寿命等方面取得了长足进步。
2. 固态电池技术的突破固态电池作为下一代电池技术备受关注,具有能量密度高、安全性好、寿命长等优点。
近年来,固态电池技术取得了一系列关键突破,预计将成为未来电池技术发展的重要方向。
3. 智能化和集成化趋势随着智能手机、便携式电子产品、新能源汽车和储能等市场的快速增长,电池产品的智能化和集成化趋势日益明显。

原电池知识点归纳总结一、电池的基本原理1. 电池的定义:电池是一种将化学能转化为电能的装置,它通过化学反应产生电流,从而驱动电子器件工作。
2. 电池的组成:电池由正极、负极和电解质组成。
正极和负极之间通过电解质连接,构成电池内部的电化学反应环境。
3. 电池的工作原理:当电池两极之间连接电路时,电解质中的离子会在正负极之间移动,产生电流。
这是一种化学能转化为电能的过程。
二、电池的分类1. 按用途分类:主要有家用电池、工业电池、车载电池等。
2. 按电化学原理分类:主要有原电池(非可充电电池)和蓄电池(可充电电池)两种类型。
三、原电池的原理及种类1. 原电池的原理:原电池是一种将化学能转化为电能的装置,但不能通过外部电流再将其转化为化学能的装置。
2. 原电池的分类:原电池主要包括干电池、碱性锰电池、铅酸电池、锌碳电池等。
四、干电池1. 干电池的结构:干电池由正极(锌罐)、负极(碳棒)、电解质(NH4Cl和锌氧化物)、电容器、外壳等组成。
2. 干电池的工作原理:干电池通过在阳极反应产生电子,然后这些电子被负极吸收,正负极之间的电流就被接通。
五、碱性锰电池1. 碱性锰电池的结构:碱性锰电池由锰二氧化物正极、氢氧化钠电解质、锌负极和电容器等组成。
2. 碱性锰电池的工作原理:碱性锰电池是单用原电池,通过化学反应产生电流。
3. 碱性锰电池的特点:碱性锰电池有较高的容量,适用于需要稳定电压输出的设备。
六、铅酸电池1. 铅酸电池的结构:铅酸电池由正极(铅二氧化物)、负极(纯铅)、电解液(硫酸)和隔膜等组成。
2. 铅酸电池的工作原理:铅酸电池在放电时,正极的铅二氧化物和负极的纯铅通过化学反应产生电流。
3. 铅酸电池的特点:铅酸电池是一种常用的蓄电池,具有较高的储能密度和较长的寿命。
七、锌碳电池1. 锌碳电池的结构:锌碳电池由碳杆、锌罐、电解质、隔膜、外壳等组成。
2. 锌碳电池的工作原理:锌碳电池是一种干电池,通过在阳极反应产生电子,然后这些电子被负极吸收,正负极之间的电流就被接通。


电池基本知识1.1 电池的定义电池是将物质化学反应产生的能量直接转换成电能的一种装置。
在充电时它将电能转换为化学能,并以化学形式储存能量,放电时将化学能转换为电能,以电能形式释放能量。
1.2 电池的分类按化学电源的工作性质电池可分为以下几类:(1)原电池(一次电池)电池经过连续放电或间歇放电后,不能用充电的方法使两极的活性物质恢复到初始状态,即反应是不可逆的,因此两极上的活性物质只能利用一次。
原电池的特点是小型,携带方便,但放电电流不大。
一般用于仪器及各种电子元器件。
常见的原电池有:锌锰干电池 Zn∣NH4Cl ,ZnCl2∣MnO2碱锰干电池 Zn∣KOH∣MnO2锌银电池 Zn∣KOH∣Ag2O(2)蓄电池(二次电池)电池工作时,在两极上进行的反应均为可逆反应。
因此可用充电的方法使两极活性物质恢复到初始状态,从而获得再生放电的能力。
这种电池能够充电和放电循环多次。
常见的蓄电池有:铅酸蓄电池 Pb∣H2SO4∣PbO2镉镍蓄电池 Cd ∣KOH∣ NiOOH锌空气电池 Zn∣KOH∣O2(空气)镍氢蓄电池 MH∣KOH∣ NiOOH锂离子电池 LiCoO2∣有机电解质∣ C(3)燃料电池(连续电池)燃料电池是一种能量转换装置,在工作时必须有能量(燃料)输入,才能产出电能。
普通蓄电池是一种能量储存装置,必须先将电能储存到电池中,在工作时只能输出电能,在工作时不需要输入能量,也不产生电能,这是燃料电池与普通电池本质的区别。
燃料电池是将化学能转变为电能,普通蓄电池也是将化学能转变为电能,这是它们共同之处,但燃料电池在产生电能时,参加反应的反应物质在经过反应后,不断地消耗不再重复使用,因此,要求不断地输入反应物质。
普通蓄电池的活性物质随蓄电池的充电和放电变化,活性物质反复进行可逆性化学变化,活性物质并不消耗。
按电解质划分,燃料电池大致可分为五类:碱性燃料电池(AFC)、磷酸型燃料电池(PAFC)、固体氧化物燃料电池(SOFC)、熔融碳酸盐燃料电池(MCFC)和质子交换膜燃料电池(PEMFC)目前最常用的燃料电池为质子交换膜燃料电池(PEMFC)。

高三物理电池知识点归纳总结电池是一种将化学能转化为电能的装置。
在我们的日常生活和工业生产中,电池起着至关重要的作用。
而在高三物理学习中,掌握电池的知识点对于理解电路和电能转化有着重要的影响。
下面将对高三物理学习中的电池知识点进行归纳总结。
一、电池的基本原理及分类1. 电池由正负两极和电解质组成,正极为电池的正极,负极为电池的负极,电解质则是连接正负极的媒介物质。
2. 电池按使用方式可分为常用干电池和可充电电池两大类。
3. 常用干电池是将化学能转化为电能的装置,其正极一般由二氧化锰构成,负极由锌构成,电解质为浓的氯化铵溶液。
二、电池的电动势和内阻1. 电动势是电池输出电能的能力,符号为E,单位为伏特(V)。
2. 电池的电动势与电解质的浓度、金属的种类以及材料表面的处理等因素有关。
3. 内阻是电池内部的电流阻力,符号为r,单位为欧姆(Ω)。
4. 电池的实际电动势为E实,E实 = E - Ir,其中I为通过电池的电流。
三、电池的连接方式1. 串联连接:将多个电池的正极与负极依次相连,使整个电路的电动势之和为各个电池电动势之和。
2. 并联连接:将多个电池的正极相连,负极相连,使整个电路的电动势相等,但电流加大,使用时间延长。
四、电池的使用与管理1. 在日常使用电池时,应正确安装正负极,避免短路和反装。
2. 温度对电池的性能有影响,应避免将电池放置在高温环境下。
3. 定期检查电池电量,及时更换电池。
4. 废旧电池要进行分类处理,按规定的方法进行回收利用。
五、电池的续航能力1. 续航能力是指电池在一定负载下能提供电能的时间,单位为小时。
2. 电池的续航能力与电池类型、容量以及电流大小有关。
3. 续航能力可以通过公式C=Q/I来计算,其中C为续航时间,Q为电池的电荷量,I为电流强度。
六、电池的损耗与效率1. 电池的损耗主要体现在内阻上,电流通过电池时会产生热量,使电池发热。
2. 电池的效率为电池输出的电能与输入的化学能之比。

电池基础知识培训电池是我们日常生活中必不可少的能源设备,它们广泛应用于移动电子设备、车辆、工业设备等领域。
了解电池的基础知识对于我们正确并安全地使用电池至关重要。
在本篇培训中,我们将介绍电池的工作原理、常用类型和正确的使用方法。
一、电池的工作原理电池是通过化学反应将化学能转化为电能的装置。
它由正极、负极和电解质组成。
正极和负极之间的化学反应将产生电子流动,形成电流。
换句话说,电池的原理是通过电化学反应产生电能。
二、常见的电池类型1. 锂离子电池:锂离子电池是目前最常见的可充电电池类型之一。
它们具有高能量密度、长循环寿命和低自放电率的优点。
锂离子电池广泛应用于智能手机、笔记本电脑等移动电子设备中。
2. 镍氢电池:镍氢电池也是一种常见的可充电电池。
它们相对较便宜,循环寿命较长。
镍氢电池被广泛应用于数码相机、无线电话等设备中。
3. 铅酸电池:铅酸电池是一种非常成熟的电池技术,常用于汽车起动、备用电源等场景。
它们价格低廉,但能量密度相对较低。
4. 锂聚合物电池:锂聚合物电池是一种锂离子电池的变种,具有更高的能量密度和更薄的形状。
锂聚合物电池广泛应用于薄型笔记本电脑、平板电脑等设备。
三、正确使用电池的方法1. 选购合适的电池:根据使用设备的需求选择合适的电池类型和规格。
不同设备对电池的要求不同,需谨慎选择,避免混用不兼容的电池。
2. 充电和放电注意事项:对于可充电电池,使用专用充电器,并按照电池说明进行正确操作。
不要将电池长时间放置在充电器或设备中,以避免过充或过放。
不可充电电池应及时更换,避免液体泄漏。
3. 储存电池的方法:对于不常使用的电池,应在储存之前将其放置在适宜的环境温度下,并确保电池电量处于适当的便捷。
长时间不使用的电池应定期进行充放电循环,以维护其性能。
4. 处理废旧电池:废旧电池应遵循正确的处理方法。
不可将废旧电池随意丢弃,应按照当地相关规定进行回收处理,以减少对环境的污染。
总结:电池作为一种重要的能源装置,对我们的生活产生了深远影响。
电池技术入门知识点总结一、电池的基本概念1. 电池的定义电池是一种将化学能转化为电能的装置,可以将化学反应中储存的能量转化为电流输出,是电子设备的重要能源之一。
2. 电池的组成电池由正极、负极和电解质组成,正极和负极之间由隔膜隔开。
正极和负极上的化学反应产生电子,通过外部电路流动,构成电流。
3. 电池的工作原理电池内的化学反应会产生电子并将其转移到外部电路中,从而产生电流。
电池在放电时,化学反应产生电流,而在充电时,外部电流逆转这些化学反应,使电池重新储存能量。
4. 电池的分类根据化学反应的不同,电池可以分为原电池和二次电池。
原电池是一次性电池,因为其化学反应一旦进行就无法逆转。
而二次电池又被称为可充电电池,因为其化学反应可以逆转,允许多次充放电循环。
二、常见的电池类型及其特点1. 干电池干电池是一种广泛应用于家用电器和便携式电子设备中的原电池。
其特点是体积小巧、重量轻,不易泄漏,适合长时间放置使用。
但是其电压不稳定,不适合大电流放电。
2. 碱性电池碱性电池是一种干电池,普遍用于家用电器和便携式电子设备。
其优点是可以适应大电流放电,具有较长的使用寿命和较高的电压稳定性。
3. 镍氢电池镍氢电池是一种二次电池,具有高能量密度和环保特性,广泛应用于便携式电子设备和电动车辆中。
但是其成本较高,充电时可能出现过热现象,需要特殊的充电设备。
4. 锂离子电池锂离子电池是一种二次电池,具有高能量密度、长循环寿命和低自放电率,被广泛应用于手机、笔记本电脑和电动汽车等设备中。
但是其成本较高,存在过充、过放风险,需要特殊的保护电路。
5. 铅酸电池铅酸电池是一种二次电池,具有低成本和可靠性,被广泛应用于汽车启动和UPS电源等领域。
但是其能量密度较低、重量大,不适合用于便携式设备。
6. 燃料电池燃料电池是一种以燃料为能源的化学反应装置,产生电流。
其优点是高能量密度和无污染排放,适用于航天航空、汽车和家用电力等领域。
但是其成本较高,需要特殊燃料供应和氢气处理设备。
电池知识点总结一、电池的基本概念1. 电池的定义电池是一种能够将化学能转化为电能的装置,可用于各种电子设备和机械设备。
它由一个或多个电池单元组成,每个电池单元都包括一个或多个电化学反应单元。
2. 电池的结构电池一般由正极、负极、电解质和包装等部分组成。
正极和负极分别是电池的两极,电解质充当两极之间的传导介质,而包装则用于封装整个电池。
3. 电池的分类根据电池的工作原理和化学成分,电池可以分为原电池和干电池。
原电池又分为碱性电池、中性电池、酸性电池等,而干电池又分为碱性干电池、锂电池、镍氢电池等。
4. 电池的工作原理电池的工作原理是将化学能转化为电能。
当电池处于放电状态时,正极发生氧化反应,负极发生还原反应,形成电子流;而在充电状态时,电池反过来进行还原和氧化反应,使得电池储存能量。
二、干电池1. 干电池的结构和工作原理干电池是一种用于一次性使用的电池。
它由锌壳、石墨柱、电解质、电解液、二氧化锰和罗丹明B组成。
当干电池处于放电状态时,锌壳发生氧化反应,形成锌离子,这些锌离子向外迁移,同时电子向外流动,在外部形成电路;而在充电状态时,发生反应的是二氧化锰,使得锌离子向内迁移,电子流向内部,形成充电状态。
2. 干电池的优缺点干电池具有使用方便、稳定性强、价格低廉等优点,但其使用寿命短、无法循环使用等缺点也很明显。
3. 干电池的应用和注意事项干电池广泛应用于控制电路、计算机、移动电话、电子玩具、手电筒等设备,但在使用时需要防止过充、过放、高温和损坏。
三、原电池1. 原电池的结构和工作原理原电池也称湿电池,是一种可以充放电、反复使用的电池。
它由负极、正极、介质和电解质组成。
当原电池处于放电状态时,正极发生氧化反应,负极发生还原反应,形成电子流;而在充电状态时,电池反过来进行还原和氧化反应,使得电池储存能量。
2. 原电池的分类原电池包括碱性电池、中性电池、酸性电池三种类型。
碱性电池具有功率密度大、循环寿命长等优点,适用于大功率设备;中性电池适用于中等功率设备;而酸性电池则适用于小功率设备。
电池的科普知识一、电池的概念和种类电池是将化学能转换为电能的装置,是一种能够储存和释放电能的装置。
根据其化学成分和工作原理,电池可以分为干电池、碱性电池、铅酸蓄电池、锂离子电池等多种类型。
二、干电池1. 概念:干电池是最常见的一种家用电池,也称为单用干电池,其内部由一个或多个正极材料(如锌)和负极材料(如二氧化锰)构成。
2. 工作原理:当两种不同金属材料相接触时,会产生一定的静电荷。
在干电池中,正极材料与负极材料之间隔着一个湿润的介质(如氯化铵),这个介质中含有离子,当两种金属相接触时就会产生一定的静电荷,使得离子开始移动并在两极之间形成一个闭合回路。
这时候就会产生一定的直流电流。
3. 优缺点:干电池具有体积小、重量轻、使用方便等优点,但是其寿命短,不能充电,且容易泄漏。
三、碱性电池1. 概念:碱性电池是一种使用碱性电解液的电池,其内部由一个或多个正极材料(如锌)和负极材料(如二氧化锰)构成。
2. 工作原理:碱性电池的工作原理与干电池类似,也是通过两种不同金属相接触产生静电荷,并在介质中形成闭合回路。
不同的是,碱性电解液比较稳定,可以减缓正极材料的腐蚀速度,从而延长了电池的寿命。
3. 优缺点:碱性电池具有使用寿命长、能量密度高等优点,但是其价格相对较高。
四、铅酸蓄电池1. 概念:铅酸蓄电池是一种常见的大型储能设备,主要用于汽车、UPS等领域。
其内部由铅板和硫酸溶液构成。
2. 工作原理:当铅板浸泡在硫酸溶液中时,会产生一定的化学反应。
在放电时,铅板上的氢离子和硫酸根离子反应,形成水和二氧化硫,同时释放出电子。
在充电时,则是通过外部电源将电子输送到铅板上,使得其中的化学反应逆转。
3. 优缺点:铅酸蓄电池具有容量大、维护简单等优点,但是其重量较大、体积较大、使用寿命相对较短。
五、锂离子电池1. 概念:锂离子电池是一种目前应用最为广泛的充电式电池,主要用于手机、笔记本等领域。
其内部由锂离子正极材料(如钴酸锂)和碳负极材料构成。
原电池的所有知识点电池是一种将化学能转化为电能的设备。
它由正极、负极、电解质和隔膜组成。
电池的运作原理是通过正负极之间的化学反应,将化学能转化为电能。
电池广泛应用于各个领域,如电子产品、交通工具、军事装备等。
下面将介绍电池的一些主要知识点。
1. 电池的种类和分类:根据电池的工作原理和化学反应类型,可以将电池分为原电池和蓄电池。
原电池是一次性电池,无法充电;蓄电池是可以充放电多次的电池。
原电池包括干电池和碱性电池等,蓄电池包括铅酸蓄电池、锂离子电池等。
2. 电池的电压和容量:电池的电压是指电池能够提供的电能大小,单位为伏特(V)。
不同种类的电池具有不同的电压。
电池的容量是指电池存储能量的大小,单位为安时(Ah)。
容量越大,电池可以提供的电能就越多。
3. 电池的正负极和电解质:电池的正极是指电池中能够氧化的极性,负极是指电池中能够还原的极性。
电解质是电池中起到导电和媒介作用的物质,通常是液体或凝胶状。
4. 电池的充放电过程:电池在充电过程中,化学反应会使电池的正负极逆转,将电能转化为化学能存储起来。
在放电过程中,化学反应会使电池的正负极重新恢复到原来的状态,将化学能转化为电能释放出来。
5. 电池的循环寿命:电池的循环寿命是指电池可以进行充放电的次数。
不同种类的电池具有不同的循环寿命。
循环寿命一般与电池的质量、使用条件和充放电方式等因素有关。
6. 电池的安全性:电池在使用过程中可能会发生过热、漏液、爆炸等安全问题。
为了保证电池的安全性,需要注意正确使用和存储电池,并避免电池短路、过充或过放等情况。
7. 电池的环境影响:电池的生产和处理过程可能会对环境造成一定的影响。
例如,电池中的重金属和有害物质可能会对土壤和水源造成污染。
因此,应当采取相应的环保措施,如回收和循环利用电池。
8. 电池的未来发展:随着科技的进步,电池的技术也在不断发展。
目前,锂离子电池在电动汽车等领域得到广泛应用。
未来可能出现更加高效、环保和可持续的电池技术,如固态电池、钠离子电池等。