电池基本知识讲解
- 格式:ppt
- 大小:54.50 KB
- 文档页数:27

电池知识大全电池是一种能够将化学能转化为电能的装置,被广泛应用于各种电子设备、交通工具和能源储备系统中。
下面是关于电池的综合知识大全,涵盖了电池的种类、工作原理、应用领域以及相关的环保和安全问题。
一、电池的种类1. 干电池:干电池是一种不可充电的电池,内部使用干态电解质。
最常见的干电池包括碱性电池(如碱性锰电池)、锌碳电池和银氧化锌电池。
2. 镍镉电池(Ni-Cd电池):镍镉电池是一种可充电电池,由金属镍、金属镉和碱性电解液构成。
它具有较高的能量密度和较长的寿命,但含有有毒的重金属镉,对环境造成污染。
3. 镍氢电池(Ni-MH电池):镍氢电池是一种可充电电池,使用金属氢化物作为负极材料,金属镍作为正极材料,碱性电解液导电。
相较于镍镉电池,镍氢电池具有更高的能量密度和较少的环境污染。
4. 锂离子电池(Li-ion电池):锂离子电池是一种常见的可充电电池,使用锂离子在正负极之间的迁移实现电荷和放电。
它具有高能量密度、轻量化和无记忆效应等优点,在移动设备、电动汽车等领域得到广泛应用。
5. 钠离子电池(Na-ion电池):钠离子电池类似于锂离子电池,但使用钠离子作为电荷的传输媒介。
相较于锂离子电池,钠离子电池有较低的成本和更广泛的资源供应,但能量密度稍低。
6. 燃料电池:燃料电池将化学能直接转化为电能,通常使用氢气作为燃料和氧气作为氧化剂。
燃料电池具有高效率、无污染排放和可持续性等优点,适用于电动汽车和能源储备系统。
二、电池的工作原理电池的工作原理基于电化学反应。
它由两个电极(正极和负极)以及介于两者之间的电解质组成。
当电池连接外部电路时,化学反应发生,产生电流。
1. 非可充电电池工作原理:- 正极反应:正极材料中的化学物质氧化,释放出电子和金属离子。
例如,在碱性锰电池中,正极材料为二氧化锰(MnO2),反应为:MnO2 + H2O + e- → MnO(OH) + OH-- 负极反应:负极材料中的化学物质还原,吸收电子。
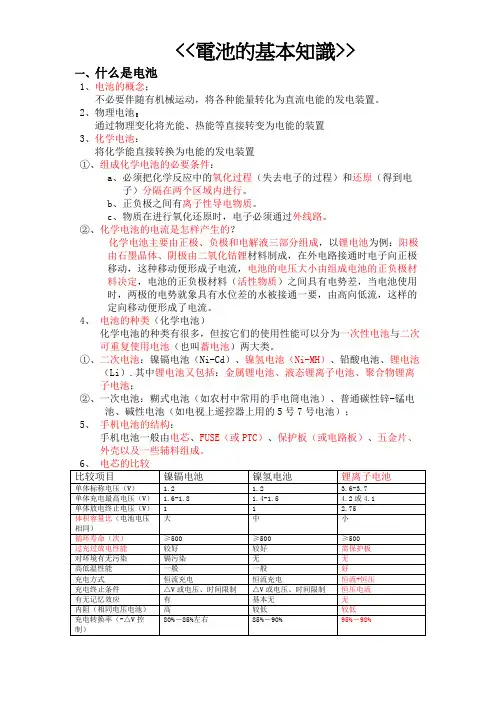
<<電池的基本知識>>一、什么是电池1、电池的概念;不必要伴随有机械运动,将各种能量转化为直流电能的发电装置。
2、物理电池:通过物理变化将光能、热能等直接转变为电能的装置3、化学电池:将化学能直接转换为电能的发电装置①、组成化学电池的必要条件:a、必须把化学反应中的氧化过程(失去电子的过程)和还原(得到电子)分隔在两个区域内进行。
b、正负极之间有离子性导电物质。
c、物质在进行氧化还原时,电子必须通过外线路。
②、化学电池的电流是怎样产生的?化学电池主要由正极、负极和电解液三部分组成,以锂电池为例:阳极由石墨晶体、阴极由二氧化钴锂材料制成,在外电路接通时电子向正极移动,这种移动便形成子电流,电池的电压大小由组成电池的正负极材料决定,电池的正负极材料(活性物质)之间具有电势差,当电池使用时,两极的电势就象具有水位差的水被接通一要,由高向低流,这样的定向移动便形成了电流。
4、电池的种类(化学电池)化学电池的种类有很多,但按它们的使用性能可以分为一次性电池与二次可重复使用电池(也叫蓄电池)两大类。
①、二次电池:镍镉电池(Ni-Cd)、镍氢电池(Ni-MH)、铅酸电池、锂电池(Li).其中锂电池又包括:金属锂电池、液态锂离子电池、聚合物锂离子电池;②、一次电池:糊式电池(如农村中常用的手电筒电池)、普通碳性锌-锰电池、碱性电池(如电视上遥控器上用的5号7号电池);5、手机电池的结构:手机电池一般由电芯、FUSE(或PTC)、保护板(或电路板)、五金片、外壳以及一些辅料组成。
从上表我们可以得出结论:①、锂离子电芯具有工作电压高、体积小、重量轻、比能量高及优良的高低温性能,它的缺点就是需保护电路,防止电芯过充过放,现已大量用于工作电压为3.6V的手机电池中;②、镍氢电池优点:它无污染以及比能量高于镍镉电而取代镍镉电用于许多手机电池中;③、镍镉电池的优点就是具有优良过充、过放及大电流充/放电特征,但由于比能量低及有污染而被淘汰(不用于手机)。

电池基本常识电池是人们生活和工作中经常使用的电源,由于其方便、便携、安全、坚固等特点,成为人们日常生活和工作中不可缺少的一部分。
但是,许多人对电池的认识还不太深刻,因此本文将介绍电池的基本常识,以便大家了解和正确使用电池。
一、电池的基本原理电池是一种将化学能转化为电能的装置。
它通过化学反应的方法,在内部产生电流。
通常由正极、负极、电解质和外壳四部分组成。
在正极上发生氧化反应,从而获得电子,负极上发生还原反应,放出电子,因此在正负极之间形成了电势差,而外部使用时即可产生电流。
二、电池的分类电池可以按不同的标准进行分类,如按形状可分为圆柱形、方形、扁平形、板式等;按化学反应原理可分为干电池、碱性电池、镍氢电池、锂离子电池等。
其中干电池是最常见的一种电池,它的正极是二氧化锰,负极是锌,而电解液为氯化铵溶液。
三、电池的使用寿命及注意事项电池的使用寿命与许多因素有关,如电池本身的容量、使用场合、环境温度等。
一般情况下,电池的使用寿命在一年左右。
为了延长电池使用寿命,应注意以下几点:1、不要将电池混用,不同型号、不同品牌、不同化学类型的电池不能混用,否则会导致电池损坏,影响使用寿命。
2、不要将电池长时间存放在高温或低温环境下,一般最佳温度范围为20℃-25℃。
3、使用时应注意正负极的连接,避免反接或短路,这样会导致电池发热、气体爆炸等危险。
4、电池放电后要即时取出,不要长时间放置在电器内,以免电池失效或泄漏。
5、电池损坏后不要随意丢弃,应妥善处理,一般建议回收利用。
四、电池的环保问题电池是一种易消耗品,每年全球消耗的电池达数十亿只,由此产生的废旧电池会对环境和人类健康造成潜在的威胁。
因此,对于电池的环保问题,我们应该进行积极的控制和管理措施,具体措施包括:1、减少电池使用量,使用充电电池或双节电池等可充电电池;2、正确处理废旧电池,将其送到指定回收站点或加强处理以减少影响;3、倡导环保行为,宣传环保主义,使更多的人意识到电池带来的环境问题,提高环保意识。

电池常见知识点总结大全电池是一种能够将化学能转化为电能的装置,被广泛应用于日常生活的各个领域。
从手提电话到电动汽车,电池都是其中不可或缺的一部分。
在这篇文章中,我们将总结一些关于电池的常见知识点,包括电池的工作原理、不同类型的电池、电池的充电和放电过程、电池的维护和安全使用等。
一、电池的工作原理电池的工作原理基于化学反应产生电能。
通常情况下,电池由两种不同的金属以及介于两者之间的电解质组成。
其中一个金属被氧化,而另一个金属被还原,产生电子流。
这个过程同时也会在电池的两极之间产生电压。
一旦一个外部电路连接到电池的两极上,电子就会开始在电线中流动,从而产生电能。
二、不同类型的电池根据使用的化学物质以及工作原理的不同,电池可以分为多种类型。
其中最常见的包括:1. 锂离子电池:使用锂离子作为电极材料,具有高能量密度和长周期寿命,适用于手机、笔记本电脑等移动设备。
2. 镍镉电池:使用镍和镉作为电极材料,具有较高的放电率,适用于相机闪光灯、无线电话等设备。
3. 铅酸电池:使用铅和酸作为电极材料,成本低廉,适用于汽车起动电池等。
4. 碱性电池:使用碱性电解液,具有较高的能量密度,适用于遥控器、手电筒等设备。
5. 镍氢电池:使用镍和氢作为电极材料,具有低的环境影响,适用于电动汽车等。
除了以上几种电池类型之外,还有其他的一些次要类型,例如锌-空气电池、铁-镍电池等。
三、电池的充电与放电过程电池的充电过程是将电池中的化学能转化为电能的过程,通过外部电源向电池施加电流,使电池中的化学物质发生反应,从而恢复电池的储能能力。
电池的放电过程是将电池中的电能转化为其他形式能量的过程,例如供给电动设备使用。
在放电过程中,化学能被转化为电能,由电子在外部电路中流动,从而驱动设备工作。
四、电池的维护和安全使用为了延长电池的寿命和保证安全使用,我们需要注意以下几点:1. 避免过充和过放:充电时要根据说明书中的要求进行,充电时不能超过规定的电压和电流,以免损坏电池;放电时也要避免过度放电,否则会造成电池损害。


电池的知识点总结一、电池的基本原理电池的基本原理是通过化学反应将化学能转化为电能。
它由正极、负极和电解质组成。
正极通常由氧化剂组成,负极通常由还原剂组成,电解质则是连接正负极并传递离子的媒介。
正负极之间进行氧化还原反应,使得正极失去电子而负极获得电子,从而产生电压和电流。
电池的电压和电流取决于正负极的反应性能和电解质的传导能力。
二、电池的类型1. 干电池:干电池是一种一次性使用的电池,它由锌壳、氧化铜、电解质和碳棒组成。
干电池在工作过程中会产生氢气,因此不适合长时间使用。
常见的干电池有碱性锰电池、碱性锌电池等。
2. 蓄电池:蓄电池是一种可以循环充放电的电池,它由正负极板、电解液和蓄电池壳体组成。
蓄电池在充放电过程中可以将化学能转化为电能,并且可以多次循环使用。
常见的蓄电池有铅酸蓄电池、镍氢蓄电池、锂离子蓄电池等。
三、电池的工作特性1. 电压:电池的电压是指正负极之间的电势差,单位是伏特(V)。
不同类型的电池具有不同的额定电压,常见的有1.5V、3V、6V等。
2. 容量:电池的容量是指电池可以释放的电荷量,单位是安时(Ah)或毫安时(mAh)。
容量越大表示电池可以储存和释放的电能越多。
3. 充放电特性:蓄电池可以进行充放电循环使用,而干电池通常只能进行一次性使用。
在充放电过程中,电池的内阻会影响电池的性能和寿命。
4. 自放电:电池在长时间存放时会因自身化学反应而产生自放电现象,导致电池容量下降。
蓄电池的自放电速度通常比干电池慢。
四、电池的使用注意事项1. 避免混用:不同类型、不同型号的电池不要混用,以免发生短路或者安全事故。
2. 正确存放:电池在存放时应避免高温、潮湿的环境,以免影响电池的性能和寿命。
3. 注意充电:对于蓄电池,应使用正确的充电器和充电方法进行充电,以避免过充或过放。
4. 合理使用:在使用电池时应按照电池的额定电压、容量等参数进行合理使用,避免过度放电或过度使用。
5. 安全处理:电池在使用过程中如有泄漏、发热等异常情况应立即停止使用,并采取安全措施处理。


电池基本知识1.1 电池的定义电池是将物质化学反应产生的能量直接转换成电能的一种装置。
在充电时它将电能转换为化学能,并以化学形式储存能量,放电时将化学能转换为电能,以电能形式释放能量。
1.2 电池的分类按化学电源的工作性质电池可分为以下几类:(1)原电池(一次电池)电池经过连续放电或间歇放电后,不能用充电的方法使两极的活性物质恢复到初始状态,即反应是不可逆的,因此两极上的活性物质只能利用一次。
原电池的特点是小型,携带方便,但放电电流不大。
一般用于仪器及各种电子元器件。
常见的原电池有:锌锰干电池 Zn∣NH4Cl ,ZnCl2∣MnO2碱锰干电池 Zn∣KOH∣MnO2锌银电池 Zn∣KOH∣Ag2O(2)蓄电池(二次电池)电池工作时,在两极上进行的反应均为可逆反应。
因此可用充电的方法使两极活性物质恢复到初始状态,从而获得再生放电的能力。
这种电池能够充电和放电循环多次。
常见的蓄电池有:铅酸蓄电池 Pb∣H2SO4∣PbO2镉镍蓄电池 Cd ∣KOH∣ NiOOH锌空气电池 Zn∣KOH∣O2(空气)镍氢蓄电池 MH∣KOH∣ NiOOH锂离子电池 LiCoO2∣有机电解质∣ C(3)燃料电池(连续电池)燃料电池是一种能量转换装置,在工作时必须有能量(燃料)输入,才能产出电能。
普通蓄电池是一种能量储存装置,必须先将电能储存到电池中,在工作时只能输出电能,在工作时不需要输入能量,也不产生电能,这是燃料电池与普通电池本质的区别。
燃料电池是将化学能转变为电能,普通蓄电池也是将化学能转变为电能,这是它们共同之处,但燃料电池在产生电能时,参加反应的反应物质在经过反应后,不断地消耗不再重复使用,因此,要求不断地输入反应物质。
普通蓄电池的活性物质随蓄电池的充电和放电变化,活性物质反复进行可逆性化学变化,活性物质并不消耗。
按电解质划分,燃料电池大致可分为五类:碱性燃料电池(AFC)、磷酸型燃料电池(PAFC)、固体氧化物燃料电池(SOFC)、熔融碳酸盐燃料电池(MCFC)和质子交换膜燃料电池(PEMFC)目前最常用的燃料电池为质子交换膜燃料电池(PEMFC)。

电池基本知识一.电池的基本概念1.1电池的概念电池是通过一系列化学反映而产生电能,或在电能与化学能之间多次转化的物质,又称为化学电源或化学电池。
与此功能比较相类似的是通过电磁效应转化电能的设备是电容。
但他们的转化机理不一样。
1.2电池分类:1.21根据电池的材料来分类,:■碳锌电池Heavy Duty Battery亦称为锌锰电池,是目前最普遍之干电池,它有价格低廉和使用安全可靠的特点,基于环保因素的考量,由于仍含有镉之成份,因此必须回收,以免对地球环境造成破坏。
■碱性电池Alkaline Battery亦称为碱性干电池,适用于需放电量大及长时间使用。
电池内阻较低,因此产生之电流较一般锰电池为大,而环保型含汞量只有0.025%,无须回收。
■水银电池Silver Oxide Button Cell水银电池,因为污染和电容量之故线已逐渐被锂-锰配方取代■锂锰电池Lithium一次锂锰电池,如CR123A ,CRV3 ,CRV2等,多用于数码相机和纽扣电池,好处是单体电池电压高,为3.6V, 可以胜任更多的用电器■镍镉充电电池Ni-Cd (Nickel Cadmium Battery)已为大众早期广泛使用,可重覆约500次之充放电,但约10次充放电后即会产生记忆效应;另一个缺点是,在充放电时,阴极会长出镉的针状结晶,有时会穿透分隔物而引起内部枝状晶体式的短路。
由于含有镉之成份,因此必须回收。
■镍氢充电电池Ni-MH (Nickel Metal Hyoride Battery)为目前市场主流之充电电池,它是使用氧化镍作为阳极,以及吸收了氢的金属合金作为阴极,一般可进行500次以上的充放电循环。
由于不含汞及镉之原料,不必回收。
■锂充电电池Rechargeable Lithium ion Battery■铅酸电池Sealed Lead-Acid Battery铅酸蓄电池,电压为12V,多用于大功率动力设备,如机车,大型电动工具等;对环境有污染,并且需要长期更换正负极板,和添加电解液,使用方面不便■太阳能电池1.2.2 充电方式恢复电池存储电能的特性分在化学电池中,根据能否用充电方式恢复电池存储电能的特性,可以分为一次电池(也称原电池)和二次电池(又名蓄电池,俗称可充电电池,可以多次重复使用)两大类。

电池基础知识介绍一.电池分类、动力电池及发展史分类:按工作性质及存储方式分:原电池,蓄电池,储备(激活)电池,燃料电池;按电解质性质分:酸性电池,碱性电池,中性电池,有机电解质溶液电池,固体电解质电池;按电池特性分:高容量电池,密封电池,免维护电池,防爆电池等。
动力电池的概念:电池输出的能量用于车辆(汽车、电动自行车等)牵引、驱动用途的电池。
动力电池发展史:1859 Plante铅酸蓄电池1901 镉镍蓄电池1943 锌银蓄电池60年代燃料电池80年代氢镍电池90年代锂离子电池二.电池的组成和基本原理1.电池简介及其组成电池即化学电源,是通过化学反应把化学能直接转变成低压直流电能的装置。
要实现能量转变,电池必须具备两个条件:①氧化和还原反应必须分隔在两个区域进行;②电子必须通过外电路。
因此电池应该包括以下基本组成部分:正极——提供容量,主要有活性物质和导电骨架组成负极——同上电解液——离子传输隔膜——防止正负极间形成电子导电通路外壳——保护作用2.基本工作原理构成适用的二次电池的条件:a电极反应必须可逆;b只能采用一种电解质溶液;c电池放电时生成的产物在溶液中是难溶的。
以锂离子电池为例锂离子电池实际上是一种锂离子浓差电池,正负电极由两种不同的锂离子嵌入化合物组成。
充电时,Li+ 从正极脱嵌经过电解质嵌入负极,负极处于富锂态,正极处于贫锂态,同时电子的补偿电荷从外电路供给到碳负极,保证负极的电荷平衡。
放电时则相反,Li+ 从负极脱嵌,经过电解质嵌入正极,正极处于富锂态。
在正常充放电情况下,锂离子在层状结构的碳材料和层状结构氧化物的层间嵌入和脱出,一般只引起层面间距变化,不破坏晶体结构,在充放电过程中,负极材料的化学结构基本不变。
因此,从充放电反应的可逆性看,锂离子电池反应是一种理想的可逆反应。
三.电池常用术语及电性能1. 电动势:电池两极在断路时处于可逆平衡状态下,两极平衡电极电位之差,是经过计算的理论值。

电池技术入门知识点总结一、电池的基本概念1. 电池的定义电池是一种将化学能转化为电能的装置,可以将化学反应中储存的能量转化为电流输出,是电子设备的重要能源之一。
2. 电池的组成电池由正极、负极和电解质组成,正极和负极之间由隔膜隔开。
正极和负极上的化学反应产生电子,通过外部电路流动,构成电流。
3. 电池的工作原理电池内的化学反应会产生电子并将其转移到外部电路中,从而产生电流。
电池在放电时,化学反应产生电流,而在充电时,外部电流逆转这些化学反应,使电池重新储存能量。
4. 电池的分类根据化学反应的不同,电池可以分为原电池和二次电池。
原电池是一次性电池,因为其化学反应一旦进行就无法逆转。
而二次电池又被称为可充电电池,因为其化学反应可以逆转,允许多次充放电循环。
二、常见的电池类型及其特点1. 干电池干电池是一种广泛应用于家用电器和便携式电子设备中的原电池。
其特点是体积小巧、重量轻,不易泄漏,适合长时间放置使用。
但是其电压不稳定,不适合大电流放电。
2. 碱性电池碱性电池是一种干电池,普遍用于家用电器和便携式电子设备。
其优点是可以适应大电流放电,具有较长的使用寿命和较高的电压稳定性。
3. 镍氢电池镍氢电池是一种二次电池,具有高能量密度和环保特性,广泛应用于便携式电子设备和电动车辆中。
但是其成本较高,充电时可能出现过热现象,需要特殊的充电设备。
4. 锂离子电池锂离子电池是一种二次电池,具有高能量密度、长循环寿命和低自放电率,被广泛应用于手机、笔记本电脑和电动汽车等设备中。
但是其成本较高,存在过充、过放风险,需要特殊的保护电路。
5. 铅酸电池铅酸电池是一种二次电池,具有低成本和可靠性,被广泛应用于汽车启动和UPS电源等领域。
但是其能量密度较低、重量大,不适合用于便携式设备。
6. 燃料电池燃料电池是一种以燃料为能源的化学反应装置,产生电流。
其优点是高能量密度和无污染排放,适用于航天航空、汽车和家用电力等领域。
但是其成本较高,需要特殊燃料供应和氢气处理设备。
电池知识点总结一、电池的基本概念1. 电池的定义电池是一种能够将化学能转化为电能的装置,可用于各种电子设备和机械设备。
它由一个或多个电池单元组成,每个电池单元都包括一个或多个电化学反应单元。
2. 电池的结构电池一般由正极、负极、电解质和包装等部分组成。
正极和负极分别是电池的两极,电解质充当两极之间的传导介质,而包装则用于封装整个电池。
3. 电池的分类根据电池的工作原理和化学成分,电池可以分为原电池和干电池。
原电池又分为碱性电池、中性电池、酸性电池等,而干电池又分为碱性干电池、锂电池、镍氢电池等。
4. 电池的工作原理电池的工作原理是将化学能转化为电能。
当电池处于放电状态时,正极发生氧化反应,负极发生还原反应,形成电子流;而在充电状态时,电池反过来进行还原和氧化反应,使得电池储存能量。
二、干电池1. 干电池的结构和工作原理干电池是一种用于一次性使用的电池。
它由锌壳、石墨柱、电解质、电解液、二氧化锰和罗丹明B组成。
当干电池处于放电状态时,锌壳发生氧化反应,形成锌离子,这些锌离子向外迁移,同时电子向外流动,在外部形成电路;而在充电状态时,发生反应的是二氧化锰,使得锌离子向内迁移,电子流向内部,形成充电状态。
2. 干电池的优缺点干电池具有使用方便、稳定性强、价格低廉等优点,但其使用寿命短、无法循环使用等缺点也很明显。
3. 干电池的应用和注意事项干电池广泛应用于控制电路、计算机、移动电话、电子玩具、手电筒等设备,但在使用时需要防止过充、过放、高温和损坏。
三、原电池1. 原电池的结构和工作原理原电池也称湿电池,是一种可以充放电、反复使用的电池。
它由负极、正极、介质和电解质组成。
当原电池处于放电状态时,正极发生氧化反应,负极发生还原反应,形成电子流;而在充电状态时,电池反过来进行还原和氧化反应,使得电池储存能量。
2. 原电池的分类原电池包括碱性电池、中性电池、酸性电池三种类型。
碱性电池具有功率密度大、循环寿命长等优点,适用于大功率设备;中性电池适用于中等功率设备;而酸性电池则适用于小功率设备。
电池常见知识点总结一、电池的基本概念和原理1. 电池的定义:电池是一种能够将化学能转化为电能的装置,它包括正极、负极和电解质。
正极和负极之间通过电解质进行离子传导,从而产生电流。
2. 电池的工作原理:电池在工作时,正极发生氧化反应,负极发生还原反应,从而在正负极之间产生电势差,驱动电子在外部回路中流动,产生电流。
3. 电池的特性:电池有一些特性,比如电压、容量、内阻等。
电压是指电池产生的电势差,容量是指电池可以储存的电荷量,内阻是指电池内部电阻对电流的阻碍。
二、电池的常见类型1. 原电池:原电池是一种一次性使用的电池,通常用于一次性装置或者少量电能需求的设备上,比如手电筒、遥控器等。
2. 复合电池:复合电池是可以充放电多次的电池,它可以通过外部电源进行充电,然后再将储存的电能释放出来供给外部设备使用。
3. 燃料电池:燃料电池是指利用氢气、甲醇等燃料进行氧化还原反应产生电能的一种电池,它具有高能量密度和低污染的特点。
4. 锂离子电池:锂离子电池是一种广泛应用于手机、笔记本电脑、电动汽车等设备上的复合电池,它具有高能量密度和长寿命的特点。
5. 镍镉电池:镍镉电池是一种历史悠久的复合电池,它具有较高的放电率和长寿命,但是由于镉的环境污染问题,逐渐被淘汰。
6. 铅酸电池:铅酸电池是一种最早被发明并广泛应用于汽车、UPS等设备上的复合电池,它具有低成本和较高的放电率。
三、电池的使用注意事项1. 充电方式:电池在使用时需要根据其类型选择合适的充电方式,比如锂离子电池和铅酸电池都需要采用特定的充电方式,否则会导致电池损坏。
2. 温度环境:电池在工作时对温度环境比较敏感,需要避免高温和低温环境,否则会影响电池的性能和寿命。
3. 维护保养:对于复合电池来说,定期的维护保养是非常重要的,比如进行电池均衡、检查电池温度等操作,可以延长电池的寿命。
4. 处置方式:电池在使用完毕后需要进行合适的处理,避免对环境造成污染,比如对于废旧电池进行分类回收处理。
电池的科普知识一、电池的概念和种类电池是将化学能转换为电能的装置,是一种能够储存和释放电能的装置。
根据其化学成分和工作原理,电池可以分为干电池、碱性电池、铅酸蓄电池、锂离子电池等多种类型。
二、干电池1. 概念:干电池是最常见的一种家用电池,也称为单用干电池,其内部由一个或多个正极材料(如锌)和负极材料(如二氧化锰)构成。
2. 工作原理:当两种不同金属材料相接触时,会产生一定的静电荷。
在干电池中,正极材料与负极材料之间隔着一个湿润的介质(如氯化铵),这个介质中含有离子,当两种金属相接触时就会产生一定的静电荷,使得离子开始移动并在两极之间形成一个闭合回路。
这时候就会产生一定的直流电流。
3. 优缺点:干电池具有体积小、重量轻、使用方便等优点,但是其寿命短,不能充电,且容易泄漏。
三、碱性电池1. 概念:碱性电池是一种使用碱性电解液的电池,其内部由一个或多个正极材料(如锌)和负极材料(如二氧化锰)构成。
2. 工作原理:碱性电池的工作原理与干电池类似,也是通过两种不同金属相接触产生静电荷,并在介质中形成闭合回路。
不同的是,碱性电解液比较稳定,可以减缓正极材料的腐蚀速度,从而延长了电池的寿命。
3. 优缺点:碱性电池具有使用寿命长、能量密度高等优点,但是其价格相对较高。
四、铅酸蓄电池1. 概念:铅酸蓄电池是一种常见的大型储能设备,主要用于汽车、UPS等领域。
其内部由铅板和硫酸溶液构成。
2. 工作原理:当铅板浸泡在硫酸溶液中时,会产生一定的化学反应。
在放电时,铅板上的氢离子和硫酸根离子反应,形成水和二氧化硫,同时释放出电子。
在充电时,则是通过外部电源将电子输送到铅板上,使得其中的化学反应逆转。
3. 优缺点:铅酸蓄电池具有容量大、维护简单等优点,但是其重量较大、体积较大、使用寿命相对较短。
五、锂离子电池1. 概念:锂离子电池是一种目前应用最为广泛的充电式电池,主要用于手机、笔记本等领域。
其内部由锂离子正极材料(如钴酸锂)和碳负极材料构成。
关于电池的一些知识点电池是一种可以转化化学能为电能的装置,广泛应用于各种电子设备和交通工具中。
在我们日常生活中离不开电池,但是你了解电池的工作原理和种类吗?本文将逐步介绍电池的相关知识点。
1.电池的基本原理电池的基本原理是通过化学反应将化学能转化为电能。
电池由正极、负极和电解质组成。
正极和负极之间存在电势差,电解质在两极之间传递离子,形成电流。
这个过程是通过氧化还原反应来实现的。
2.常见的电池类型(1)碱性电池:碱性电池是最常见的一种电池,也是家庭用电器最常使用的电池类型。
它采用碱性电解质,常见的型号有AA、AAA、C、D等。
碱性电池的优点是价格相对便宜,容量较大,适用于大多数低功率电子设备。
(2)锂离子电池:锂离子电池是一种高能量密度的电池,主要用于便携式电子设备,如手机、平板电脑等。
锂离子电池具有较小的体积和质量,长寿命,但价格相对较高。
(3)铅酸蓄电池:铅酸蓄电池通常用于汽车和摩托车等交通工具。
它具有较大的容量和较低的成本,但相对来说比较笨重,对环境有一定的污染。
(4)镍氢电池:镍氢电池是一种环保型电池,具有较高的容量和长寿命,广泛应用于数码相机、无线电话等设备。
3.电池的维护与安全(1)合理充放电:电池的寿命与充放电循环次数相关,因此应合理安排充电和放电的时间。
避免长时间过度充电或放电,并避免过度放电导致电池损坏。
(2)储存条件:长期不使用的电池应储存在阴凉干燥的地方,避免高温和潮湿环境,以延长电池的寿命。
(3)安全使用:使用电池时应注意不要将正负极短路,避免电池过热。
在更换电池时,应正确安装电池的正负极,避免反装。
4.电池的回收与环保电池是一种含有有害物质的化学品,不应随意丢弃。
用过的电池应当进行回收处理,以减少对环境的污染。
在一些地区,设有专门的电池回收站点,可以将废旧电池投放至此处进行回收处理。
总结:电池是我们日常生活中常用的电力供应装置,了解电池的工作原理和种类可以帮助我们更好地使用和维护电池。
基本概念一、蓄电池(一)基本定义1、电能可由多种形式的能量变化得来,其中把化学能转换成电能的装置叫化学电池,一般简称为电池,电池有原电池和蓄电池之分。
电后不能用充电的方式使内部活性物质再生的叫原电池,也称一次性电池。
3、放电后可以用充电的方式使内部活性物质再生,把电能储存为化学能,需要放电时再次把化学能转换为电能的电池,叫蓄电池,也称二次电池。
(二)、常用技术术语1、充电:蓄电池从其他直流电源获得电能叫做充电。
2、放电:蓄电池对外电路输出电能时叫做放电。
3、浮充放电:蓄电池和其他直流电源并联,对外电路输出电能叫做浮充放电。
有不间断供电要求的设备,起备用电源作用的蓄电池都处于该种放电状态。
4、电动势:外电路断开,即没有电流通过电池时在正负极间量得的电位差,叫电池的电动式。
5、端电压:电路闭合后电池正负极间的电位差叫做电池的电压或端电压6、安时容量:电池的容量单位为安时,即:电池容量Q(安时)=I放×t放I放为放电电流(安)t放为放电时间(小时)7、电量效率(安时效率):输出电量与输入电量之间的比叫做电池的电量效率,也叫作安时效率。
电量效率(%) =(Q放÷Q充)×100%=(I放×t放)÷(I充×I充)×100%Q放和Q充分别是放电和充电容量(安时8、自由放电:由于电池的局部作用造成的电池容量的消耗。
容量损失搁置之前的容量之比,叫做蓄电池的自由放电率自由放电率(%)= (Q1-Q2)÷Q1×100%Q1为搁置前放电容量(安时)Q2为搁置后放电容量(安时)9、使用寿命:蓄电池每充电、放电一次,叫做一次充放电循环,蓄电池在保持输出一定容量的情况下所能进行的充放电循环次数,叫做蓄电池的使用寿命。
二、铅酸蓄电池(一)定义铅酸蓄电池是是蓄电池的一种,主要特点是采用稀硫酸做电解液,用二氧化铅和绒状铅分别做为电池的正极和负极的一种酸性蓄电池。
电池常见知识点总结图一、电池的概念和分类电池是一种能够将化学能转化为电能的装置。
根据电池内部化学反应产生的电荷性质,电池可分为原电池和蓄电池两大类。
原电池是只能使用一次的电池,一旦能量耗尽就要报废;而蓄电池则是能够多次充放电使用的电池,可以反复使用。
二、电池的工作原理电池的工作原理是通过化学反应产生电流。
当电池两极之间连接外部电路时,自由电子从负极流动到正极,这就构成了电流。
化学反应导致正负两极电荷积累的差异,产生电动势差(电压),从而使电流在外部电路中流动。
当电池脱开外部电路,化学反应停止,电池不再产生电流。
三、电池的构成和性能指标1. 电池的构成电池主要由正极、负极、电解质和隔膜组成。
正极通常是氧化物,负极是还原物质,电解质则是能够导电的液体或凝胶。
隔膜则起到电解质和正负极之间隔离的作用,防止电池短路。
2. 电池的性能指标(1)电动势:电池产生的电压,用来表示电池的电性能。
(2)容量:电池所能释放和贮存的电能大小,通常用安时(Ah)或毫安时(mAh)表示。
(3)循环寿命:蓄电池的使用寿命,即能够循环充放电的次数。
四、电池的应用和发展电池已广泛应用于电子产品、汽车、航空航天等领域。
随着科学技术的发展,电池也在不断改进,如锂离子电池、聚合物电池、钠离子电池等新型电池相继问世,具有更高的能量密度和更长的寿命。
五、环保与安全问题电池的生产和回收对环境影响较大,因此需注意环保。
电池在使用过程中,温度过高或过低都会影响其性能,甚至发生爆炸。
因此在使用电池过程中需注意安全。
六、电池的储存和维护1. 电池的储存(1)不使用的电池应该存放在阴凉干燥的地方。
(2)长时间不用的电池要定期进行充放电,以保持电池性能。
2. 电池的维护(1)尽量减少深放电,以延长电池寿命。
(2)不要将电池长时间暴露在高温环境中,以免影响电池性能。
七、常见问题解决1. 电池充电速度慢可能是充电器或电池本身问题,可以更换充电器或电池。
2. 电池温度过高可能是使用环境问题,需要调整环境或更换电池。