锂电池基础知识
- 格式:ppt
- 大小:12.99 MB
- 文档页数:80


一、电池的化学知识物质发生化学反应的种类有多种,其中一种是氧化还原反应,在这种反应中,实际是电子在反应物中的转移过程。
通常把提供电子的物质叫还原剂,接受电子的物质叫氧化剂。
在电池体系里,一般把这些还原剂或氧化剂统一称作活性物质,活性物质在电池体系中发生的氧化还原反应就是电池反应。
原剂或氧化剂和导电骨架加工在一起,便成了电极,其中,还原剂电极发生电池反应时是失去电子,叫负极,而由氧化剂组成的电极在反应中则得到电子,叫正极,对于可充电的电池,正极又叫阴极,负极又叫阳极。
当电极插入到相关的溶液时,便获得了一电势,一般称为电极电位.正极,负极处于一相同溶液体系之下是否有电位差,是能否发生电池反应的必要条件。
1.1. 电池的工作原理和分类电池是将物质的化学能转变成电能的一种装置。
电池工作时,负极(阳极)发生化学反应,给出电子,电子通过外部电子通道传到正极(阴极)并被其消耗,就这样,电池工作时,电子会源源不断的从负极(阳极)跑出来,通过外部电路到达正极(阴极),直到两电极中某一方被消耗完,电子才会停止转移。
电子的定向流动便成为电流,最终获得电能。
1.2. 电池的组成要使电池能连续工作,必需包含以下部分:电极,电解质,隔离物以及电池外壳。
1.2.1 电极一般由活性物质和导电骨架组成,如前所述,又分为正(阴)极和负(阳)极,是电池的核心部分,是电池产生电能的源泉,通过两极上活性物质和化学变化使化学能转变为电能,导电骨架主要起着传导电子和支撑活性物质的作用,又叫集流体。
1.2.2 电解质的一般作用是完成电池放电时的离子导电过程。
电池工作时,负极提供的电子通过电池体系的外部电路到达正极从而提供电能,要实现这个能量转换过程,还必需要有一个内部离子导电过程以完成电流回路。
离子的正向移动产生电流,电解质的导电就是通过其内部体系的离子迁移从而实施离子导电。
1.2.3 隔离物能常是指置于电池正负极之间的材料,其作用是阻止正、负极活性材料的直接接触,防止电池的内部短路,并能阻挡两极粉状物质的透过。

电池基础知识培训资料一、锂离子电池工作原理与性能简介:1、电池的定义:电池是一种能量转化与储存的装置,它通过反应将化学能或物理能转化为电能,电池即是一种化学电源,它由两种不同成分的电化学活性电极分别组成正负极,两电极浸泡在能提供媒体传导作用的电解质中,当连接在某一外部载体上时,通过转换其内部的化学能来提供能源.2、锂离子电池的工作原理:即充放电原理。
Li-ion的正极材料是氧化钴锂,负极是碳。
当对电池进行充电时,电池的正极上有锂离子生成,生成的锂离子经过电解液运动到负极.而作为负极的碳呈层状结构,它有很多微孔,达到负极的锂离子就嵌入到碳层的微孔中,嵌入的锂离子越多,充电容量越高。
同样,当对电池进行放电时(即我们使用电池的过程),嵌在负极碳层中的锂离子脱出,又运动回正极。
回正极的锂离子越多,放电容量越高。
我们通常所说的电池容量指的就是放电容量。
在Li-ion的充放电过程中,锂离子处于从正极→负极→正极的运动状态。
Li—ion就象一把摇椅,摇椅的两端为电池的两极,而锂离子就象运动员一样在摇椅两端来回奔跑。
所以,Li—ion又叫摇椅式电池。
通俗来说电池在放电过程中,负极发生氧化反应,向外提供电子;在正极上进行还原反应,从外电路接收电子,电子从负极流到正极,而电流方向正好与电子流动方向相反,故电流经外电路从正极流向负极。
电解质是离子导体,离子在电池内部的正负极之间定向移动而导电,阳离子流向正极,阴离子流向负极。
整个电池形成了一个由外电路的电子体系和电解质的离子体系构成的完整放电体系,从而产生电能。
正极反应:LiCoO2==== Li1-xCoO2+ xLi+ + xe负极反应:6C + xLi+ + xe—=== Lix C6电池总反应:LiCoO2 + 6C ==== Li1-xCoO2 + LixC63、电池的连接:根据电池的电压与容量的需求,可以把电池做串联、并联及混连连接。
a、串联:电压升高,容量基本不变;b、并联:电压基本不变,容量升高;c、混联:电压与容量都会升高;4、化学电池的种类:锂离子电池按电池外形来分类,可分为圆柱形、方形、钮扣形和片状形等。

首先进行一些基础的解释,解释一下锂电池的这些指标,看到现在有很多很多的新手甚至是老鸟总被这些指标弄得一头雾水的在此作为一个知识性的普及吧!应该对大家有用说的不对的欢迎指正。
1.电压:通常有3.6V锂离子电池,3.7V锂聚合物电池他们在%电压方面的%充电和使用基本上可以归为一类,标准放电平台都是3.0V~4.2V 也就是安全电压。
当然这个使用上的一类只是电压上的!电流方面锂离子电池远远不如锂聚合物电池。
稍候阐述。
2.容量:通常有mAh Ah等。
这是一个复合型单位,mA,A代表的是电流 1000MA=1A (A:安培amper)H当然就是时间(H:Hour,小时)这些都是英文的简写。
例如一块电池如果是1000mAh的那么就代表该电池在1小时放完自身所有电量的情况下(从4.2V~2.0V)(V:volt 伏特)能够达到1000mA的平均电流。
或者简单一些可以理解为能够以1000mA的电流放电持续1小时。
1000MAH可以换算为1Ah,这里大家存在一个误区,可能简单的认为我们以2000mAh的电流放这块电池那么这块电池的放电时间就可以坚持半小时。
这样说不能说是错误的但至少是不严谨的。
因为随着电流的增加电池的内阻不变的情况下,产生的热量在不断的增加,并且电池的内阻越是大电流的情况下体现的越明显,因为外部电路的电阻随着放电电流的增加必然减少而电池内阻不变的情况下必然导致效率降低发热增高,所以刚才提到的举例的那块电池在2000MAH下放电时间必然少于半小时并且电流越大这点体现的越明显,也就是说这块电池在10A的情况下放电时间将远远少于6分钟!还有另一种容量单位,在模型中不常用,就是瓦时(WH)瓦特/每小时简单的说就是用电压乘以电流得到的。
仍然是上边举例的电池1000ma放电1小时那么它的电量就是3.7Vx1000mah=3700mWh(毫瓦/小时)=3.7WH代表这块电池能够以3.7瓦的功率放电1小时。
换一个例子大家就可以理解了,例如我的450级直升机的电池是3S1P 2200MAH 20C 11.1V的那么我的这个电池就是大概是120W左右这样用电池的24.4Wh除以120W约等于0.2小时=12分钟了。


锂电池基础知识及航空运输指南
锂电池基础知识包括以下几个方面:
1、锂是一种特别容易发生反应的金属,外观呈银白色,非常柔软、可伸展,且易燃。
2、锂电池的危险性取决于其所含的锂。
当锂电池遇到水、过度充电、极限温度等情况时,有可能发生短路、着火等危险。
3、锂电池的规格和容量各不相同,需要根据其额定电压和容量进行分类和运输。
4、锂电池的存储和运输需要遵守相关规定,如禁止在高温或低温环境下存储和运输,禁止与易燃物品混合存放等。
航空运输锂电池时需要注意以下几点:
1、需要了解锂电池的规格和容量,以及航空公司和机场对锂电池的具体要求和限制。
2、需要准备相关文件和资料,如危险品申报单、锂电池测试报告、包装证明等。
3、需要选择符合要求的包装箱和固定装置,以确保锂电池在运输过程中的安全。
4、需要遵守航空公司和机场的相关规定,如禁止在高温或低温环境下存储和运输,禁止与易燃物品混合存放等。
5、需要了解目的地机场对锂电池的进口要求和限制,以及相关税费和手续。
总之,锂电池是一种危险品,需要谨慎处理和运输。
在航空运输过程中,需要遵守相关规定和要求,以确保锂电池的安全。

一、电池的化学知识物质发生化学反应的种类有多种,其中一种是氧化还原反应,在这种反应中,实际是电子在反应物中的转移过程。
通常把提供电子的物质叫还原剂,接受电子的物质叫氧化剂。
在电池体系里,一般把这些还原剂或氧化剂统一称作活性物质,活性物质在电池体系中发生的氧化还原反应就是电池反应。
原剂或氧化剂和导电骨架加工在一起,便成了电极,其中,还原剂电极发生电池反应时是失去电子,叫负极,而由氧化剂组成的电极在反应中则得到电子,叫正极,对于可充电的电池,正极又叫阴极,负极又叫阳极。
当电极插入到相关的溶液时,便获得了一电势,一般称为电极电位.正极,负极处于一相同溶液体系之下是否有电位差,是能否发生电池反应的必要条件。
1.1. 电池的工作原理和分类电池是将物质的化学能转变成电能的一种装置。
电池工作时,负极(阳极)发生化学反应,给出电子,电子通过外部电子通道传到正极(阴极)并被其消耗,就这样,电池工作时,电子会源源不断的从负极(阳极)跑出来,通过外部电路到达正极(阴极),直到两电极中某一方被消耗完,电子才会停止转移。
电子的定向流动便成为电流,最终获得电能。
1.2. 电池的组成要使电池能连续工作,必需包含以下部分:电极,电解质,隔离物以及电池外壳。
1.2.1 电极一般由活性物质和导电骨架组成,如前所述,又分为正(阴)极和负(阳)极,是电池的核心部分,是电池产生电能的源泉,通过两极上活性物质和化学变化使化学能转变为电能,导电骨架主要起着传导电子和支撑活性物质的作用,又叫集流体。
1.2.2 电解质的一般作用是完成电池放电时的离子导电过程。
电池工作时,负极提供的电子通过电池体系的外部电路到达正极从而提供电能,要实现这个能量转换过程,还必需要有一个内部离子导电过程以完成电流回路。
离子的正向移动产生电流,电解质的导电就是通过其内部体系的离子迁移从而实施离子导电。
1.2.3 隔离物能常是指置于电池正负极之间的材料,其作用是阻止正、负极活性材料的直接接触,防止电池的内部短路,并能阻挡两极粉状物质的透过。
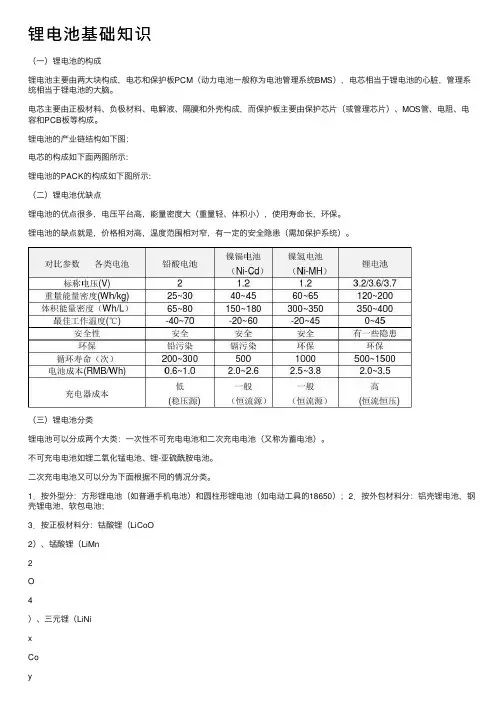
锂电池基础知识(⼀)锂电池的构成锂电池主要由两⼤块构成,电芯和保护板PCM(动⼒电池⼀般称为电池管理系统BMS),电芯相当于锂电池的⼼脏,管理系统相当于锂电池的⼤脑。
电芯主要由正极材料、负极材料、电解液、隔膜和外壳构成,⽽保护板主要由保护芯⽚(或管理芯⽚)、MOS管、电阻、电容和PCB板等构成。
锂电池的产业链结构如下图:电芯的构成如下⾯两图所⽰:锂电池的PACK的构成如下图所⽰:(⼆)锂电池优缺点锂电池的优点很多,电压平台⾼,能量密度⼤(重量轻、体积⼩),使⽤寿命长,环保。
锂电池的缺点就是,价格相对⾼,温度范围相对窄,有⼀定的安全隐患(需加保护系统)。
(三)锂电池分类锂电池可以分成两个⼤类:⼀次性不可充电电池和⼆次充电电池(⼜称为蓄电池)。
不可充电电池如锂⼆氧化锰电池、锂-亚硫酰胺电池。
⼆次充电电池⼜可以分为下⾯根据不同的情况分类。
1.按外型分:⽅形锂电池(如普通⼿机电池)和圆柱形锂电池(如电动⼯具的18650);2.按外包材料分:铝壳锂电池,钢壳锂电池,软包电池;3.按正极材料分:钴酸锂(LiCoO2)、锰酸锂(LiMn2O4)、三元锂(LiNixCoyMnzO2)、磷酸铁锂(LiFePO4);4.按电解液状态分:锂离⼦电池(LIB)和聚合物电池(PLB);5.按⽤途分:普通电池和动⼒电池。
6.按性能特性分:⾼容量电池、⾼倍率电池、⾼温电池、低温电池等。
(四)常⽤术语解释1.容量(Capacity)指⼀定的放电条件下可以从电池锂获得的电量。
我们在⾼中学物理是知道,电量的公式为Q=I*t,单位为库伦,电池的容量单位规定为Ah (安时)或mAh(毫安时)。
意思是1AH的电池在充满电的情况下⽤1A的电流放电可以放1个⼩时。
以前的NOKIA的⽼⼿机的电池(像BL-5C)⼀般是500mAh,现在的智能⼿机电池800~1900mAh,电动⾃⾏车⼀般都是10~20Ah,电动汽车⼀般都是20~200Ah等。
2.充放电倍率(Charge-Rate/Discharge-Rate)表⽰以多⼤的电流充电、放电,⼀般以电池的标称容量的倍数为计算,⼀般称为⼏C。

锂电池基础知识三篇篇一:锂电池基础知识配料基础知识一、电极的组成:1、正极组成:a、钴酸锂:正极活性物质,锂离子源,为电池提高锂源。
b、导电剂:提高正极片的导电性,补偿正极活性物质的电子导电性。
提高正极片的电解液的吸液量,增加反应界面,减少极化。
c、PVDF粘合剂:将钴酸锂、导电剂和铝箔或铝网粘合在一起。
d、正极引线:由铝箔或铝带制成。
2、负极组成:a、石墨:负极活性物质,构成负极反应的主要物质;主要分为天然石墨和人造石墨两大类。
b、导电剂:提高负极片的导电性,补偿负极活性物质的电子导电性。
提高反应深度及利用率。
防止枝晶的产生。
利用导电材料的吸液能力,提高反应界面,减少极化。
(可根据石墨粒度分布选择加或不加)。
c、添加剂:降低不可逆反应,提高粘附力,提高浆料黏度,防止浆料沉淀。
d、水性粘合剂:将石墨、导电剂、添加剂和铜箔或铜网粘合在一起。
e、负极引线:由铜箔或镍带制成。
二、配料目的:配料过程实际上是将浆料中的各种组成按标准比例混合在一起,调制成浆料,以利于均匀涂布,保证极片的一致性。
配料大致包括五个过程,即:原料的预处理、掺和、浸湿、分散和絮凝。
三、配料原理:(一)、正极配料原理1、原料的理化性能。
(1)钴酸锂:非极性物质,不规则形状,粒径D50一般为6-8μm,含水量≤0.2%,通常为碱性,PH值为10-11左右。
锰酸锂:非极性物质,不规则形状,粒径D50一般为5-7μm,含水量≤0.2%,通常为弱碱性,PH值为8左右。
(2)导电剂:非极性物质,葡萄链状物,含水量3-6%,吸油值~300,粒径一般为2-5μm;主要有普通碳黑、超导碳黑、石墨乳等,在大批量应用时一般选择超导碳黑和石墨乳复配;通常为中性。
(3)PVDF粘合剂:非极性物质,链状物,分子量从300,000到3,000,000不等;吸水后分子量下降,粘性变差。
(4)NMP:弱极性液体,用来溶解/溶胀PVDF,同时用来稀释浆料。
2、原料的预处理(1)钴酸锂:脱水。