瑞氏染色液配制及使用方法
- 格式:docx
- 大小:73.36 KB
- 文档页数:3

瑞氏染色操作步骤瑞氏染色是一种常见的染色技术,用于细胞、组织和生物样本的研究中。
该技术可用于确定细胞形态、染色体数量和形态、染色体变异等。
以下是瑞氏染色的操作步骤:1.样本处理:样本一般采用新鲜的、保存良好的细胞或组织样本。
在处理之前,需要检查样本是否符合要求。
例如,细胞样本应具有充足的数量和活力,组织样本应达到一定的厚度和大小。
此外,需要对样本进行预处理,如固定处理、去除上皮细胞等。
2.制片:制作干片是瑞氏染色的重要步骤。
首先,用无菌的玻片将样本涂抹均匀。
有时还需要使用刮片等工具辅助涂抹。
然后,制片需通过加热、干燥等过程。
这使得细胞或组织与玻片表面相关联,以便在后续染色过程中处理。
3.染色:将制片进行染色是瑞氏染色的核心步骤。
瑞氏染色使用吉姆萨染色(Giemsa stain)或艾因染色(Ehrlich stain)方法。
在吉姆萨染色中,可以使用不同的吉姆萨组合来改变细胞或染色体染色的颜色。
在艾因染色中,使用配制艾因染液进行染色。
两种方法的染色时间和温度也有所不同。
在染色过程中,需要控制好样本的染色时间和温度,以避免染色过度或过轻。
4.显微镜观察:经过染色后,制片需要用显微镜观察。
观察时要准确、认真、耐心、细致。
需要注意的是,显微镜的放大倍数和焦距要调整到合适的位置,以获得清晰的细胞或染色体图像。
5.结果分析:根据显微镜观察得到的图像,可以对样本进行分析和判断。
主要从细胞形态、染色体数量和形态、染色体变异等方面进行评估,并与常模比较,以便对生物样本进行分类、鉴定和研究。
总的来说,瑞氏染色是一种简单、常用的染色技术,适用于细胞、组织和生物样本的研究。
操作过程中需要注意样本处理、制片、染色、显微镜观察和结果分析等关键步骤。
只有仔细、细致地操作,才能获得高质量的实验数据。

瑞氏染液使用说明货号:G1040规格:50ml/100ml保存:室温避光保存,有效期至少2年。
产品说明:瑞氏染料是由碱性染料美蓝(Methvlem blue)和酸性染料伊红(Eostm Y)组成的复合染料,溶于甲醇。
伊红通常为钠盐,有色部分为阴离子。
美蓝通常为氯盐,有色部分为阳离子。
甲醇的作用:一是溶解美蓝和伊红,使其解离为有色美蓝正离子的和伊红负离子。
后两者可以选择性地吸附于血细胞内的不同成分而使其着色;二是固定细胞形态,加速染色反应,增强染色效果。
使用方法:本产品可作为多种组织或细胞的染色使用,不同组织、细胞,不同的用途可以有不同的使用方法。
具体方法请根据自己需求参考既有文献,本产品以涂片为例,举例说明,仅供参考。
1、取涂片、自然干燥。
2、滴加瑞氏染液染3分钟,使标本被其中甲醇所固定。
3、加等量PH6.4的磷酸盐缓冲液(或等量超纯水)轻轻晃动玻片,与瑞氏染色液混匀,静置5分钟。
4、水洗、吸干、镜检。
5、细菌染成蓝色,组织细胞胞浆红色,细胞核蓝色。
注意事项:1、涂片厚薄适宜,涂片干透后固定,否则细胞在染色过程中容易脱落。
2、所加染液不能过少,以免蒸发而使染料沉淀。
冲洗时间不能过久,以防脱色。
3、染色对pH十分敏感,稀释染液必须用缓冲液,冲洗用水应接近中性,否则可能会导致细胞染色异常,形态难以识别,甚至错误。
4、染色过淡可以复染,复染时应先加缓冲液,然后加染液。
染色过深可用流水冲洗或浸泡,也可用甲醇脱色。
相关试剂:P210010×多聚赖氨酸G1010姬姆萨染色液G1100伊红染色液G1140苏木素染色液(常规染色)G1120H-E染色试剂盒。

瑞氏染色操作步骤瑞氏染色是一种常用的细胞染色方法,主要用于观察细胞核形态和染色体结构。
下面将详细介绍瑞氏染色的操作步骤。
一、实验前准备1.1 材料准备瑞氏染色所需的材料有:0.075mol/L KCl、甲醛、乙酸、96%乙醇、苯酚红溶液、甲基绿溶液和天然丝。
1.2 设备准备实验所需的设备有:离心机、恒温水浴器和显微镜等。
二、样品制备2.1 细胞培养首先需要培养好待检测的细胞,使其达到适当生长状态。
在培养过程中,应注意避免污染和过度生长等问题。
2.2 细胞处理将待检测的细胞收集到离心管中,并加入0.075mol/L KCl缓冲液进行离心。
将上清液倒掉,再加入甲醛进行固定处理。
2.3 固定处理将含有甲醛的离心管放置在恒温水浴器中,在37℃下固定处理30分钟,使细胞膜破裂并释放染色体。
2.4 滴定染色将固定后的细胞加入苯酚红溶液,再滴入甲基绿溶液,使染料均匀地覆盖在细胞上。
三、显微镜观察将染好色的细胞片放置在显微镜下进行观察。
可以通过调节显微镜的焦距和光源亮度等参数来获得更清晰的图像。
四、实验注意事项4.1 操作过程中应注意保持无菌环境,避免污染样品。
4.2 在固定处理时,应控制好温度和时间,避免过度固定或过短固定导致样品失真。
4.3 在滴定染色时,应注意均匀地覆盖在细胞上,并避免出现气泡等问题。
总结:瑞氏染色是一种常用的细胞染色方法,其操作步骤包括实验前准备、样品制备、显微镜观察和实验注意事项等方面。
在操作过程中需要注意保持无菌环境、控制好温度和时间、均匀地覆盖染料等问题,以获得更准确的实验结果。

瑞氏染色瑞氏染色是目前最常用而又最简单的染色方法。
1原理:瑞氏试剂中之酸性伊红和碱性美篮混合经化学作用后,变成中性之伊红化美蓝,久置后,经氧化而含有天青。
此三种染料分别和细胞核及浆中的NH3+和COO-等结合,使细胞核及胞浆着色。
由于系中性染料,又有缓冲液调节酸碱度,所以细胞受染后,蓝红等颜色都较适中,核染质、胞浆及其中之颗粒显色较为清楚。
2 试剂配制:1、瑞氏试剂瑞氏染料(粉)1克,加不含醋酮之甲醇600毫升溶解过滤后即成。
混合方式可将瑞氏染料置于研钵内,加适量甲醇混合研磨,使染料溶解,将已溶解的液体倒入清洁玻瓶,再放入甲醇继续溶解剩下染料,直至染料及甲醇均用完为止,然后过滤,以深色中性之玻璃瓶储备待用。
亦可将1克染料一次加入600毫升甲醇中,盛深色玻璃瓶内,塞好瓶口,置于温暖而黑暗之处或37度温箱内,每日振荡5min,连续7天以上,然后过滤储备用。
染液宜久置后使用,通常存放愈久,染色效果愈好。
2、缓冲液由1%的磷酸氢二钠和1%的磷酸二氢钾各30毫升加蒸馏水1000毫升配成,或以上两药各1克加2500毫升左右蒸馏水制成。
以石蕊试纸检验、调整酸碱度,使PH在6.5-7之间即可。
缓冲液亦可永新鲜蒸馏水或煮沸后密闭保存的蒸馏水。
如蒸馏水与空气过多接触,则可因吸收空气中之二氧化碳而使PH值变低,影响染色,故不宜使用。
3、染色步骤1 将已编号之涂片水平置于染色板或者染色架上,涂片两端各划一道蜡笔线,主要防止染液外溢。
2 滴加瑞氏染色液。
其多少依标本所占面积大小而定,一般为4-8滴,至染液将标本完全盖住为止。
染液不宜过少,否则,甲醛挥发后,易产生沉淀;不可过多,以免因过盛而流失,影响染色。
3 1-2分钟后,滴入缓冲液(染液与缓冲液的比例约为1:1.5,冬季1:1,夏季1:2)。
以气囊向玻璃片上轻轻打气,使染液和缓冲液混合均匀,一般不宜口吹起,以免呼出二氧化碳改变缓冲液酸碱度而影响染色。
4 自缓冲液滴入10-15分钟后,用自来水冲洗。

瑞氏染色操作流程一、瑞氏染色实验前准备1.1准备染色液和显影液针对瑞氏染色实验,首先要准备染色液和显影液,染色液由25mL的瑞氏染料,90mL的盐酸溶液(浓度为5%),以及1mL的激发剂混合而成。
而显影液则是在10mL的9N的硫酸、10mL的5%的NaOH溶液、10mL的1%的苯甲醇和10mL的1%的芳香族醇基乙醇混合而成。
1.2准备染色木质菌梗在预先准备瑞氏染色液和显影液后,接下来要准备染色用的木质菌梗才能开始瑞氏染色实验。
首先,用洗碗笠将要染色的木质菌梗洗淨,然后用医用刀在木质菌梗中切出厚约2mm的薄片,最后用蒸汽–水泼淋法将木质菌梗片浸湿,方可准备瑞氏染色实验。
二、瑞氏染色实验操作2.1放置染色片在准备好染色液和显影液,以及木质菌梗薄片后,此时要把准备的的木质菌梗薄片放置在染色槽内,以留出表面空间,方便染色液充分浸渍。
2.2加入染色液之后将准备的瑞氏染色液加入染色槽,在实验室内控制温度为37℃,放置20分钟后,可以观察菌梗表面是否呈染色,一般都可以看到浅色到深色之间的蓝色或紫色染色,这说明瑞氏染色已经取得成功。
2.3加入显影液如果瑞氏染色实验成功,那么接下来可以准备将木质菌梗片洗净后加入显影液了,而此时温度需要将控制在22℃,放置5-10分钟后,可以发现菌梗片变淡,并且半透明,证明显影液已经取得成功。
2.4用x网影像再接着,用X网影像观测染色后的木质菌梗,当观测到菌梗表面开始出现斑斑点点发亮时,这表明染色实验结束,在此基础上对木质菌梗进行另一个体系的判断,也就是对菌梗的形态和染色的准确性进行分类、认定和鉴定。
三、瑞氏染色实验结束完成上述瑞氏染色实验操作后,就可以对经过染色后的木质菌梗进行分析、鉴定,完成木质菌梗的离子吸收率、分子斑点和染色效果等等内容,通过瑞氏染色实验把细菌聚集在一起,以便进行实验分析,这正是瑞氏染色实验取得成功的原因。


瑞氏染液配制、使用方法及注意事项南宁市二医院检验科马升俊1.瑞氏染色的原理:瑞氏染色法使细胞着色既有化学亲和反应,又有物理吸附作用。
瑞氏染料由酸性染料伊红和碱性染料美蓝的氧化物(天青)组成,其深于甲醇后,解离为带正电的美蓝和带负电的伊红离子。
各种细胞由于其所含化学成分不同,对染料的亲和力也不一样,因此,染色后各种细胞呈现出各自的染色特点。
2.试剂的配制:2.1 瑞氏染液的配制:2.1.1 自配染液:瑞氏染粉0.1g,甲醇(AR)60ml。
将瑞氏染粉放入清洁干燥研钵中,先加少量甲醇,充分研磨使染料溶解,将巳溶解的染料倒入棕色试剂瓶中,未溶解的再加少量甲醇研磨,直至染料完全溶解,甲醇全部用完为止。
染液配好后放于室温下,一周后即可使用。
新配制染液效果较差,放置时间延长,染色效果越好。
久置应密封,以免甲醇挥发或氧化成甲酸。
染液中也可加中性甘油2~3ml,除可防止甲醇过早挥发外,也可使细胞着色清晰。
2.1.2 成品瑞氏染液:现巳有成品瑞氏染液,如四川迈克科技公司出的快速瑞氏染色试剂(500ml/瓶)其只需室温密闭储存,可长期稳定,染色效果好。
2.2 缓冲液的配制: 称取磷酸二氢钾(无水)0.3 g,磷酸氢二钠(无水)0.2 g;加蒸馏水至1000 ml使其溶解。
配好后磷酸盐缓冲溶液应校正PH值,其范围在PH6.4~6.8即可,后塞紧瓶口备用。
3. 瑞氏染色的使用方法:(以血涂片为例):3.1把制好的血涂片编好号,然后将血片平放在染色架上;3.2加瑞氏染液数滴,使其覆盖整个血膜,固定细胞约1分钟;3.3滴加等量或稍多的缓冲液(可按1:2滴加),使染液充分混匀,染色5~10分钟;3.4用流水冲洗去染液,待干后镜检。
4.染色结果判断:在正常情况下,血膜外观染成淡紫红色。
显微镜下,红细胞呈粉红色,在厚薄均匀处,略有碟状感。
白细胞浆中颗粒清楚,并显示出各种细胞特有的色彩。
细胞核染紫红色,核染色质结构清楚。
5.注意事项:5.1 PH对细胞染色有影响。

简述瑞氏染色法的步骤
瑞氏染色法是一种常用的染色技术,可以用于细胞和组织的染色。
它
是由丹麦科学家汉斯·克里斯蒂安·瑞氏于1884年首次提出的。
该方法
通过使用甲苯和乙醇的混合物处理样本,然后用胰蛋白酶去除细胞膜上的
脂肪,最后用甲苯溶液进行染色,以显示细胞的核和胞质细胞器。
具体步
骤如下:
1.处理样本:首先,将待染色的细胞或组织样本置于甲苯中,以去除
样本中的脂肪。
2.脱水:将样本放入一系列乙醇浓度不断增加的溶液中,以脱水样本。
这一步骤有助于防止样本的脂肪重新进入细胞。
3.清洗:用清洁的甲醇或二甲苯清洗样本。
这一步骤有助于去除残留
的脂肪和乙醇。
4.染色:将样本放入瑞氏染色剂中。
瑞氏染色剂是一种由甲苯、酸性
染料(如酸性果胶酸和酸性红G)和邻苯二甲酸二丁酯组成的溶液。
该溶
液可以染色细胞核和胞质细胞器。
5.清洗:将样本从染色剂中取出,用甲醇或二甲苯轻轻洗涤,以去除
多余染料。
6.干燥:用空气吹干样本或者放置在加热器中干燥。
7.盖片:将样本置于玻璃盖片上,加入合适的封片剂(如硬脂酸树脂),然后覆盖另一块盖片。
8.固定:将盖片置于120°C的烘箱中固定,使其更加耐久。
使用瑞氏染色法可以染色细胞核为蓝色或紫色,并使胞质细胞器以深红色或橙色显现。
这种染色方法在生物学、医学和组织学等领域被广泛使用,它可以帮助研究人员观察细胞和组织的结构与功能,提供有关细胞和组织的信息。

瑞氏-姬姆萨染液说明书货号:G1020规格:100ml/500ml保存:室温避光保存,有效期至少2年。
产品说明:瑞氏-姬姆萨染液是一种复合染液,兼有瑞氏和姬姆萨染液二者优点,主要应用于血液和骨髓涂片染色。
各种细胞及细胞的各种成分由于其化学性质不同,对瑞氏-姬姆萨染色液中的酸性染料和碱性染料的亲和力也不同,因此,标本涂片经瑞氏-姬姆萨染色液染色后,相应各类细胞呈现不同的着色,从而达到辨别其形态特征的目的。
瑞氏染色液对胞浆着色力较强,能较好的显示胞浆的嗜碱性程度,着色清晰,色泽纯正,但是对胞核着色偏深,核结构显示较差。
姬姆萨染色对细胞核着色程度适中,细胞核结构和色泽清晰艳丽,对核结构的识别较佳,但对胞浆着色较差,故采用瑞氏姬姆萨混合染色,具有染色效果好,对比清晰,操作简便等特点。
使用方法:本产品可作为多种组织或细胞的染色使用,不同组织、细胞,不同的用途可以有不同的使用方法。
具体方法请根据自己需求参考既有文献,本产品以涂片为例,举例说明,仅供参考。
1、取涂片、自然干燥。
2、滴加瑞氏-姬姆萨染液2-3滴覆盖整个标本涂片,染1-2分钟。
3、滴加等量的0.01M磷酸盐缓冲液(PH6.4-6.8),轻轻晃动玻片,与瑞氏-姬姆萨染色液充分混匀,染色3-5分钟。
4、水洗、吸干、镜检。
5、染色后胞浆和胞核的染色清晰分明,细胞核着色呈深浅不同的紫红色,胞浆呈浅红色,胞浆中颗粒区分明显。
注意事项:1、涂片厚薄适宜,涂片干透后固定,否则细胞在染色过程中容易脱落。
2、所加染液不能过少,以免蒸发而使染料沉淀。
冲洗时间不能过久,以防脱色。
3、染色对pH十分敏感,稀释染液必须用缓冲液,冲洗用水应接近中性,否则可能会导致细胞染色异常,形态难以识别,甚至错误。
4、染色过淡可以复染,复染时应先加缓冲液,然后加染液。
染色过深可用流水冲洗或浸泡,也可用甲醇脱色。
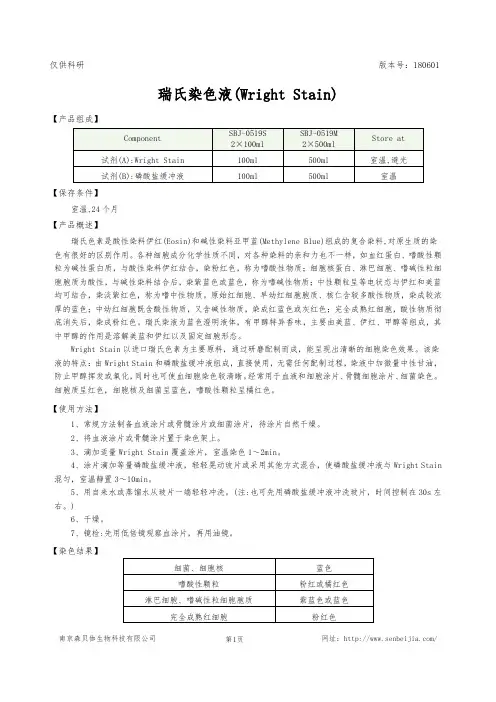
南京森贝伽生物科技有限公司 网址:/仅供科研版本号:180601瑞氏染色液(Wright Stain)【产品组成】【保存条件】室温,24个月【产品概述】瑞氏色素是酸性染料伊红(Eosin)和碱性染料亚甲蓝(Methylene Blue)组成的复合染料,对原生质的染色有很好的区别作用。
各种细胞成分化学性质不同,对各种染料的亲和力也不一样,如血红蛋白、嗜酸性颗粒为碱性蛋白质,与酸性染料伊红结合,染粉红色,称为嗜酸性物质;细胞核蛋白、淋巴细胞、嗜碱性粒细胞胞质为酸性,与碱性染料结合后,染紫蓝色或蓝色,称为嗜碱性物质;中性颗粒呈等电状态与伊红和美蓝均可结合,染淡紫红色,称为嗜中性物质。
原始红细胞、早幼红细胞胞质、核仁含较多酸性物质,染成较浓厚的蓝色;中幼红细胞既含酸性物质,又含碱性物质,染成红蓝色或灰红色;完全成熟红细胞,酸性物质彻底消失后,染成粉红色。
瑞氏染液为蓝色澄明液体,有甲醇特异香味,主要由美蓝、伊红、甲醇等组成,其中甲醇的作用是溶解美蓝和伊红以及固定细胞形态。
Wright Stain 以进口瑞氏色素为主要原料,通过研磨配制而成,能呈现出清晰的细胞染色效果。
该染液的特点:由Wright Stain 和磷酸盐缓冲液组成,直接使用,无需任何配制过程,染液中加微量中性甘油,防止甲醇挥发或氧化,同时也可使血细胞染色较清晰。
经常用于血液和细胞涂片、骨髓细胞涂片、细菌染色。
细胞质呈红色,细胞核及细菌呈蓝色,嗜酸性颗粒呈橘红色。
【使用方法】1、常规方法制备血液涂片或骨髓涂片或细菌涂片,待涂片自然干燥。
2、将血液涂片或骨髓涂片置于染色架上。
3、滴加适量Wright Stain 覆盖涂片,室温染色1~2min 。
4、涂片滴加等量磷酸盐缓冲液,轻轻晃动玻片或采用其他方式混合,使磷酸盐缓冲液与Wright Stain 混匀,室温静置3~10min 。
5、用自来水或蒸馏水从玻片一端轻轻冲洗。
(注:也可先用磷酸盐缓冲液冲洗玻片,时间控制在30s 左右。
仅供科研使用版本号:170303瑞氏染色液(Wright Stain)【产品组成】Component SBJ-0519S2×100mlSBJ-0519M2×500mlStore at试剂(A):Wright Stain 100ml 500ml 室温,避光试剂(B):磷酸盐缓冲液100ml 500ml 室温【保存条件】室温,24个月【产品概述】瑞氏色素是酸性染料伊红(Eosin)和碱性染料亚甲蓝(Methylene Blue)组成的复合染料,对原生质的染色有很好的区别作用。
各种细胞成分化学性质不同,对各种染料的亲和力也不一样,如血红蛋白、嗜酸性颗粒为碱性蛋白质,与酸性染料伊红结合,染粉红色,称为嗜酸性物质;细胞核蛋白、淋巴细胞、嗜碱性粒细胞胞质为酸性,与碱性染料结合后,染紫蓝色或蓝色,称为嗜碱性物质;中性颗粒呈等电状态与伊红和美蓝均可结合,染淡紫红色,称为嗜中性物质。
原始红细胞、早幼红细胞胞质、核仁含较多酸性物质,染成较浓厚的蓝色;中幼红细胞既含酸性物质,又含碱性物质,染成红蓝色或灰红色;完全成熟红细胞,酸性物质彻底消失后,染成粉红色。
瑞氏染液为蓝色澄明液体,有甲醇特异香味,主要由美蓝、伊红、甲醇等组成,其中甲醇的作用是溶解美蓝和伊红以及固定细胞形态。
Wright Stain以进口瑞氏色素为主要原料,通过研磨配制而成,能呈现出清晰的细胞染色效果。
该染液的特点:由Wright Stain和磷酸盐缓冲液组成,直接使用,无需任何配制过程,染液中加微量中性甘油,防止甲醇挥发或氧化,同时也可使血细胞染色较清晰。
经常用于血液和细胞涂片、骨髓细胞涂片、细菌染色。
细胞质呈红色,细胞核及细菌呈蓝色,嗜酸性颗粒呈橘红色。
【使用方法】1、常规方法制备血液涂片或骨髓涂片或细菌涂片,待涂片自然干燥。
2、将血液涂片或骨髓涂片置于染色架上。
3、滴加适量Wright Stain覆盖涂片,室温染色1~2min。
828晦学理沧与实践2(302年第15巷第7期JMed'131cor&PracVol15,No7-July2002———一————一———一———————————一—————正确,耗时j3~151。
,一F均鉴定值为878%.比常规鉴定法快些,但细菌鉴定的符音率相对低些。
刈链球菌鉴定的符台率为7l4%,耗州3。
15h.其中,化脓性链球菌、B群链球菌在3h即可鉴定出米,鉴定值均在92%以上。
从对肺炎链球荫的鉴定情况束看,卫生部一北发了3次((9704、9810、2006),H有第3次鉴定出来.=分析原因有:链球菌不易乳化,而且很难混匀.存实际操作叫,可将菌液浓度词到1##”麦氏单位;另一方面,所发质控菌株来自呼吸道感染,多为混台菌,婀不能丹纯,会影响鉴定结果。
3.3革兰氏阳}生杆蔺一一共发了5株,Vitek一32对c+b的鉴定不如G+c.在做c+c的鉴定时需注意:①正确观察细菌溶血情况和操作触酶试验;②注意镜下细菌的形态和排列方式;③将Viiek一32的生化档定结果采用双歧检索表进行鉴定。
在所发的5株荫巾.笔者根据Vitek一32的生化反应结果.结台荫落颜色、形态、溶血情况,触酶试验,完成r9701、9805、9807、9901、2002这5株菌的鉴定.且完全正确。
34时真菌的鉴定,除9702鉴定与质控菌株不符外,其余5株垒部鉴定正确.j:l鉴定值均在99%以上,耗肘24~48h,较传统方法提前24—48h,总结4年中Vltek一32对真菌的鉴定情毗,应注意:①在用Vilek一32测试时,应适当结合形态学观察;②应注意孵育时间:有的真菌在30℃培养24h后.YBC卡上机读数可直接鉴定出来,但有的需再孵育24h再次读数,切记不能将YBC昔直接孵育48h再读数,因为YBC暑培养24h和培养48t.后.判断备生化反应孔陌性界值是不同的。
综上所述,Vitek.32的运用,有勘于实验室快速诊断,提高工作效率,但同时,检验人员应加强微生物基础知识和技能的培训,加强对仪器原理的理解,严格按仪器操作规程操作,怍好室内质控工作.只有这样,才能更快,更好地为临床提供可靠的诊断和治疗依据。
瑞氏染色操作流程
1.实验准备
- 收集需要染色的细胞或组织样本,并固定在载玻片或试管中。
常用的固定方法包括用乙醇、甲醛、Perfix等。
-根据样品的特性和染色目的,选择适当的瑞氏染色方法和试剂。
常用的瑞氏染色方法包括瑞氏-厄利染色法、瑞氏-黛染色法等。
2.染色步骤
-将固定的细胞或组织样本浸入去离子水中,使其恢复至自然状态。
-准备适当浓度的染色试剂。
瑞氏染色试剂一般包括硒铁酸盐和酸性柠檬酸溶液。
-将样本浸入硒铁酸盐溶液中,浸泡时间根据实验需要和染色方法而定。
染色时间过长可能导致染色物质过量或染色效果不佳。
-用去离子水或PBS缓冲液冲洗样本,使其清洁并去除多余的染色试剂。
-将样本浸入酸性柠檬酸溶液中,去除多余的染色物质并增强染色效果。
-再次用去离子水或PBS缓冲液冲洗样本。
3.结果观察和分析
-将处理后的样本进行显微镜观察。
瑞氏染色可以用于可视化染色物质(如核酸和蛋白质)或细胞器结构(如核、线粒体等)。
-在显微镜下观察样本时,可以调整镜头焦距、曝光时间等参数,以获得清晰且准确的图像。
-观察到的染色结果可以进行进一步的分析和解释。
例如,可以量化染色强度或比较不同样本之间的染色差异。
总结:
瑞氏染色是一种常用的细胞和组织染色技术,可以用于生物学实验室的各种研究和应用。
该操作流程包括样本固定、染色步骤和结果观察与分析。
通过瑞氏染色,可以可视化并研究细胞和组织中的特定结构和分子,为生物学研究提供重要的实验基础。
改良瑞氏吉姆萨快速染色液的配制及应用【摘要】目的:通过改良瑞氏吉姆萨染色液配方和方法实现一步快染;用于白带常规检测,确认染色效果及结果。
方法:自配瑞氏吉姆萨染液,对360例白带样本采用常规染液和改良后染液检验,分析改良前后效果、结果差异。
结果:改良瑞氏吉姆萨快速染色在滴虫、真菌、线索细胞及清洁度等,与常规瑞氏吉姆萨染色检测结果无显著差异(P>0.05)。
结论:改良瑞氏吉姆萨染色液在15-25s对白带样本进行染色,效果、结果较常规染液无显著性差异;改良染液操作便捷,利于使用。
【关键词】表面活性剂;瑞氏吉姆萨染色液;白带;瑞氏吉姆萨染色是一种常用染色方法,可对血液、体液细胞染色检查,如对白带的染色检查【1】,是对妇科疾病常用的手段之一。
常规瑞氏吉姆萨染色流程为A液染色、B液染色、水洗,需要4-30min。
本文在常规染剂上优化配方及流程【3-4】,对白带样本进行15-25秒快速染色,观测效果、检测结果与常规染色方法的差异。
1材料与方法1.1瑞氏吉姆萨试剂及染色方法珠海贝索生物技术有限公司,批号20220216。
使用方法如下:①白带于玻片上烤干或烘干,滴加染色A液(约0.5ml-0.8ml)覆盖整个标本染色约2min;②加A液2-3倍量的缓冲液B液于A液上,两液混合,染色3-10min后水洗,干燥、镜检。
1.2改良瑞氏吉姆萨试剂及染色方法改良试剂配制:染液A配制:瑞氏吉姆萨染料 0.83g,甲醇0.5L,甘油50mL,曲拉通X-100 5mL,吐温-80 10mL;染料放乳钵内研磨至细粉末,加甘油、甲醇研磨,再加入曲拉通、吐温继续研磨,最后转移加甲醇定量,摇匀待用。
缓冲液B液配制:1%KH2PO4 30mL;1/15M KH2PO4 73.5 mL,结晶紫0.5g,纯化水定量至1L。
使用方法如下:①将A液与B液约按3:1混合,得到可直接使用混合染液。
②白带于玻片上烤干或烘干,滴加混合染液(约0.5ml-0.8ml)覆盖整个标本染色约15-25S后水洗,干燥、镜检。
清洁液(洗液)重铬酸钾(工业品纯)300g浓硫酸(工业品纯)300ml自来水3000ml实际上重铬酸钾、硫酸和自来水之比为1:1:10。
先将重铬酸钾溶于水,如加热须待冷后,再缓慢加入浓硫酸,边加边搅。
不准将水倒入浓硫酸内!!!另外,清洁液只能用于玻璃仪器的清洗,不能浸泡金属器械。
血涂片的制备:1、载玻片及盖玻片泡酸时间大于24小时,一张一张放,保证每一张都浸湿2、冲洗,先用自来水冲净至没有颜色,再用流水冲洗一夜3、放在95%的酒精中浸泡过夜4、取出后用棉布擦干,涂片,并用甲醇固定,竖直干燥。
Wright染色法制作血涂片1、取涂好的血片,用玻璃笔划出染色区,以防染液滴落后溢流。
2、将涂片平放桌上或者架上,滴加Wright染液至恰好布满所划范围的血膜,混动使混匀,染色约3分钟。
Wright染液配法:Wright粉剂0.1g,加甲醇60毫升。
将Wright粉剂放在乳钵内,充分研磨,越细越好。
然后取甲醇逐步加入乳钵内,边加边研磨,直至染料全部溶解,置试剂瓶中密封,以后走后可用,以放置一个月后再用最佳。
3、加入等量磷酸盐缓冲液(pH6.8~7),不断晃动,染色约12分钟,直接放与流水下冲洗。
4、染色后甩干或者直立晾干,用中性树胶或者合成树脂或香柏油封片,或不封片直接镜检。
时间:温度较低时约15分钟(染3分钟,加缓冲液不断晃动12分钟。
温度较高时,总时间约5分钟。
剂量:染液与缓冲液剂量之比为1:1如果染色不够,蒸馏水冲洗后,在按照原步骤重新染封片:干燥后的血涂片,浸入二甲苯中后在其干燥前,擦去蜡线,滴明胶与血涂片的一边(半滴至一滴),眼科镊捏住盖玻片正面在酒精灯上烘烤一下后反面贴于载玻片上。
结果:红细胞呈橘红色;中性粒细胞颗粒蓝紫色至紫红色;嗜酸性粒细胞鲜红色至橘红色;嗜碱性粒细胞颗粒深蓝紫色;淋巴细胞核深蓝紫色,胞质天蓝色;单核细胞核蓝紫色,胞质灰蓝色。
、注:①Wright染料对pH较敏感,因此用缓冲液稀释染液,可使染色作用稳定,便于识别和比较细胞的变化。
瑞氏染液
产品说明:
瑞氏染料是由碱性染料美蓝(Methvlem blue)和酸性染料伊红(Eostm Y)组成的复合染料,溶于甲醇。
伊红通常为钠盐,有色部分为阴离子。
美蓝通常为氯盐,有色部分为阳离子。
甲醇的作用:一是溶解美蓝和伊红,使其解离为有色美蓝正离子的和伊红负离子。
后两者可以选择性地吸附于血细胞内的不同成分而使其着色;二是固定细胞形态,加速染色反应,增强染色效果。
使⽤⽅法:
本产品可作为多种组织或细胞的染色使用,不同组织、细胞,不同的用途可以有不同的使用方法。
具体方法请根据自己需求参考既有文献,本产品以涂片为例,举例说明,仅供参考。
1、取涂片、自然干燥。
2、滴加瑞氏染液染3 分钟,使标本被其中甲醇所固定。
3、加等量PH6.4 的磷酸盐缓冲液(或等量超纯水)轻轻晃动玻片, 与瑞氏染色液混匀,静置5 分钟。
4、水洗、吸干、镜检。
5、细菌染成蓝色,组织细胞胞浆红色,细胞核蓝色。
注意事项:
1、涂片厚薄适宜,涂片干透后固定,否则细胞在染色过程中容易脱落。
2、所加染液不能过少,以免蒸发而使染料沉淀。
冲洗时间不能过久,以防脱色。
3、染色对pH 十分敏感,稀释染液必须用缓冲液,冲洗用水应接近中性,否则可能会导致细胞染色异常,形态难以识别,甚至错误。
4、染色过淡可以复染,复染时应先加缓冲液,然后加染液。
染色过深可用流水冲洗或浸泡,也可用甲醇脱色。
产地:国产
提示:本品仅用于科研实验,不能用作医疗及临床诊断。
储存条件::室温避光保存,有效期至少2年
关键词:瑞氏染液
瑞氏染液相关染色产品:。