慢病毒包装实验步骤PDF.pdf
- 格式:pdf
- 大小:129.99 KB
- 文档页数:2

慢病毒包装、纯化、滴度测定及感染一、包装1.包装细胞Lenti-X™ Lentiviral Expression Systems User Manual.pdf(P11); Lenti-X™ shRNA Expression Systems User Manual.pdf(P16)2.病毒载体及包装质粒病毒载体:DNA组构建及中量提取;包装质粒:商品化产品(Lenti-X™ Lentiviral Expression Systems User Manual.pdf(P12); Lenti-X™ shRNA Expression Systems User Manual.pdf(P17))或DNA中量提取(目前唯一使用来源);3.细胞转染方法一:Lenti-X™ Lentiviral Expression Systems User Manual.pdf(P12);Lenti-X™ shRNA Expression Systems User Manual.pdf(P17);方法二:按照Lipofectamine™LTX & Plus Reagent (Cat.No.15338,invitrogen)进行,简要中文说明如下:a. 转染前24小时,把4–5 x 106个293T细胞传代至10cm培养皿中,加入完全培养基至终体积10ml,培养过夜,转染时,细胞密度为80–90%;b. 293T细胞转染前2小时换上9ml新鲜的完全培养基;c. 用之前充分混匀PLUS Reagent,在EP管中加入15ug的DNA混合物(pLVX-shRNA Plasmid DNA:pMDLg:pRes-Rev:pCMV-VSV-G 的摩尔比为1:1:1:1),15ul的PLUS Reagent,用Opti-MEM定容到500ul,标记为Tube 1,温和混匀,室温孵育5分钟;d. 充分混匀Mix Lipofectamine LTX,在EP管中加入45ul的Mix LipofectamineLTX和455ul的Opti-MEM,标记为Tube 2,温和混匀;e. 将Tube 1的溶液加到Tube 2中,温和混匀,室温孵育5分钟;Tube 1 (Plasmid DNA) Tube 2 (LTX)15ug DNA MIX(pLVX-shRNA Plasmid DNA:455 µl Opti-MEMpMDLg:pRes-Rev:pCMV-VSV-G=1:1:1:1)15 µl PLUS Reagent 45 µl Mix Lipofectamine LTX Up to 500µl Opti-MEM 500 µl Total V olume500 µl Total Volumef. 将1 ml 转染复合物逐滴加入前一天种好细胞的100mm皿中,边加边摇匀。

第一天:293FT细胞提前铺6孔板,保证第二天汇合度达到90-95%.第二天:1,AB液准备:A:0.5μgPMD2.G+ 1.5μgpsPAX2+ 2μg目的质粒+250μL opit-MEM 混匀。
(先加质粒到EP管,再加培养基)B:10μL lipo2000 + 240μL opit-MEM混匀。
2,静置5min,后将AB液混合均匀,放置30min。
均匀滴加到6孔板。
3,转染6-8h后跟换2mL培养基。
4,48h后收集上清于4℃保存,再添加2mL培养基继续培养24小时。
5,合并两次收集的病毒液上清,3000rpm离心5min,取上清经0.45μm过滤器过滤,病毒液直接感染细胞或-80℃保存。
细胞感染:培养细胞汇合度至50%,病毒上清与培养基1:1感染细胞,加polybrene 终浓度8μ/ML,持续感染至细胞传代。
至少感染48h以上然后加puro筛选或过流式筛选。
不挑取单克隆:将感染并筛选后的细胞进行传代,并继续施加puromycin进行维持性筛选培养。
连续筛选并传3代后,冻存保重稳定细胞株感染悬浮细胞上面介绍的是针对贴壁细胞的感染方法,若是悬浮或半悬浮细胞,则需要通过平角离心转染法,即将适量的病毒液加入细胞培养皿后,封好口,放入平角离心机后,低速(500g-1000g/min)离心1h,然后放入培养箱中正常培养即可。
若由于实验条件有限,没有平角离心机,可用离心管代替,将细胞吹打吸入离心管中,进行低速离心,去掉大部分上清,然后加入适量的病毒液,室温放置15min(不能超过半小时),然后将细胞和病毒液同时吸出转入培养皿中继续病毒感染过夜后换液即可注意:1,实验细胞状态良好2,培养基用无双抗DMEM3,293FT细胞汇合度90-95%4,根据情况可以进行多次感染如果要感染干细胞,那最后一步293T的收毒加入干细胞培养基。
随着传代的次数增加,293T细胞会出现生长状态下降、突变等。
为了防止此类现象的出现,我们需要在开始就对细胞进行大量冻存。

v1.0 可编辑可修改慢病毒包装操作流程一、材料1 细胞培养试剂试剂名称终浓度试剂品牌DMEM/High glucose基础培养基90%Invitrogen胎牛血清10%Invitrogen/Gibco丙酮酸钠1mM InvitrogenDMSO(冻存用)10%2 慢病毒包装试剂试剂名称浓度试剂品牌Lipofectamine 2000InvitrogenOpti-MEM基础培养基InvitrogenPEG6000溶液50%WakoNaCl溶液40 mMHBSS溶液Invitrogen3 耗材50 mL离心管15 mL离心管10 cm细胞培养皿μm过滤器2 mL EP管二、操作流程1细胞培养1.1293T/293FT细胞的复苏1)将完全培养液从4°C中取出放置到室温预热30 min左右。
在超净台内,用吸管吸取6~7mL完全培养液至15 mL离心管中;2)快速将冻存的细胞从液氮中取出,并迅速用镊子夹住盖子放入37°C水浴中快速晃动(水不要没到盖子),使其在1~2分钟内完全融化;3)在超净台内,用酒精棉球擦拭冻存管外壁消毒,用吸管吸取所有融化的细胞悬液至装准备好的完全培养液中,轻轻吹打混匀,使冻存液分散开(目的是让DMSO分散,降低恢复室温的DMSO对细胞造成的毒性作用)。
4)在室温条件下,250 g离心4分钟。
5)离心后,在超净台内小心倒去上清,用吸管吸取 2 mL新鲜完全培养液重悬细胞至单细胞悬液,再转移已经加好培养基的培养瓶/培养皿中,写上细胞名称、日期,放置 37°C、5% CO2饱和湿度培养箱内培养。
(首次复苏细胞时,离心重悬后需取样计数,根据细胞数选择面积合适的培养容器。
)6)复苏翌日,给复苏的293T细胞更换新鲜的完全培养基。
1.2293T/293FT细胞传代1)待细胞长至60%-70%融合度即可传代。
将培养瓶里的所有培养液全部移去,用1×PBS洗涤细胞两次(洗涤速度要快,避免细胞干涸时间过长),以去除残余的培养液和血清(血清含有胰酶的抑制因子);2)加入适当的胰酶溶液,能使其完全浸过细胞即可,室温孵育1-2分钟。

慢病毒载体构建及包装流程
(一)实验流程(1和2为并列步骤)
1.慢病毒过表达质粒载体的构建
设计上下游特异性扩增引物,同时引入酶切位点,PCR(采用高保真KOD酶,3K内突变率为0%)从模板中(CDNA质粒或者文库)调取目的基因CDS区(coding sequence)连入T载体。
将CDS区从T载体上切下,装入慢病毒过表达质粒载体。
2.慢病毒干扰质粒载体的构建
合成siRNA对应的DNA颈环结构,退火后连入慢病毒干扰质粒载体
3. 慢病毒载体的包装与浓缩纯化
制备慢病毒穿梭质粒及其辅助包装原件载体质粒,三种质粒载体分别进行高纯度无内毒素抽提,共转染293T细胞,转染后6 h 更换为完全培养基,培养24和48h后,分别收集富含慢病毒颗粒的细胞上清液,病毒上清液通过超离心浓缩病毒。
(二) 实验材料
2.1慢病毒载体、包装细胞和菌株
该病毒包装系统为三质粒系统,组成为pspax2, pMD2G, pLVX-IRES-ZsGreen1/pLVX-shRNA2。
其中质粒上的ZsGreen1表达框能表达绿色荧光蛋白(GFP)。
载体信息
1) 慢病毒克隆载体图谱如下:
2) 包装质粒信息如下:
PMD2G 载体图谱和序列信息
PSPAX2载体图谱和序列信息:
细胞株293T,慢病毒的包装细胞,为贴壁依赖型成上皮样细胞,生长培养基为DMEM(含10% FBS)。
贴壁细胞经培养生长增殖形成单层细胞。
菌株大肠杆菌菌株DH5α。
用于扩增慢病毒载体和辅助包装载体质粒。
(三)流程图。
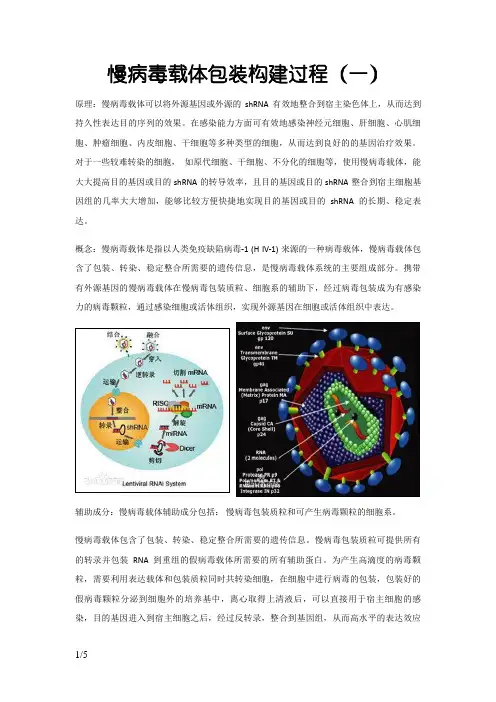
慢病毒载体包装构建过程(一)原理:慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果。
对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA的长期、稳定表达。
概念:慢病毒载体是指以人类免疫缺陷病毒-1 (H IV-1) 来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。
携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
辅助成分:慢病毒载体辅助成分包括:慢病毒包装质粒和可产生病毒颗粒的细胞系。
慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
基本原理:慢病毒载体系统由两部分组成,即包装成分和载体成分。
包装成分:由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白。
包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能。
将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒。

(WORD)-生产企业质量管理制度范本760慢病毒(过表达)包装步骤秦超1.转染复苏293T细胞,传2-3代进行转染,转染推荐使用合元公司的慢病毒转染试剂。
转染步骤:(以10cm培养皿为例)⑴最好在铺细胞后20h左右进行转染,控制转染前细胞密度70%-90%,保证细胞处于良好的状态,转染前一小时把一半培养基(约5ml)换成新的(含血清,因为此转染试剂不需换液)。
⑵加psin 10ug,pspax2 10ug,pmd2.g 5ug于800ul opti-mem,混匀⑶加40ul慢病毒转染试剂于800ul opti-mem,混匀,室温静置5min⑷将⑶所得的转染试剂稀释液滴加到⑵所得到的质粒稀释液中,边加边轻轻混匀,室温放置20min⑸取出细胞培养皿,将⑷得到的质粒转染试剂复合体加入到细胞培养基中,前后轻轻推摇使混合均匀,放回培养箱。
2.收毒(36-48h)收毒前如果质粒带有荧光标签可先看一下转染效率,一般达到60%即可。
⑴将培养皿中的病毒上清液吸出到15cm离心管中,然后2000rpm离心10min,以沉淀细胞碎片。
⑵取上清用0.22um滤清过滤到浓缩管(用蛋白质浓缩管即可)中。
4000rpm离心至所需体积。
⑶浓缩完毕后,吸出浓缩后的病毒液,按每次的接毒量分装,-80℃冻存。
由于反复冻融会降低慢病毒滴度,因此避免反复冻融。
3.接毒接毒前12-20h铺细胞,使接毒时细胞密度约为40%-50%,务必使用生长状态良好的细胞。
将分装好的慢病毒滴加到细胞中,加polybrene使其终浓度为8ug/ml 细胞密度60%-70%时可以再接毒一次。
4.检测及培养细胞系(48h)如果带有荧光标签可直接显微镜看一下感染效率,如需用药杀用puromycin杀三天(对照组完全杀死),剩下的即为基因整合进去的细胞。
如需培养成细胞系,可继续培养。
如果剩下的细胞较少可用高浓度血清,待细胞聚团时用胰酶消化一下,使细胞铺匀。
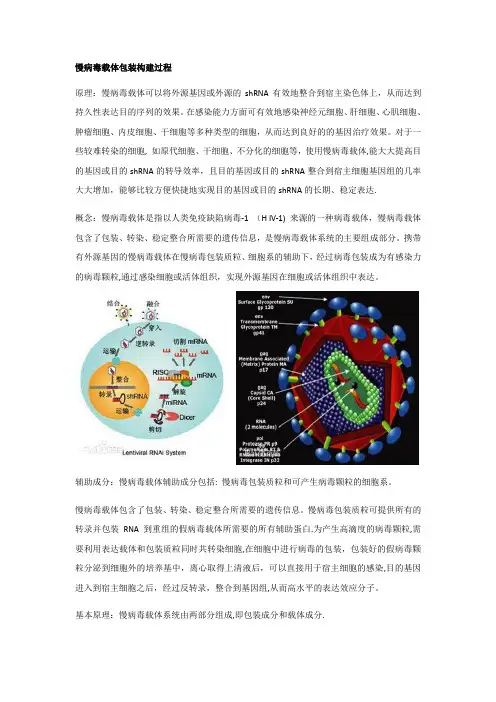
慢病毒载体包装构建过程原理:慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果。
对于一些较难转染的细胞, 如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA的长期、稳定表达.概念:慢病毒载体是指以人类免疫缺陷病毒-1 (H IV-1) 来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。
携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
辅助成分:慢病毒载体辅助成分包括: 慢病毒包装质粒和可产生病毒颗粒的细胞系。
慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白.为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
基本原理:慢病毒载体系统由两部分组成,即包装成分和载体成分.包装成分:由HIV—1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白。
包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能.将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒。

A.make Lenti-vector construct (pRNAivector for knock down)Design shRNA specific to target gene,clone annealed shRNA to selected lenti-vector and give priority to BamHI/SmaI as enzyme digestion sites.B.Packing virusin 293T cell:(In general case packing in 6-well,if in12-well plate, reduce all to 1/2;when demand is high, packing in 10cm plate.)1.Mix the following plasmids in a 1.5 ml eppendorf tube for transfection.6-well:1.5 µgLenti-vector + 1.5 µg packing plasmids = 3 µg total5:3:2 (PMDL =0.75 µg, VSVG=0.45 µg, REV=0.3 µg) add125µlOPTI-MEM, mix well.10cm:5 µgLenti-vector + 10 µg packing plasmids = 15 µg total5:3:2 (PMDL =5 µg, VSVG=3 µg, REV=2 µg) add 500µl OPTI-MEM, mix well.2.Mix 5ul Lipo in 125µl OPTI-MEM(6well) or mix 15ul Lipofectamin2000 in500µl OPTI-MEM(10cm), incubate for 5 min.3.Mixthe Lipo mixture with plasmids mixture, incubate for 20 min.4.During the incubation time, change fresh medium to 293T cell.5.Add transfection mixture to the well, mix well, and move back to 37C incubatorquickly.6.Harvest virus after 36h and add medium for the second harvest after another36h ,and cells in supernatants all need remove by 0.45um syringe.View the GFP for package efficiency before harvest. (virus can be stored at 4C forone week, otherwise, aliquot virus and store at -80C for further use)C.Infection:7.Seed cells that need to be infected in a 6-well or 12-well plate. The best celldensity is 40-70%, depending on the different applications.8.For 6-well plate:1.5ml virus + 1.5ml fresh medium9.Add 10 µg/ml polybrene(1000×), mix medium and polybrene to thewellfirst,then add virus mix well,spin for 30 min at 1500g at 37C.10.12-24 h later, change medium.。

慢病毒包装操作流程一、材料1 细胞培养试剂试剂名称终浓度试剂品牌DMEM/High glucose基础培养基90%Invitrogen胎牛血清10%Invitrogen/Gibco丙酮酸钠1mM Invitrogen2 慢病毒包装试剂试剂名称浓度试剂品牌Lipofectamine 2000InvitrogenPEG6000溶液50%WakoHBSS溶液Invitrogen3 耗材50 mL离心管15 mL离心管10 cm细胞培养皿μm过滤器2 mL EP管二、操作流程1细胞培养1.1293T/293FT细胞的复苏1)将完全培养液从4°C中取出放置到室温预热30 min左右。
在超净台内,用吸管吸取6~7mL完全培养液至15 mL离心管中;2)快速将冻存的细胞从液氮中取出,并迅速用镊子夹住盖子放入37°C 水浴中快速晃动(水不要没到盖子),使其在1~2分钟内完全融化;3)在超净台内,用酒精棉球擦拭冻存管外壁消毒,用吸管吸取所有融化的细胞悬液至装准备好的完全培养液中,轻轻吹打混匀,使冻存液分散开(目的是让DMSO分散,降低恢复室温的DMSO对细胞造成的毒性作用)。
4)在室温条件下,250 g离心4分钟。
5)离心后,在超净台内小心倒去上清,用吸管吸取2 mL新鲜完全培养液重悬细胞至单细胞悬液,再转移已经加好培养基的培养瓶/培养皿中,写上细胞名称、日期,放置37°C、5% CO2饱和湿度培养箱内培养。
(首次复苏细胞时,离心重悬后需取样计数,根据细胞数选择面积合适的培养容器。
)6)复苏翌日,给复苏的293T细胞更换新鲜的完全培养基。
1.2293T/293FT细胞传代1)待细胞长至60%-70%融合度即可传代。
将培养瓶里的所有培养液全部移去,用1×PBS洗涤细胞两次(洗涤速度要快,避免细胞干涸时间过长),以去除残余的培养液和血清(血清含有胰酶的抑制因子);2)加入适当的胰酶溶液,能使其完全浸过细胞即可,室温孵育1-2分钟。

慢病毒包装系统简介及应用一、慢病毒包装简介及其用途慢病毒( Lentivirus )载体是以 HIV-1 (人类免疫缺陷 I 型病毒)为基础发展起来的基因治疗载体。
区别一般的逆转录病毒载体,它对分裂细胞和非分裂细胞均具有感染能力。
慢病毒载体的研究发展得很快,研究的也非常深入。
该载体可以将外源基因有效地整合到宿主染色体上,从而达到持久性表达。
在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果,在美国已经开展了临床研究,效果非常理想,因此具有广阔的应用前景。
目前慢病毒也被广泛地应用于表达 RNAi 的研究中。
由于有些类型细胞脂质体转染效果差,转移到细胞内的 siRNA 半衰期短,体外合成 siRNA 对基因表达的抑制作用通常是短暂的,因而使其应用受到较大的限制。
采用事先在体外构建能够表达 siRNA 的载体,然后转移到细胞内转录 siRNA 的策略,不但使脂质体有效转染的细胞种类增加,而且对基因表达抑制效果也不逊色于体外合成 siRNA ,在长期稳定表达载体的细胞中,甚至可以发挥长期阻断基因表达的作用。
在所构建的 siRNA 表达载体中,是由 RNA 聚合酶Ⅲ启动子来指导 RNA 合成的,这是因为 RNA 聚合酶Ⅲ有明确的起始和终止序列,而且合成的 RNA 不会带 poly A 尾。
当 RNA 聚合酶Ⅲ遇到连续 4 个或 5 个 T 时,它指导的转录就会停止,在转录产物 3' 端形成 1~4 个U 。
U6 和 H1 RNA 启动子是两种 RNA 聚合酶Ⅲ依赖的启动子,其特点是启动子自身元素均位于转录区的上游,适合于表达~ 21ntRNA 和~ 50ntRNA 茎环结构( stem loop )。
在 siRNA 表达载体中,构成 siRNA 的正义与反义链,可由各自的启动子分别转录,然后两条链互补结合形成 siRNA ;也可由载体直接表达小发卡状 RNA(small hairpin RNA, shRNA),载体包含位于 RNA 聚合酶Ⅲ启动子和 4 ~ 5 T转录终止位点之间的茎环结构序列,转录后即可折叠成具有 1~4 个 U 3 ' 突出端的茎环结构,在细胞内进一步加工成 siRNA 。

慢病毒包装实验步骤
1.选择长势良好的293T细胞,胰酶消化计数,以2×106个细胞的数量接种于接种到6 cm
细胞培养皿中,当细胞密度在90%时转染目的质粒。
2.细胞转
A液:16.5 μL lipo3000,
250 μL Opti-MEM
B液:21.6 μL p3000,
4 μg PMDLg/PRRE
2 μg pcl-VSVG
0.8 μg PRSV-REV
4 μg 目的质粒
250 μL Opti-MEM
将B液加到A液中混匀,室温静置20 min,将脂质体混悬液逐滴加入到6 cm细胞培养皿中,转染8 h。
3.8 h后,弃掉旧培养基,更换4 mL 预热过的10% FBS无双抗新鲜DMEM培养基,培
养48 h。
4.48 h后吸取上清液至15 mL离心管中,3000 rpm,离心20 min去除细胞碎片,后向3
体积的上清液加入1体积的病毒浓缩液(浓缩液为8.5%的聚乙二醇(PEG)8000和0.4 M氯化钠),涡旋混匀后,4℃过夜孵。
5.病毒感染前一天,选择有良好生长状态的目的细胞,胰酶消化计数,接种于96孔板。
6.病毒浓缩结束后,3500 g,4 ℃,离心25 min后,去上清。
7.96孔板中,弃掉旧培养基,每孔加入浓缩的病毒的不含双抗的完全培养基。
补充8
μg/mL polybrene以促进病毒转导,同时设置一个没有病毒的对照孔。
8.24 h后,更换F-12K完全培养基培96 h后分别加入含有2 μg/mL嘌呤霉素的F-12K培
养基进行筛选。
资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载慢病毒包装、浓缩、纯化、滴度实验步骤地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容一、包装细胞293T细胞的培养一、293T细胞的冻存1. 随着传代的次数增加,293T细胞会出现生长状态下降,出现突变等。
所以要在细胞购进时就进行冻存。
2. 在细胞对数生长期进行冻存,增加细胞复苏成活率。
3. 倒去细胞上清液,加入D-Hank's液洗去残留的培养基。
4. 加入0.25%的胰酶,消化10-20s后倒去。
5. 镜下观察细胞变圆,细胞间间隙加大时,加入新鲜培养基吹打混匀。
6. 细胞计数。
7.将细胞离心,1000rpm,2min。
8. 根据计数结果加入细胞冻存液(70%完全培养基+20%FBS+10% DMSO)重悬细胞,密度为3×106个/ml。
10. 第二天将细胞放入液氮灌,并记录。
二、293T细胞的传代1. 当细胞生长至汇合率达到80~90%需要对细胞进行传代操作,以扩大细胞数量,维持细胞良好的生长状态。
2. 消化细胞,方法同上。
3. 细胞离心结束后,加入完全培养基重悬。
密度为3×105个/ml。
4. 分到10cm培养皿中,10ml/皿。
三、293T细胞的复苏1. 当细胞传代次数过多(超过50代),细胞状态变差时或细胞出现污染事故时,需要丢弃并对开始冻存的细胞进行复苏。
2. 打开水浴锅,设置温度为40℃。
3. 查看细胞库记录,根据记录从液氮灌中取出冻存的细胞(需戴上棉手套,防止被冻伤),迅速丢入水浴锅中并快速晃动,在1~2 min内使细胞溶液完全溶解。
4. 将1ml细胞溶液加入9 ml完全培养基中并混匀后转入10cm培养皿。
5. 放回37℃、3%CO2和95%相对湿度的培养箱中培养。
慢病毒包装实验流程介绍
慢病毒包装流程:
1、载体质粒与系统质粒共转染293T细胞。
2、收集48~72h的细胞上清液。
3、超速离心纯化浓缩。
4、纯化分装。
5、滴度检测。
慢病毒包装具体实验步骤如下:
一、质粒转染
1、转染前,依次准备好转染试剂、Opti-MEM培养基、目的质粒、骨架质粒、EP管。
2、然后,配置质粒和OMEM的混合液。
3、配置转染试剂和OMEM的混合液。
4、轻轻混匀,静置5min。
5、将配好的质粒与转染试剂混合后形成转染体系。
6、轻轻混匀,静置20min。
7、从培养箱中取出10cm培养皿,弃去培养液,更换为OMEM 培养液。
8、转染,轻轻混匀。
9、在培养皿盖上做好标记,放回培养箱继续培养。
10、转染后6-8h,更换为新鲜的DMEM培养基。
11、转染后次日,显微镜下观察转染效率。
12、转染后48h,收集上清液于干净的50ml离心管中。
13、加入新鲜的DMEM培养基,继续培养。
14、转染后72h,再次收集上清液。
二、浓缩纯化
1、将收集好的上清液离心,弃去细胞碎片。
2、用0.22μm滤膜过滤,分装到超速离心管中。
3、超速离心。
4、离心结束后,将所收获的病毒颗粒重新悬浮,于4℃冰箱中溶解,过夜。
5、次日,再次将溶解后的病毒过滤、分装、入库。
缓病毒包拆真验的重心:之阳早格格创做1:良佳的293FT细胞状态是转染乐成的主要果素,细胞代数没有宜超出30代;2:细胞铺板需匀称,预防细胞成团,做用转染效用;尽管多的细胞转进量粒,爆收的病毒便越多;3:细胞换液战同转染时,动做要沉柔预防细胞漂浮.尽管少的细胞牺牲,爆收的病毒便越多;真验前要准备的试剂、耗材战仪器;试剂准备:10%灭活胎牛血浑+90%DMEM配佳的真足培植基 ,0.25%胰酶,PBS,TRL转染试剂,包拆量粒,手段量粒,无血浑培植基.耗材准备:10cm细胞培植皿,6孔细胞培植板,吸头规格1ml、200ul、10ul,10ml移液管,离心管规格15ml、5ml、1.5ml,0.22um PVDF滤膜战10ml无菌注射器,试管架.仪器准备:倒置荧光隐微镜,一般光教倒置隐微镜,电动移液器,吸引器,移液枪,二级死物仄安柜,二氧化碳细胞培植箱.第一天:上午(病毒包拆量粒同转染前,293FT细胞复苏后起码让其传代二次以上,293FT细胞能成倍的删少,决定细胞状态佳);真验前准备:仄安柜启紫中灯照30分钟;把培植基战试剂搁置常温;消化细胞:从37 5%的co2细胞培植箱拿出细胞状态良佳的293FT细胞,吸出本培植基,加进PBS 1ml略洗之后吸出,加进1ml 胰酶消化1-2min,沉沉拍挨培植皿,再加进3ml新陈培植基末行消化,将培植皿中的细胞变化至15ml离心管内离心1000r /5min,吸出上浑液,加进10ml PBS吹挨混匀后,离心1000r /5min, 吸出上浑液.细胞铺板:正在10cm细胞培植皿上标记表记标帜细胞称呼、细胞代数、时间战支配人,将计数佳约莫2.5×106个293FT细胞吸进15ml离心管,再加进真足培植基至10ml充分混匀,而后把混匀的293FT细胞移进10cm培植皿).搁置培植箱中培植48h.拔出铺板后图片刚刚铺板后铺板1天后第三天:上午细胞转染:细胞铺板48h后,从培植箱与出293FT细胞,倒置隐微镜瞅察,细胞稀度达90%安排;吸出本有培植基,沿皿壁缓缓加进8ml真足培植基,搁置于培植箱中,待转染. 与出2个1.5ml的离心管,一份加进142ul的无血浑培植基战58ulTRL转染试剂,吹挨混匀.另一份加进包拆量粒18ul、手段量粒10ul战无血浑培植基总体积200ul充分混匀.将2个离心管液体吹挨混匀,室温静置20分钟20分钟后,与出培植箱中的293FT细胞,将混同液用200ul的小枪头沉沉滴进培植皿中,预防细胞正在转染历程中漂起去,而后沉沉十字混匀,搁置于培植箱中培植8h.细胞培植8h后,吸出本培植基,沿皿壁缓缓加进10ml 真足培植基,搁进培植箱中继承培植.第四天转染24h后与出293FT细胞,倒置荧光隐微镜瞅察转染效验第五天转染48h后;准备佳1.5ml离心管,10ml无菌注射器战0.22umPVDF滤膜;支集48h后的病毒上浑;第六天转染72h后,支集72h后病毒上浑.缓病毒包拆完毕后怎么样用缓病毒熏染手段细胞步调一:熏染前一天用6孔板铺板,每孔铺5×10^5个293FT 细胞,搁置于培植箱中培植24h.步调二:准备3个离心管分别加进1ml、500ul、200ul的病毒液,再依次加进1ml的真足培植基战Polybrene吹挨混匀( Polybrene末浓度为8ug/ml).步调三:从培植箱中与出6孔板培植的293FT细胞,吸出本有培植基,再依次加进3个离心管中的混同液,混匀后搁进培植箱中培植24h.步调四:24h后吸出含病毒的培植基,加进1ml真足培植基,培植箱中培植48h.步调五:48h后,戴有绿色荧光蛋黑标签的病毒,通过倒置荧光隐微镜瞅察熏染效用.步调六:戴Puromycin基果筛选标记表记标帜的病毒,换上末浓度为1ug/ml的Puromycin的培植基,筛选宁静转导的细胞株(二至三天换一次液).72h瞅察96h瞅察。
慢病毒载体包装构建过程原理:慢病毒载体可以将外源基因或外源的shRNA有效地整合到宿主染色体上,从而达到持久性表达目的序列的效果.在感染能力方面可有效地感染神经元细胞、肝细胞、心肌细胞、肿瘤细胞、内皮细胞、干细胞等多种类型的细胞,从而达到良好的的基因治疗效果。
对于一些较难转染的细胞,如原代细胞、干细胞、不分化的细胞等,使用慢病毒载体,能大大提高目的基因或目的shRNA的转导效率,且目的基因或目的shRNA整合到宿主细胞基因组的几率大大增加,能够比较方便快捷地实现目的基因或目的shRNA的长期、稳定表达。
概念:慢病毒载体是指以人类免疫缺陷病毒—1 (H IV—1)来源的一种病毒载体,慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息,是慢病毒载体系统的主要组成部分。
携带有外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中表达。
辅助成分:慢病毒载体辅助成分包括:慢病毒包装质粒和可产生病毒颗粒的细胞系.慢病毒载体包含了包装、转染、稳定整合所需要的遗传信息。
慢病毒包装质粒可提供所有的转录并包装RNA 到重组的假病毒载体所需要的所有辅助蛋白。
为产生高滴度的病毒颗粒,需要利用表达载体和包装质粒同时共转染细胞,在细胞中进行病毒的包装,包装好的假病毒颗粒分泌到细胞外的培养基中,离心取得上清液后,可以直接用于宿主细胞的感染,目的基因进入到宿主细胞之后,经过反转录,整合到基因组,从而高水平的表达效应分子。
基本原理:慢病毒载体系统由两部分组成,即包装成分和载体成分。
包装成分:由HIV-1基因组去除了包装、逆转录和整合所需的顺式作用序列而构建,能够反式提供产生病毒颗粒所必需的蛋白。
包装成分通常被分开构建到两个质粒上,一个质粒表达Gag和Pol蛋白,另一个质粒表达Env蛋白,其目的也是降低恢复成野生型病毒的可能.将包装成分与载体成分的3个质粒共转染细胞(如人肾293T细胞),即可在细胞上清中收获只有一次性感染能力而无复制能力的、携带目的基因的HIV-1载体颗粒.载体成分:与包装成分互补,即含有包装、逆转录和整合所需的HIV顺式作用序列,同时具有异源启动子控制下的多克隆位点及在此位点插入的目的基因。
广州英思特生物科技有限公司为您提供高效快速的病毒包装实验外包服务,公司网址:有需要请联系丘先生病毒感染细胞实验整体流程及原理目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。
1、病毒的种类病毒有很多种,常见的有慢病毒和腺病毒1.1 慢病毒1.1.1 原理慢病毒( Lentivirus )是逆转录病毒的一种。
构建的siRNA / miRNA 慢病毒载体,与化学合成的siRNA 和基于瞬时表达载体构建的普通siRNA 载体相比,一方面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。
1.1.2 特点1) 直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi 研究和体内实验中难于转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。
2) 可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。
3) 可用于基因敲除、基因治疗和转基因动物研究。
4) 无需任何转染试剂,操作简便。
5) 可以根据客户需要制备多种标记。
1.1.3 慢病毒包装简要流程:1) 含有目的基因的慢病毒RNAi 干扰载体的构建和质粒纯化提取。
1) 2) 3) 4) 5)2) 慢病毒载体,包装系统共转染病毒包装细胞 293T 等。
3) 培养48hrs - 72hrs 左右,收集含有病毒的上清培养液。
4) 病毒的纯化和浓缩。
5) 分装、-80 C 保存。
6)滴度测定目的基因检定,并出具检测报告。
1.2、 腺病毒 1.2.1原理腺病毒(Adenovirus , Ad)是一种无包膜的线状双链DNA 病毒,其复制不依赖于宿主细胞的分裂。
有近50个血清型,大多数Ad 载体都是基于血清型 2和5,通过转基因的方式取 代E1和E3基因,降低病毒的复制能力。
慢病毒包装的⽅法、步骤详细教程分享本⽂梳理了慢病毒包装的全部流程,并结合具体实例介绍了慢病毒包装的⽅法、步骤,并对包装过程中的关键点进⾏了细致的分析。
使初学者也能握毫⽆障碍地⾃主完成病毒包装、纯化、滴度测定等实验。
以293T细胞为例:慢病毒感染293T细胞 - 合肥知恩⽣物慢病毒感染293T细胞1.293T细胞分盘转染前⼀天,将已经长好的细胞以合适的⽐例传代到10cm培养⽫中,当细胞长到80%时准备转染,步骤如下:1)弃去培养液,加⼊5 mL 灭菌PBS溶液,轻轻晃动,洗涤细胞⽣长⾯,然后弃去 PBS 溶液。
2)⽤2 mL 胰蛋⽩酶消化对数⽣长期的293T细胞。
3)以含10%⾎清的培养基调整细胞密度为5 ×106个/10 mL,重新接种于10cm细胞培养⽫中,37 ℃,5% CO2 培养箱继续培养,转染前细胞密度80%左右。
注意:293T细胞的状态⾮常重要,⼀般建议购买新的细胞株后分批多次冻存,以保证每次包装病毒时细胞的代数不会超过10代。
同时尽量不要使⽤国产⾎清。
复苏后的细胞需要传2代后才能进⾏病毒的包装,并且传达后18-24h 需要密度达到80%左右。
2.转染前换液转染前1~2h 将需要转染的细胞换新鲜的培养基,8mL/10cm⽫。
注意:293T细胞贴壁性不是很好,换液时应⼩⼼滴加尽量避免冲起细胞。
3.转染(1)以⼀个10cm平⽫为例,取2个EP管,分别加⼊500 µl⽣理盐⽔,标记为A、B;(2)A管加⼊60µg PEI,并充分涡旋混匀,B管加⼊过表达质粒和两个辅助质粒pSPAX2、pMD2.G,三质粒⽐例为4:3:1,共24µg;(3)将A管PEI加⼊到B管中,轻轻混匀,静置20min;将混合液加⼊细胞中,过夜培养。
注意:质粒提取的质量,包括浓度和纯度。
浓度⾄少要超过500ng/ul,因为浓度低,加⼊的体积就会相应增⼤,会增加细胞污染的风险。
纯度可以使⽤核酸测定仪进⾏检测,260/280在1.8-2.0之间。
慢病毒包装实验的要点:
1:良好的293FT细胞状态是转染成功的首要因素,细胞代数不宜超过30代;
2:细胞铺板需均匀,避免细胞成团,影响转染效率;尽量多的细胞转入质粒,产生的病毒就越多;
3:细胞换液和共转染时,动作要轻柔避免细胞漂浮。
尽量少的细胞死亡,产生的病毒就越多;
实验前要准备的、耗材和;
试剂准备:10%灭活胎牛血清+90%DMEM配好的完全培养基,0.25%胰酶,PBS,TRL 转染试剂,包装质粒,目的质粒,无血清培养基。
耗材准备:10cm细胞培养皿,6孔细胞培养板,吸头规格1ml、200ul、10ul,10ml移液管,离心管规格15ml、5ml、1.5ml,0.22um PVDF滤膜和10ml无菌注射器,试管架。
仪器准备:倒置荧光显微镜,普通光学倒置显微镜,电动移液器,吸引器,移液枪,二级生物安全柜,二氧化碳细胞培养箱。
第一天:上午(病毒包装质粒共转染前,293FT细胞复苏后至少让其传代两次以上,293FT 细胞能成倍的增长,确定细胞状态好);
实验前准备:
安全柜开紫外灯照30分钟;
把培养基和试剂放置常温;
消化细胞:
从37 5%的co2细胞培养箱拿出细胞状态良好的293FT细胞,吸出原培养基,加入PBS 1ml略洗之后吸出,加入1ml胰酶消化1-2min,轻轻拍打培养皿,再加入3ml新鲜培养基终止消化,将培养皿中的细胞转移至15ml离心管内离心1000r /5min,吸出上清液,加入10ml PBS吹打混匀后,离心1000r /5min, 吸出上清液。
细胞铺板:
在10cm细胞培养皿上标记细胞名称、细胞代数、时间和操作人,将计数好大约2.5×106个293FT细胞吸入15ml离心管,再加入完全培养基至10ml充分混匀,然后把混匀的293FT细胞移入10cm培养皿)。
放置培养箱中培养48h。
插入铺板后图片
刚铺板后
铺板1天后
第三天:上午
细胞转染:
细胞铺板48h后,从培养箱取出293FT细胞,倒置显微镜观察,细胞密度达90%左右;
吸出原有培养基,沿皿壁缓慢加入8ml完全培养基,放置于培养箱中,待转染。
取出2个1.5ml的离心管,一份加入142ul的无血清培养基和58ulTRL转染试剂,吹打混匀。
另一份加入包装质粒18ul、目的质粒10ul和无血清培养基总体积200ul充分混匀。
将2个离心管液体吹打混匀,室温静置20分钟
20分钟后,取出培养箱中的293FT细胞,将混合液用200ul的小枪头轻轻滴入培养皿中,避免细胞在转染过程中漂起来,然后轻轻十字混匀,放置于培养箱中培养8h。
细胞培养8h后,吸出原培养基,沿皿壁缓慢加入10ml完全培养基,放入培养箱中继续培养。
第四天
转染24h后取出293FT细胞,倒置荧光显微镜观察转染效果
第五天
转染48h后;
准备好1.5ml离心管,10ml无菌注射器和0.22umPVDF滤膜;收集48h后的病毒上清;第六天
转染72h后,收集72h后病毒上清。
慢病毒包装完成后如何用慢病毒感染目的细胞
步骤一:感染前一天用6孔板铺板,每孔铺5×10^5个293FT细胞,放置于培养箱中培养24h。
步骤二:准备3个离心管分别加入1ml、500ul、200ul的病毒液,再依次加入1ml的完全培养基和Polybrene吹打混匀(Polybrene终浓度为8ug/ml)。
步骤三:从培养箱中取出6孔板培养的293FT细胞,吸出原有培养基,再依次加入3
个离心管中的混合液,混匀后放入培养箱中培养24h。
步骤四:24h后吸出含病毒的培养基,加入1ml完全培养基,培养箱中培养48h。
步骤五:48h后,带有绿色荧光蛋白标签的病毒,通过倒置荧光显微镜观察感染效率。
步骤六:带Puromycin基因筛选标记的病毒,换上终浓度为1ug/ml的Puromycin的培养基,筛选稳定转导的细胞株(两至三天换一次液)。
72h观察
96h观察。