08级物理化学B卷
- 格式:doc
- 大小:131.00 KB
- 文档页数:6


习题一一、选择题:(本题共5小题,每小题3分,共15分)1、作为熵增原理,下述表述中,错误的是( )A. 孤立体系的熵值永远增加B. 在绝热条件下,趋向平衡的过程中封闭体系的熵值增加C. 孤立体系的熵值永不减少D. 可用体系的熵的增加或不变来判断过程是否可逆2、溶液内任一组分的偏摩尔体积( )A. 不可能是负B. 总是正值C. 可能是正值,也可能是负值D. 必然和纯组分的摩尔体积相等3、在T 时,一纯液体的蒸气压为8000 Pa,当0.2 mol 的非挥发性溶质溶于0.8 mol的该液体中时,溶液的蒸气压为4000 Pa,若蒸气是理想的,则在该溶液中溶剂的活度系数是( )A. 2.27B. 0.625C. 1.80D. 0.2304、同一温度下,微小晶粒的饱和蒸汽压和大块颗粒的饱和蒸汽压哪个大? ( )A. 微小晶粒的大B. 大块颗粒的大C. 一样大D. 无法比较5、在10 cm3,1mol·dm-3的KOH溶液中加入10cm3水,其摩尔电导率将()A. 增加B. 减小C. 不变D. 不能确定二、填空题:(本题共6小题,每空1分,共15分)1、状态函数的特征是,功、热、体积、焓和熵中不是状态函数的有。
2、化学反应的等温方程式为,化学达平衡时等温方程式为,判断化学反应的方向用参数,等温等压条件下若使反应逆向进行,则应满足条件。
3、形成负偏差的溶液,异种分子间的引力同类分子间的引力,使分子逸出液面的倾向,实际蒸气压依拉乌尔定律计算值,且△mi x H0,△mi x V0。
4、NH4HS(s)和任意量的NH3(g)及H2S(g)达平衡时,自由度f=。
5、液滴越小,饱和蒸气压越__________;而液体中的气泡越小,气泡内液体的饱和蒸气压越__________ 。
6、当一反应物的初始浓度为 0.04 mol ·dm -3时,反应的半衰期为 360 s ,初始浓度为0.024 mol ·dm -3时,半衰期为 600 s ,此反应级数n = 。

物理化学期末复习一、单项选择题1. 涉及焓的下列说法中正确的是 ( )(A)单质的焓值均等于零(B)在等温过程中焓变为零(C)在绝热可逆过程中焓变为零(D)化学反应中系统的焓变不一定大于内能变化2. 下列三种胶体分散系统中,热力不稳定的系统是: ( )A. 大分子溶胶B. 胶体电解质C. 溶胶3. 热力学第一定律Δ U=Q+W只适用)(A) 单纯状态变化(B) 相变化(C) 化学变化(D) 封闭物系的任何4.第一类永动机不能制造成功的原因是 ( )(A)能量不能创造也不能消灭(B)实际过程中功的损失无法避免(C)能量传递的形式只有热和功(D)热不能全部转换成功5.如图,在绝热盛水容器中,浸入电阻丝,通电一段时间,通电后水及电阻丝的温度均略有升高,今以电阻丝为体系有( )(A)W =0 ,Q <0 ,U <0(B). W>0,Q <0,U >0(C)W <0,Q <0,U >0(D). W <0,Q =0,U >06.对于化学平衡 , 以下说法中不正确的是( )(A)化学平衡态就是化学反应的限度(B)化学平衡时系统的热力学性质不随时间变化(C)化学平衡时各物质的化学势相等(D)任何化学反应都有化学平衡态7.封闭系统内的状态变化: ( )A 如果系统的 S sys>0,则该变化过程自发B 变化过程只要对环境放热,则该变化过程自发C 仅从系统的 S sys ,变化过程是否自发无法判断8. 固态的 NH 4HS 放入一抽空的容器中,并达到化学平衡,其组分数、独立组分数、相数及 自由度分别是( )A. 1 ,1,1,2B. 1 ,1,3,0C. 3 ,1,2,1D. 3 ,2,2,2 9. 在定压下, NaCl 晶体,蔗糖晶体,与它们的饱和混合水溶液平衡共存时,独立组分数 C 和条件自由度 f:( ) A C =3, f=1 B C =3 , f=2 CC =4, f=2DC =4 , f=310. 正常沸点时,液体蒸发为气体的过程中( )(A) Δ S=0 (B) ΔG=0 (C) Δ H=0 (D) ΔU=012. 下面的说法符合热力学第一定律的是( )(A) 在一完全绝热且边界为刚性的密闭容器中发生化学反应时 , 其内能一定变化 (B) 在无功过程中 , 内能变化等于过程热 , 这表明内能增量不一定与热力学过程无关(C) 封闭系统在指定的两个平衡态之间经历绝热变化时 , 系统所做的功与途径无关 (D) 气体在绝热膨胀或绝热压缩过程中 , 其内能的变化值与过程完成的方式无关 13. 对于理想的水平液面,其值为零的表面物理量是( )(A) 表面能 (B) 比表面吉布斯函数 (C) 表面张力 (D) 附加压力14. 实验测得浓度为 0.200mol ·dm -3的 HAc 溶液的电导率为 0.07138S ·m -1,该溶液的摩尔 电导率Λ m (HAc) 为( )2 -1 2 -1A. 0.3569S · m 2· mol -1B. 0.0003569S ·m 2·mol -12 -1 2 -1C. 356.9S · m 2· mol -1D. 0.01428S ·m 2· mol -115. 某化学反应其反应物消耗 7/8 所需的时间是它消耗掉 3/4 所需的时间的 1.5 倍,则反 应的级数为( )A. 零级反应B. 一级反应C. 二级反应D. 三级反应11. 以看作封闭体系的是( A. 绝热箱中所有物质 B. 两个铜电极 C. 蓄电池和铜电极 D. CuSO 4 水溶液 如图,将 C uSO 4水溶液置于绝热箱中,插入两个铜电极,以蓄电池为电源进行电解,可)。

一、单项选择题( )8.某温度时,反应(g)CO (g)N 21CO(g)NO(g)22+=+的2θ104-⨯=K ,则反应 (g)CO 21(g)N 41CO(g)21NO(g)2122+=+的θK 为A .5B .1C .25D .251( )10.升高温度可以增加反应速率,主要是因为A .增加了分子总数B .增加了活化分子百分比C .降低了反应的活化能D .升高了反应活化能( )11.反应(g)O 3NO(g)4(g)O N 2252+=,则对NO 而言,反应的级数是A .4B .2C .1D .不确定( )12.NO(g)2(g)O (g)N 22=+ 0θm r >∆H ,下列变化中,不影响平衡状态的是A .升高温度B .加大2N 压力C .延长反应时间D .通入2O( )13.下列说法正确的是A .催化剂能增加反应物的转化率B .催化剂能增加反应的平衡常数C .催化剂只能增加正反应的反应速度D .催化剂能同等程度地改变正、逆反应的反应速度( )16.在描述一级反应的特征时,那一点是不正确的A .c ln 对时间t 作图将为一条直线B .半衰期12T 与反应物起始浓度成反比C .反应物消耗的百分数相同时,所需的时间一样(同一反应)D .速率常数的单位为(时间)-1D .23)Ca(HCO( )5.n 摩尔单原子理想气体恒压下温度从1T 变到2T ,H ∆等于A .T nC ∆pB .T nC V ∆ C .T nR ∆D .12ln T T nR ( )7.下列函数中不是状态函数的是A .焓B .热力学能C .热D .熵( )15.(g)NH 2(g)H 3(g)N 322=+中2N 、2H 、3NH 的化学计量数分别为A .2,3,1B .2,3,1--C .2,3,1-D .2,3,1---( )4.不可逆过程热温商与熵变ds 的关系是A .相等B .T Q s δd >C .为零D .TQ s δd ≥ ( )8.下列哪一个反应的焓变等于(g)O C 2的标准摩尔生成焓A .1m,r 2(g)CO C(s)CO(g)H ∆=+B .2m,r 22(g)CO (g)O 21CO(g)H ∆=+C .3m,r 22(g)CO (g)O C(s)H ∆=+D .4m,r 22(g)CO 2(g)O 2C(s)2H ∆=+( )1.半衰期为10天的某放射形元素8克,40天后其净重为多少克A .0.5克B .2.0克C .4.2克D .不能确定( )5.已知反应(g)CO (g)N 21CO(g)NO(g)22+→+的1θm r mol KJ 373.2K)298(-⋅-=∆H ,要有利于取得有毒气体NO 和CO的最大转化率,可采取的措施是A .低温低压B .高温高压C .低温高压D .高温低压( )7.下列条件改变时,能影响标准平衡常数θK 改变的是A .总压强B .浓度C .温度D .分压( )8.元反应(g)O N 2(g)O NO(g)222=+在一定温度下进行,)(O 2p 不变,(NO)p 增加为原来的两倍,则反应速率增加到原来的A .2倍B .4倍C .9倍D .不变( )9.对一个化学反应来说,下列说法正确的是A .θm r H ∆越负,反应速率越快B .θm r G ∆越小,反应速率越快C .活化能越小,反应速率越快D .活化能越大,反应速率越快( )12.化学反应达到平衡的特征是A .各反应物和生成物的浓度相等B .正反应和逆反应的速率常数相等C .反应物和生成物浓度之和等于常数D .体系中各物质的浓度不随时间而变( )16.若(g)NH 2(g)H 3(g)N 322=+,63.0θ=K 。

,考试作弊将带来严重后果!华南理工大学期末考试《 物理化学 》(48、56、64学时)试卷(B)1. 考前请将密封线内填写清楚; 所有答案请直接答在试卷上; .考试形式:闭卷;本试卷共 四 大题,满分100分, 考试时间120分钟。
选择题.(每题2分, 10题共20分)1. 已知反应CO(g)+1/2O 2(g) → CO 2(g) 的焓变为△H ,下列说法中何△H 是CO 2(g) 的生成焓 B. △H 是CO(g)的燃烧焓 △H 是负值 D. △H 与反应△U 的数值不等2. 室温下,10 p O 的理想气体绝热节流膨胀至 5p O 的过程有:(1) W < 0 ; (2) T 1> T 2; (3) Q = 0 ; (4) △S > 0A. (3)、(4)B. (2)、(3)C. (1)、(3)D. 、(2)3. 反应N 2(g) + 3H 2(g) = 2NH 3(g) 可视为理想气体间反应,在反应达平衡后,若维持系统温度与压力不变,而于系统中加入惰性气体,则A. K p不变,平衡时N2和H2的量将增加,而NH3的量减少B. K p不变,且N2, H2, NH3的量均不变C. K p不变,平衡时N2和H2的量将减少,而NH3的量增加D. K p增加,平衡时N2和H2的量将减少,NH3的量增加4. 298K时A和B两种气体在某一溶剂中溶解的享利系数分别为k A 和k B,且知k A>k B,则当A和B压力相同时,在该溶剂中所溶解的量是( )A. A的量大于B的量B. A的量小于B的量C. A的量等于B的量 C. A的量与B的量无法比较5. NH4HS(s) 和任意量的 NH3(g) 及 H2S(g) 达平衡时有( )A. C = 2,P = 2,F = 2;B. C = 1,P = 2,F = 1;C. C = 2,P = 3,F = 2;D. C = 3,P = 2,F = 3;6. 下列纯物质两相平衡有关的描述,不正确的是( )A.沸点将随压力增加而升高B. 熔点将随压力增加而升高C.蒸气压将随温度升高而加大D. 升华温度将随压力增大而升高7. 同一温度、压力下,一定量某纯物质的熵值______________ 。

复习题1.在一个密闭绝热的房间里放置一台电冰箱,将冰箱门打开,并接通电源使其工作,过一段时间之后,室内的平均气温将如何变化?(A) 升高(B) 降低(C) 不变(D) 不一定2.一可逆热机与另一不可逆热机在其他条件都相同时,燃烧等量的燃料,则可逆热机牵引的列车行走的距离。
(A)较长(B)较短(C)一样(D)不一定3.在101.3kP a、373K下,1mol H2O(l)变成H2O(g)则()(A)Q<0(B)△U=0(C)W>0(D)△H>04.溶胶和大分子溶液。
(A)都是单相多组分系统(B)都是多相多组分系统(C)大分子溶液是单相多组分系统,溶胶是多相多组分系统(D)大分子溶液是多相多组分系统,溶液是单相多组分系统5. 当理想气体反抗一定的外压做绝热膨胀时,则.(A) 焓总是不变的(B)热力学能总是不变的(C)焓总是增加的(D) 热力学能总是减小的6.将克拉佩龙方程用于H2O的液固两相平衡,因为V m(H2O,1)<V m(H2O,s),所以随着压力的增大,则HO(1)的凝固点将:()2(A)上升(B)下降(C)不变7.下述化学势的公式中,不正确的是。
(A)(B)(C)(D)8.在373K,200kPa,液态水和气态水化学势的大小为。
(A)μl=μg=0(B)μl=μg<0(C)μl>μg(D)μl<μg9.二组分理想液态混合物的蒸气总压()(A)与溶液的组成无关(B)介于两纯组分的蒸气压之间(C)大于任一纯组分的蒸气压(D)小于任一纯组分的蒸气压10.纯液体在正常相变点凝固,则下列量减小的是。
(A)S;(B)G;(C)蒸汽压;(D)凝固热。
11.今有A(s) B(s) C(l)三组分相图,图中三相平衡区为。
(A) AFE(B) CFED(C) AEB(D) BED12.反应2NO(g)+O2(g)==2NO2(g)是放热的,当反应在某温度、压力下达平衡时,若使平衡向右移动。

2010 ─ 2011 学年 第 1 学期 《物理化学B 》课程考试试卷( A 卷)注意:1、本试卷共 4 页; 2、考试时间:120分钟3、姓名、学号必须写在指定地方4、专业:09级食科和农资专业一、选择题(每小题 2 分,共 24 分)1. 关于循环过程,下列表述正确的是( )。
A. 可逆过程一定是循环过程B. 循环过程不一定是可逆过程C. 循环过程⎰=δ0QD. 对理想气体⎰≠0dT C V 2. 下述化学势的公式中,不正确的是( )。
A. B C n n p T B n G ≠⎪⎪⎭⎫⎝⎛∂∂,, B. BC n n p S B n H ≠⎪⎪⎭⎫ ⎝⎛∂∂,, C. B C n n ,p ,T Bn A ≠⎪⎪⎭⎫ ⎝⎛∂∂ D. BC n n V S B n U ≠⎪⎪⎭⎫ ⎝⎛∂∂,, 3. 在相图上,当系统处于下列哪一点时,只存在一个相( )。
A. 恒沸点B. 熔点C. 临界点D. 低共熔点 4. 单原子分子理想气体的C V , m =23R ,温度由T 1变到T 2时,等压过程系统的熵变 ΔS p 与等容过程熵变ΔS V 之比是( )。
A. 1 : 1B. 2 : 1C. 3 : 5D. 5 : 35. 298 K ,当 H 2SO 4溶液的浓度从 0.01 mol·kg -1增加到 0.1 mol·kg -1时,其电导率 k 和摩尔电导率Λm 将( )。
A . k 减小,Λm 增加 B. k 增加,Λm 增加C. k 减小,Λm 减小D. k 增加,Λm 减小 6. 对化学反应进度ξ,下列表述正确的是( )。
A. ξ值与反应式的写法无关B. ξ值是体系的状态函数,其值不小于零C. 对指定的反应,ξ值与物质的选择有关D. 对指定的反应,随反应的进行ξ值不变7. 某电池反应为 2 Hg (l )+O 2(g )+2 H 2O (l )=2 Hg 2++ 4OH -,当电池反应达平衡时,电池的电动势E 必然是( )。

物理化学复习、练习题答案选择题答案计算题部分:电化学部分:1、三种盐 NaCl 、KCl 与KNO 3分别溶于水,其极稀溶液的摩尔电导率m Λ/(10-4S·m 2·mol -1)分别为:126 、150和145。
且 NaCl 溶液中 Na +迁移数为 0.39 。
求NaNO 3极稀溶液的摩尔电导率与此溶液中 Na +的迁移数。
1、解:m Λ (NaNO 3)=m Λ(KNO 3)+ m Λ(NaCl) - m Λ(KCl)= 126 + 145 - 150 = 121×10 -4 S·m 2·mol -1 [2分]∵ 在 NaCl 中 t (Na +)= 0.39∴ m Λ (Na +)= m Λ(NaCl)× 0.39 = 49.14×10 -4 S·m 2·mol -1 [1分]在 NaNO 3中,t (Na +)=m Λ(Na +)/m Λ(NaNO 3)=49.14/121=0.406 [2分]2、计算AgBr 饱 和 水 溶 液 在25 ℃ 时的电导率。
已知其在此温度下的溶度积 K SP =4.81×10-13 mol 2⋅dm -6;AgNO 3, KBr, KNO 3的无限稀释摩尔电导率分别等于133.3×10-4 S·m 2·mol -1,151.9×10-4S·m 2·mol -1,144.9×10-4S·m 2·mol -1,所用水的电导率为4.40×10-6 S·m -1。
2、解:c (AgBr) = K SP 1/2= 6.94×10-7mol·dm -3m ∞Λ(AgBr) = m ∞Λ (AgNO 3) +m ∞Λ ( KBr )- m ∞Λ (KNO 3)=140.3×10-4 S·m 2·mol -1 [2分]κ(AgBr) = m Λ(AgBr)⨯c (AgBr) =m ∞Λ(AgBr)⨯c (AgBr) =9.74×10-6S·m -1 [2分]κ(溶液) =κ (AgBr) +κ (H 2O)=1.414×10-5S·m -1 [1分]3、电池Cu(s)│CuAc 2(0.1 mol·kg -1)│AgAc(s)∣Ag(s),在 298 K 时,电动势 E = 0.372 V ,当温度升至308K 时,E = 0.374 V ,已知 298 K 时, E ∃ (Ag +|Ag) = 0.800 V ,E ∃ (Cu 2+|Cu) = 0.340 V 。

淮 阴 师 范 学 院 2008 级化学工程专业物理化学课程期中试卷题号 得分 一 二 三 四 总分姓名一、 选择题(每题 2 分,共 20 题,40 分)密1. 理想气体在恒定外压 pӨ 下,从 10 dm3 膨胀到 16 dm3,同时吸热 126 J。
计算此气 体的 ΔU。
(A) -284 J (B) 842 J (C) -482 J (D) 482 J ( )学号2.有一容器四壁导热,上部有一可移动的活塞,在该容器中同时放入锌块和盐酸, ) (B) Q = 0, (D) Q < 0, W > 0, W<0, ΔrU < 0 ΔrU < 0发生化学反应后活塞将上移一定距离,若以锌和盐酸为体系则: (封(A) Q < 0, W = 0, ΔrU < 0 (C) Q < 0 , W > 0, ΔrU = 0班级3.0 若以 B 代表化学反应中任一组分, nB 和 nB 分别表示任一组分 B 在 ξ= 0 及反应进度为 ξ 时的物质的量,则定义反应进度为:0 (A) ξ= nB - nB 0 (B) ξ= nB- nB 0 (D) ξ= ( nB -nB)/ νB 0 (C) ξ=(nB- nB )/νB()线4.熵变S 是:系别(1) 不可逆过程热温商之和 (3) 与过程无关的状态函数 以上正确的是: (A) 1, 2 (B) 2 (C) 2 , 3(2) 可逆过程热温商之和 (4) 与过程有关的状态函数 ( (D) 4 )5. 某气体的状态方程为 pVm = RT +αp, 其中 α 为大于零的常数, 该气体经恒温膨胀, 其内能: (A) 不变 (B) 增大 (C) 减少1( (D)) 不能确定6. 下列四种表述: (1) 等温等压下的可逆相变过程中,体系的熵变Δ S =Δ H 相变/T 相变 (2) 体系经历一自发过程总有 dS > 0 (3) 自发过程的方向就是混乱度增加的方向 (4) 在绝热可逆过程中,体系的熵变为零 两者都不正确者为: (A) (1),(2) (C) (2),(3) (B) (3),(4) ( )(D) (1),(4)7、在 300K 时, 2 mol 某理想气体的吉布斯自由能 G 与赫姆霍兹自由能 A 的差值为: ( ) (A) G-A=1.247 kJ (B) G-A=2.494 kJ (C) G-A=4.988 kJ (D) G-A=9.977 kJ8. 当计算 1mol 理想气体经历可逆的绝热过程的功时,下列哪一个式子是不是用的? (A) Cv(T1-T2) (B) Cp(T2-T1) (C)p1V 1 p 2V 2 1(D)R (T 1 T 2) 19.体 系 的 压 力p( 体 系 ) 与 环 境 的 压 力p( 环 境 ) 有 何 关 系 ? ( )(A) 相等 (C) p(体系)>p(环境)(B) 无关系 (D) 可逆变化途径中 p(体系)=p(环境)10. 在标准压力 p下,383.15 K 的水变为同温下的蒸气, 吸热 Qp。
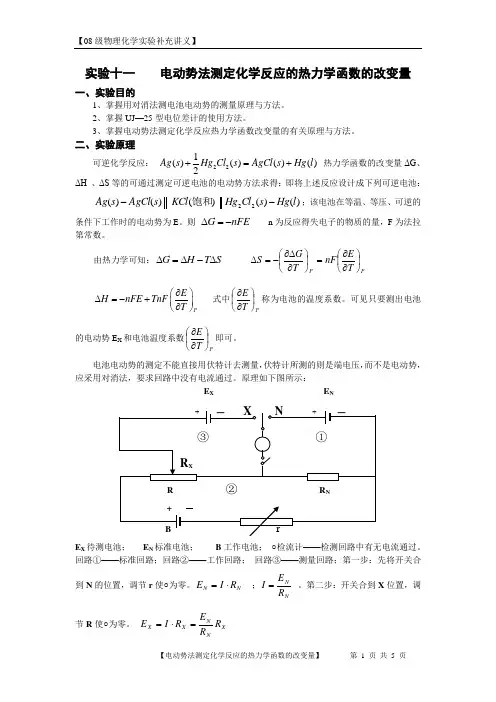
实验十一 电动势法测定化学反应的热力学函数的改变量一、实验目的1、掌握用对消法测电池电动势的测量原理与方法。
2、掌握UJ —25型电位差计的使用方法。
3、掌握电动势法测定化学反应热力学函数改变量的有关原理与方法。
二、实验原理可逆化学反应: 221()()()()2A g s H g C l s A gC l s H g l +=+ 热力学函数的改变量ΔG 、ΔH 、ΔS 等的可通过测定可逆电池的电动势方法求得:即将上述反应设计成下列可逆电池:)()()()()(22l Hg s Cl Hg KCl s AgCl s Ag --饱和;该电池在等温、等压、可逆的条件下工作时的电动势为E 。
则 nFE G -=∆ n 为反应得失电子的物质的量,F 为法拉第常数。
由热力学可知:S T H G ∆-∆=∆ PP T E nF T G S ⎪⎭⎫ ⎝⎛∂∂=⎪⎭⎫ ⎝⎛∂∆∂-=∆ P E H nFE TnF T ∂⎛⎫∆=-+ ⎪∂⎝⎭ 式中PT E ⎪⎭⎫ ⎝⎛∂∂称为电池的温度系数。
可见只要测出电池的电动势E X 和电池温度系数PT E ⎪⎭⎫ ⎝⎛∂∂即可。
电池电动势的测定不能直接用伏特计去测量,伏特计所测的则是端电压,而不是电动势, 应采用对消法,要求回路中没有电流通过。
原理如下图所示:E XE NE X 待测电池; E N 标准电池; B 工作电池; ○检流计——检测回路中有无电流通过。
回路①——标准回路;回路②——工作回路; 回路③——测量回路;第一步:先将开关合到N 的位置,调节r 使○为零。
N N R I E ⋅= ;N N R E I = 。
第二步:开关合到X 位置,调节R 使○为零。
X N N X X R R E R I E =⋅=三、仪器与药品1、UJ —25型电位差计 1台 6、甲电池 2个2、AC 15/2直流复射式检流计 1台 7、滴管 1个3、甘汞电极、银—氯化银电极 各1支 8、50mL 烧杯(KCl ) 1个4、标准电池 1个 9、饱和KCl 溶液(公用)5、501—SP 超级恒温槽 1台四、实验步骤1.恒温槽调到25℃并检查甘汞电极、银—氯化银电极是否符合使用要求。

1 盐城师范学院考试试卷2008 — 2009 学年第一学期化学化工学院制药工程专业《物理化学B(2)》试卷A班级学号姓名一、填空题(本大题共15空,每空1分,计15分)1、同一电导池测得浓度为0.01mol·mol·dmdm -3的A 溶液和浓度为0.1 mol·mol·dm dm -3的B 溶液的电阻分别为1000Ω和500Ω,则它们的摩尔电导率之比Λm (A)/Λm (B)等于。
2、混合等体积的0.08 mol·mol·dm dm -3KI 和0.1 mol·d m dm -3 AgNO3溶液得AgI 溶胶,试写出该溶胶的胶团结构式:。
3、25℃时,0.002 mol·mol·kg kg -1CaCl 2水溶液中离子平均活度系数为γ±1,0.002 mol·mol·kgkg -1CuSO 4水溶液中离子平均活度系数为γ±2,则γ±1γ±2。
4、液滴越小,其饱和蒸气压越;气泡越小,气泡内液体的饱和蒸气压越。
(选填“大”或“小”)。
5、设物质A 可发生两个平行的一级反应:(a)C B A Ea ka +¾¾®¾,(b)E D A Eb kb +¾¾®¾,式中,B 和C 是需要的产品,D 和E 为副产物。
设两反应的频率因子相等且与温度无关,E a >E b ,则反应(a)和反应(b)相比,速率较大的反应是,升高温度对反应更有利。
6、对于均相反应bB→W+Z ,测得速率常数k 与温度T 的关系是lgk = -3800/T +13,该反应的指前因子为,活化能为。
7、将反应Fe 2++Ag +→Fe 3++Ag(s)设计成电池,其电池符号为:。
8、测定电池电动势时,盐桥的作用是;对于电池Ag(s) AgCl(s) | Cl (a 1)‖Ag +|Ag(s)不能使用含Cl --离子的电解质溶液作盐桥,其原因是。
2007-2008学年第二学期物理化学(下册)期末考试试卷班级 姓名 学号 08年6月一、填空(在以下各小题画有“ ”处填上正确答案。
)1.在298K ,101325Pa 下,将直径d =0.1mm 的毛细管插入水中,已知水的表面张力γ水-气=0.0728N/m ,水的密度ρ=1.0g/cm 3,接触角θ=0˚,重力加速度g =9.8m/s 2,则平衡后液面上升高度h = m 。
2.在400 K 时,某气相反应的速率常数k p = 10-3(kPa)-1·s -1,若速率常数用 k C 表示,则k C = (mol ·m -3)-1·s -1。
3.设计一个可求AgI 溶液K sp 的电池: 。
4.某温度下,反应A —→B 为一级反应,若21t 和41t 分别代表该反应物A 消耗掉50%和75%所需时间,则比值21t :41t =________________。
5.若某1-1型电解质溶液的摩尔电导率为正负离子的摩尔电导率之和,这一规律所适用于: 。
6.由AgNO 3和KI 生成AgI 溶胶,若Al(NO 3)3,Mg(NO 3)2和NaNO 3对该溶胶的聚沉值分别为0.067mol ·dm -3,2.60 mol ·dm -3和140 mol ·dm -3,则该AgI 的胶团结构为: 。
7.一维简谐振子振动能级的简并度为 ,线型刚性转子转动能级的简并度为 。
8.一个双原子分子的振动配分函数表示为1/[1-exp(- v /T )],该配分函数是以 为能量零点的振动配分函数。
二、选择题:(请将答案填在答案表格中)1. 在25℃时,若电池Pb(Hg)(a 1)∣Pb(NO 3)2(aq) ∣Pb(Hg)(a 2)中,a 1> a 2,则电池电动势E A. >0 B. <0 C. =0 D. 无法确定2.某电池电动势与温度的关系为: E /V=1.01845-4.05×10-5(T /K-293) -9.5×10-7(T/K-293)2 在298K 时,若该电池可逆放电,则过程热:A.Q > 0B. Q < 0C. Q = 0D.不能确定3.在溶胶的光学性质中,散射光的强度I 与入射光的波长λ、分散相及分散介质的折射率n 、n 0之间的关系中正确的是:A .I 与λ4成正比,I 与(n 2-n 20)2成正比B .I 与λ4成反比,I 与(n 2+n 20)2成正比C .I 与λ4成正比,I 与(n 2-n 20)2成反比D .I 与λ4成反比,I 与(n 2-n 20)2成正比4.(N 、U 、V )确定的离域子系统中,某种分布的微观状态数W D 为:A .∏i i n i n g N i!!B .∏ii ni n g i !C .∑ii g in n i!D .∑ii ni n g i !5.已知某复合反应的反应历程为D C B B A kk k −→−+===-211,则B 的浓度随时间的变化率=dtdc BA .k 1c A − k 2cB cC B .k 1c A −k -1c B −k 2c B c C C .k 1c A −k -1c B + k 2c B c CD .−k 1c A + k -1c B + k 2c B c C6.HI 分解反应在没有催化剂条件下时活化能为184.1kJ ·mol -1,反应速率常数为k 非,平衡转化率为α非,反应热为Q非,平衡常数为K 非。
化学动力学练习(一)一、选择题1. 对于反应2NO2= 2NO + O2,当选用不同的反应物和产物来表示反应速率时,其相互关系为:( )(A) -2d[NO2]/d t = 2d[NO]/d t = d[O2]/d t(B) - d[NO2]/2d t = d[NO]/2d t = d[O2]/d t= dξ/d t(C) - d[NO2]/d t = d[NO]/d t = d[O2]/d t(D) - d[NO2]/2d t= d[NO]/2d t=d[O2]/d t = 1/V dξ/d t2. 理想气体反应A + BC[ABC]≠→产物,若设E a为阿累尼乌斯活化能,∆≠Hm表示活化络合物与反应物在标准状态下的焓差,则( )(A) E a= ∆≠Hm+ RT(B) E a= ∆≠Hm+ 2RT(C) E a= ∆≠Hm+ 3RT(D) E a= ∆≠Hm- 2RT3. 均相反应A + B k1C +D , A+ B k2E +F 在反应过程中具有∆[C]/∆[E] = k1/k2的关系,∆[C],∆[E] 为反应前后的浓差,k1,k2是反应(1),(2)的速率常数。
下述哪个是其充要条件?( )(A) (1),(2) 都符合质量作用定律(B) 反应前C,E 浓度为零(C) (1),(2) 的反应物同是A,B(D) (1),(2) 反应总级数相等4. 400 K 时,某气相反应的速率常数k p= 10-3(kPa)-1·s-1,如速率常数用k C表示,则k C应为:( )(A) 3.326 (mol·dm-3)-1·s-1(B) 3.0×10-4 (mol·dm-3)-1·s-1(C) 3326 (mol·dm-3)-1·s-1(D) 3.0×10-7 (mol·dm-3)-1·s-15. 在反应Ak1Bk2C,Ak3D 中,活化能E1> E2> E3,C 是所需要的产物,从动力学角度考虑,为了提高 C 的产量,选择反应温度时,应选择:( )(A) 较高反应温度(B) 较低反应温度(C) 适中反应温度(D) 任意反应温度6. 如果某反应的△r H m= 100kJ·mol-1,那么活化能E a将:( )(A) E a≠100kJ·mol-1(B) E a≥100kJ·mol-1(C) E a≤100kJ·mol-1(D) 都可以7. 某反应物起始浓度相等的二级反应,k =0.1 dm3·mol-1·s-1,c0= 0.1 mol·dm-3,当反应率降低9 倍所需时间为:( )(A) 200 s(B) 100 s(C) 30 s(D) 3.3 s8. 过渡态理论的速率常数的公式为()()()k k T h q q q E RT=≠-B A B//exp/∆,下述说法正确的(A)q≠不是过渡态的全配分函数(B)q A, q B是任意体积中分子的配分函数(C) q A , q B , q ≠均是分子在基态时的配分函数(D) ()k T h B /是过渡态M ≠中任一个振动自由度配分函数9. 1-1 级对峙反应 12A B kk 由纯 A 开始反应,当进行到 A 和 B 浓度相等的时间为: (正、逆向反应速率常数分别为 k 1 ,k 2)( )(A) t = ln 12kk (B) t = 11221ln k k k k - (C) t = 1121212ln k k k k k +- (D) 112121ln k t k k k k =+-10. 在温度 T 时,实验测得某化合物在溶液中分解的数据如下:初浓度 c 0/mol ·dm -3 0.501.102.48半衰期 t 12/ s -1 4280885 174则该化合物分解反应的级数为:( )(A) 零级(B) 一级反应(C) 二级反应(D) 三级反应11. 两个活化能不相同的反应,如 E 2>E 1,且都在相同的升温度区间内升温, 则: ( ) (A)21d ln d ln d d k k T T >(B) 21d ln d ln d d k k T T < (C )21d ln d ln d d k k T T=(D) 21d d d d k k T T>12. 下表列出反应 A + B → C 的初始浓度和初速:此反应的速率方程为: ( )(A) r = k c B(B) r = k c A c B (C) r = k c A (c B )2(D) r = k c A13. 实验测得反应 3H 2+ N 2→ 2NH 3 的由此可推知该反应的速率方程 d p (NH 3)/2d t 等于:( )(A) kp H 23p N 2 (B) kp H 22p N 2 (C) kp H 2 p N 2(D) kp H 2 p N 2214. 如果臭氧 (O 3) 分解反应 2O 3→ 3O 2的反应机理是:O 3→ O + O 2 (1)O + O3→2O2(2)请你指出这个反应对O3而言可能是:( )(A) 0 级反应(B) 1 级反应(C) 2 级反应(D) 1.5 级反应15. 对于气相基元反应,按过渡态理论,不正确的关系式是:( )(A)E a=∆≠Um+RT(B)E a=∆≠Hm+nRT(C)E a=E0+ RT(D)E a=E0+mRT16. 单原子分子A与双原子分子B生成非线性过渡态时,据A(TST)=(k B T/h)[q≠/(q A q B)]计算A时,q≠为( )(A) f t3f r2f v3(B) f t3f r2f v4(C) f t3f r3f v3(D) f t3f r3f v217. 气相反应A + 2B ─→2C,A 和B 的初始压力分别为p A和p B,反应开始时并无C,若p为体系的总压力,当时间为t 时,A 的分压为:( )(A) p A- p B(B) p - 2p A(C) p - p B(D) 2(p - p A) - p B18. 基元反应 A + B - C →A - B + C 的摩尔反应焓∆r H m< 0,B - C 键的键能为εBC,A 为自由基,则反应活化能等于:( )(A) 0.30 εBC(B) 0.05 εBC(C) 0.05 εBC + ∆H m(D) 0.05 εBC - ∆H m 19. 反应 A →产物为一级反应,2B →产物为二级反应,t12(A) 和t12(B) 分别表示两反应的半衰期,设 A 和 B 的初始浓度相等,当两反应分别进行的时间为t = 2t12(A) 和t = 2t12(B) 时,A,B 物质的浓度c A,c B的大小关系为:( )(A) c A> c B(B) c A= c B(C) c A< c B(D) 两者无一定关系20. 一个反应的活化能是33 kJ·mol-1, 当T= 300 K 时,温度每增加1K,反应速率常数增加的百分数约是:( )(A) 4.5%(B) 90%(C) 11%(D) 50%二、计算题21.1,3-二氯丙醇在NaOH存在条件下, 发生环化作用,生成环氧氯丙烷反应, 反应为二级(对1,3-二氯丙醇及NaOH均为一级)。
中南大学考试试卷2008 -- 2009 学年二学期时间110分钟物理化学课程40 学时2.5 学分考试形式:闭卷专业年级:化工、制药、应化07级总分100分,占总评成绩70 % 注:此页不作答题纸,请将答案写在答题纸上一、选择题(每题2分,共24分)1. 下列关于连串反应的各种说法中正确的是( )(A) 连串反应进行时,中间产物的浓度一定会出现极大值(B) 连串反应的中间产物的净生成速率等于零(C) 所有连串反应都可以用稳态近似法处理(D) 在不考虑可逆反应时,达到稳定态的连串反应受最慢的基元步骤控制2.某反应,无论作用物的初始浓度是多少,在相同时间和温度条件下,无论作用物的消耗浓度为定值,则该反应是( )(A) 负级数反应(B) 零级反应(C) 一级反应(D) 二级反应3. 下列关于催化剂的说法不正确的是( )(A) 催化剂不改变反应热(B) 催化剂不改变化学平衡(C) 催化剂不参与化学反应(D) 催化剂具有选择性4. 若向摩尔电导率为1.4×10-2S·m2·mol-1的CuSO4水溶液加入1 m3的纯水,则稀释后CuSO4水溶液的摩尔电导率将( )(A) 降低(B) 增高(C) 不变(D) 不确定5.电极电势可以改变电极反应速率,其直接原因是改变了( )(A) 反应的活化能(B)电极过程的超电势(C)活性粒子的化学势(D) 电极-溶液界面的双电层6.当电流通过电池时,电极将发生极化。
当电流密度增大时,通常将发生( )(A) 原电池的正极电势增高 (B ) 原电池的负极电势增高(C) 电解池的阳极电势减少 (D) 无法判断7. 已知V 0360Fe Fe 3./-=Θ+E ,V 771023Fe Fe ./=Θ++E ,则Θ+Fe Fe 2/E 等于 ( )(A) 0.735V (B) 0.807V (C ) -0.44 V (D) -0.699 V8.下列电池中,哪个电池的反应为H + + OH - === H 2O ( )(A) Pt, H 2(g) | H + (aq) || OH -(aq) | O 2(g), Pt(B) Pt, H 2(g) | NaOH (aq) | O 2(g), Pt(C ) Pt, H 2(g) | NaOH (aq) || HCl (aq) | H 2(g), Pt(D) Pt, H 2(g,p 1) | H 2O (l) | H 2(g, p 2), Pt9.Langmuir 吸附等温式有很多种形式,而最常见的是bpbp +=1θ,但它不适用于( ) (A ) 多种分子同时被强吸附 (B) 单分子层吸附(C) 物理吸附 (D) 化学吸附10.弯曲液面所产生的附加压强一定 ( )(A) 等于零 (B ) 不等于零 (C) 大于零 (D) 小于零11.溶胶与高分子溶液的主要区别在于 ( )(A) 分散相粒子大小不同 (B) 渗透压不同(C) 外观颜色不同 (D ) 相状态和热力学稳定性不同12. 下列关于电泳现象的各种阐述中正确的是 ( )(A ) 电泳和电解没有本质区别 (B) 外加电解质对电泳的影响很小(C) 胶粒的电泳速度与一般离子的电迁移速度差别很大(D) 胶粒的电泳速度外加电场的电位梯度无关二、填空题(共16分)1. (3分) 链反应是由链的 、链的 和链的 三个基本步骤构成的。
华南理工大学《物理化学》64-3试卷 (参考答案其它试题)专业________ 班级编号______ 姓名分数一、选择体(每题2分,共20分)1. 在恒T、pθ下,C(石墨) + O2 (g)─→CO2(g) 的反应焓为△r H mθ,下列哪种说法是错误的( )A. △r H mθ是CO2(g)的标准生成焓B. △r U mθ< △r H mθC. △r H mθ是石墨的燃烧焓D. △r H mθ=△r U mθ2. 1mol的纯液体在其正常沸点时汽化为蒸气,该过程中增大的量是( )A. 蒸气压B. 汽化焓C. 系统熵D. 吉氏函数3. 根据依数性以渗透压法来测定化合物的摩尔质量时,最广泛被用来测定的化合物是( )A. 无机非电解质B.低分子的有机物C.无机的电解质D.大分子化合物4. 反应 CO(g) + H2O(g) = CO2(g) + H2(g) 在 600℃、100kPa下达到化学平衡,当压力增大到 5000kPa 时,各气体的逸度系数为:ϕ(CO2) = 1.90 ϕ(H2) = 1.10 ϕ(CO) = 1.23 ϕ(H2O) = 0.77 则平衡点( )A. 向右移动B. 不移动C. 向左移动D. 无法确定5. 将NH4Cl(s)置于抽空容器中,加热到597K,使NH4Cl(s)分解, NH4Cl(s)=NH3(g)+HCl(g)达平衡时系统总压力为100kPa,则热力学标准平衡常数K pθ为( )A. 0.5B. 0.025C. 0.05D. 0.256. 下列各电池中,其电池电动势与氯离子的活度a(Cl-)无关的是( )A. Zn |ZnCl2(aq) | Cl2(p),PtB. Zn | ZnCl2(aq) KCl(aq) | AgCl(s) | AgC.Pt,H2(p1) | HCl(aq)| Cl2 (p2),PtD. Ag | AgCl(s) | KCl(aq) | Cl2(p),Pt7. 当表面活性物质加入溶剂后,所产生的结果是( )A. dγ/d c < 0,正吸附B. dγ/d c <0,负吸附C. dγ/d c > 0,正吸附D. dγ/d c >0,负吸附8. 微小晶体与普通晶体相比较,那一种性质不确?( )A. 微小晶体的饱和蒸气压大B. 微小晶体的溶解度大C. 微小晶体的熔点较低D. 微小晶体的溶解度较小9. 反应速率常数随温度变化的阿累尼乌斯(Arrhenius)经验公式适用于( )A. 基元反应B. 基元反应和大部分非基元反应C. 对行反应D. 所有化学反应10. 憎液溶胶是热力学上的( )A. 不稳定、可逆的系统B. 不稳定、不可逆系统C. 稳定、可逆的系统D. 稳定、不可逆系统二、填空题(共12分)1. 一个过程系统的熵变为△S,而另一个过程的始终态与前过程相同,但路径不同,则此过程系统的熵变应为___________。
2009—2010年第2学期考试试题 (A )卷课程名称 物理化学下册 任课教师签名 孙雯、向建敏等 出题教师签名 审题教师签名考试方式 (闭 )卷 适用专业 08制药、化工等(注意:请将所有题目的答案均写在答题纸上。
) 一、选择填空题(共34分,每空2分) 1、已知, 则 等于( )A 。
1。
25VB 。
2。
5V C. 1。
06V D 。
0.53V 2、反应Zn (s)+H 2SO 4(aq )→ZnSO 4(aq)+H 2(p)在298 K 和p压力下,反应的热力学函数变化值分别为∆r H m (1),∆r S m (1)和Q 1;若将反应设计成可逆电池,在同温同压下,反应进度与上相同,这时各变化值分别为∆r H m (2),∆r S m (2)和Q 2 。
则其间关系为 ( )A.B 。
C. D 。
3、已知某反应速率常数的单位为dm 3·mol —1·s —1 , 则反应级数为( )A .零级B 。
一级C 。
二级D 。
三级4、对任意给定的反应 有( )A. B 。
反应的级数 n=1.5C. 反应的分子数为1.5D.5、利用反应合成物质B ,若提高温度对提高产物B 的产率有利,则表明活化能( ) A 。
E 1<E 2,E 1<E 3 B. E 1>E 2,E 1〉E 3 C 。
E 2>E 1,E 2>E 3 D 。
E 3〉E 1,E 3〉E 26、某反应速率常数与各基元反应速率常数的关系为 ,则该反应的表观活化能 E a 与各基元反应活化能的关系为( )A. E a =2E a,2+1/2(E a,1-E a,4) B 。
E a =E a ,2+1 /2(E a ,1-E a ,4) C. E a =2E a ,2+E a,1-E a ,4 D 。
E a =E a ,2+E a ,1-1/2E a ,4 7、在一个密闭的容器中,有大小不同的两个水珠,长期放置后,会发生:( )A 。
(A) ∆U 与温度无关 (B) ∆A 与温度无关 (C) ∆S 与温度无关
(D) ∆G 与温度无关
7.等熵等容条件下,过程自发进行时,下列关系肯定成立的是( ) (A) ∆G < 0; (B) ∆A < 0; (C) ∆H < 0; (D) ∆U < 0 。
8.一个已充电的蓄电池以1.8 V 输出电压放电后,用2.2 V 电压充电使其回复原状,则总的过程热力学量变化( ) (A) Q < 0,W > 0,∆S > 0,∆G < 0 ; (B) Q < 0,W < 0,∆S < 0,∆G < 0 ; (C) Q > 0,W > 0,∆S = 0,∆G = 0 ; (D) Q < 0,W > 0,∆S = 0,∆G = 0
9.冬季建筑施工时,为了保证施工质量,常在浇筑混凝土时加入盐类,为达到 上述目的,现有下列几种盐,你认为用哪一种效果比较理想( ) (A) NaCl ;
(B) NH 4Cl ; (C) CaCl 2 ; (D) KCl 。
10.由A 及B 二种液体组成理想溶液,A 、B 的饱和蒸气压分别为**b A p p 、,x 为 液相组成,y 为气相组成,若**b A p p ( * 表示纯态),则( )
(A) x(A) > x(B) ; (B) x(A) > y(A) ; (C) x(A) < y(A) ; (D) 无法确定 。
11.气相反应2NO + O 2 = 2NO 2 在27℃时的Kp 与Kc 之比值约为( ) (A) 4×10-4 ; (B) 4×10-3 ; (C) 2.5×103 ; (D) 2.5×102 。
12.恒温下,在反应2NO 2(g) = N 2O 4(g) 达到平衡后的体系中加入惰性气体,则( )
(A) 平衡向右移动 ;
(B) 平衡向左移动 ;
(C) 平衡不移动; (D) 条件不充分,无法判断 。
13.NaCl 水溶液和纯水,经半透膜达到渗透平衡,该体系的自由度数是( )
(A) f = 4 ;
(B) f = 3 ;
(C) f = 2 ;
(D) f = 1 。
14.加压于冰,冰可部分熔化成水,这是什么原因( ) (A) 冰的密度小于水;
(B) 冰的晶格受压崩溃 ;
(C) 冰熔化时吸热 ; (D) 加压生热。
15.如图A 与B 是两组分恒压下固相部分互溶 凝聚体系相图,图中有几个两相区( )
(A) 1个 ; (B) 2个 ; (C) 3个 ; (D) 4个 。
16-19填空题内容在“>”、“ <”或“ =”中选择。
16. 理想气体经历一个绝热不可逆过程,其S ∆ 0。
17.理想气体的节流膨胀过程,其T ∆ 0。
18.在等温等压下发生的可逆相变A(l ) == A(g),其G ∆ 0。
19.在一个绝热钢瓶中,发生一个放热的分子数增加的化学反应,其U ∆ 0。
20. 既是偏摩尔量,又是化学位的偏微商是 。
21.物质在相间传递的方向,是向化学位 的方向。
(增大或减小) 22.根据相律可知,在一个单组分系统中最多存在的相数为 。
23. 在理想液体混合物中,各种分子间的作用力 。
(相同或不相同) 24.在理想气体反应体系中,实验平衡常数x p K K 与的关系是 。
25.在恒温恒容条件下,在建立了化学平衡的合成氨体系中,充入惰性气体,平衡将如何移动 。
(填“正反应方向”、“逆反应方向”、不移动)
26.卡诺循环是可逆过程,当系统经历一个卡诺循环后,系统和环境都将复原。
27.实际气体经绝热自由膨胀后,因Q = 0,W = 0,据热力学第一定律知ΔU = 0,所以气体温度不变。
28.对任意一可逆循环过程其ΔS = 0,而不可逆循环过程则ΔS > 0。
29. 热力学基本公式,只适用于单组分单相,多组分组成不变的单相系统。
三、判断题:正确选用“√”,错误选用“×”。
本题共10题,每题1分,共10分。
二、填空题:本题共10题,每题1
分,共10分。
30. 在混合形成理想液体混合物过程中,0=∆H mix 。
31. 在简单低共熔物的相图中,三相线上的任何一个物系点的液相组成都相同。
32.理想稀溶液中的溶质和溶剂均遵守拉乌尔定律。
33.在多相平衡系统中,杠杆规则适用于二组分系统的任何相区。
34.欲使反应产物的平衡浓度最大,反应物的投料比应等于计量系数之比
35.如果某一化学反应的0<∆θm r H ,则该反应的θK 随温度的升高而增大。
36、下图是二组分凝聚体系相图,按下列要求回答:
⑴ 在原图的右侧,画出物系点Q 、M 、N 在冷却过程中的步冷曲线(3分) ⑵ E 点称作
;(1分)
⑶ 相区2中存在的相数为 ;(1分) ⑷ 相图中条件自由度f *=0的点有 ;(2分)
⑸ 写出FEG 水平线上存在的具体的相态 。
(3分)
四、相图分析:本题共1题,每题10分,共10分。
300K 的1mol 理想气体作定温膨胀,起始压力为1.5×106Pa ,3。
求该过程的∆U 、∆H 、∆S 、∆A 、∆G A 和B 混合形成理想液体混合物。
某温度时溶液上×104Pa ,气相中A 的物质的量分数为0.450,液相中为0.650.和纯B 的蒸汽压。
五、计算题:本题共5题,共40分。
39、(6分)在298K时,C2H6OH(l)的标准摩尔燃烧焓为-1367kJ/mol,CO2(g)和H2O(l)的标准摩尔生成焓分别为-393.5kJ/mol和-285.8kJ/mol,求298K时
C2H6OH(l)的标准摩尔生成焓。
40、(10分)反应N2O4(g)===2NO2(g) 在60℃时 K=1.33。
试求算在60℃及标准压力时
⑴纯N2O4气体的解离度
⑵ 1mol N2O4在2mol惰性气体中,N2O4的解离度
41、(6分)UF4(s),UF4(l)的蒸气压与温度的关系分别由如下两个方程表示,试计算UF4(s),UF4(l)),UF4(g)三相共存时的温度和压力(式中p单位为Pa,T单位为K)。
ln p(UF4,s)= 41.67 -
T
10017
ln p(UF4,l)= 29.43 -
T 5.
5899。