常见酸碱盐的除杂
- 格式:pptx
- 大小:1.18 MB
- 文档页数:12
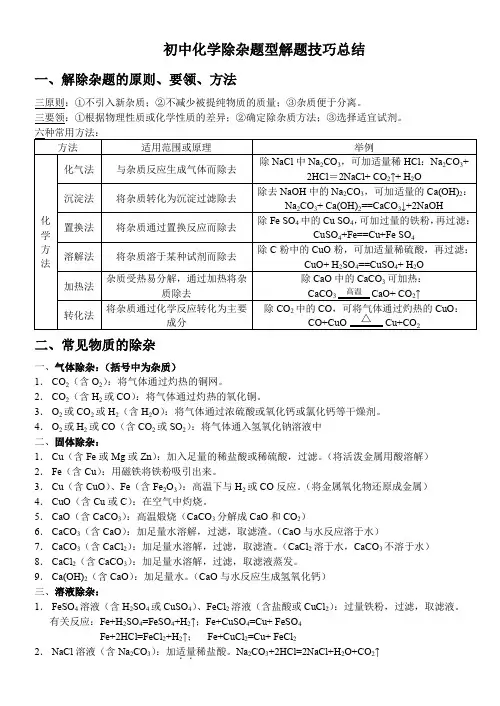
初中化学除杂题型解题技巧总结一、解除杂题的原则、要领、方法三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。
三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
二、常见物质的除杂一、气体除杂:(括号中为杂质)1.CO2(含O2):将气体通过灼热的铜网。
2.CO2(含H2或CO):将气体通过灼热的氧化铜。
3.O2或CO2或H2(含H2O):将气体通过浓硫酸或氧化钙或氯化钙等干燥剂。
4.O2或H2或CO(含CO2或SO2):将气体通入氢氧化钠溶液中二、固体除杂:1.Cu(含Fe或Mg或Zn):加入足量的稀盐酸或稀硫酸,过滤。
(将活泼金属用酸溶解)2.Fe(含Cu):用磁铁将铁粉吸引出来。
3.Cu(含CuO)、Fe(含Fe2O3):高温下与H2或CO反应。
(将金属氧化物还原成金属)4.CuO(含Cu或C):在空气中灼烧。
5.CaO(含CaCO3):高温煅烧(CaCO3分解成CaO和CO2)6.CaCO3(含CaO):加足量水溶解,过滤,取滤渣。
(CaO与水反应溶于水)7.CaCO3(含CaCl2):加足量水溶解,过滤,取滤渣。
(CaCl2溶于水,CaCO3不溶于水)8.CaCl2(含CaCO3):加足量水溶解,过滤,取滤液蒸发。
9.Ca(OH)2(含CaO):加足量水。
(CaO与水反应生成氢氧化钙)三、溶液除杂:1.FeSO4溶液(含H2SO4或CuSO4)、FeCl2溶液(含盐酸或CuCl2):过量铁粉,过滤,取滤液。
有关反应:Fe+H2SO4=FeSO4+H2↑;Fe+CuSO4=Cu+ FeSO4Fe+2HCl=FeCl2+H2↑;Fe+CuCl2=Cu+ FeCl22.NaCl溶液(含Na2CO3):加适量..稀盐酸。
Na2CO3+2HCl=2NaCl+H2O+CO2↑3.Na2SO4溶液(含CuSO4):加适量..NaOH溶液。
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4三、经典例题( )例1.除去KCl溶液中混有的少量K2CO3,选用的试剂是A.H2SO4溶液B.稀盐酸C.K2SO4溶液D. AgNO3溶液( )例2.除去下列各物质中的少量杂质所选用的试剂及操作方法均正确的是( )例3.下列除杂方法正确的是A.用NaOH除去CO2中混有的HClB.用点燃的方法除去CO2中混有少量的COC.用水除去MnO2中混有的KClD.用硝酸除去NaCl中混有的Na2CO3 ( )例4.下表列出了除去物质中所含少量杂质的方法,其中错误的是( )例5.除去下列物质中所含少量杂质的方法正确的是( )...四、中考链接( )1.下表中,除去物质所含杂质的方法正确的是( )2.除去下列各组物质中的杂质,所用试剂和方法均正确的是()3.下列除杂选用试剂正确的是A.用过量的O2除去CO2中CO B.用过量的FeSO4溶液除去Zn中的Fe C.用过量的NaOH除去CaCl2溶液中HCl D.用过量HCl溶液除去Cu中CuO ()4.除去下表所列物质中含有的杂质,所用试剂和操作方法均正确的是()5.除去下列物质中括号内少量杂质的方法,合理的是A. CaO(CaCO3):加入足量的稀盐酸B. CO2(CO):在氧气中点燃C. H2 (HCl、H2O):把混合气体通过盛有足量生石灰和烧碱混合固体的干燥管D. KNO3(K2SO4):溶解,加入过量的硝酸钡溶液、过滤()6.下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)A. NaCl( Na2CO3 ):加入足量稀盐酸、蒸发、结晶B. CaCl2 ( CaCO3 ) :加入足量稀硫酸、蒸发、结晶C. Fe (Cu) :加入足量稀盐酸、过滤、洗涤、干燥D. MnO2 (KCl):加入足量的水溶解、过滤、洗涤、干燥()7.下列除杂试剂选用正确的是()8.除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是()9.除去下列物质中少量的杂质,所用方法错误的是()10.下表中,除去物质中所含少量杂质的方法错误的是()11.为了除去括号内的杂质,所选用试剂和操作方法都正确的是((下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)()14.下表中,除去物质所含杂质的方法正确的是()15.下列除去杂质所选择牟试剂错误的是:()16.下列各组括号内除杂技的方法或试剂错误的是A.CO2中混有CO(点燃)B.Cu粉中混有CuO(稀硫酸)C.CO中混有CO2 (氢氧化钠溶液)D.Cu粉中混有Fe粉(用磁铁吸引)((()19.除去下列物质中混有的杂质,所选用的试剂及操作方法均正确的是(()22. 除去下列物质中的少量杂质,所用试剂或方法不正确的是()23.除去下列物质中所含的少量杂质,所选试剂正确的是。


除杂和调pH知识点归纳1. 引言在化学实验室中,进行实验时常常会遇到需要除去杂质或调整溶液pH值的情况。
除杂和调pH是实验中非常常见的操作步骤,掌握这些知识点对于实验的成功与否至关重要。
本文将介绍除杂和调pH的基本知识和步骤。
2. 除杂知识点除杂是指将溶液中的杂质去除,使得溶液纯净。
常用的除杂方法有过滤、沉淀和萃取等。
2.1 过滤过滤是将固体颗粒从溶液中分离的方法。
常见的过滤设备有纸漏斗、玻璃纤维滤纸和膜滤器等。
过滤时要注意选择合适的滤纸孔径,以保证除去所需的颗粒而保留溶液。
2.2 沉淀沉淀是指通过加入化学试剂使溶液中的杂质形成固体颗粒沉淀下来。
常见的沉淀剂有盐酸、硫酸和氢氧化钠等。
沉淀后,可以通过离心或过滤等方法将沉淀分离出来。
2.3 萃取萃取是将溶液中的目标物质转移到另一种溶剂中的过程。
常见的萃取方法有液液萃取和固相萃取等。
液液萃取常用有机溶剂如醚类、酮类和酯类,固相萃取常用活性炭和硅胶等。
3. 调pH知识点调pH是指通过加入酸碱溶液调整溶液的酸碱度。
溶液的酸碱度可以通过pH 值来表示,pH值越小表示溶液越酸,pH值越大表示溶液越碱。
3.1 酸碱中和反应酸碱中和反应是指酸与碱反应生成盐和水的反应。
常用的酸碱指示剂可以帮助判断溶液的酸碱性。
常见的酸碱指示剂有酚酞、溴酚蓝和甲基橙等。
通过加入酸或碱溶液,可以控制溶液的酸碱度。
3.2 pH调节剂pH调节剂是指能够调节溶液pH值的化学物质。
常见的pH调节剂有醋酸、氢氧化钠和硫酸等。
通过逐渐加入pH调节剂,可以逐步调节溶液的酸碱度。
4. 除杂和调pH步骤除杂和调pH的步骤一般如下:4.1 除杂步骤1.准备好需要除杂的溶液和相应的除杂设备,如滤纸或漏斗。
2.将滤纸或漏斗放置在容器上方,注意固定好以避免倾斜。
3.慢慢将溶液倒入滤纸或漏斗中,让溶液通过滤纸或漏斗,固体颗粒会被滤纸或漏斗留下,纯净的溶液流入容器中。
4.如果溶液中有较细的颗粒,可以选择使用更加细密的过滤设备进行二次过滤。

化学除杂方法
化学除杂方法是指通过化学反应将杂质转化为可分离的物质,从而达到除杂的目的。
常用的化学除杂方法有:
1. 沉淀法:通过加入适当的沉淀剂,使杂质转化为沉淀,然后过滤分离。
2. 酸碱法:通过加入酸或碱,使杂质转化为可溶性盐或气体,然后分离。
3. 氧化还原法:通过加入氧化剂或还原剂,使杂质转化为气体或沉淀,然后分离。
4. 络合法:通过加入络合剂,将杂质转化为可溶性络合物,然后分离。
5. 吸附法:通过使用吸附剂吸附杂质,然后分离。
6. 分液法:通过将混合物中的液体和固体或两种不相溶的液体分开,达到除杂的目的。
7. 蒸馏法:通过将混合物中的不同组分在不同的温度下进行蒸馏,达到除杂的目的。
8. 结晶法:通过将混合物中的可溶性固体在溶剂中的溶解度随温度变化而分离,达到除杂的目的。
9. 磁铁法:通过磁铁将混合物中的磁性物质和无磁性物质分离。
10. 渗析法:通过使用半透膜袋将混有离子或分子杂质的胶体分离,达到除杂的目的。
不同的化学除杂方法适用于不同的杂质和物质,需要根据实际情况选择合适的方法。



酸碱盐部分——除杂、共存、鉴别1. 物质的除杂(提纯):“除杂”即“提纯”,方法很多,常用的有(1)物理方法① 沉淀过滤法:即通过过滤,除去不溶性杂质。
例如除去粗盐中混有少量的泥沙。
可将粗盐溶解于水,充分搅拌,然后过滤,再把滤液蒸发结晶,即可得到不含泥沙的食盐。
再如KCl (MnO 2)② 结晶法:见当两种固体物质的溶解度相差很大时,可利用结晶的方法将杂质除掉。
例如硝酸钾中混有少量的氯化钠。
(2)化学方法① 沉淀法:加入某种试剂,跟杂质反应形成沉淀,滤去沉淀,即可除掉杂质。
例如,要除掉NaOH 溶液中少量的Na 2CO 3,可加入适量的石灰水,滤去CaCO 3沉淀,即可达到除去Na 2CO 3的目的。
有关的化学方程式:Na 2CO 3+Ca (OH )2=CaCO 3↓+2NaOH ;② 化气法:加入某种试剂,跟杂质反应,化为气体逸出,即可除掉杂质。
例如,用盐酸除去NaCl 中的Na 2CO 3。
Na 2CO 3+2HCl =2NaCl +H 2O +CO 2↑;③ 吸收法:用某种物质做吸收剂,把杂质吸收。
例如,实验室用锌跟盐酸反应制取氢气时,氢气中常含有少量氯化氢气体和水蒸气,欲得纯净干燥的氢气,可用下列洗气装置将氯化氢和水蒸气吸收,以达到除杂的目的。
再如H 2(CO 2、HCl 、水蒸气)分别将气体通过盛有浓氢氧化钠溶液的洗气瓶,除去 CO 2、HCl ;和盛有浓硫酸的洗气瓶,除去水蒸气。
④ 溶解法:将杂质用化学方法溶解。
例如用化学方法除去铜粉中的少量铁粉,可往混合物中加入少量盐酸,充分反应后过滤即得不含铁的铜粉。
有关的化学方程式:Fe +2HCl =FeCl 2+H 2↑;再如CuSO 4(CuO )H 2SO 4有关的化学方程式: CuO+H 2SO 4=CuSO 4+H 2O ; ⑤ 加热法:通过加热,使杂质分解,从而除掉杂质。
例如,要除掉Na 2CO 3中混有的NaHCO 3,就可以用加热的方法。


第一,要知道除杂质的原则,除掉杂质的同时,不能生成新的杂质。
第二,要背得物质的溶解性表,这样才能很好、很快的找到形成沉淀的离子例如氢氧化钠忠混有碳酸钠,阴离子不同,而碳酸根与很多的阳离子都能形成沉淀,常用的可以是氢氧化钙。
这样,反应后就将碳酸钠除掉,生成了氢氧化钠,也不生成新的杂质。
将混合物中的几种物质分开而分别得到较纯净的物质,这种方法叫做混合物的分离。
将物质中混有的杂质除去而获得纯净物质,叫提纯或除杂。
除杂题是初中化学的常见题,它灵活多变,可以综合考察学生的解题能力。
现列举几种方法:1 物理方法1.l 过滤法.原理:把不溶于液体的固体与液体通过过滤而分开的方法称为过滤法。
如:氯化钙中含有少量碳酸钙杂质,先将混合物加水溶解,由于氯化钙溶于水,而碳酸钙难溶于水,过滤除去杂质碳酸钙,然后蒸发滤液,得到固体氯化钙。
如果要获得杂质碳酸钙,可洗涤烘干。
练习1 下列混合物可以用溶解、过滤、蒸发操作来分离的是:()A.CaCO3 CaO B.NaCl KNO3 C.NaNO3 BaSO4 D.KCl KClO31.2 结晶法.原理:几种可溶性固态物质的混合物,根据它们在同一溶剂中的溶解度或溶解度随温度的变化趋势不同,可用结晶的方法分离。
例如:除去固体硝酸钾中混有的氯化钠杂质,先在较高温度下制成硝酸钾的饱和溶液,然后逐步冷却,由于硝酸钾的溶解度随温度的升高而显著增大,温度降低,大部分硝酸钾成为晶体析出,而氯化钠的溶解度随温度的升高而增大得不显著,所以大部分氯化钠仍留在母液中,通过过滤把硝酸钾和氨化钠溶液分开。
为进一步提纯硝酸钾,可再重复操作一次,叫重结晶或再结晶。
练习2 下列混合物适宜用结晶法分离的是:()A.NaNO3 Na2CO3 B.NaNO3 NaCl C.NaOH Mg(OH)2 D.NaCl BaSO42. 化学方法:原理(一)、加入的试剂只与杂质反应,不与原物反应。
(二)、反应后不能带入新的杂质。

除杂常用的五种化学方法物质的除杂问题能考查出学生是否掌握了元素、化合物的重要性质(包含物理性质和化学性质)以及相互之间的转化关系。
物质的除杂问题是初中化学中常见的题型,它贯穿于初中化学的始终。
为了使学生能准确解答此类问题,我在教学中采用明确目标,分析讨论,选择试剂,回归检验等步骤,较好的解答除杂问题,并与学生总结出了用化学原理除杂常用的五种方法,现举例如下:1、使杂质转变为沉淀被除去。
(1)盐酸或可溶性盐酸盐与硝酸银溶液反应生成氯化银沉淀。
例1:如何除去硝酸钠中的少量氯化钠。
分析:两种物质均为可溶性盐,把混合物溶于水得含Na+、NO3-、Cl-的溶液,只需除去Cl-即可。
这就要求所选除杂试剂中的阳离子与Cl-生成沉淀,阴离子应与保留物质的阴离子相同。
故可选AgNO3,将AgNO3溶液逐滴加至不再产生沉淀为止,过滤,蒸发滤液就可得到较纯净的硝酸钠。
NaCl+AgNO3=AgCl +NaNO3②硫酸或可溶性硫酸盐与含有钡离子的溶液反应生成硫酸钡沉淀。
例2、如何除去盐酸中混有的少量硫酸。
分析:盐酸和硫酸的混合溶液中存在着H+、Cl-、SO42-三种离子,只需除去SO42—即可。
这就要求所选除杂试剂中的阳离子能与SO42-生成沉淀,阴离子应与保留物质的阴离子相同,故可选BaCl2溶液。
向混合溶液中逐滴滴加BaCl2溶液至不再产生沉淀为止,过滤即可得到纯净的盐酸。
同理,混合物中混有可溶性碳酸盐应与含有钡离子(或钙离子)的溶液反应生成碳酸钡或(碳酸钙)沉淀(也可用酸除去CO32-);混合物中混有的可溶性铁盐或铜盐应与可溶性碱反应生成氢氧化铁或氢氧化铜沉淀而除去。
2、使杂质转变为气体被除去。
初中化学中常见的反应为:碳酸盐与酸反应生成二氧化碳气体。
所选用的酸中的酸根与保留物质中的酸根应相同。
例3、如何除去氯化钠中的碳酸钠。
分析:把混合物溶于水得含Na+、Cl-、CO32-的溶液,只需除去CO32-即可。
因此可加入酸使CO32-转变为二氧化碳而除去(也可使CO32-转化为沉淀)。

中考化学考前必背知识点总结5其他单质、氧化物、酸、碱、盐的除杂方法:溶液后过滤〗7.化肥的检验8.氢氧化钠的变质探究:验证已经变质:加足量稀盐酸——有气泡冒出。
验证部分变质:加足量CaCl2溶液后,用石蕊(变蓝)或酚酞(变红)或pH试纸(pH 大于7)。
除去变质生成的Na2CO3:溶解后,滴加Ca(OH)2溶液至无沉淀产生,然后过滤、蒸发。
植物缺乏氮肥:叶片发黄。
缺乏磷肥:植株特别矮小。
缺乏钾肥:易倒伏,叶片的边缘和尖端呈褐色9.尾气处理装置:有CO生成或参加的反应如下:CO2与C——黑粉消失;CO与CuO——黑变红;CO与Fe2O3——红变黑。
尾气中CO的处理方法:用酒精灯点燃或用气球收集或用排水法收集。
10.电解水装置:通电后,电极上出现气泡,一段时间后试管1(O2)和试管2(H2)中所收集的气体体积比约为1∶2。
【负氢】〖O2、H2的质量比为8∶1。
〗结论:水由氢、氧两种元素组成;在化学反应中分子可分,原子不可分。
11.净化水装置及多种方法:自来水厂:取、沉淀、过滤、吸附、消毒、供明矾:胶状物→小颗粒聚集→大颗粒沉降。
活性炭:有吸附性,起脱色去味作用。
蒸馏:净化水准最高。
【蒸馏水可视为纯水】上述净化水的方法中,只有蒸馏能使硬水软化。
12.铁(铜)生锈实验、防锈方法:⑴探究铁生锈条件:A:Fe、O2、H2O;B:Fe、H2O;C:Fe、O2。
防锈:洁净干燥、涂油、喷漆、镀其他金属、烤蓝、制成合金。
〖资源保护〗⑵铜生锈的条件:铜、氧气、水、二氧化碳四种物质共同作用。
如何探究铜生锈的条件?【可做七个对比实验】〖铁生锈做三个对比实验〗12.模拟炼铁:验纯后〖防爆〗,通CO、加热〖防爆〗,停止加热、继续通CO至冷却。
【尾气处理】。
纯⼲货!酸碱盐除杂、制备、鉴别的全部内容,都在这⾥了!(强⼒收藏贴)每天⼀起涨知识!初中化学酸碱盐的知识⼀直是很多同学⽐较头痛的问题,尤其是酸碱盐的除杂和鉴定等问题,更是让很多同学⼀头雾⽔,今天⾖姐为⼩可爱们整理的这篇⼲货,⼀定能帮助你彻底搞懂这些内容!除杂⼀、物质的除杂⼀、物质的(⼀)混合物的分离和提纯(除杂)1. 分离与提纯的基本原理(1)分离:就是⽤物理或化学的⽅法将混合物⼱的各组分分开,并将物质恢复到原状态。
(2)提纯和除杂:⽤物理或化学的⽅法把混合物中的杂质除去⽽得到纯物质。
在提纯过程中,如果杂质发⽣了化学变化,不必恢复成原物质。
⼆者的⽅法在很多情况下是相似的,但分离⽐提纯的步骤要多,因为各组分均要保留,绎过化学反应使混合物中各组分经转化⽽分离后还要复原为原来的组分物质提纯和除杂过程中经常⽤到分离操作,⼆者有时⼜密不可分。
2.分离和提纯应遵循的原则(1)不能“⽟⽯俱焚”:即试剂⼀般要求与杂质反应,不与要保留的物质反应。
但在特殊情况下,所加试剂可和保留物质应应,但最终要转化成需要保留的物质如除去FeCl3,溶液中的NaCl,可加过量的NaOH溶液→过滤→洗涤→加适量稀盐酸。
(2)“不增““不减”:即不增加新的杂质,不减少要保留的物质如除去FeCl3中的少量Fe2(SO4)3应选⽤BaCl2⽽不应选⽤Ba(NO3)2,否则发⽣反应3Ba(NO3)2+Fe2(SO4)3==3BaSO4↓+2Fe(NO3)3溶液中⼜增加了Fe(NO3)3.易分离:反应后,物质的状态不同,便于分离。
(3)易分离:不污染环境:即耍求所选⽤的除杂⽅法不能产⽣可污染环境的物质。
(4)不污染环境:(5)不能“旧貌变新颜”:即除杂结束前,要恢复保留物质的原有状态。
(⼆)常见除杂的⽅法CO2(O2):将⽓体通过灼热的铜⽹CO2(H2或CO):将⽓体通过灼热的氧化铜O2或CO2或H2(含H2O):将⽓体通过浓硫酸或氧化钙或氯化钙等⼲燥剂O2或H2或CO(含CO2或SO2):将⽓体通⼊氢氧化钠溶液中Cu(含Fe或Mg或Zn):加⼊⾜量的稀盐酸或稀硫酸,过滤Fe(含Cu):⽤磁铁将铁粉吸引出来Cu(含CuO),Fe(含Fe2O3):⾼温下与H2或CO反应CuO(含Cu或C):在空⽓中灼烧CaO(含CaCO3):⾼温煅烧(CaCO3分解成CaO和CO2)CaCO3(含CaO):加⾜量⽔溶解,过滤,取滤渣Ca(OH)2(含CaO)加⾜量⽔FeSO4溶液(含H2SO4或CuSO4),FeCl2溶液(含盐酸或CuCl2):加过量铁粉,过滤,取滤液NaCl溶液(含Na2CO3):加适量稀盐酸Na2SO4溶液(含CuSO4):加适量 NaOH 溶液(三)酸、碱、盐溶液的除杂技巧1.被提纯物与杂质所含阳离⼦相同时,选取与杂质中的阴离⼦不共存的阳离⼦,再与被提纯物中的阴离⼦组合出除杂试剂。