原子核外电子排布与元素周期律
- 格式:doc
- 大小:114.50 KB
- 文档页数:2

原子核外电子排布与元素周期律一、核外电子的排布规律⑴核外电子运动的特征:质量小,运动空间小,运动速度快,没有确定的轨道。
(2)电子云:电子在核外空间作高速运动,没有确定的轨迹,好象带负电荷的云雾笼罩在原子核的周围,人们形象地称之为电子云。
(3)电子层:根据电子的能量差别和通常运动区域离核的远近不同,核外电子处于不同的电子层。
(4)电子层排布倾向能量最低:核外电子总是尽先排布在能量最低的电子层里,然后由里往外,依次排布在能量逐步升高的电子层里。
(5)各电子层容纳的电子数:各电子层最多容纳的电子数是2n 2个,最外层电子数不超过8个(K 层不超过2个),次外层电子数不超过18个,倒数第三层不超过32个。
(6)电子层排布的表示方法:原子结构示意图1、排布规律⑴核外电子排布与能量关系电子离核距离: 近 → 远 电子能量: 低 → 高 ⑵核外电子的分层排布 ① 核外电子层能量不同 电子层离核距离: 近 → 远 电子能量: 低 → 高电子层数(n ): 1 (K) 2(L) 3 (M) 4 (N) 5 (O)② 电子排布规律Ⅰ 能量最低原理:先排满低能量电子层,再依次排布在能量较高的电子层中。
Ⅱ 各电子层最多容纳的电子数:2n 2 Ⅲ 最外层电子数≤8 Ⅳ 次外层电子数≤18 Ⅴ 倒数第三层电子数≤32注意:以上三条规律不是孤立的,而是相互制约,必须同时满足。
2、常见元素微粒结构特点稀有气体元素原子的电子层结构与同周期的非金属元素的阴离子的电子层结构相同,与下一周期的金属元素形成的阳离子的电子层结构相同。
如:(1)核外有2个电子微粒(与He 原子电子层结构相同的离子):H -、Li +、Be 2+ (2)核外有10个电子微粒(与Ne 原子电子层结构相同的微粒):阳离子:+Na 、+2Mg 、+3Al 、+4NH 、+O H 3;阴离子:N -3、O -2、F -、OH -、NH -2;分子:Ne 、HF 、H 2O 、NH 3、CH 4(3)核外有18个电子微粒(与Ar 原子电子层结构相同的微粒):离子:Cl -、S 2-、P 3-、K +、Ca 2+ 分子:Ar 、HCl 、H 2S 、SiH 4、H 2O 2、PH 3、C 2H 6 (4)前18号元素的原子构的特殊性○111 H ○2最外层有1个电子的元素:H 、Li 、Na ○3最外层有2个电子的元素:Be 、Mg 、He ○4最外层电子数等于次外层电子数的元素:Be 、Al 。

原子核外电子排布与元素周期律一、原子结构(Z 个)原子核注意:(N 个) 质量数(A)=质子数(Z)+中子数(N)1.X 原子序数= = =核外电子(Z 个)2.原子核外电子的排布规律:①电子总是尽先排布在能量 的电子层里;②各电子层最多容纳的电子数是 ;③最外层电子数不超过 个(K 层为最外层不超过 个),次外层不超过 个,倒数第三层电子数不超过 个。
电子层: 一(能量最低) 二 三 四 五 六 七 对应表示符号: 3.元素、核素、同位素元素: 。
核素: 。
同位素: 。
(对于原子来说) 二、元素周期表 1.编排原则:①按 递增的顺序从左到右排列 ②将 相同..的各元素从左到右排成一横行..。
(周期序数=原子的电子层数) ③把 相同..的元素按电子层数递增的顺序从上到下排成一纵行..。
=原子最外层电子数 2.结构特点:核外电子层数 元素种类第一周期 种元素短周期 第二周期 种元素周期 第三周期 种元素元 (7个横行) 第四周期 种元素 素 (7个周期) 第五周期 种元素 周 长周期 第六周期 种元素 期 第七周期 未填满(已有 种元素) 表 主族:ⅠA ~ⅦA 共7个主族族 副族:ⅢB ~ⅦB 、ⅠB ~ⅡB ,共7个副族 (18个纵行) 第Ⅷ族: 纵行,位于 之间 (16个族) 零族: ① 主族(A ):由 和 元素共同组成的族(除第18纵列)列序与主族序数的关系② 副族(B ):完全由 元素组成的族(第8、9、10纵列除外)③ Ⅷ族:包括 三个纵列。
④ 0族:第 纵列,该族元素又称为 元素。
三、元素周期律1.元素周期律: 。
元素性质的周期性变化实质是... 。
族碱金属元素: ( 是金属性最强的元素,位于周期表 ) 第ⅦA 族卤族元素: ( 是非金属性最强的元素,位于周期表 ) ★判断元素金属性和非金属性强弱的方法:(1)金属性强(弱)——① ;② ;③ 。
(2)非金属性强(弱)——① ;② ;③ 。
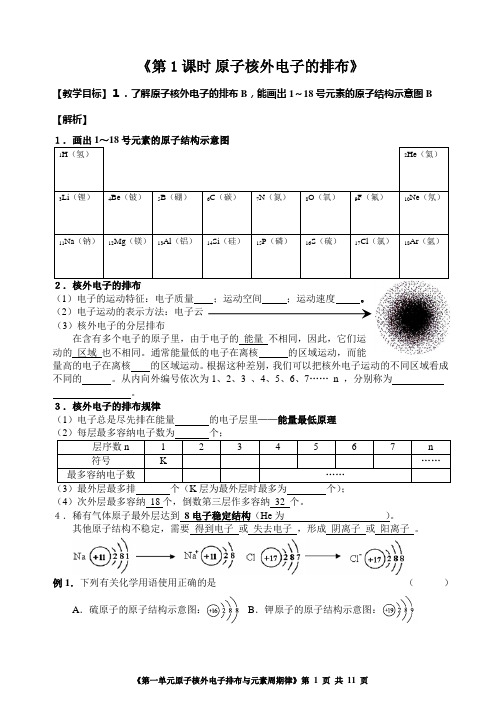
《第1课时原子核外电子的排布》【教学目标】1.了解原子核外电子的排布B,能画出1~18号元素的原子结构示意图B 【解析】(1)电子的运动特征:电子质量;运动空间;运动速度。
(2)电子运动的表示方法:电子云(3)核外电子的分层排布在含有多个电子的原子里,由于电子的能量不相同,因此,它们运动的区域也不相同。
通常能量低的电子在离核的区域运动,而能量高的电子在离核的区域运动。
根据这种差别,我们可以把核外电子运动的不同区域看成不同的。
从内向外编号依次为1、2、3 、4、5、6、7……n ,分别称为。
3.核外电子的排布规律(1)电子总是尽先排在能量的电子层里——能量最低原理)最外层最多排个(层为最外层时最多为个)(4)次外层最多容纳18个,倒数第三层作多容纳32 个。
4.稀有气体原子最外层达到8电子稳定结构(He为)。
其他原子结构不稳定,需要得到电子或失去电子,形成阴离子或阳离子。
例1.下列有关化学用语使用正确的是()A.硫原子的原子结构示意图:B.钾原子的原子结构示意图:C.氯离子的离子结构示意图:D.原子核内有10个中子的氧原子:《第1课时 原子核外电子的排布》练习1.下列有关Si 4214的说法不正确的是()A .Si 4214原子核内含有14个质子B .Si 4214的原子序数为14C .Si 4214的核外电子数为14D .Si 4214原子核内含有42个中子2.某微粒的核外电子的数目分别为:K 层2个,L 层8个,M 层8个,该微粒是( )A .氩原子B .钾离子C .氯离子D .无法确定3.某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是( )A .SB .C C .SiD .Cl 4.下列表示式书写正确的是 ( )A .Cl -的结构示意图B .铝原子的结构示意图C .S 2-的结构示意图D .镁原子的结构示意图5.与Ne 的核外电子排布相同的离子是 ( )A .ClB .Na +C .K +D .S 2-6.某元素的原子最外层电子数为次外层电子数的3倍,则该元素原子核内质子数为( )A .3B .7C .8 .D .107.元素A 的原子获得2个电子或元素B 的原子失去3个电子后,它们的电子排布均与氖原 子的电子排布相同。



原子核外电子排布和元素周期律原子是由原子核和围绕核运动的电子组成的。
原子核由质子和中子组成,而质子的数量决定了原子的元素。
原子核外的电子以不同的方式排布,这种排布决定了元素的化学性质。
元素周期律描述了元素的周期性变化规律,是化学中最重要的概念之一原子核外电子排布是描述电子在原子中的位置和能量分布的方式。
根据量子力学理论,电子存在于不同的能级上,每个能级可以容纳一定数量的电子。
根据波尔模型,原子的外层电子称为价电子,也是化学反应中参与原子间相互作用的电子。
原子核外电子排布可以通过倒易电子构型的方式来表示。
倒易电子构型表示了一个元素最外层电子的分布情况。
在倒易电子构型中,外层电子被表示为和最接近核心的壳层相同的能级。
例如,石墨的原子核是由6个质子和6个中子组成的,其倒易电子构型为1s²2s²2p²。
这意味着石墨的最外层电子是在2p轨道上的。
在倒易电子构型中,电子的分布遵循普遍原则、泡利不相容原理和阜居规则。
普遍原则指出,电子首先填充能量最低的轨道。
泡利不相容原理指出,一个轨道上最多只能容纳两个电子,并且这两个电子的自旋方向必须相反。
阜居规则指出,当填充轨道时,电子会尽量选择不同的轨道来填充,以最小化库伦排斥力。
元素周期律是根据元素的原子核中质子的数量和原子核外电子的排布,将元素按照一定规律排列的表格。
最早的元素周期表是由门捷列夫于1869年提出的。
现代元素周期表按照亨利·莫西里夫在1913年提出的核电荷排列。
元素周期表按照原子序数的增加顺序列出了所有已知元素。
原子序数是指原子核中质子的数量,也是元素周期表中元素的核电荷。
元素周期表的每一行称为一个周期,原子序数在周期内逐渐增加。
元素周期表的每一列称为一个组,元素周期表中的元素按照相似的性质分布在同一组中。
元素周期表按照一定的规律排列,这些规律反映了元素的原子结构和化学性质的周期性变化。
最著名的周期性性质是元素的物理性质和化学性质的周期性变化。
原子核外电子排布和元素周期律首先,我们来了解一下原子的结构。
原子是由质子、中子和电子组成的。
质子和中子位于原子核中心,质子的电荷为正,中子的电荷为中性。
电子则围绕原子核的轨道上运动,电子的电荷为负。
原子核外电子排布描述了电子如何分布在原子的不同能级(轨道)上。
根据能级理论,电子可以处于不同的能级和亚能级上。
其中,第一能级最靠近原子核,能级数越高,离原子核越远。
每个能级最多容纳2n^2个电子,其中n为能级数。
例如,第一能级最多容纳2个电子,第二能级最多容纳8个电子。
根据电子能级的规律,我们可以了解到元素周期表的排布方式。
元素周期表是将化学元素按照原子序数的增序排列的表格。
元素周期表可以分为周期和族两个方向。
元素周期表的周期是指元素周期性质的变化规律。
周期表中的每一个周期代表着一个能级。
在同一个周期中,元素的最外层电子壳的能级相同,受到的核吸引力相近,因此具有类似的化学性质。
元素周期表的周期依次为K、L、M、N、O等,对应着原子的能级。
元素周期表的族是指元素的主族和次族。
主族元素是指位于周期表左边的元素,它们具有相似的化学性质。
主族元素的最外层电子壳填满的电子数都相同。
例如,第一族(碱金属)的元素最外层电子壳只填满了一个电子,第二族(碱土金属)的元素最外层电子壳填满了两个电子。
次族元素是指位于周期表右边的元素,它们具有相似的化学性质。
次族元素的最外层电子壳填满的电子数也相同。
例如,第十六族(卤族)的元素最外层电子壳填满了六个电子。
元素周期表的排列方式和周期性质的变化规律可以总结为以下几点:1.周期性:在元素周期表中,各周期的化学性质有规律地变化。
例如,金属元素通常位于周期表左侧,具有良好的导电性和热导性,而非金属元素通常位于周期表右侧,具有较差的导电性。
2.原子半径:随着周期数的增加,原子半径逐渐增大。
这是因为随着电子层数的增加,电子对原子核的屏蔽作用增强,电子云的尺寸增大。
3.电离能:随着周期数的增加,元素的电离能逐渐增大。
第1课时原子核外电子的排布元素周期律[目标导航]1、了解原子的核外电子能量高低与分层排布的关系、2。
了解核外电子分层排布的规律。
3、了解元素的原子结构和元素性质的周期性变化。
4、理解元素周期律的内容和实质。
一、原子核外电子的排布1、核外电子的分层排布在多电子的原子里,电子的能量并不相同。
能量低的,通常在离核近的区域运动;能量高的,通常在离核远的区域运动。
核外电子的分层运动,又叫核外电子的分层排布、其关系如下:23、(1)原子(离子)结构的表示方法,如下所示:(2)原子结构示意图中,核内质子数等于核外电子数,而离子结构示意图中,二者则不相等。
如: Na+;Cl-。
阳离子:核外电子数小于核电荷数。
阴离子:核外电子数大于核电荷数、点拨(1)电子层实质上是一个“区域”,或者说是一个“空间范围”,它与宏观上层的含义完全不同、(2)核外电子排布的规律是互相联系的,不能孤立地理解。
如钙原子由于受最外层电子数不超过8个的限制。
其原子结构示意图为而不应该是。
议一议判断正误,正确的打“√",错误的打“×”(1)锂的原子结构示意图是()(2)某原子M层电子数为L层电子数的4倍( )(3)某离子M层和L层电子数均为K层的4倍( )(4)离子的核电荷数一定等于其核外电子数( )答案(1)×(2)×(3)√ (4)×二、元素周期律1、原子结构的周期性变化(1)元素原子核外电子排布的周期性变化规律:随着原子序数的递增,元素原子的最外层电子排布呈现由1到8的周期性变化(第一周期除外)。
(2)元素原子半径的周期性变化规律:随着原子序数的递增,元素的原子半径呈现由大到小的周期性变化。
2、元素性质的周期性变化(1)元素主要化合价的周期性变化规律:随着原子序数的递增,元素的最高正化合价呈现+1→+7,最低负化合价呈现-4→-1的周期性变化。
点拨元素化合价的“三个二"(1)二“特别”F无正价,O无最高正价。
元素周期律的本质是元素原子核外电子排布呈周期性变化元素周期律是化学中的重要规律,它揭示了元素在周期表中的排列方式和性质随周期变化的规律性。
而元素周期律的本质正是元素原子核外电子的排布呈现周期性变化的特征。
原子结构的基本概念要理解元素周期律的本质,首先需要了解原子的基本结构。
原子由原子核和围绕核旋转的电子构成。
原子核中包含质子和中子,质子带正电荷,中子电中性。
而电子带负电荷,环绕在核外。
元素周期表的结构元素周期表是按照元素原子序数递增排列的表格。
元素周期表中元素的横向排列称为周期,纵向排列称为族(或组)。
在周期表中,从左至右,从上至下排列的元素,其原子结构中的外层电子数呈现出周期性的变化规律。
原子外层电子的重要性原子的化学性质主要取决于其外层电子的排布情况。
原子在化学反应中往往通过失去、获得或共享电子,以完成其最外层电子的排布,以达到稳定状态。
原子外层电子排布的规律在元素周期表中,原子的外层电子数呈现出周期性变化的规律。
例如,一周期内,原子的外层电子数从1增加至8,然后重新从1开始。
这种周期性变化反映了元素的周期性行为。
周期性表现在化学性质上元素周期表中相邻元素的相似性主要源于其外层电子的排布相似,因此它们在化学性质上通常有着类似的表现。
比如,同一族元素通常具有相似的化合价和反应性。
元素周期律的应用元素周期律的发现和理解为化学研究和应用提供了重要基础。
通过元素周期表,我们可以推测元素性质、反应行为等。
元素周期表也被广泛用于元素分类、新元素的发现等领域。
结语元素周期律的本质是元素原子核外电子排布呈现周期性变化的规律。
这种周期性变化是元素周期表排列的基础,也是我们理解元素性质和行为的重要依据。
深入学习和掌握元素周期律,有助于我们深入了解化学世界的奥秘。
原子核外电子排布与元素周期律一、原子结构质子(Z 个)原子核 注意:中子(N 个) 质量数(A)=质子数(Z)+中子数(N)1.X 原子序数=核电荷数=质子数=原子的核外电子数核外电子(Z 个)二、原子核外电子排布1、分层排布:经过长期的研究发现,在含有多个电子的原子中,电子的能量并不相同,电子运动的主要区域离原子核的远近也不相同。
能量低的电子通常在离核近的区域运动,能量高的电子通常在离核远的区域运动。
即:电子在原子核外分层排布。
(1) 电子层:为了描述不同电子的运动情况,通常将核外电子运动的不同区域看成不同的电子层。
例:(2) 电子层的表示方法:各电子层由内向外的序数n 依次为1、2、3、4、5、6、7……,分别称为K 、L 、M 、N 、O 、P 、Q ……电子层。
各电子层的能量由内向外依次增高2、排布规律:一低三不超(1) 能量最低原则:核外电子总是尽先排在能量较低的电子层中,然后由内向外,依次排在能量逐渐升高的电子层中。
即:最先排在K 层,当K 层排满后,再排L 层……(2) 各电子层最多能容纳的电子数为2n 2(n 表示电子层)(3) 最外层电子数不能超过8个电子(K 层为最外层时不能超过2个) (4) 次外层电子数不能超过18个电子(K 层为次外层时不能超过2个);倒数第三层不超过32个电子。
例1:某元素的原子核外电子排布中,K 电子层和L 电子层电子数之和等于M 电子层与N 电子层电子数之和,则该元素的核电荷数为:( ) A 、30 B 、20 C 、12 D 、17例2:有A 、B 、C 、D 、E 五种元素,他们的核电荷数依次增大,且都小于20,其中C 、E 是金属元素;A 和E 元素原子的最外层都只有1个电子;B 和D 元素原子的最外层电子数相同,且B 元素原子L 层电子数是K 层电子数的3倍;C 元素原子最外层电子数是D 元素原子最外层电子数的一半,由此推指:A 、B 、C 、D 、E 分别是什么元素? 3、核外电子排布的表示方法: (1)原子结构示意图:以钠为例:核电荷数=核外电子数(2)离子的结构示意图:核电荷数=核外电子数+化合价(代数式)4、原子核外电子排布和元素性质的关系:原子的核外电子排布,特别是最外层电子数决定着元素的主要化学性质。
原子核外电子排布与元素周期律
1.元素的化学性质主要取决于原子的
A.质子数B.中子数C.核外电子总数D.最外层电子数
2.已知元素的原子序数,可以推断出原子的
①质子数②中子数③质量数④核电荷数⑤核外电子数
A.①②③B.①④⑤C.②④⑤D.③④⑤
3.下列各组元素,按原子半径依次增大排列的是
A.Na、Mg、S、Si B.H、Li、F、K C.Cl、P、Si、Na D.C、O、Cl、S 4.下列递变规律不正确的是
A.最外层电子数:Na<Mg<Al B.最高正化合价:N<O<F
C.原子半径:P>S>Cl D.金属性:Na>Mg>Al
5.元素性质呈周期性变化的原因是
A.相对原子质量逐渐增大B.核电荷数逐渐增大
C.核外电子排布呈周期性变化D.元素的化合价呈周期性变化
6.判断元素非金属性强弱可依据
A.元素氧化物对应水化物的酸性强弱B.非金属单质熔沸点的高低
C.非金属元素气态氢化物的稳定性D.非金属元素原子的最外层电子数7.有三种金属元素X、Y、Z,在相同条件下,Y的最高价氧化物的水化物的碱性比X的最高价氧化物的水化物的碱性强;X可以从Z的盐溶液中置换出Z。
这三种金属元素的金属性由强到弱的顺序是
A.X、Y、Z B.Y、X、Z C.Y、Z、X D.Z、Y、X
8.下列事实不能用于判断元素金属性强弱的是
A.金属间发生的置换反应
B.金属单质在反应中失去电子的多少
C.金属元素最高价氧化物的水化物的碱性强弱
D.金属单质与水(或酸)反应置换出氢气的难易
9.已知X、Y、Z三种元素原子的核外电子层数相同,且它们的最高价氧化物的水化物的酸性依次增强。
下列判断正确的是
A.原子半径按X、Y、Z的顺序增大B.阴离子的还原性按X、Y、Z的顺序增强C.单质的氧化性按X、Y、Z的顺序增强D.氢化物的稳定性按X、Y、Z的顺序增强10.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
A.常压下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
11.用“>”或“<”符号回答下列问题:
(1)酸性:H 2CO 3 H 2SiO 3 , H 2SiO 3 H 3PO 4
(2)碱性:Ca(OH)2 Mg(OH)2,Mg(OH)2 Al(OH)3
(3)气态氢化物的稳定性:H 2O H 2S ,H 2S HCl
(4)还原性:H 2O H 2S ,H 2S HCl
从以上答案中可以归纳出:
①元素的非金属性越强,其最高价氧化物的水化物的酸性越 ②元素的金属性越强,其最高价氧化物的水化物的碱性越
③元素的 性越强,其气态氢化物的稳定性越
④非金属性越强的元素,其气态氢化物的还原性越
12.短周期元素X 、Y 、Z 在周期表中的位置关系如右图所示,据此回答下列问题:
(1)X 元素形成单质的分子式是__________;
(2)写出Y 元素形成的单质跟水反应的化学方程式:
_____________ ;
(3)写出单质Z 与钠反应的化学方程式:
_________________ 。
12.A 、B 、C 三种元素的原子具有相同的电子层数,B 原子的核电荷数比A 原子的核电荷数大2,B 原子的电子总数比C 原子的电子总数少4。
1molA 单质跟足量盐酸反应可产生11.2 L 氢气(标准状况),反应中A 转化成与氖原子具有相同电子层结构的离子。
请回答下列问题。
(1)A 是 元素,B 是 元素,C 是 元素。
(2)写出B 的最高价氧化物的水化物分别跟A 的最高价氧化物的水化物和C 的气态氢化物的水溶液反应的离子方程式: , 。
13.下表是周期表中的一部分,根据A —I 在周期表中的位置,用元素符号或化学式回答下列
ⅠA
0 1 A
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2
D E G I 3 B C F H
(1)表中元素,化学性质最不活泼的是 ,只有负价而无正价的是 ,氧化性最强的单质是 ,还原性最强的单质是 ;
(2)最高价氧化物的水化物碱性最强的是 ,酸性最强的是 ,呈两性的是 ;
(3)A 分别与D 、E 、F 、G 、H 形成的化合物中,最稳定的 ;
(4)在B 、C 、D 、E 、F 、G 、H 中,原子半径最大的是 .
族 周 期。