Pichia酵母表达系统使用心得
- 格式:doc
- 大小:54.00 KB
- 文档页数:9



毕赤酵母表达知识很好,需要好好研究一下原文地址:毕赤酵母表达知识01转载于丁香作者:思时尔非a.配制500×BIOTIN stock solution(0.02%)有这么3种方案:1、懒人是将Biotin直接溶在去离子水中,放过夜,基本就能溶;2、急性子是将溶液配成0.02N的NaOH,就很容易溶解了;3、水浴加热,温度不能高于50度。
D-生物素是具有生物活性的生物素,也就是vitaminH。
在毕赤酵母代谢过程中,作为多种酶的辅基起作用。
天然培养基中一般可以不单独添加,因为YNB中、酵母粉、蛋白胨中均含有一定量的生物素,但是做高密度发酵还是必须要添加的。
b.有几个比较迷惑的问题请教大家:(很典型的小问题)1、制感受态细胞,OD多少比较好?pyrimidine 战友的方法:取1mlGS115过夜培养物(OD约6-10) 分装到1.5ml EP 管中。
说明书还有一些文献是说在1.3左右效率高,再高了效率会很低2、关于高效转化法,文献说用(LiAc),而invitrogen的说明书说转化毕赤酵母用(LiAc)没用,要用LiCl。
Lithium acetate does not work with Pichia pastoris. Use only lithium chloride.3、YNB到底能高温灭么?有的说能有的说不能。
过滤灭菌的怎么操作?我是把滤器装好膜绑到瓶口用纱布盖上,报纸包上,瓶盖放烧杯里单灭。
然后把配好的溶液用注射器一点点推进去。
4、葡萄糖为什么在YPD里一起灭颜色很深,单灭则不会。
该115度还是121度灭?网上搜了下,都有人用!5、电转化参数用400欧还是200欧?有的用400,有的还专门说不是用400。
都是从园里看到的!电击参数:1.5KV,25uF,200欧姆(不是400)6、电转后,在MD平板上长的应该就是整合了目的基因的重组子了吧?如果不想筛高拷贝的,是否PCR验证一下即可?网友的回答:ynb最好不灭菌,我是0.22um过滤处理的。

毕赤酵母表达系统前言:所用表达质粒有pPIC3.5K,pAO815用于胞内表达,而pPIC9K用于分泌表达,所有载体均利用AOX1启动子来诱导高水平表达。
抗性选择:最有效的筛选遗传霉素抗性及高抗性克隆的程序需要先对HIS+转化子进行选择,再进行不同水平遗传霉素抗性筛选。
毕赤菌株表型:毕赤酵母菌GS115 及KM71 在组氨酸脱氢酶位点(His4)有突变,因而不能合成组氨酸,所有表达质粒都有HIS4 基因可与宿主进行互补,通过不含组氨酸的培养基来选择转化子。
GS115 及KM71都可在复合培养基如YPD(YEPD)及含组氨酸的最小培养基中生长。
转化之前,GS115 及KM71 都不能在最小培养基中生长,因为它们是His-。
培养温度:毕赤酵母生长温度为28-30度(液体、平板、斜面)。
在32 度以上诱导生长时,对蛋白表达有害,甚至会导致细胞死亡。
贮存:贮存细胞几周或几月,用YPD培养基或YPD 琼脂斜面1 挑取所需菌株单克隆在YPD 平板上划线生长;2 挑取单克隆转移至YPD进行穿刺培养,30 度2 天;3 细胞在4 度可放几周几月或几年,存于-80度1 挑取所需菌株单克隆在YPD 中过夜培养;2 收集细胞,在含15%甘油的YPD 中悬浮至终OD600 为50-100(大约2.5-5.0×109细胞/ml);3 细胞先用液氮或干冰/酒精浴中冰冻再贮存于-80 度。
注意:在4 度或-80 度长期保存后,用之前建议在MM、MD 或MGY 平板上划线培养以检测His+转化子的表型是否正确及其活力。
以质粒pPIC9K,酵母Pichia pastoris GS115为例说明做法。
载体pPIC9K酶切为点线性化质粒DNA:建议使用下列方法线性化载体以获得Mut+及Muts重组子,可能其中一个会比另一个更利于表达多拷贝重组子。
如果只想得到Muts重组子,使用KM71 菌株。
单个十字交换事件可比双重十字交换更容易、更有效地获得Muts重组菌(例如:插入AOX1或his4 而不是取代AOX1)。


毕赤酵母表达系统使用心得PichiaPichiaPichiaPichia酵母表达系统使用心得甲醇酵母表达系统有不少优点其中以Invitrogen公司的Pichia酵母表达系统最为人熟知并广泛应用于外源蛋白的表达。
虽然说酵母表达操作简单表达量高但是在实际操作中并不是每个外源基因都能顺利得到高表达的。
不少人在操作中会遇到这样那样的问题收集了部分用户在使用EasySelectPichiaExpressionSystem这个被誉为最简单的毕赤酵母表达的经典试剂盒过程中的心得体会。
其中XiangYang是来自美国乔治城大学GeorgetownUniversityLombardi癌症中心LombardiCancerCenter部分用户来自国内。
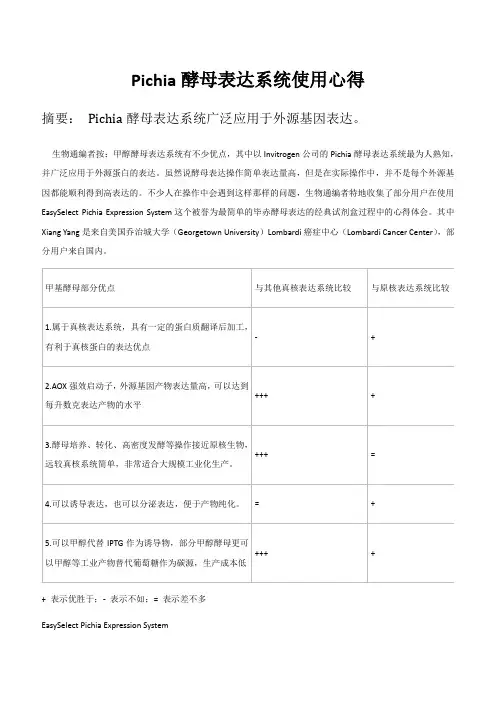
甲基酵母部分优点与其他真核表达系统比较与原核表达系统比较1.属于真核表达系统具有一定的蛋白质翻译后加工有利于真核蛋白的表达优点-2.AOX强效启动子外源基因产物表达量高可以达到每升数克表达产物的水平3.酵母培养、转化、高密度发酵等操作接近原核生物远较真核系统简单非常适合大规模工业化生产。
4.可以诱导表达也可以分泌表达便于产物纯化。
5.可以甲醇代替IPTG作为诱导物部分甲醇酵母更可以甲醇等工业产物替代葡萄糖作为碳源生产成本低表示优胜于-表示不如表示差不多EasySelectPichiaExpressionSystem产品性能优点——使用简单表达量高His-tag便于纯化缺点——酵母表达蛋白有时会出现蛋白切割问题全面产品报告及心得体会巴斯德毕赤酵母Pichiapastoris是一种能高效表达重组蛋白的酵母品种一方面由于其是属于真核生物因此表达出来的蛋白可以进行糖基化修饰另一方面毕赤酵母生长速度快可以将表达的蛋白分泌到培养基中方便蛋白纯化。
毕赤酵母表达载体pPICZ在多克隆位点MCR3端带有his-tag和c-mycepitopes这些tag有利于常规检测和纯化而且在MCR5端引入了alphafactorα-factor用以增加表达并且在表达后α-factor可以自动被切除。
Pichia酵母表达系统使用心得摘要:Pichia酵母表达系统广泛应用于外源基因表达。
生物通编者按:甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia酵母表达系统最为人熟知,并广泛应用于外源蛋白的表达。
虽然说酵母表达操作简单表达量高,但是在实际操作中,并不是每个外源基因都能顺利得到高表达的。
不少人在操作中会遇到这样那样的问题,生物通编者特地收集了部分用户在使用EasySelect Pichia Expression System这个被誉为最简单的毕赤酵母表达的经典试剂盒过程中的心得体会。
其中Xiang Yang是来自美国乔治城大学(Georgetown University)Lombardi癌症中心(Lombardi Cancer Center),部分用户来自国内。
+ 表示优胜于;- 表示不如;= 表示差不多EasySelect Pichia Expression System产品性能:优点——使用简单,表达量高,His-tag便于纯化缺点——酵母表达蛋白有时会出现蛋白切割问题全面产品报告及心得体会:巴斯德毕赤酵母(Pichia pastoris)是一种能高效表达重组蛋白的酵母品种,一方面由于其是属于真核生物,因此表达出来的蛋白可以进行糖基化修饰,另一方面毕赤酵母生长速度快,可以将表达的蛋白分泌到培养基中,方便蛋白纯化。
毕赤酵母表达载体pPICZ在多克隆位点(MCR)3'端带有his-tag和c-myc epitopes,这些tag有利于常规检测和纯化,而且在MCR5'端引入了alpha factor(α-factor)用以增加表达,并且在表达后α-factor可以自动被切除。
在进行克隆的时候,如果你选择的是EcoRI,那么只需在目标蛋白中增加两个氨基酸序列即可完成。
另外pPICZ系列选用的是Zeocin抗生素作为筛选标记,而诱导表达的载体需要甲醇——甲醇比一般用于大肠杆菌表达诱导使用的IPTG便宜。

1、菌株用GS115表达不出蛋白,换KM71H后,大部分克隆能表达。
2、温度:在28度和室温下诱导表达,表达水平可能都不低。
3、pH手册上用6.0,pH提高到6.8,不表达的蛋白可能就表达出来。
BMMY的pH7.0-7.5比较合适。
国内外做的最好的rHSA,最适pH大概5-6左右。
pH3的时候yeast和peptone好像会沉淀的,可以用磷酸和磷酸二氢钾调,具体比例自己去试试。
4、偏爱密码子codonbias一般不是主要的问题,你要表达的蛋白特性才是主要问题,酵母对分子量大(30KD 以上),结构复杂(如一些蛋白酶),二硫键含量多的蛋白往往不能有效表达,尤其是分泌表达。
密码子改造对一些较小的而且结构简单的蛋白表达量的提高可能有一些作用。
比如一位战友用Pichia酵母表达一个单链抗体,29KD,含有2对二硫键,表达量约几毫克每升,选用酵母偏好密码子全基因合成后,表达量没有什么提高。
5、表达时间与空质粒转化对照诱导时间长了以后,是会有很多蛋白分泌出来的,时间越长杂蛋白就越多,且分子量都比较大。
最好做一个空质粒转化的对照,这样就会比较肯定到底是不是自身的蛋白分泌的结果。
6、污染每个样品从G418板上挑10个左右单克隆于2ml BMGY摇菌(30ml玻璃管,比LB管大一点),纱布一般用8层,一天左右看着比较浑离心,留样1ml,余1ml换2ml BMMY诱导表达,3,4层纱布足够了。
污染一般都是跟瓶口覆盖有关的原因造成的,只盖纱布肯定会污染。
加盖报纸后,就再没遇到过污染。
如果只用6层纱布,污染的可能当然很大,100ml三角瓶,装量10ml培养液,用橡筋把8层纱布和2层报纸拴紧封口,空气浴摇床。
7、不表达蛋白有没有表达就要看你的运气了,一般重复2-3次实验都没有表达菌株,这个蛋白就放弃表达了。
8、表达量30KD,10mg/L表达量已经很高,最直接的方法是发酵,一般提高5-10倍。
大肠杆菌一样出现大团的超表达蛋白。


α32岩藻糖化增强,许多乳房肿瘤丧失了Le b抗原的表达,这和疾病的恶性程度和转移性相关。
乳房癌组织中S Le x也有增加。
3.肿瘤转移O2G alNAc聚糖结构对肿瘤转移的形成是很关键的。
对肝癌细胞株P LC/PEF/5的研究表明含大量核心1、核心2结构的O2G alNAc聚糖与一种新型的肿瘤相关抗粘附素(dysadherin)结合,抑制了抗粘附素的稳定表达并导致E2钙粘蛋白表达上调。
结果促进了细胞之间的粘附作用,促进了肿瘤转移[1]。
在各种人类结肠癌细胞中,K M12细胞表达与粘蛋白链结合的二聚S Le x,表现出高度转移性。
K M122HX细胞表达S Le a抗原,结果较无S Le a表达的K M122LX细胞表现出更强的粘附能力[10]。
抑制唾液酸化可以减弱肿瘤细胞的转移能力。
以上这些表明,唾液酸化链可能调节肿瘤细胞和其他细胞以及细胞基质之间的相互作用、影响肿瘤细胞的粘附和抗粘附性并延长其在血液中的生存期。
参考文献[1] Tsuiji H et al.G lycobiology,2003,13(7):521—527[2] Seko A et al.G lycobiology,2002,12(6):379—388[3] Schneider F et al.Cancer Res,2001,61:4605—4611[4] W ang F et al.J Histochem Cytochem,2001,49:1581—1592[5] M eichenin M et al.Cancer Res,2000,60:5499—5507[6] Seko A et al.G lycobiology,2000,10(9):919—929[7] M are L et al.Eur J Biochem,2004,271:186—194[8] M achida E et al.Cancer Res,2001,61:2226—2231[9] Dalziel M et al.J Biol Chem,2001,276(14):11007—11015[10] Ota M et al.Cancer Res,2000,60:5261—5268 文章编号:100021336(2004)0420353203毕赤酵母表达蛋白质的糖基化顾 园 诸欣平 王少华(首都医科大学寄生虫学教研室,北京100054)摘要:毕赤酵母表达系统可对表达产物进行翻译后加工如糖基化等。

饮茶后进入血浆的儿茶素,可通过抑制与癌细胞转移相关的蛋白酶活性,阻碍癌细胞浸润,从而有抑癌效果。
茶氨酸可增强阿霉素(adriamycin)抑制肿瘤生长的作用。
眼睛晶体脂质因自由基作用,失去透光性,发生白内障,茶氨酸消除自由基的作用可预防白内障。
人体在代谢过程中产生自由基,在正常情况自由基的生成和消除达到动态平衡;人到中年后,清除自由基的能力逐渐衰退,过量自由基影响机体功能,导致多种疾病的发生,如帕金森氏综合征、老年性痴呆症、肿瘤、自身免疫性疾病、白内障、炎症等等。
茶叶含有多种抗氧化、能清除自由基的成分,这些成分多数溶于水,易为人体吸收,又无毒害。
茶是一类有益健康、防衰老的绿色保健饮料。
参考文献[1] Chen C et al.J A gric Food Chem,2000,48(11):5411—5418[2] Hashimoto R et al.J A gric Food Chem,2000,48(12)6380—6383[3] Tokunaga S et al.A nn Epi demiol,2002,12(3):157—165[4] Y okozawa T et al.Ex p Toxicol Pathol,1997,49(5):329—335[5] Song DU et al.A rch Biochem Biophys,2002,397(2):424—429[6] Kukada T et al.Neuroscience2Letters,2000,289(3):189—192[7] Y okogoshi H et al.Biosci Biotechnol Biochem,1998,62(4):816—817[8] Y okogoshi H et al.Neurochem Res,1998,23(5):667—673[9] Y okogoshi H et al.L if e Sciences,1998,62(12):1065—1068[10] K imura R et al.Chem Pharm B ull,1986,34(7):3053—3057[11] Kukada T et al.Biosci Biotechnol Biochem,2000,64(2):287—293[12] K obayashi K et al.Ni ppon Nogeikagaku2Kaishi,1998,72(2)153—157[13] Adcocks C et al.J N ut r,2002,132(3):341—346 文章编号:100021336(2003)0120046204酵母表达系统及其应用研究吴丽娟 蒋建新 朱佩芳 王正国 康格非1(第三军医大学大坪医院野战外科研究所,重庆400042;1重庆医科大学医学检验系,重庆400046)摘要:酵母表达系统是研究真核蛋白质表达和分析的有力工具,拥有转录后加工修饰功能,适合于稳定表达有功能的外源蛋白质。
甲醇营养型毕赤酵母表达系统介绍巴斯德毕赤酵母(Pichia pastoris)是近几年发展起来的较为完善的、
被广泛用来表达外源蛋白的甲醇营养型酵母表达系统。
目前通过毕赤
酵母表达了很多种性质不同的蛋白,越来越多的实验室及公司开始搭
建毕赤酵母表达系统的平台,相信随着对毕赤酵母表达系统的研究越
来越深入,会有更多成功表达并进行商业化应用的案例出现。
1.其优点主要为:
1) 具有强有力的乙醇氧化酶(Alochol Oxidase,AOX1)基因启动子,可严格调控外源蛋白的表达;
2) 作为真核表达系统,可对表达的蛋白进行翻译后的加工与修饰,
从而使表达出的蛋白具有生物活性;
3) 营养要求低、生长快、培养基廉价,便于工业化生产; 4) 可高密度发酵培养,在发酵罐中细胞干重甚至可达120g/L以上; 5) 表达量高,许多蛋白可达到g/L以上水平;
6) 在P. pastoris中表达的蛋白既可存在于细胞内,又可分泌到胞外,
自身分泌的蛋白非常少,十分有利于纯化;
7) 糖基化程度低,与S. cerevisiae相比,P. pastoris不产生过度的糖基化。
P. pastoris表达的糖蛋白的糖链长度为8-14个甘露糖,而S. cerevisiae 糖链中甘露糖多达50-150个;S. cerevisiae分泌的糖蛋白的核心寡聚糖具有终端α-1,3糖苷连接,使分泌的糖蛋白的抗原性明
显增强,而P.pastoris的糖基化位点与哺乳类细胞的相同,其所分泌
的糖蛋白的免疫原性较低,更利于临床应用。
酵母表达系统使用心得第一篇:酵母表达系统使用心得Pichia酵母表达系统使用心得甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia 酵母表达系统最为人熟知,并广泛应用于外源蛋白的表达。
虽然说酵母表达操作简单表达量高,但是在实际操作中,并不是每个外源基因都能顺利得到高表达的。
不少人在操作中会遇到这样那样的问题,收集了部分用户在使用EasySelect Pichia Expression System这个被誉为最简单的毕赤酵母表达的经典试剂盒过程中的心得体会。
其中Xiang Yang是来自美国乔治城大学(Georgetown University)Lombardi癌症中心(Lombardi Cancer Center),部分用户来自国内。
甲醇酵母部分优点:1.属于真核表达系统,具有一定的蛋白质翻译后加工,有利于真核蛋白的表达;2.AOX强效启动子,外源基因产物表达量高,表达产物可以达到每升数克的水平;3.酵母培养、转化、高密度发酵等操作接近原核生物,远较真核系统简单,非常适合大规模工业化生产;4.可以诱导表达,也可以分泌表达,便于产物纯化;5.可以甲醇代替IPTG作为诱导物,部分甲醇酵母更可以用工业甲醇替代葡萄糖作为碳源,生产成本低。
产品性能:优点——使用简单,表达量高,His-tag便于纯化;缺点——酵母表达蛋白有时会出现蛋白切割问题。
巴斯德毕赤酵母(Pichia pastoris)是一种能高效表达重组蛋白的酵母品种,一方面由于其是属于真核生物,因此表达出来的蛋白可以进行糖基化修饰,另一方面毕赤酵母生长速度快,可以将表达的蛋白分泌到培养基中,方便蛋白纯化。
毕赤酵母表达载体pPICZ在多克隆位点(MCR)3'端带有his-tag 和c-myc epitopes,这些tag有利于常规检测和纯化,而且在MCR5'端引入了alpha factor(α-factor)用以分泌表达,并且在表达后α-factor可以自动被切除。
酵母表达外源蛋白1、菌株用GS115表达不出蛋白,换KM71H后,大部分克隆能表达。
2、温度:在28度和室温下诱导表达,表达水平可能都不低。
3、pH手册上用6.0,pH提高到6.8,不表达的蛋白可能就表达出来。
BMMY 的pH7.0-7.5比较合适。
国内外做的最好的rHSA,最适pH大概5-6左右。
pH3的时候yeast和peptone好像会沉淀的,可以用磷酸和磷酸二氢钾调,具体比例自己去试试。
4、偏爱密码子codon bias一般不是主要的问题,你要表达的蛋白特性才是主要问题,酵母对分子量大(30KD以上),结构复杂(如一些蛋白酶),二硫键含量多的蛋白往往不能有效表达,尤其是分泌表达。
密码子改造对一些较小的而且结构简单的蛋白表达量的提高可能有一些作用。
比如一位战友用Pichia酵母表达一个单链抗体,29KD,含有2对二硫键,表达量约几毫克每升,选用酵母偏好密码子全基因合成后,表达量没有什么提高。
5、表达时间与空质粒转化对照诱导时间长了以后,是会有很多蛋白分泌出来的,时间越长杂蛋白就越多,且分子量都比较大。
最好做一个空质粒转化的对照,这样就会比较肯定到底是不是自身的蛋白分泌的结果。
6、污染每个样品从G418板上挑10个左右单克隆于2ml BMGY摇菌(30ml 玻璃管,比LB管大一点),纱布一般用8层,一天左右看着比较浑离心,留样1ml,余1ml换2ml BMMY诱导表达,3,4层纱布足够了。
污染一般都是跟瓶口覆盖有关的原因造成的,只盖纱布肯定会污染。
加盖报纸后,就再没遇到过污染。
如果只用6层纱布,污染的可能当然很大,100ml三角瓶,装量10ml培养液,用橡筋把8层纱布和2层报纸拴紧封口,空气浴摇床。
7、不表达蛋白有没有表达就要看你的运气了,一般重复2-3次实验都没有表达菌株,这个蛋白就放弃表达了。
8、表达量30KD,10mg/L表达量已经很高,最直接的方法是发酵,一般提高5-10倍。
大肠杆菌一样出现大团的超表达蛋白。
第28卷第1期 农业科学研究2007年3月 Vol.28No.1 Journal of Agricultural Sciences Mar.2007文章编号:167320747(2007)0120068204巴斯德毕赤酵母表达系统研究进展魏凡华1,2,3,曹瑞兵3,吴 润1,陈溥言3(1.宁夏大学农学院,宁夏银川 750021; 2.甘肃农业大学,甘肃兰州 730071;3.南京农业大学农业部疫病诊断与免疫重点开放实验室,江苏南京 210095)摘 要:巴斯德毕赤酵母(Pichia pastoris)表达系统是基因工程研究中广泛使用的真核表达系统,对Pichia pasto2 ris基因结构、载体元件以及影响外源基因表达的因素等进行了较为全面的综述.关键词:巴斯德毕赤酵母;基因表达系统;研究进展中图分类号:TQ926.1 文献标志码:A 目前,大肠杆菌类原核表达系统虽然较为成熟,但表达产物以包含体形式存在,无翻译后的糖基化等修饰加工过程,并且可能还会有细菌毒素.昆虫细胞表达存在不正确的糖基化,产物复杂,不易纯化,而哺乳动物细胞表达成本高,产量低.甲基营养型巴斯德毕赤酵母(Pichi a p astoris)已发展成为能够生成多种外源蛋白的卓越表达系统.1 巴斯德毕赤酵母菌株一般用于外源基因表达的Pichi a p astoris菌株有Y211430,M2C10023,GS115,KM71,SMD1168等.根据利用甲醇的能力,可将巴斯德毕赤酵母分为3型[1]:①Mut+型为甲醇快利用型,此型毕赤酵母具有完整的AOX1和AOX2基因,绝大多数毕赤酵母为Mut+表型.②Muts型,此型毕赤酵母(如KM71)菌细胞AOX2基因编码的醇氧化酶可依赖15%AOX活性,为甲醇慢利用型.③Mut2型(如M2G10023),此型毕赤酵母AOX1及AOX2基因均被敲除,为甲醇不利用型.研究发现,蛋白酶缺陷型毕赤酵母,如SMD1163, SMD1165和SMD1168可有效降低外源目的蛋白的酶解.一般说来,蛋白胞内表达时,优先考虑用Muts表型,对于分泌表达,Mut+和Muts都可使用.甲醇慢利用型有时比Mut+型菌株能够达到更高的表达量[2].2 Pichi a p astoris表达载体载体是由许多元件构成的,包括启动子、终止子、选择标记、报告基因、复制起点和信号肽序列等,典型的表达载体含有乙醇氧化酶基因5′AOX1启动子和3′AOX1终止子,其中含有供外源基因插入的多克隆位点,以组氨醇脱氢酶基因HIS4作为互补筛选标志或ZeocinR作为筛选标志.2.1 启动子Pichia pastoris含有两个基因编码醇氧化酶: AOX1和AOX2,二者序列有92%同源性,但是AOX1表达水平高于AOX2.AOX1启动子的表达受甲醇严格调控[3].以甲醇为碳源生长时,约5%的mRNA 由AOX1基因转录.P GA P(三磷酸甘油醛脱氢酶启动子)是最近在毕赤酵母中克隆到的一个组成型启动子,GA P启动子不需甲醇诱导,发酵工艺更为简单.Vassilen利用GA P启动子表达乙肝表面抗原获得高表达[4],Genzyme也利用GA P启动子表达人几丁质酶,不仅获得高表达,而且还可以避免蛋白酶水解[5].Phongdara在H ansenul a pol y mor p ha克隆到酸性磷酸酶(p HO1)基因启动子[6].这些启动子丰富了甲醇酵母对启动子的选择.2.2 选择标记选择标记一般为对应于营养缺陷型受体的野生型基因,常用HIS4,也可用来源于酿酒酵母的AR G4基因和SUC2基因.kanr基因和Shbler基因能够作为细菌和酵母菌的选择标记,因此较其他表达载体更易于筛选.2.3 信号肽序列可供毕赤酵母选择的信号肽有外源蛋白自身的收稿日期:2006205220作者简介:魏凡华(19802),男,宁夏隆德人,硕士研究生,主要从事微生物学与免疫学研究.信号肽和酵母本身的信号肽.有些蛋白的自身信号肽不能被毕赤酵母有效利用,可试用甲醇酵母信号肽.目前可供选择的酵母信号肽有α2交配因子的前导肽序列、酸性磷酸酶信号肽和蔗糖酶信号肽等.其中酿酒酵母α2交配因子前导肽序列的使用最为广泛.酶切割位点周围氨基酸序列及外源蛋白的3级结构可以影响信号肽的加工效率.Waterham 等也利用定向肽在巴斯德毕赤酵母中成功地将PG AP 启动下的β2半乳糖苷酶定向输送到过氧化物酶体[7].2.4 表达载体的种类Invit rogen 公司开发出了若干系列的表达载体可供选择.当前常用的巴斯德毕赤酵母表达载体可分为2类.①胞内表达载体.如p HIL 2D2,p AO815,p PIC3K ,PICZ ,p HWO10,p GA PZ.②分泌表达载体.如p HIL 2S1,p PIC9K ,p PICZα,p GA PZ α[8].目前主要采用酵母内源性的信号肽来引导外源基因表达产物的分泌,常用A2因子信号肽.许多蛋白的正确构像和翻译后加工(如糖基化等)都是在分泌途中完成的.3 基因整合证明表达载体构建正确后,转入巴斯德毕赤酵母中诱导表达.毕赤酵母转化方法最常用的是电转化法和原生质体法,其中电转化法最为方便,转化效率最高,最容易产生多拷贝整合.ZeocinR 抑制细胞壁的形成,因此PICZ 系列不能使用原生质体法进行转化.转化时,载体DNA 必须切成线状才能与染色体进行同源重组,将整个载体连同外源基因整入宿主染色体.通常有以下几种整合方式:①双位点互换.发生在染色体AOX1位点和表达质粒中的P AOX1及转录终止区,产生的表达菌的表型为His +Mut -[9].②AOX1单位点互换.发生在染色体和表达质粒的AOX1区.产生的表型是His +Mut +.③His 单位点置换.发生在染色体His 位点和表达质粒的His 位点,使得1个或多个表达单位插入在His 位点,产生的表型也是His +Mut +.巴斯德毕赤酵母载体在宿主染色体上大多为单拷贝整合,由于PAOX1的强启动性和整合后的稳定性,所以单拷贝也能获得较高的产量.4 重组蛋白翻译后修饰Pichi a p astoris 能进行与高等真核细胞相似的许多翻译后修饰,包括二硫键形成、信号序列加工、折叠、O 2连接和N 2连接糖基化等.巴斯德毕赤酵母对分泌的外源蛋白的糖基化已成为研究的热点.巴斯德毕赤酵母对外源目的蛋白的糖基化作用具有2个主要特征:①极少出现过度糖基化.一般情况下Pp 能产生较酿酒酵母明显要短的高甘露糖型寡糖链,且较均一,长度在8~14个之间,使产物更加稳定.②糖链中不含具有潜在致敏作用的α21,32甘露糖[10].然而,一些在天然分泌时不被糖基化的蛋白,由巴斯德毕赤酵母表达时却可能发生糖基化.如人体内合成的胰岛素样生长因子I 为非糖基化蛋白,而由巴斯德毕赤酵母表达时,却有15%发生了糖基化作用[11].不合适的糖基化和寡聚体可能会在机体内产生免疫反应或毒副作用,解决这一问题的可能方法主要是尝试胞内表达,利用基因工程改造糖基化位点[12],用糖苷酶进行处理,降低抗原性[13].5 影响外源基因表达的因素影响外源基因在巴斯德毕赤酵母中表达的因素主要包括:外源基因自身的特性、表达框的拷贝数、染色体整合位点和方式、宿主菌的甲醇利用表型、基因剂量、分泌信号、产物稳定性、翻译后修饰以及培养条件等[14].5.1 外源基因自身的特性外源基因在P.p 中表达时,其自身就是影响表达水平的重要因素.许多高A +T 质量分数的基因常会由于提前终止而不能有效转录,不合适的mRNA 5′非翻译区的核苷酸序列和长度也可能会影响基因的正常表达.Sreekrishna 等通过调整人血清白蛋白的mRNA5′非翻译区与醇氧化酶的5′非翻译区相同后,HSA 的表达量可以提高50倍以上[15].赵翔等研究证明,Pichia pastoris 有密码子偏爱倾向[16].所以一般需要进行全基因合成,使编码序列符合毕赤酵母偏爱密码子用法和具有更高的G +C 质量分数.5.2 表达框染色体整合位点巴斯德毕赤酵母中的稳定高效表达主要通过整合性载体实现.整合性载体的表达盒稳定,可以多位点整合而获得多拷贝以及进行不同整合方式.AOX1和组氨酸脱氢酶(HIS4)基因位点都已被成功用于表达外源蛋白.Sreekrishna 等认为,由于表达框中his4染色体突变拷贝与完好的his4基因能够发生基因转换,所以首选aox 1位点作为整合位点.5.3 宿主菌的甲醇利用表型原则上,如果是胞内表达,应尽量用Mut -细胞,这样得到的蛋白产物中醇氧化酶蛋白量较少而蛋白纯化更易进行.现在无需甲醇诱导的组成性表达载体p GA PZ 和p GA PZα已经构建成功,它们常能生产比诱导型载体p PICZ 和p PICZα更高的外源96 第1期 魏凡华等:巴斯德毕赤酵母表达系统研究进展蛋白.Doring等研究表明,在生产哺乳动物膜转运蛋白时,p GA P比pAOX1更理想.5.4 基因剂量一般来说,高拷贝整合可以提高表达量,但许多实例表明,含单拷贝表达框的宿主菌足以得到最佳产量.Jeffrey等发现,重组CD40L的最高产量是在有8个以上表达框的菌株中获得的[17].不过个别情况下拷贝数增加对产量也会产生负效应,原因可能在于过高表达会对分泌途径产生负反馈抑制.因此,高表达菌株的筛选只应以表达的蛋白量为唯一标准,基因剂量与表达水平的关系取决于特定的外源蛋白.Jeffrey等建立了一种双滤膜筛查方法,可以快速地从大量重组菌株中筛选出高表达克隆.5.5 分泌信号不适合的信号肽可导致信号肽加工不完全,或者蛋白分泌水平低,甚至不能分泌.尝试不同的信号肽,对信号肽进行突变改造或人工全合成信号肽等策略可用于实现信号肽正确加工和提高分泌水平[18].韦宇拓等利用菊粉酶的信号肽序列来构建巴斯德毕赤酵母分泌载体并表达了B2葡聚糖酶,结果表明ISP信号肽序列分泌效率不低于利用A因子信号肽的表达载体p P IC9K.Singh等通过定向缺失诱变导致了含有天然N端的成熟干扰素的正确释放,可以成为解决这一问题的一种好方法.5.6 发酵系统培养巴斯德毕赤酵母在发酵系统中外源基因的转录水平是过量甲醇诱导时的3~5倍.可有效监控p H、通气量和碳源浓度并及时排出代谢产物,控制维持产物稳定性的因素,可达到最优化发酵条件,使蛋白产量在标准以上水平.现在已建立了较成熟的补料分批培养制度和连续灌注培养方法.5.7 产物稳定性酵母细胞膜上有一种KEXO2样蛋白水解酶,能专一性水解α因子前体中羧基端的肽键.改变培养基的p H值,推荐范围为2.8~6.5,加入适量的酵母提取物和蛋白胨,都能够提高外源蛋白的稳定性,而某些酶抑制剂在增加其稳定性的同时会使一些原先并不明显的蛋白变得非常明显,影响其使用效果.另外,使用蛋白酶缺陷株如SMD1163, SMD1165或SMD1168亦可避免产物降解的发生.在另外一种情况下,如果基因工程产物会影响宿主菌生长代谢活性的话,也可能出现高度降解的情况.6 结束语巴斯德毕赤酵母(Pichi a p astoris)表达系统是近年发展起来的一种新型真核表达系统,具有发酵工艺成熟,易于工业化,培养成本低廉,又具有真核表达系统,可进行蛋白翻译后的修饰、加工和折叠等优点,而得到广泛应用,目前许多诊断用的抗原及治疗用的疫苗都有在P Pichi a p astoris中得到表达.巴斯德毕赤酵母表达系统具有极好的生产应用前景,其主要优势如下:①巴斯德毕赤酵母表达载体整合后具有高稳定性.②可进行胞外表达和胞内表达,胞外分泌表达更有利于蛋白纯化.③发酵培养适合进一步大规模生产.④表达蛋白的加工修饰适中.但巴斯德毕赤酵母的更广泛应用,还有待于对此体系进行进一步的研究和开发.参考文献:[1] CREGG J M,CEREGHINO J L,SHI J,et al.Re2combinant protein expression in Pichia pastoris:a re2view[J].Molecular Biotechnology,2000,16(1):23252.[2] CREGG J M,V EDV IC K T S,RASCH KE W C.Re2cent Advances in the expression of foreign genes inPichia pastoris[J].Teclmology,1993,11(8):9052910.[3] CREGG J M,MADDEN K R,BARRIN GER K J,etal.Functional characterization of the two alcoholoxi2dase genes f rom the yeast Pichia pastoris[J].MolCell Biol,1989,9:131621323.[4] VASSIL EVA A,GHU GH D A,SWAMINA T HANS,et al.Expression of hepatitis B surface antigen inthe methylotrophic yeast Pichia pastoris using theGAP promoter[J].J Biotechnol,2001,88:21235. [5] GOODRIC K J C,XU M,FINN EGAN R,et al.High2level expression and stabilization of recombinanthuman chitinase produces in a continuous constitutivePichia pastoris expression system[J].Biotechnologyand Bioengineering,2001,174:4922497.[6] P HON G DARA A,M ERXKELBACH A,KEU P P,et al.Cloning and characterization of the gene enco2ding a repressible acid phosphatase(p HO1)f rom themethylotrophic yeast Hansennula pol y morpha[J].Appl Microbiol Biotechnol,1998,50:772841.[7] WA TER HAM H R,DIGAN M E,KOU TZ P J,etal.Isolation of the Pichia pastoris glyceraldehydes23′22phosphate and regulation and use of its promoter[J].Gene,1997,186(1):37244.[8] SEARS I B,CONNOR J,RO SSAN ESE O W,et al.A versatile set of vectors for constitutive and regulatedgene expression in Pichia pastoris[J].Yeast,1998,14(8):7832790.[9] CEREGHION J L,CREGG J M.Heterologous protein07农业科学研究 第28卷 expression in the methylotrophic yeast Pichia pastoris [J ].FEMS Microbiology Rev ,2000,24(1):45266.[10] MON TEINO R ,GARCIA R ,QU IN TERO O ,et al.Variation in N 2linked oligosaccharide structures on heterologous proteins secreted by the methylotrophic yeast Pichia pastoris [J ].Protein Expr Purif ,1998,14(2):1972207.[11] BRIERL EY R A.Secretion of recombinant human in 2sulin 2like growth factor I (IGF 21)[J ].Methods Mol Biol ,1998,103:1492177.[12] U RBA TSCH I L ,WIL KE 2MOUN TS S ,GIMI K ,et al.Purification and characterization of N 2glycosy 2lation mutant mouse and human P 2glycoproteins ex 2pressed in Pichia pastoris cells [J ].Arch Biochem Biophys ,2001,388:17121771.[13] CALL EWA ER T N ,L AREY W ,CADIR GI H ,ete of HDEL 2tagged Trichoderma reesei manno 2syl oligosaccharide 1,22alpha 2D 2mannosidase forN2glycan engineering in Pichia pastoris [J ].FEBSLett ,2001,503:1732178.[14] SREEK RISHNA K ,BRAN KAMP R G ,KROPP KE ,et al.Strategies for optimal synthesis and secre 2tion of heterologous proteins in the methylotrophic yeast Pichia pastoris [J ].G ene ,1997,190(1):55.[15] SREEKRISHNA K ,BARR K A ,HOARD S A ,etal.Expression of human serum albumin in Pichia pastoris [J ].Yeast ,1990,6(special issue ):447.[16] 赵翔,霍克克,李育阳.毕赤酵母的密码子用法分析[J ].生物工程学报,2000,16(3):2082211.[17] CL ARE J J ,ROMANOS M A ,RA YM EN T F B ,etal.Production of mouse epidermal growth factor in yeast :high level secretion using Pichia pastoris strains containing multiple gene copies [J ].Gene ,1991,105,2052212.[18] 熊爱生,彭日荷.信号肽序列对毕赤酵母表达外源蛋白质的影响[J ].生物化学与生物物理学报,2003,35(2):1542160.R esearch progress of the expression system of Pichia pastorisW ei Fanhua1,2,3,Cao R uibi ng 3,W u R un 1,Chen g Puy an3(1.School of Agriculture ,Ningxia University ,Y inchuan 750021,China ;2.Gansu Agricultural University ,Lanzhou 730071,China ;3.Nanjing Agricultural University ,Nanjing 210095,China )Abstract :As a eukaryote expression system ,Pichi a p astoris has been widely used in genetic engineering ,has many merit s in t he gene exp ressio n.These factors including t he st ruct ure of gene ,secretion signal peptides ,vector element s ,and factord influenced exp ression levels etc are analyzed.K ey w ords :Pichi a p astoris ;gene expression system ;research(责任编辑、校对 武晓兰)土地面积法定单位及其大致使用场合关于土地面积的法定计量单位,已于1990年12月28日由农业部、国家土地管理局和国家技术监督局联名发部的文件(该文件经国务院批准)中公布(见下表),从1992年1月1日起实施.土地面积法定单位及其大致使用场合名称中文符号国际符号换算关系大致使用场合平方千米,平方公里千米2km 21km 2=106m 2国家版图,地区疆域面积公顷公顷hm 21hm 2=104m 2=15市亩耕地、林地、草地面积平方米米2m2建筑面积,宅基地面积 注:土地面积单位“亩”是非法定单位,应停止使用.17 第1期 魏凡华等:巴斯德毕赤酵母表达系统研究进展。
巴斯德毕赤酵母及启动子1.1 毕赤酵母表达系统简介随着蛋白异源表达的飞速发展,越来越多的表达系统被建立并得到应用。
酵母作为单细胞真核生物,因具有比较完备的基因表达调控机制和对表达产物的加工修饰能力,仍表现出不可比拟的优势。
以甲醇营养型酵母(Methylotrophic yeast)-毕赤酵母为代表的第二代酵母表达系统,是近年来被公认的最有效的外源蛋白表达系统之一,已有多种外源蛋白在该宿主系统中获得了成功表达[1]。
作为生产外源蛋白的重要宿主菌,依靠其各种不同功能的表达载体,已经得到广泛的应用。
表达的蛋白质包括酶、膜蛋白、抗原、抗体和调节蛋白等[2,3]。
毕赤酵母(Pichia pastoris)表达系统是近年来发展迅速、应用广泛的一种真表达系统。
它是甲醇营养型酵母菌,有两个乙醇氧化酶(alcohol oxidase,Aox)码基因AOX1和AOX2,两者序列相似,AOX1基因严格受甲醇诱导和调控。
当甲醇为唯一碳源时,AOX1启动子可被甲醇诱导,启动乙醇氧化酶的表达,从而用甲醇进行代谢[4]。
含AOX1启动子的质粒可用来促进编码外源蛋白的目的因的表达。
随着Invitrogen公司开发的一系列毕赤酵母表达试剂盒的应用,目前用该统已成功表达出了数以千计的来自细菌、真菌、原生动物、植物、无脊椎动物、包括人在内的脊椎动物以及病毒等的具有生物学功能的外源蛋白或蛋白结构[5,6]。
1.1.1 P.Pastoris表达载体及其元件由于毕赤酵母没有稳定的附加质粒,表达载体需与宿主染色体发生同源重组,外源基因表达框架整合于染色体中以实现外源基因的表达整合表达的优点在于保持外源基因稳定性并可产生多拷贝基因。
典型的毕赤氏酵母表达载体含有醇氧化酶基因的调控序列,主要的结构包括:5′AOX1启动子片段、多克隆位点(MCS)、转录终止和polyA形成基因序列(TT)、筛选标记(His4或Zeocin)、3′AOX1基因片段,作为一个能在大肠杆菌中繁殖扩增的穿梭质粒,它还有部分pBR322质粒或COLE1序列。
Pichia酵母表达系统使用心得摘要:Pichia酵母表达系统广泛应用于外源基因表达。
生物通编者按:甲醇酵母表达系统有不少优点,其中以Invitrogen公司的Pichia酵母表达系统最为人熟知,并广泛应用于外源蛋白的表达。
虽然说酵母表达操作简单表达量高,但是在实际操作中,并不是每个外源基因都能顺利得到高表达的。
不少人在操作中会遇到这样那样的问题,生物通编者特地收集了部分用户在使用EasySelect Pichia Expression System这个被誉为最简单的毕赤酵母表达的经典试剂盒过程中的心得体会。
其中Xiang Yang是来自美国乔治城大学(Georgetown University)Lombardi癌症中心(Lombardi Cancer Center),部分用户来自国内。
+ 表示优胜于;- 表示不如;= 表示差不多EasySelect Pichia Expression System产品性能:优点——使用简单,表达量高,His-tag便于纯化缺点——酵母表达蛋白有时会出现蛋白切割问题全面产品报告及心得体会:巴斯德毕赤酵母(Pichia pastoris)是一种能高效表达重组蛋白的酵母品种,一方面由于其是属于真核生物,因此表达出来的蛋白可以进行糖基化修饰,另一方面毕赤酵母生长速度快,可以将表达的蛋白分泌到培养基中,方便蛋白纯化。
毕赤酵母表达载体pPICZ在多克隆位点(MCR)3'端带有his-tag和c-myc epitopes,这些tag有利于常规检测和纯化,而且在MCR5'端引入了alpha factor(α-factor)用以增加表达,并且在表达后α-factor可以自动被切除。
在进行克隆的时候,如果你选择的是EcoRI,那么只需在目标蛋白中增加两个氨基酸序列即可完成。
另外pPICZ系列选用的是Zeocin抗生素作为筛选标记,而诱导表达的载体需要甲醇——甲醇比一般用于大肠杆菌表达诱导使用的IPTG便宜。
第一步构建载体Xiang Yang:pPICZ系列有许多克隆位点可供选择,同时也有三种读码框以便不用的用户需要。
红叶山庄:有关是选择pPIC9K还是pPICZ系列?pPIC9K属于穿梭质粒,也可以在原核表达,而pPICZ系列比较容易操作,大肠和毕赤酵母均用抗Zeocin筛选(PIC9K操作麻烦一点,大肠用amp抗性,而毕赤酵母先用His缺陷筛选阳性克隆,在利用G418筛选多拷贝),而且对于大小合适(30—50KD)的蛋白在产量上是pPIC9K 无法比拟的。
leslie:要做毕赤酵母表达实验,首先当然就要了解这个可爱的酵母了(椭圆形,肥嘟嘟的,十分可爱),她和大肠杆菌长得有较大区别(大肠杆菌是杆状的),因此在培养的过程中要区别这两种菌体,除了气味,浓度,颜色以外,也可以取样到显微镜中观测。
大家做毕赤表达的时候应该都遇过这种情况吧,表达过程中染菌(我们实验室曾经污染过各种颜色形状的细菌,那真是一段可怕的经历),如果在不知情的情况下继续做下去,那可以就是浪费大把的时间了。
基本熟悉了毕赤酵母,了解了她生长的喜好(多糖偏酸环境),生长的周期等等情况后,当然更多的精力还是应该花在表达的目的蛋白上,我的表达蛋白有些恐怖,有100KD,本来当然应该放在大肠杆菌中表达,但是为了分泌表达(其实后来发现大肠杆菌pET系列分泌表达系列也不错)和糖基化修饰(主要是这个方面,因为我的蛋白是人源的,表达出来用于酵母双杂,因此需要有完备的糖基化修饰)。
这样我的DNA片段由于较长,所以在做克隆的时候也要非常小心,需要注意的是:①酶切位点不能出现在目的DNA片段中——如果片段长无法避免,可以采用平末端连接;②虽然α-factor可以自动切除,但是在设计表达的时候,如果在N端不能出现任何多余的aa(比如药物蛋白表达),需要特别留意(说明书上有详细说明:P13);③有三种不同的读码框(对于pPICZα系列来说就是对上α-factor序列),在设计克隆的时候要反复确定自己的读码框是否正确,这可是致命的问题;④无论pPICZ还是pPICZα都有TGA(终止密码子),但是pPICZ系列没有ATG(起始密码子),有人认为酵母启动子与外源基因的ATG之间的距离越短对于表达的该基因越有利;⑤如果不希望有c-myc和His-tag,可以在基因片段末尾加入终止密码子;⑥Pichia的密码子与酿酒酵母的相似,有关基因表达偏好密码子的问题有人认为没有必要更换,有人认为一定要换,个人认为以产量为主要目的的可以考虑更换基因密码子,而如果片段过长就比较麻烦,不过有许多真核保守蛋白其实是和酵母密码子相似的;⑦克隆菌株需要有recA,endA,试剂盒带有的TOP10挺好用的(其它像是DH5α都行),但是要注意带有筛选抗生素Zeocin的培养基要用低盐培养基(NaCl减半),这主要是因为怕影响到抗生素作用(Zeocin平板要避光保存);⑧测序引物可以用α-factor信号引物,也可以用5'AOX1引物;⑨如果需要高量表达,可以考虑做克隆的时候串联基因片段进行表达,另外也可以在转化酵母的时候重复转化。
⑩目的基因中最好不要含有pro-glu-ser-thr这样的序列,因为这个序列是激活蛋白水解酶的作用底物,会影响表达,另外也不要含有x-phe-x-arg-gln和gln-arg-x-phe-x这样的序列(x=任何氨基酸),因为这些序列容易受到容酶体的切割,而且目的蛋白末端最好是ala,asp,val,ser这样的氨基酸。
除此之外许多高A+T含量的基因通常会由于提前终止而不能有效转录,也需要多加注意。
第二步线性化的DNA转化入Pichia酵母Xiang Yang:EasySelect试剂盒准备了三种菌株:X33,GS115和KM71H。
我倾向于选择X33,因为这个菌株转化率和表达量相对而言较高,如果你有电转仪(electroporator),可以尝试一下。
如果没有的话,EasySelect 也准备了化学转化试剂——EasyComp Transformation,但是由于转化率的缘故,我建议使用电转仪。
leslie:在得到了正确的序列之后就可以准备转化毕赤酵母了,试剂盒携带有的是X-33,GS115和KM71H这三种毕赤酵母(另外常用的还有SMD1168),每种酵母的特点有些不尽相同(Manual上写的很清楚),其中X-33由于是野生型,因此耐受性比较好,如果担心转化率的话可以考虑这种酵母菌,而GS115与X33一样都是属于MUT+表现型,也就是说可以在含甲醇的培养基中快速生长,但是据说会对外源基因表达有影响,KM71是MUT-型酵母,在甲醇培养基中生长缓慢,但是也有利于翻译后加工,比如形成二硫键,糖基化等等,另外SMD1168则是基因组中的Pep4基因发生突变,造成蛋白水解酶活性的丧失,可以保护表达产物免受降解,促进表达量的提高。
一般来说,如果是胞内表达,应尽量用Mut-细胞,这样得到的蛋白产物中醇氧化酶蛋白量较少而目的蛋白量相对较多(约占Pp总分泌蛋白量的30-90%,如人乙酰胆碱酯酶B变异链的含量占到90%,使下游纯化更易进行。
而对于分泌蛋白的表达,无论是甲醇利用慢(Mut-)还是甲醇利用快(Mut+)的细胞都可应用,如在人血清白蛋白(HSA)(为分泌型蛋白)的表达中就看不出两种类型的细胞之间有什么明显差别。
所以一般手册都会建议同时在这几种菌株中进行转化,这主要是因为不同的基因在不同的酵母菌中可能表达量截然不同,因此在最开始的时候建议多用几种酵母菌实验。
另外有个保存问题,原始酵母菌一定要保存好,因为酵母在传代多次后会影响其转化率和表达量,所以一方面分多管分装保存于-80℃,另一方面如果出现了转化或者表达的问题,在其它方面都没有出错的前提下可以考虑重新取出新菌液(每次都要涂平板挑菌)。
在准备酵母菌的同时也需要准备质粒,由于酵母菌转化对转化质粒的要求较高,量也较大(5-10ug),因此许多时候都会用PEG大提质粒,或者用大提试剂盒,总而言之要准备好足够量的质粒,并且不要忘记也要同时准备空载体以做对照。
在转化前质粒需要进行线性化,这主要是为了增加重组率(EasySelect试剂盒表达量高的一个重要原因也就在于其原理是将目的片段整合到载体上,大大的增加了目的片段的表达)。
线性化位点个人认为也会影响到表达量,对于基因片段不大的蛋白可以考虑用几个线性化位点同时进行转化筛选,但是如果片段大,就有可能供选择的机会少,而且也有可能遇上没有合适的线性化位点的情况,这个时候也不是说不能进行表达,但是准备的质粒就要增加10倍,另外也可以进行部分酶切(即先进行预实验,掐定时间和酶量保证被切开的质粒有部分是在线性化位点切开而基因片段保存完好)。
在线性化之后的质粒就可以酒精沉淀回收了——中间步骤需要使酶失活,说明书建议是热失活或者EDTA,个人认为前者比较好,主要是担心EDTA对于转化的影响,另外这三种酶失活的温度都是65℃/20min。
沉淀回收之后是离心10分钟,用80%的酒精洗涤后风干,这一步需要多加注意保证风干完全,因为有实验证明残留的酒精对于转化的影响颇大。
接下来就是酵母转化了,这是令许多人头疼的一步,也是影响实验决定表达的关键步骤。
转化方法有不少,例如电转,化学转化,原生质体转化,其方法的难易程度和转化率高低呈反向递减的,也就是说电转最容易,转化率较高(但要求有电转仪),而原生质体最麻烦,而且效果不好(比较传统),因此不建议使用,EasySelect 说明书上这么建议,并且也详细说明了电转,化学转化(EasyComp和LiCl)方法的过程,可以按部就班。
需要注意的是:(电转过程)①最好每次都从平板上挑酵母菌,用培养过的酵母放置时间不要超过一个星期;②扩大培养的浓度一定要控制好,个人认为不需要OD600达到1.3-1.5,1.0-1.3的就好,这个时候的酵母比较新鲜,转化率比较高;③整个感受态制作过程中一定要在冰上操作,离心最好也用冷冻离心机,这是影响转化的关键——为了进一步保证这一点,无菌水可以是冰水混合物,另外山梨醇和电转杯都要预冷;④电转仪需要预热,所以准备感受态的时候就可以把电转仪打开了,电转后山梨醇的加入要快,曾有人做实验证明晚一秒就会降低转化的数量级,虽然不一定可信,但是我个人也认为这个过程要快,电转后可以看看时间,如果时间过短(比如〈4)就可能说明杂质较多,会影响转化率;⑤转化后温育是个增加同源重组,增加存活率的过程,需要注意不要感染了大肠杆菌,再加入培养基30℃摇一段时间,可以取部分涂板(不同浓度抗生素),或者也有人将菌短暂离心,弃去上清,剩余全部涂板以保证转化率。
(化学转化)如果没有电转仪,LiCl转化是一种可供选择的方法,转化率是102到103cfu/ug。