氢氧化钠的性质和用途(第一课时)
- 格式:doc
- 大小:37.50 KB
- 文档页数:4

九年级氢氧化钠的知识点一、化学反应中的氢氧化钠氢氧化钠(化学式:NaOH),是一种强碱,具有强烈的腐蚀性。
在化学实验中,氢氧化钠常被用作酸中和剂,也用于制造肥皂、纸浆等工业领域。
九年级化学课程中,学生通常会学习有关氢氧化钠的一些基本知识,如性质、应用以及与其他物质的反应等。
二、氢氧化钠的性质氢氧化钠是以固体形式存在,并且在室温下呈现出无色、结晶性和吸湿性。
它在溶于水时会放出大量热量,是一种强碱。
在空气中,氢氧化钠的固体形式会逐渐吸湿,并变成液态。
这是因为氢氧化钠具有吸湿性,能吸收空气中的水分。
与酸性物质相反,碱性物质可以中和酸,并能使酸和碱达到一定的平衡。
在中学化学实验中,我们通常将氢氧化钠溶液滴加到试管中的酸性物质中,这时会观察到氢氧化钠中和了酸性物质,试管中的液体变得中性或呈碱性。
三、氢氧化钠的应用氢氧化钠具有许多实际应用价值。
它常被用作工业生产中的重要原料。
比如,制造肥皂、纸浆、合成纤维等。
此外,氢氧化钠还可以被用作清洁剂,用于清洗排水管道、溶解油脂等。
因为它具有强腐蚀性,所以在使用时需要小心谨慎,并注意防护措施。
四、氢氧化钠的与其他物质的反应氢氧化钠可以与许多物质发生化学反应,产生不同的产物。
其中一种重要的反应是与酸发生中和反应。
当氢氧化钠与酸反应时,会生成氯化钠、水和二氧化碳等产物。
另外,氢氧化钠与盐酸反应时,生成氯化钠和水。
这个反应是常见的酸碱中和反应,也是氢氧化钠在实际应用中的一种常见反应。
此外,氢氧化钠还可以与硫酸反应,生成硫酸钠和水。
除了与酸反应外,氢氧化钠还可以与金属发生反应。
比如,当氢氧化钠与铝反应时,会生成铝烷和氢气。
在这个反应中,氢氧化钠起到了催化剂的作用,促使反应的进行。
总结:氢氧化钠作为一种强碱,具有强烈的腐蚀性。
在化学实验中,它被用作酸中和剂,常见于制造肥皂、纸浆、合成纤维等工业生产。
氢氧化钠与酸发生反应时能产生氯化钠、水和二氧化碳等产物。
与金属反应时,氢氧化钠能催化反应的进行。

氢氧化钠化学性质
氢氧化钠(Sodium Hydroxide)以NaOH的形式用作日常化学工作中的碱性试剂。
它是一
种无色或淡黄色的泥状固体,在湿的情况下易溶于水,极易腐蚀性,质量分数可以高达50%,具有强碱性。
它在25℃时,水溶液密度为1.404g / ml,蒸气密度为6.51x 10-4 g / l。
氢氧化钠的化学反应极易发生,尤其是与强酸发生反应时特别活跃。
它可以与さ及Cl离
子生成氢氯化钠和氯气;与H2S(卤化氢)反应,生成Na2S和H2,也可以与二价酸生成碱性盐。
它还可以与醛(糖醛)发生反应,生成烃,也可以与二羧酸生成代醛。
此外,氢氧化钠的用途也广泛,可以用来生产高级表面活性剂、洗涤用品、防腐剂、抗病毒剂、牙膏等食品加工工业;用于医药、农药、植物激素、染料、润滑油等行业;在制作烟草、制皂等领域也有使用。
此外,它还可以用作水洗房墙壁和地面的漂白剂,用于清洗厕所和垃圾,以及其他分解有机污染物。
氢氧化钠化学性质复杂,具有多种用途。
根据其化学性质,它可用于生产食品加工、防腐剂、抗病毒剂等多种行业,也可用作清洗房间壁面或地面的漂白剂和清水剂,用于清洗厕所和垃圾,以及其他分解有机污染物。
因此,深知氢氧化钠的化学性质和用途是非常重要的,这有助于我们更好地使用它,同时防止有害冲击。

常见的碱----氢氧化钠任淑霞教学目标知识与技能(1)认识氢氧化钠的吸水性和腐蚀性,了解其用途。
(2)认识氢氧化钠和氢氧化钙的化学性质。
和NaOH的反应。
(3)探究CO2过程与方法通过一些探究活动,进一步认识与体验科学探究的过程;学会用碱的有关性质解释有关生活现象。
情感态度与价值观(1)通过实验设计及实验分析,培养学生的创新能力。
(2)通过学生亲身参与科学探究活动,激发学习化学的兴趣,培养学生尊重事实的科学态度,发展善于合作,勤于思考的科学精神。
(四)教学重点和难点重点:氢氧化钠和氢氧化钙的性质。
难点:碱的化学性质。
(五)教学设计思想总的思路是先设置情景,通过“活动与探究”和“小组实验”,让学生归纳总结常见碱的和NaOH的反应。
以学生为主体,培养学生的探究能力和性质,通过“活动与探究”,探究CO2动手操作能力,激发学生学习化学的兴趣。
(六)实验准备:教师准备:NaOH固体、20%NaOH溶液、CaO固体、澄清的石灰水、盐酸、硫酸、蒸馏水、乙醇、石蕊试液、酚酞试液、洗净的鸡爪、去壳的熟鸡蛋、导线、灯泡、烧杯、试管、软塑料瓶、表面皿、滴管、点滴板。
学生准备:生石灰干燥剂、生鹧鸪蛋。
(七)教学设计过程:教学环节教师活动学生活动 教学意图 引入新课一. 新课导入上课前我先给大家变一个魔术: 【创设问题情境】 演示:1.实验(如图)观察图中发生的现象。
1、教师往黑板上贴一张白纸(预先用酚酞溶液写好“碱”),然后用小喷壶往上喷氢氧化钠溶液,鲜艳的大红字“碱”跃然纸上。
问题:大家想一想,这些神奇的现象存在的反应原理是什么? 【引入课题】就让我们一起通过实验来认识常见的碱---氢氧化钠,学完这节课,我们的魔术原理也就揭晓了。
多么奇妙的化学世界! 学生疑问:熟鸡蛋为什么会掉下去呢?个个眉飞色舞,无不惊叹。
通过神奇的化学实验把学生轻松地引入化学课堂。
把游戏引入课堂,寓教学于游戏中。
氢氧化钠的物理性质二、合作探究 【提出问题】氢氧化钠固体有哪些重要的物理性质呢?实验引导NaOH 的性质及用途要求学生用镊子夹取3小块NaOH 固体,放在表面皿上观察其颜色状态并实验,在试管中溶解固体NaOH 并感知其温度变化。

氢氧化钠的性质1. 概述氢氧化钠(NaOH),也被称为苛性钠、腐蚀性钠、烧碱,是一种广泛应用的无机化合物。
它是一种白色固体,常见的形式是白色颗粒或蓝色颗粒,易于溶解在水中。
氢氧化钠是一种强碱,具有许多独特的性质和应用。
本文将介绍氢氧化钠的化学性质、物理性质以及其在工业和实验室中的常见用途。
2. 化学性质2.1 腐蚀性氢氧化钠具有很强的腐蚀性,对许多金属、有机物和无机物都具有强烈的腐蚀作用。
当与酸反应时会产生剧烈的放热反应,并且可以迅速溶解许多有机物和纤维素等。
2.2 水解反应氢氧化钠在水中会发生水解反应,产生氢氧根离子和钠离子。
水解反应的化学方程式如下:NaOH + H2O -> Na+ + OH-这个反应是放热的,因此在氢氧化钠溶液中可以观察到升温现象。
2.3 中和反应由于氢氧化钠是一种强碱,它可以与酸发生中和反应。
在中和反应中,氢氧化钠中的氢氧根离子与酸中的氢离子结合,形成水分子。
根据反应的摩尔比例,可以确定所需的氢氧化钠用量,从而进行准确的中和过程。
2.4 与酸反应氢氧化钠可以与许多酸反应,产生盐和水。
例如,与盐酸反应生成氯化钠和水的化学方程式如下:NaOH + HCl -> NaCl + H2O这个反应是中和反应的一个特例。
3. 物理性质3.1 外观氢氧化钠呈现为白色固体,常见的形式是白色颗粒或蓝色颗粒。
它有时也可以以棒状结晶的形式出现。
3.2 溶解性氢氧化钠易溶于水,在20℃下,每100克水可以溶解约109克NaOH。
其溶液呈碱性,pH值大于7。
3.3 熔点和沸点氢氧化钠的熔点约为318℃,沸点约为1390℃。
3.4 密度氢氧化钠的密度约为2.13克/立方厘米。
密度的高低与氢氧化钠溶液的浓度有关,浓溶液的密度更高。
4. 应用4.1 工业应用氢氧化钠在工业中广泛应用于制药、纸浆和纸张生产、清洁剂制造、金属腐蚀防护等领域。
例如,在制药工业中,氢氧化钠常用于药物中间体的合成和药物的制剂调整。

氢氧化钠的用途氢氧化钠:化学式为NaOH,俗称烧碱、火碱、片碱、苛性钠(香港亦称“哥士的”),为一种具有高腐蚀性的强碱,一般为片状或颗粒形态,易溶于水并形成碱性溶液,可增强水的导电性,另有潮解性,易吸取空气中的水蒸气。
NaOH是化学实验室其中一种必备的化学品,亦为常见的化工品之一。
纯品是无色透明的晶体。
密度2.130g/cm³。
熔点318.4℃。
沸点1390℃。
工业品含有少量的氯化钠和碳酸钠,是白色不透明的固体。
有块状、片状、粒状和棒状等。
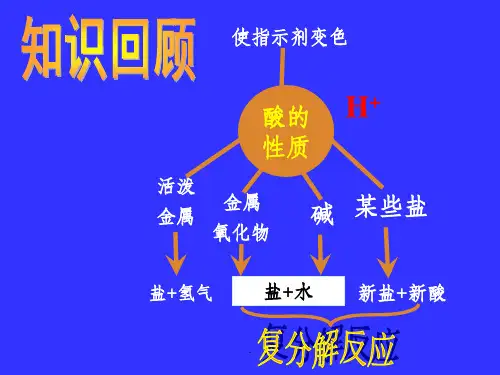
碱性氢氧化钠氢氧化钠溶于水中会完全解离成钠离子与氢氧根离子,所以它具有碱的通性。
它可与任何质子酸进行酸碱中和反应:NaOH + HCl = NaCl + H₂O(复分解反应)2NaOH + H₂SO₄=Na₂SO₄+2H₂O(复分解反应)NaOH + HNO₃=NaNO₃+H₂O(复分解反应)同样,其溶液能够与盐溶液发生复分解反应:NaOH + NH₄Cl = NaCl +NH₃·H₂O2NaOH + CuSO₄= Cu(OH)₂↓+ Na₂SO₄2NaOH+MgCl₂= 2NaCl+Mg(OH)₂↓皂化反应许多的有机反应中,氢氧化钠也扮演着类似催化剂的角色,其中,最具代表性的莫过于皂化反应:RCOOR' + NaOH = RCOONa + R'OH其他之所以氢氧化钠于空气中容易变质,是因为空气中含有二氧化碳:2NaOH + CO₂ = Na₂CO₃ + H₂O倘若持续通入过量的二氧化碳,则会生成碳酸氢钠,俗称为小苏打,反应方程式如下所示:Na₂CO₃ + CO₂ + H ₂O = 2NaHCO₃同样,氢氧化钠能够与像二氧化硫等酸性氧化物发生如下反应:2NaOH + SiO₂ = Na₂SiO₃ + H₂O2NaOH + SO₂(微量)= Na₂SO₃ + H₂ONaOH + SO₂(过量)= NaHSO₃(生成的Na₂SO₃和水与过量的SO₂反应生成了NaHSO₃)颜色反应它能与指示剂发生反应:氢氧化钠溶液通常使石蕊试液变蓝,使酚酞试液变红腐蚀性氢氧化钠对玻璃制品有轻微的腐蚀性,两者会生成硅酸钠(sodium silicate),使得玻璃仪器中的活塞黏着于仪器上。





氢氧化钠的性质和用途(第一课时)大连市沙河口区第七十九中学姓名冯军一、教材分析:本节内容采用从已有经验和知识引出,通过实验观察进行归纳和比较,将知识的应用分散穿插与最后集中陈述相结合的方式出现。
本节内容实验较多、现象鲜明,容易引发学生的学习兴趣。
但本节内容涉及到的化学反应方程式有一定难度,这又给学生学习带来了一定的困难。
因此,在教学时从学生的已有经验和知识入手,增加感知实例,尽可能让学生多动手做实验,并充分应用比较的方法,进行实验现象比较,从而认识碱的性质和用途。
二、学情分析:学生已经学习了常见的酸的物理性质、化学性质和用途,对分类学习物质的性质和用途有了一定的基础,但初中学生对于抓住知识的规律性来学习一类物质的性质,还需要教师不失时机地进行引导。
因此教学中应从学生已有的经验和知识入手,尽可能让学生多思考,多动手实验,让学生能根据已知来主动探究未知,真正体会到生活中处处有化学,从而对氢氧化钠的性质和用途有较深的认识。
三、三维目标:[知识与技能]1、了解氢氧化钠的性质和用途,进一步提高正确书写化学方程式的能力。
2、会用氢氧化钠的性质解释日常生活中的一些现象。
3、认识强碱的腐蚀性。
[过程与方法]1、用氢氧化钠的性质并联系物理及生物知识,自己设计实验,培养创新精神和创新能力、实验能力、观察能力及认识规律的能力。
2、初步学会用科学探究的方法认识物质的性质。
3、学会观察、实验、记录、探索、设计等基本的科学研究方法。
[情感态度价值观]1、逐步培养学生严谨求实、一丝不苟的科学态度。
2、以实验为载体,保持和增强学生对化学现象的好奇心和探究欲,发展学习化学的兴趣。
四、重难点:[重点]氢氧化钠的化学性质。
[难点]氢氧化钠和非金属氧化物反应的化学方程式。
五、课前准备:[教师]药品:氢氧化钠固体、蒸馏水、石蕊试液、酚酞试液、一瓶二氧化碳、氢氧化钠溶液、硫酸铜溶液、氯化铁溶液。
仪器:试管、表面皿、点滴板、胶头滴管、气球、双孔橡皮塞、试管夹、酒精灯。
氢氧化钠的性质与作用用途氢氧化钠即苛性钠,化学式为NaOH,是一种重要的无机化学品。
它是无色的晶体,具有强烈的碱性和腐蚀性。
首先,让我们来了解一下氢氧化钠的性质。
氢氧化钠是一种强碱,能发生放热性反应。
它具有很强的腐蚀性能,能够与许多金属反应生成对应的金属氢氧化物和氢气。
氢氧化钠在空气中吸湿,易溶于水,形成氢氧化钠溶液。
溶液呈碱性,可以与酸发生中和反应,生成相应的盐和水。
氢氧化钠在工业和日常生活中具有广泛的作用用途。
以下将详细介绍几个主要的应用领域。
1. 化学工业:氢氧化钠是许多化学反应的重要原料。
例如,它是制备合成纤维、纸张、皂液、清洁剂、塑料等的基础原料。
氢氧化钠也常用于酯化和酰化反应中,用于制备酯类和酸酐。
2. 钢铁工业:氢氧化钠可以与铁氧化物反应,去除钢铁表面的氧化物和脱除硅,从而提高钢铁的质量。
此外,在焊接和铸造过程中,氢氧化钠也可用作熔剂。
3. 石化工业:氢氧化钠广泛应用于石油和天然气加工过程中。
它可用于脱酸、脱硫和脱碱处理,帮助提纯石油产品。
4. 污水处理:氢氧化钠在污水处理中用作调节剂,帮助调整污水的酸碱度。
它可以中和酸性污水和废水中的酸性物质,从而达到污水中酸碱平衡的目的。
5. 塑料工业:氢氧化钠可用于合成聚氨酯和聚酯等塑料。
它还可用作合成纤维的脱酸剂,帮助去除纤维中的杂质。
6. 食品工业:氢氧化钠有时被用作食品加工过程中的调味剂。
它可以调节食品的酸碱度,并且还可用于制作面包、饼干和巧克力等。
除了以上应用之外,氢氧化钠还被用作实验室试剂以及一些特殊领域的处理剂。
但是需要注意的是,由于氢氧化钠具有强腐蚀性,使用时需要注意安全,并避免与皮肤和眼睛接触。
总而言之,氢氧化钠是一种重要的无机化学品,具有强碱性和腐蚀性。
它在化学工业、钢铁工业、石化工业、污水处理、塑料工业和食品工业等领域具有广泛的应用。
通过它与其他物质的反应,可以促进许多化学反应的进行,并产生许多具有实用价值的化学产品。
然而,在使用过程中,我们必须牢记安全第一,正确操作,以避免潜在的危险。
重要的碱氢氧化钠(NaOH ,俗称苛性钠、烧碱或火碱)①物理性质氢氧化钠为白色块状或片状的固体,极易溶于水,溶解时放出大量的热。
其水溶液有涩味和滑腻感。
氢氧化钠易吸收空气中的水蒸气而发生潮解。
可作干燥剂,但不能干燥酸性气体。
有强烈的腐蚀性,称量时需放在小烧杯或表面皿中。
如不慎将碱液沾到皮肤上,应用大量的水冲洗,并涂上硼酸溶液。
被氢氧化钠腐蚀的鸡爪②保存及检验变质的方法由于氢氧化钠易潮解,且易吸收空气中的二氧化碳。
因此,氢氧化钠应保存在配有橡胶塞的玻璃广口瓶中。
检验变质的方法为:加稀盐酸,如有气泡产生,则氢氧化钠已变质。
反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O。
③化学性质④用途:氢氧化钠固体有吸水性,因而常做氢气、氧气、氨气等中性或碱性气体的干燥剂。
氢氧化钠是一种重要的化工原料,用于生产肥皂、石油、造纸、纺织、印染等工业中。
生活中可用于去除油污。
【微点拨】碱与CO2反应的判断(1)对于CO2与NaOH溶液发生反应的考查经常在中考中出现,由于无明显现象,无法肯定反应是否发生,所以需要借助简单的实验,通过明显的现象来判断是否发生。
如图所示的一些装置可以帮助我们判断:A B C DE F G观察到的现象分别为:A.烧杯中的水进入导管;B.软塑料瓶变瘪;C.试管内液面上升;D.U 形管中的水左液面高于右液面;E.锥形瓶中气球胀大;F. 鸡蛋被吸进集气瓶中;G.烧杯中的水进入烧瓶,形成喷泉。
为排除可能是二氧化碳与氢氧化钠溶液中的水发生了反应,还需把上述实验中的氢氧化钠溶液换成等体积的水,做对比实验。
(2)NaOH和Ca(OH)2与CO2反应后会生成对应的Na2CO3和CaCO3,利用Na2CO3和CaCO3都能与稀盐酸反应生成CO2气体这一现象,来证明NaOH和Ca(OH)2与CO2发生了反应,或者是NaOH和Ca(OH)2变质。
解答此类问题应注意以下几个方面:(1)利用对比形变的程度观察。
典型危险化学品应急处置——氢氧化钠氢氧化钠,也称苛性钠、烧碱、火碱,是一种无机化合物,化学式NaOH。
氢氧化钠具有强碱性,腐蚀性极强,极易溶于水,同时强烈放热,并溶于乙醇和甘油;不溶于丙酮、乙醚。
暴露在空气中,最后会完全溶解成溶液。
可作酸中和剂、显色剂、皂化剂、去皮剂、洗涤剂等,主要用于生产纸张、人造丝、冶炼金属、石油精制、木材加工及机械工业等方面,用途广泛。
(一)理化性质(二)危害信息1.危险性类别氢氧化钠属于危险化学品中的第8类腐蚀性物质。
2.火灾与爆炸危险性不燃,无特殊燃爆特性,遇水、水蒸气和酸类物质反应并放出大量热,可引燃周边可燃物。
遇潮时对铝、锌和锡有腐蚀性,产生易燃易爆的氢气,与铵盐反应生成氨,遇火源可引起爆炸。
3.活性反应与酸类等禁配物发生反应;与金属铝和锌、非金属硼和硅等反应放出氢;与氯、溴、碘等卤素发生歧化反应;与酸类起中和作用而生成盐和水,固态氢氧化钠暴露在空气中时容易吸收水分,表面潮湿而逐步溶解。
4.禁忌物强酸、易燃或可燃物、二氧化碳、过氧化物、水。
5.健康危害本品有强烈刺激和腐蚀性。
粉尘和烟雾刺激眼和呼吸道,腐蚀鼻中隔;皮肤和眼,直接接触可引起灼伤;误服可造成消化道灼伤,黏膜糜烂、出血和休克。
6.环境危害对水体可造成污染,对植物和水生生物有害。
大量泄漏的氢氧化钠流散到土壤,会对土壤造成污染,破坏酸碱性,严重影响耕种。
(三)事故类型特点1.流散性、渗漏性氢氧化钠溶液具备流动性、强刺激性、腐蚀性,在发生泄漏时危害性较高。
氢氧化钠液体发生泄漏易四处流散、渗漏,会对生态环境造成污染,如吸收或筑堤不当,后期处置程序将难度大增。
2.腐蚀性氢氧化钠与水或水蒸气反应形成强腐蚀性溶液,对承载容器腐蚀性较强,可能导致设备破损,发生危险化学品泄漏事故,造成人员伤亡、设备财产损失和环境污染。
如防护不当,可通过人体呼吸道、消化道进入体内,腐蚀皮肤。
3.与其他物质发生变化产生的危害固体氢氧化钠遇水、水蒸气和酸类物质放热,可引燃周围介质,造成火灾;与铵盐反应生成氨,遇火源可引起爆炸,遇潮时对铝、锌和锡有腐蚀性,并放出易燃易爆的氢气,产生火灾爆炸的危险。
氢氧化钠的物化性质和应用[物化性质]氢氧化钠是一种频繁的主要强碱。
化学式为NaOH,相对分子质量为40.01,熔点318.4℃,沸点1390℃。
纯的无水氢氧化钠为白色半透亮,结晶状固体。
氢氧化钠极易溶于水,溶解度随温度的上升而增大,溶解时能放出大量的热,288K时其饱和溶液浓度可达26.4mol/L(1:1)。
它的水溶液有涩味和滑腻感,溶液呈强碱性,具备碱的一切通性。
市售烧碱有固态和液态两种:纯固体烧碱呈白色,有块状、片状、棒状、粒状,质脆;纯液体烧碱为无色透亮液体。
氢氧化钠还易溶于、甘油;但不溶于、、液氨。
对纤维、皮肤、玻璃、陶瓷等有腐蚀作用,溶解或浓溶液稀释时会放出热量;与无机酸发生中和反应也能产生大量热,生成相应的盐类;与金属铝和锌、非金属硼和硅等反应放出氢;与氯、溴、碘等卤素发生歧化反应。
能从水溶液中沉淀金属离子成为氢氧化物;能使油脂发生皂化反应,生成相应的有机酸的钠盐和醇,这是去除织物上的油污的原理。
[制备办法] (1)纯碱苛化法。
(2)电解NaCl水溶液。
[应用]氢氧化钠的用途非常广泛,在化学试验中,除了用做试剂以外,因为它有很强的吸湿性,还可用做碱性干燥剂。
烧碱在国民经济中有广泛应用,许多工业部门都需要烧碱。
用法烧碱最多的部门是化学药品的创造,第二是造纸、炼铝、炼钨、人造丝、人造棉和肥皂创造业。
另外,在生产染料、塑料、药剂及有机中间体,旧橡胶的再生,制金属钠、水的电解以及无机盐生产中,以及制取硼砂、铬盐、、等,也要用法大量的烧碱。
工业用氢氧化钠应符合国家标准GB209-2006;工业用离子交换膜法氢氧化钠应符合国家标准GB/T11199-2006;化纤用氢氧化钠应符合国家标准GB11212-2003;食用氢氧化钠应符合国家标准GB5175-2008。
另外,在化学清洗前,设备通常用1%~2%的氢氧化钠溶液举行脱油脂的预处理。
氢氧化钠用于清洗时,对其中杂质含量应做要求,尤其是高参数锅炉机组清洗时,应严格要求其氯离子含量。
氢氧化钠的性质和用途(第一课时)
大连市沙河口区第七十九中学姓名冯军
一、教材分析:
本节内容采用从已有经验和知识引出,通过实验观察进行归纳和比较,将知识的应用分散穿插与最后集中陈述相结合的方式出现。
本节内容实验较多、现象鲜明,容易引发学生的学习兴趣。
但本节内容涉及到的化学反应方程式有一定难度,这又给学生学习带来了一定的困难。
因此,在教学时从学生的已有经验和知识入手,增加感知实例,尽可能让学生多动手做实验,并充分应用比较的方法,进行实验现象比较,从而认识碱的性质和用途。
二、学情分析:
学生已经学习了常见的酸的物理性质、化学性质和用途,对分类学习物质的性质和用途有了一定的基础,但初中学生对于抓住知识的规律性来学习一类物质的性质,还需要教师不失时机地进行引导。
因此教学中应从学生已有的经验和知识入手,尽可能让学生多思考,多动手实验,让学生能根据已知来主动探究未知,真正体会到生活中处处有化学,从而对氢氧化钠的性质和用途有较深的认识。
三、三维目标:
[知识与技能]
1、了解氢氧化钠的性质和用途,进一步提高正确书写化学方程式的能力。
2、会用氢氧化钠的性质解释日常生活中的一些现象。
3、认识强碱的腐蚀性。
[过程与方法]
1、用氢氧化钠的性质并联系物理及生物知识,自己设计实验,培养创新精神和创新能力、实验能力、观察能力及认识规律的能力。
2、初步学会用科学探究的方法认识物质的性质。
3、学会观察、实验、记录、探索、设计等基本的科学研究方法。
[情感态度价值观]
1、逐步培养学生严谨求实、一丝不苟的科学态度。
2、以实验为载体,保持和增强学生对化学现象的好奇心和探究欲,发展学习化学的兴趣。
四、重难点:
[重点]氢氧化钠的化学性质。
[难点]氢氧化钠和非金属氧化物反应的化学方程式。
五、课前准备:
[教师]
药品:氢氧化钠固体、蒸馏水、石蕊试液、酚酞试液、一瓶二氧化碳、氢氧化钠溶液、硫酸铜溶液、氯化铁溶液。
仪器:试管、表面皿、点滴板、胶头滴管、气球、双孔橡皮塞、试管夹、酒精灯。
用品:多媒体课件(展示有关实验要求及思考题)、叶脉书签。
[学生]
有关课外资料、预习资料。
氢氧化钠的性质和用途
用途
氢氧化钠NaOH
物理性质化学性质:1、氢氧化钠溶液与酸碱指示剂的反应
2、氢氧化钠溶液和二氧化碳的反应
2NaOH + CO2 = Na2CO3+ H2O
3、氢氧化钠溶液与硫酸铜溶液、
氯化铁溶液的反应
2NaOH+CuSO4= Na2SO4 + Cu(OH)2↓
3NaOH+ FeCl3= 3NaCl+ Fe(OH)3↓
八、随堂练习:(3~5分钟的练习题)
1、用托盘天平称量固体烧碱时,烧碱应放在()
(1)烧杯中(2)纸上(3)右盘上(4)左盘上
A、(1)(3)
B、(2)(3)
C、(1)(4)
D、(2)(4)
2、下列气体中,不能用氢氧化钠固体进行干燥的是()
A、O2
B、H2
C、CO
D、CO2
3、若向无色的氢氧化钠溶液中滴加紫色石蕊试液,则溶液的颜色呈;若是向无色的
氢氧化钠溶液中滴加的是无色的酚酞试液,则溶液的颜色呈。
4、在表面皿上放一些固体烧碱露置在空气中,可以观察到烧碱表面先变潮湿,过一段时间,表面又出现白色粉末。
发生上述变化的原因是,反应的化学方程式为。
5、我国古代纺织业常用氢氧化钾作漂洗的洗涤剂,前人将贝壳灼烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用,即可制得氢氧化钾,请用化学方程式表示上述过程。
九、教学反思:
本课内容通过实验来探究氢氧化钠的性质,采用小组合作,运用多种方法获取信息。
从学生已有的经验和知识入手,增加感知实例,培养学生主动地与他人交流、合作的意识,并且能清楚地表达自己的观点,逐步形成良好的学习习惯。
教师不失时机地进行引导,尽可能让学生多思考,多动手做实验,让学生能根据已知来主动探究未知,在自主探究中理解知识、提高能力,从而对本节内容有较深的认识。