溶剂效应图解
- 格式:docx
- 大小:228.94 KB
- 文档页数:2


溶剂的拉平效应与区分效应
溶剂是化学反应中不可或缺的一部分,它可以影响反应的速率、选择性和产物的性质等。
在溶液中,溶剂分子与反应物或产物分子之间发生相互作用,这种相互作用可以分为拉平效应和区分效应。
一、拉平效应
拉平效应是指溶剂分子对反应物或产物分子的空间取向进行调整,使得它们更容易相互接触和反应。
这种效应通常发生在极性溶剂中,因为极性溶剂分子具有极性键和极性分子中心,可以与反应物或产物分子中的极性键或极性分子中心形成氢键、离子键或范德华力等相互作用。
例如,在水中,氨分子可以与水分子形成氢键,使得氨分子的氢原子朝向水分子的氧原子,氨分子的氮原子朝向水分子的氢原子,从而使得氨分子的空间取向更加有序,更容易与其他反应物或产物分子发生反应。
二、区分效应
区分效应是指溶剂分子对反应物或产物分子的化学性质进行调整,使得它们在反应中表现出不同的活性和选择性。
这种效应通常发生在非极性溶剂中,因为非极性溶剂分子不具有极性键和极性分子中心,不能与反应物或产物分子形成氢键、离子键或范德华力等相互
作用。
例如,在苯中,苯酚和苯胺的活性和选择性有所不同。
苯酚可以与苯分子形成氢键,使得苯酚分子的羟基更容易被质子化,从而表现出更强的酸性。
而苯胺则不能与苯分子形成氢键,使得苯胺分子的氨基更容易被质子化,从而表现出更强的碱性。
溶剂的拉平效应和区分效应是化学反应中不可忽视的因素,它们可以影响反应的速率、选择性和产物的性质等。
因此,在进行化学反应时,需要考虑溶剂的选择和使用条件,以充分利用溶剂的作用,实现反应的最佳效果。


溶剂概述和溶剂效应摘要:对化学反应中溶剂的种类和作用做概述,以及溶剂效应在紫外,荧光,红外,核磁波谱和液相色谱中的作用。
关键词:溶剂溶剂效应吸收光谱液相色谱1,溶剂1.1溶剂的定义溶剂是一种可以溶化固体,液体或气体溶质的液体,继而成为溶液,最常用的溶剂是水。
1.2溶剂的分类溶剂按化学组成分为有机溶剂和无机溶剂有机溶剂是一大类在生活和生产中广泛应用的有机化合物,分子量不大,常温下呈液态。
有机溶剂包括多类物质,如链烷烃、烯烃、醇、醛、胺、酯、醚、酮、芳香烃、氢化烃、萜烯烃、卤代烃、杂环化物、含氮化合物及含硫化合物等等,多数对人体有一定毒性。
(本文主要概述有机溶剂在化学反应以及波谱中的应用)2,溶剂效应2.1溶剂效应的定义溶剂效应是指溶剂对于反应速率,平衡甚至反应机理的影响。
溶剂对化学反应速率常数的影响依赖于溶剂化反应分子和相应溶剂化过渡态的相对稳定性。
2.2溶剂效应在紫外,荧光,红外,核磁中的应用2.2.1溶剂效应在紫外吸收光谱中的应用[5]有机化合物紫外吸收光谱的吸收带波长和吸收强度,与所采用的溶剂有密切关系。
通常,溶剂的极性可以引起谱带形状的变化。
一般在气态或者非极性溶剂(如正己烷)中,尚能观察到振动跃迁的精细结构。
但是改为极性溶剂后,由于溶剂与溶质分子的相互作用增强,使谱带的精细结构变得模糊,以至完全消失成为平滑的吸收谱带。
这一现象称为溶剂效应。
例如,苯酚在正庚烷溶液中显示振动跃迁的精细结构,而在乙醇溶液中,苯酚的吸收带几乎变得平滑的曲线,如图所示2.2.1.1溶剂极性对n→π*跃迁谱带的影响[2]n→π*跃迁的吸收谱带随溶剂的极性的增大而向蓝移。
一般来说,从以环己烷为溶剂改为以乙醇为溶剂,会使该谱带蓝移7nm:如改为以极性更大的水为溶剂,则将蓝移8nm。
增大溶剂的极性会使n→π*跃迁吸收谱带蓝移的原因如下:会发生n→π*跃迁的分子,都含有非键电子。
例如C=O在基态时碳氧键极化成Cδ+=Oδ-,当n电子跃迁到π*分子轨道时,氧的电子转移到碳上,使得羰基的激发态的极性减小,即Cδ+=Oδ-(基态)→C=O(激发态)。

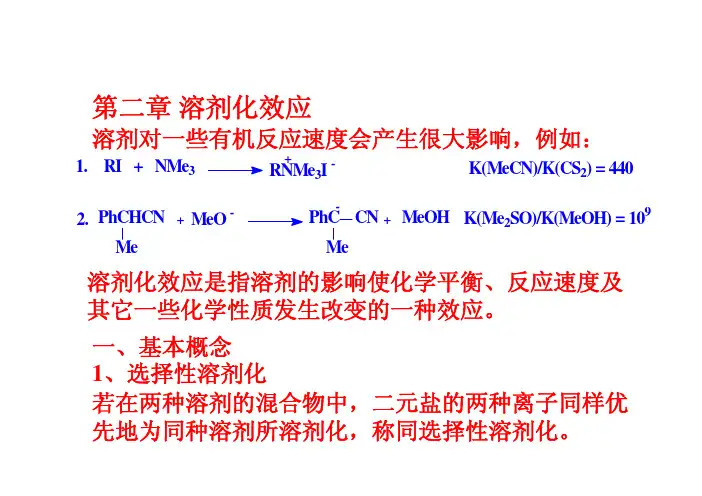
例:CaCl在水-甲醇体系中,Ca2+和Cl–都优先被2水溶剂化。
如阳离子优先被一种溶剂溶剂化,而阴离子优先被另一种溶剂溶剂化,则称异选择性溶剂化。
例:硝酸银在乙腈-水体系中,Ag+优先被乙腈溶剂-优先被水溶剂化。
化, 而NO32、溶剂和溶质分子间的相互作用第一类包括定向诱导力和色散力,这些力是非特异性的,不可能完全饱和。
第二类包括氢键力和电荷转移力,或称电子对授受力。
这类作用有方向并且可以饱和生成化学计量的分子化合物。
C、偶极-诱导偶极力具有永久偶极矩的分子或离子能诱导邻近分子,产生诱导偶极矩,分子在被诱导的瞬间总是处于诱导偶极的方向,两者之间有吸引力。
非极性分子可极化率越大,诱导偶极矩也越大。
这对偶极分子和离子在非极性溶剂中的体系最重要。
D、瞬间偶极-诱导偶极力(色散力〕非极性分子由于电子不断运动,会瞬间产生小的偶极矩,它使邻近分子产生脉冲性极化,从而产生分子间的相互吸引力,这称为色散力。
在两个键已饱和的分子间形成一个附加的成键作用必须是在电子给体分子中存在一个能量足够高的已占据分子轨道,而在电子受体分子中存在一个能量足够底的未占据分子轨道。
3、溶剂的极性和分类(1)质子性溶剂(2)极性非质子性溶剂(3)非极性溶剂量度溶剂极性的标准:(1)偶极矩u常见有机溶剂分子偶极矩的数值在0-5.5D, 在不存在特异性溶质-溶剂间相互作用时,分子极性大小与偶极矩大小一致。
溶剂极性加大,K T 值降低,cis-烯醇式减少。
因为:1、在两种互变异构体中,烯醇式极性较小。
分子内氢键的形成降低羰基偶极-偶极斥力,而在酮式中,这种斥力使其极性加大。
2、分子内氢键使烯醇稳定化,溶剂极性加大,分子间氢键加强,分子内氢键被削弱,烯醇含量减少。
烯醇含量与1,3-二羰基化合物浓度有关。
当偶极性的1,3-二羰基化合物用非极性溶剂稀释,溶剂与羰基作用弱,两羰基偶极斥力大,不稳定;烯醇与溶剂分子间氢键弱,分子内氢键强,烯醇含量增高。




样品溶剂效应很多因素可以导致峰形变差。
样品溶液的组成与进样体积很可能就是导致此种现象的原因。
问题色谱图上较早洗脱的峰扭曲变形或者开叉,与此同时较晚洗脱的峰则较为尖锐与对称,这些现象显示一个比较特殊的起因――样品溶液的溶剂很可能强于流动相。
此种强溶剂效应的例子在图10-1A中可见。
此处的样品溶液的溶剂是100%乙腈(100%的强溶剂),而流动相的组成则较弱,18%的乙腈与72%的水。
第一个峰是开叉的,并且与第二个峰相比,明显地变宽了。
当样品溶液的溶剂变成流动相时,所有的峰形都改善了,且变得尖锐。
见图10-1B。
解释当样品进样时,有可能出现峰展宽,最佳的样品溶液组成和体积将会保持在10%甚至更低,在这个例子里,当样品溶剂与流动相溶剂强度不同时,换句话来说,也就是样品未用流动相溶解,因此,有些样品分子溶解在强溶剂(100%ACE),并随强溶剂流过柱子,而有些则溶解在流动相中,从而导致峰分叉.当样品与流动相强度相差较小,进样影响也会小,第一个峰可能会宽于第二个峰,而当这种展宽导致必要的分离度降低时,这样情况应引起注意,在图10-2A中,使用一根短柱,和5UL进样,这与最佳进样体积4UL相近,用了极性更强的溶剂导致分离度明显的降低,从2.1降到1.5(如图10-2B),分离度为2或更大是评估一个完善方法的一个必要参数,也是每天方法的验证参数,1.5只是一个基本的分离度,任何一个方法或一根柱子都必需满足这个条件,当进样为一倍时,也就是10UL时,分离度更一步降低,此方法就不行了溶剂峰未用流动相溶解的样品溶剂峰还是会有点的。
流动相也出峰的,基线就是稳定流速下的流动相通过检测池的吸收度,即流动相中各物质的混合吸收度。
理论上来说,只要进入检测池中的物质浓度发生变化,吸收即会发生变化。
因此当你进样时,由于单位时间通过检测池的流动相的量发生了变化,那么相应的吸收度也会发生变化,因此在你的色谱图中的表征就是出峰了。
这也就是通常液相色谱中的死保留时间或死体积的表征。

液相色谱分离的溶剂效应“溶剂效应”会致使哪些峰形异样?如何幸免溶剂效应?在HPLC分析中样品溶剂的选择和流动相是如何的联系?为何建议利用流动相溶解样品?。
一系列的问题都和样品溶剂的选择紧密相关,如何解决真正的溶剂效应问题,又如何分辨哪些是非溶剂效应问题,不同的问题有不同的解决方式,有哪些先辈留下的实战体会可供分享呢?一路来看看吧!什么是溶剂效应?样品溶液的溶剂强度强于流动相溶剂强度时可能会造成的峰展宽、峰分叉现象。
即色谱图上较早洗脱的峰前沿或开叉,与此同时较晚洗脱的峰那么较为正常的现象。
例如样品溶液的溶剂是100%乙腈(100%的强溶剂),而流动相的组成那么较弱,18%的乙腈与72%的水。
第一个峰是开叉的,而且与第二个峰相较,明显地变宽了。
当样品溶液的溶剂变成流动相时,所有的峰形都改善了,且变得尖锐。
可能发生溶剂效应的情形:●出峰时刻早;●保留弱;●进样量大。
用流动相溶解样品能够取得专门好的峰形当溶解样品的溶剂不同于流动相时,样品溶剂与流动相发生混合,样品溶剂被冲稀。
若是进样溶剂之强度高于流动相,样品在刹时会表现为在较强溶剂中,并以较快速度通过色谱柱。
表此刻色谱图上确实是∶色谱峰的保留时刻缩短。
`当进样溶剂与流动相混合时,一部份分子会先与流动相混合,致使这些分子通过色谱柱的速度发生转变,使峰形扭曲,发生变形。
洗脱较早的色谱峰峰变形要比洗脱晚的色谱峰严峻。
解决进样溶剂问题的关键是使进样体积足够小,如此稀释进程会超级快;或利用比流动相弱的溶剂溶解样品。
较弱的溶剂会使样品在色谱柱上发生浓缩,在某些情形下,色谱峰会比利用较强溶剂时窄一些。
因此,在通常情形下,若是溶解样品的溶剂比流动相强,进样体积应不高于25mL。
进样体积大小与进样溶剂与流动相之间的不同大小有关。
这一不同很容易凭体会取得∶慢慢加大进样体积,直至发生峰变形现象。
采纳比发生峰变形时小一些的进样体积即可。
问题中发生的峰变形确实是因为溶解样品的溶剂甲醇强度远远高于流动相,因此取得了变形的、展宽的峰。
溶剂效应图解
图解很好!
其实是样品,样品溶剂,流动相和固定相综合作用的关系.当样品在样品溶剂中的相对溶解度大于在流动相时(可以理解为样品溶剂的洗脱能力大于流动相),样品就更喜欢在样品溶剂中,并很想随之流动.但同时与固定相的强作用只能使之形成追赶样品溶剂的效果.最终导致前延峰或裂峰的出现.(如图2:高溶解性溶剂).但当样品与固定相作用很弱时,大部分样品可能会赶上样品溶剂,但又由于与固定相的弱作用,导致其不可能与样品溶剂同时流出,最终导致拖尾峰的出现.
这也就是为什么在一般反相色谱中要用低有机相(比流动相低)溶解样品的原因!其效果就如图1:低溶解性溶剂
样品溶剂效应
很多因素可以导致峰形变差。
样品溶液的组成与进样体积很可能就是导致此种现象的原因。
问题
色谱图上较早洗脱的峰扭曲变形或者开叉,与此同时较晚洗脱的峰则较为尖锐与对称,这些现象显示一个比较特殊的起因――样品溶液的溶剂很可能强于流动相。
此种强溶剂效应的例子在图10-1A中可见。
此处的样品溶液的溶剂是100%乙腈(100%的强溶剂),而流
动相的组成则较弱,18%的乙腈与72%的水。
第一个峰是开叉的,并且与第二个峰相比,明显地变宽了。
当样品溶液的溶剂变成流动相时,所有的峰形都改善了,且变得尖锐。
见图10-1B。
解释
当样品进样时,有可能出现峰展宽,最佳的样品溶液组成和体积将会保持在10%甚至更低,在这个例子里,当样品溶剂与流动相溶剂强度不同时,换句话来说,也就是样品未用流动相溶解,因此,有些样品分子溶解在强溶剂(100%ACE),并随强溶剂流过柱子,而有些则溶解在流动相中,从而导致峰分叉.
当样品与流动相强度相差较小,进样影响也会小,第一个峰可能会宽于第二个峰,而当这种展宽导致必要的分离度降低时,这样情况应引起注意,在图10-2A中, 使用一根短柱,和5UL进样,这与最佳进样体积4UL相近,用了极性更强的溶剂导致分离度明显的降低,从2.1降到1.5(如图10-2B),分离度为 2 或更大是评估一个完善方法的一个必要参数,也是每天方法的验证参数,1.5只是一个基本的分离度,任何一个方法或一根柱子都必需满足这个条件,当进样为一倍时,也就是10UL时,分离度更一步降低,此方法就不行了
尽量用流动相去溶解样品,如果样品在流动相中溶解性差不得不用强溶剂溶解,那就尽量减少进样量。