高等有机第二章-溶剂化效应
- 格式:pdf
- 大小:141.15 KB
- 文档页数:19
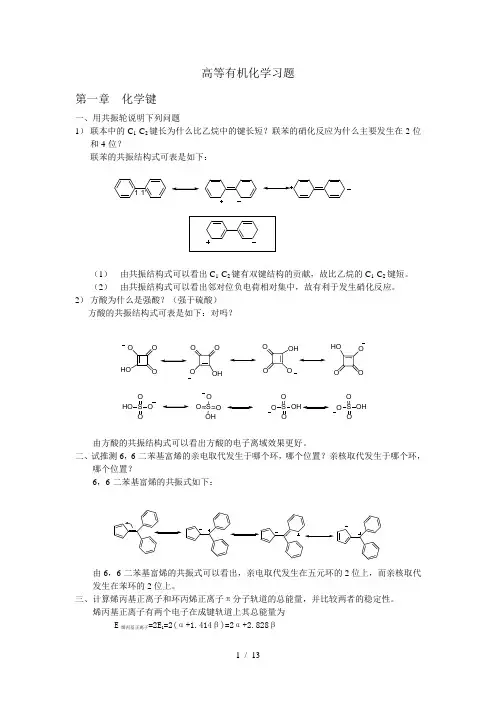
高等有机化学习题第一章 化学键一、用共振轮说明下列问题1) 联本中的C 1-C 2键长为什么比乙烷中的键长短?联苯的硝化反应为什么主要发生在2-位和4-位?联苯的共振结构式可表是如下:(1) 由共振结构式可以看出C 1-C 2键有双键结构的贡献,故比乙烷的C 1-C 2键短。
(2) 由共振结构式可以看出邻对位负电荷相对集中,故有利于发生硝化反应。
2) 方酸为什么是强酸?(强于硫酸) 方酸的共振结构式可表是如下:对吗?由方酸的共振结构式可以看出方酸的电子离域效果更好。
二、试推测6,6-二苯基富烯的亲电取代发生于哪个环,哪个位置?亲核取代发生于哪个环,哪个位置?6,6-二苯基富烯的共振式如下:由6,6-二苯基富烯的共振式可以看出,亲电取代发生在五元环的2位上,而亲核取代发生在苯环的2位上。
三、计算烯丙基正离子和环丙烯正离子π分子轨道的总能量,并比较两者的稳定性。
烯丙基正离子有两个电子在成键轨道上其总能量为 E 烯丙基正离子=2E 1=2(α+1.414β)=2α+2.828β11'O HO O O O OH O O O OH O O OHO O O O S O O HO O S O O OH O S O O O S OOOH环丙烯正离子有两个电子在成键轨道上其总能量为 E 环丙烯正离子=2E 1=2(α+2β)=2α+2β 能量差值为E 烯丙基正离子- E 环丙烯正离子=(2α+2.828β)- (2α+2β)=0.828β 因此,环丙烯正离子比烯丙基正离子稳定。
四、用HMO 法分别说明烯丙基负离子和环丙烯负离子的电子排布和成键情况,并比较两者稳定性。
五、简要说明1)吡咯和吡啶分子的极性方向相反,为什么?吡咯分子中氮原子给出一对为共用电子参与了共轭分子的大π键,也就是电子从氮原子流向五员环,而吡啶分子中氮原子只拿出一个电子参与共轭,并且氮原子的电负性大于碳原子使电子流向氮原子的方向。
因此,两个分子的极性正好相反。



有机化学中的溶剂化效应——溶剂对反应历程和立体化学的影响作者:蒙慧芹来源:《赤峰学院学报·自然科学版》 2011年第6期蒙慧芹(赤峰学院化学化工学院,内蒙古赤峰 024000)摘要:有机化学反应大多数是在溶剂中进行的,溶剂对化学反应起着非常重要的作用.在已知的300多种溶剂和无数混合溶剂中,选择适当溶剂作为反应场所与选择合适的催化剂相比,具有更重要的意义.本文主要介绍了溶剂的分类和极性,有选择地讨论了某些反应,当改变溶剂时,将引起这些反应在反应历程和立体化学方面的变化.关键词:溶剂;反应历程;立体化学;影响中图分类号:O621文献标识码:A文章编号:1673-260X(2011)06-0001-03许多化学反应是在溶剂中进行的,溶剂在有机化学中的应用十分普遍,它不仅影响着反应平衡及反应速率,而且对反应历程和立体化学也有着重大影响.那么溶剂具有怎样的分类,以及决定溶剂极性的参数有那些?它们对有机反应历程和立体化学有什么影响?分别讨论如下:1关于溶剂的分类和极性1.1溶剂的分类溶剂的数量繁多,有各种对溶剂进行分类的方法,通常从以下四个方面对溶剂加以分类:1.1.1按照溶剂的化学结构把溶剂分为烃类、卤代烃类、醇类、酯类、胺类等等.1.1.2按照溶剂的酸碱性把溶剂分为酸性溶剂、碱性溶剂、中性溶剂等等.1.1.3按照溶剂的物理性质如:根据沸点、相对密度、粘度、极性等分类.1.1.4按照溶剂与溶质的专属作用把溶剂分类.专属作用是指溶剂与溶质间的相互作用,包括氢键、电子授受、电荷转移等.后两种分类体系较为科学,更能反映其实质,是目前常用的分类方法.若将它们结合起来,可把溶剂分为以下四类:极性溶剂、非极性溶剂、质子型溶剂和非质子型溶剂.1.2溶剂的极性溶剂的极性有很多量度方法,长期以来,溶剂极性的大小,常以偶极矩值(μ)和介电常数(ε)来量度.有机溶剂的永久偶极矩处于0到18.3×10-30c·m(0到5、5D)之间.从烃类溶剂到含有极性基团的溶剂,其偶极矩值逐步提高.有机溶剂的介电常数一般为2~190.通常认为ε>15,偶极矩大于8.34×10-30c·m(2、5D)为极性溶剂,若ε<15,偶极矩处于0~6.67-30c·m(0~2D)的溶剂为非极性溶剂.表1列出了一些溶剂的介电常数.2溶剂对反应历程和立体化学的影响2.1溶剂对亲核取代反应的影响饱和碳原子上的亲核取代反应有两种典型的历程:单分子亲核取代反应(SN1)历程和双分子亲核取代反应(SN2)历程.SN1反应历程:SN1反应是分两步进行的,第一步是控制反应速率的一步,即慢的一步.在这一步中极性较小的底物分子逐渐发生化学键的解离,形成极性较大的过渡态,最后离解成碳正离子,即在反应过程中极性加大,增加溶剂的极性有利于过渡态的形成.溶剂与分子或离子通过静电力而结合的作用叫做溶剂化作用.溶剂与SN1反应的过渡态有偶极-偶极相互作用,即溶剂化作用.底物在形成过渡态时需要能量,此能量可由溶剂与过渡态偶极-偶极相互作用时所释放的能量提供,因此溶剂的极性大,溶剂化的力量也大,提供的能量也大,离解就能很快进行.SN2反应历程:SN2反应是同步进行的协同反应,溶剂对SN2反应历程的影响比较复杂.当正离子与中性试剂、中性底物与负离子、正离子与负离子反应时,由于生成的过渡态中没有离子存在,电荷得到了分散和消失.因此增加溶剂极性,不利于过渡态的形成,使反应速率降低.反之,当中性底物与中性试剂反应时,生成的过渡态反而比底物的电荷增加.因此,增加溶剂极性,有利于过渡态的形成,使反应速率增加.如下列为中性底物与负离子的反应历程:在形成过渡态时,由电荷比较集中的亲核试剂变成电荷比较分散的过渡态,亲核试剂的一部分负电荷通过R传给了L,过渡态的负电荷比较分散,不如亲核试剂集中,因而过渡态的极性不如亲核试剂大,增加溶剂的极性,使极性大的亲核试剂溶剂化,而不利于SN2过渡态的形成.在反应a中,溶剂乙醚的极性低,有利于反应按SN2历程进行,所以亲核试剂碘离子向位阻小的甲基进攻,生成了碘甲烷和叔丁醇在反应b中,溶剂水的极性高,有利于反应按SN1历程进行,因而生成了甲醇和叔丁基碘:2.2溶剂对亲电加成反应的影响烯烃的亲电加成也有两种典型的历程,即碳正离子中间体历程和环状鎓离子历程.碳正离子历程:在CH3NO2溶剂中,反式加成:顺式加成,1:9在CCI4溶剂中,反式加成:顺式加成,10:1在强极性的溶剂硝基甲烷(介电常数为36)中,碳正离子由于较强的溶剂化作用而比溴鎓离子稳定,因而以顺式加成产物为主.在弱极性的溶剂四氯化碳(介电常数为2.2)中,由于溶剂化作用微弱,所以溴鎓离子比碳正离子稳定,于是得到反式加成为主的产物.炔烃与卤素的亲电加成类似与烯烃,在不同溶剂中进行炔烃的亲电加成反应时,加成的立体化学也不同.例如,苯乙炔与溴的加成在不同的溶剂中生成的产物比例如下:实例3[3]2.3溶剂对环加成反应的影响在光化学诱导的[2+2]环加成反应中,立体化学也受溶剂极性的影响.实例4[4]当溶剂的极性提高时,反向/顺向产物的比例随之降低,这是由于溶剂的极性愈强,将愈强烈地使活化配合物溶剂化,导致偶极性的顺向产物的增加.2.4溶剂对Wittig反应的影响在Wittig反应中,生成的烯烃如有顺、反异构体时,溶剂对所产生异构体的比例也有很大影响.经研究证明:反应在极性溶剂中进行,有利于顺式异构体的生成;在非极性溶剂中进行,则有利于反式异构体的生成.这个原理已在昆虫激素的生产实践上得到成功的应用.例如:组成.当反式比例占10%左右时,诱蛾活性最高.过去,按乙炔路线合成时,需先分别合成顺、反两种异构体,再按一定比例混合,路线长,手续麻烦.中国科学院、北京动物研究所用Wittig反应来合成梨小食心虫性外激素,找到了最有利的反应溶剂条件,使产物中的顺反构型产物正好占88%,田间试验表明具有最大的诱蛾活性.这就大大缩短了合成路线,降低了成本,使梨小食心虫性外激素在生产上得到推广使用.3结论综上所述,在有机化学反应中,溶剂不仅影响着反应历程,而且对立体化学也有着重要的影响.因此在有两种和多种可供选择的反应途径中,可通过选择适当溶剂,使反应按某一途径进行,得到高效的产物.参考文献:〔1〕丁新腾,黄乃聚.有机化学[M].高等教育出版社,1985.〔2〕南京大学化学系有机化学教研室主编.有机化学(下册).人民教育出版社,1979. 〔3〕尹冬冬.有机化学(下册)[M].高等教育出版社,2006.〔4〕陈光旭.有机化学专题论(一)[M].北京师范大学出版社,1987.。





例:CaCl
在水-甲醇体系中,Ca2+和Cl–都优先被
2
水溶剂化。
如阳离子优先被一种溶剂溶剂化,而阴离子优先被另一种溶剂溶剂化,则称异选择性溶剂化。
例:硝酸银在乙腈-水体系中,Ag+优先被乙腈溶剂-优先被水溶剂化。
化, 而NO
3
2、溶剂和溶质分子间的相互作用
第一类包括定向诱导力和色散力,这些力是非特异性的,不可能完全饱和。
第二类包括氢键力和电荷转移力,或称电子对授受力。
这类作用有方向并且可以饱和生成化学计量的分子化合物。
C、偶极-诱导偶极力
具有永久偶极矩的分子或离子能诱导邻近分子,产生诱导偶极矩,分子在被诱导的瞬间总是处于诱导偶极的方向,两者之间有吸引力。
非极性分子可极化率越大,诱导偶极矩也越大。
这对偶极分子和离子在非极性溶剂中的体系最重要。
D、瞬间偶极-诱导偶极力(色散力〕
非极性分子由于电子不断运动,会瞬间产生小的偶极矩,它使邻近分子产生脉冲性极化,从而产生分子间的相互吸引力,这称为色散力。
在两个键已饱和的分子间形成一个附加的成键作用必须是在电子给体分子中存在一个能量足够高的已占据分子轨道,而在电子受体分子中存在一个能量足够底的未占据分子轨道。
3、溶剂的极性和分类
(1)质子性溶剂
(2)极性非质子性溶剂
(3)非极性溶剂
量度溶剂极性的标准:
(1)偶极矩u
常见有机溶剂分子偶极矩的数值在0-5.5D, 在不存在特异性溶质-溶剂间相互作用时,分子极性大小与偶极矩大小一致。
溶剂极性加大,K T 值降低,cis-烯醇式减少。
因为:1、在两种互变异构体中,烯醇式极性较小。
分子内氢键的形成降低羰基偶极-偶极斥力,而在酮式中,这种斥力使其极性加大。
2、分子内氢键使烯醇稳定化,溶剂极性加大,分子间氢键加强,分子内氢键被削弱,烯醇含量减少。
烯醇含量与1,3-二羰基化合物浓度有关。
当偶极性的1,3-二羰基化合物用非极性溶剂稀释,溶剂与羰基作用弱,两羰基偶极斥力大,不稳定;烯醇与溶剂分子间氢键弱,分子内氢键强,烯醇含量增高。
用偶极溶剂稀释,烯醇含量降低。
溶剂影响反应速率的定性理论-休斯-英戈尔德(Hughes-Ingold)规则:
1、如活化络合物比反应物具有更大电荷密度,则提高溶剂极性将使反应速度加快。
2、活化络合物比反应物电荷密度小,则提高溶剂极性将使反应速度降低。
3、如从反应物到活化络合物的转变电荷密度变化很小或没有变化,则溶剂改变对反应速率影响很小。