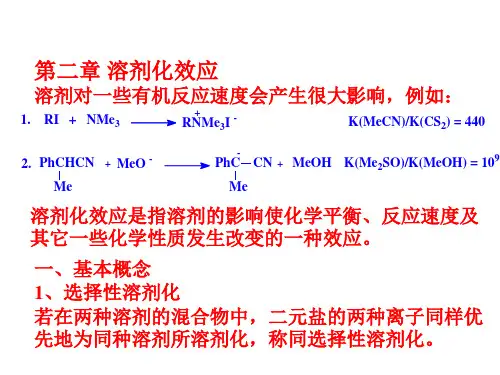
溶剂的分类及溶剂化作用
- 格式:pdf
- 大小:985.10 KB
- 文档页数:10

溶剂概述和溶剂效应摘要:对化学反应中溶剂的种类和作用做概述,以及溶剂效应在紫外,荧光,红外,核磁波谱和液相色谱中的作用。
关键词:溶剂溶剂效应吸收光谱液相色谱1,溶剂1.1溶剂的定义溶剂是一种可以溶化固体,液体或气体溶质的液体,继而成为溶液,最常用的溶剂是水。
1.2溶剂的分类溶剂按化学组成分为有机溶剂和无机溶剂有机溶剂是一大类在生活和生产中广泛应用的有机化合物,分子量不大,常温下呈液态。
有机溶剂包括多类物质,如链烷烃、烯烃、醇、醛、胺、酯、醚、酮、芳香烃、氢化烃、萜烯烃、卤代烃、杂环化物、含氮化合物及含硫化合物等等,多数对人体有一定毒性。
(本文主要概述有机溶剂在化学反应以及波谱中的应用)2,溶剂效应2.1溶剂效应的定义溶剂效应是指溶剂对于反应速率,平衡甚至反应机理的影响。
溶剂对化学反应速率常数的影响依赖于溶剂化反应分子和相应溶剂化过渡态的相对稳定性。
2.2溶剂效应在紫外,荧光,红外,核磁中的应用2.2.1溶剂效应在紫外吸收光谱中的应用[5]有机化合物紫外吸收光谱的吸收带波长和吸收强度,与所采用的溶剂有密切关系。
通常,溶剂的极性可以引起谱带形状的变化。
一般在气态或者非极性溶剂(如正己烷)中,尚能观察到振动跃迁的精细结构。
但是改为极性溶剂后,由于溶剂与溶质分子的相互作用增强,使谱带的精细结构变得模糊,以至完全消失成为平滑的吸收谱带。
这一现象称为溶剂效应。
例如,苯酚在正庚烷溶液中显示振动跃迁的精细结构,而在乙醇溶液中,苯酚的吸收带几乎变得平滑的曲线,如图所示2.2.1.1溶剂极性对n→π*跃迁谱带的影响[2]n→π*跃迁的吸收谱带随溶剂的极性的增大而向蓝移。
一般来说,从以环己烷为溶剂改为以乙醇为溶剂,会使该谱带蓝移7nm:如改为以极性更大的水为溶剂,则将蓝移8nm。
增大溶剂的极性会使n→π*跃迁吸收谱带蓝移的原因如下:会发生n→π*跃迁的分子,都含有非键电子。
例如C=O在基态时碳氧键极化成Cδ+=Oδ-,当n电子跃迁到π*分子轨道时,氧的电子转移到碳上,使得羰基的激发态的极性减小,即Cδ+=Oδ-(基态)→C=O(激发态)。




溶剂化作用溶剂效应(solvent effect)亦称“溶剂化作用”。
指液相反应中,溶剂的物理和化学性质影响反应平衡和反应速度的效应。
溶剂化本质主要是静电作用。
对中性溶质分子而言,共价键的异裂将引起电荷的分离,故增加溶剂的极性,对溶质影响较大,能降低过渡态的能量,结果使反应的活化能减低,反应速度大幅度加快。
了解溶剂效应,有助于研究有机物的溶解状况和反应历程。
基本简介对于等极性过滤态和自由基过滤态反应,溶剂效应较小;对于偶极过渡态反应,溶剂效应较大,例如非质子偶极溶剂的特点是正端藏于分子内部,负端露于分子外部,负端可以与正离子起作用,而正端却不能与负离子起作用,因此,在非质子溶剂中,用负离子作为试剂时,由于它不被溶剂分子包围,可以很容易地进行反应,成为加快反应速度的重要手段。
溶剂效应对反应的影响的关注历史悠久。
不同的溶剂可以影响反应速率,甚至改变反应进程和机理,得到不同的产物。
溶剂对反应速率的影响十分复杂,包括反应介质中的离解作用、传能和传质、介电效应等物理作用和化学作用,溶剂参与催化、或者直接参与反应(有人不赞成将溶剂参与反应称作溶剂效应)。
溶剂效应溶剂效应的模拟通常我们对溶剂效应的静态模拟,关心的是溶剂效应的两个方面:一是溶剂分子反应中心有键的作用,包括配位键和氢键等,这种作用属于短程作用,另一个是极性溶剂的偶极距和溶质分子偶极距之间的静电相互作用,这个属于远程作用,当然溶剂和溶质之间的色散力作用也是重要的远程作用,特别是对于非极性溶剂而言,但是色散力的描述是量子化学模拟的一个难题。
高斯计算时,考虑溶剂效应,可以采用三种策略:对于短程作用十分重要的体系,我们采用microsolvation model,或者称为explicit Solvation model。
直接考虑溶剂分子和反应中心的作用。
对于没有短程作用的体系,我们直接用虚拟溶剂模型(Implicit Solvation Model)来模拟远程作用。

溶剂用途分类溶剂是一种能够溶解其他物质的介质,广泛应用于各个领域。
根据其用途,可以将溶剂分为以下几类:1. 工业应用类:工业溶剂主要用于溶解、稀释、分离和提取工业原料、中间体和成品。
工业溶剂主要包括有机溶剂和无机溶剂两大类。
有机溶剂常用于油漆、涂料、胶粘剂、塑料、橡胶、香精味料等的制备过程中。
无机溶剂主要用于化工工业,如碱金属、碱土金属和铝的生产过程中。
2. 医药应用类:医药溶剂主要用于药物制剂和药物分析。
药物制剂中,溶剂用于溶解药物成分,使其变为液体或者是与其他成分进行混合。
药物分析中,溶剂用于溶解样品或者纯化药物标准品。
常见的医药溶剂有水、无水乙醇、环己烷等。
3. 冶金应用类:溶剂在冶金工业中主要用于提取金属。
例如,溶剂萃取法在铜冶炼中用于从硫化铜矿石中提取铜。
溶剂萃取法通过选择性溶解以及逆萃、萃取液的再生等过程,实现了铜的有效分离和提取。
4. 环境保护类:溶剂在环境保护领域中有许多应用。
例如,有机溶剂可以用于废水处理中的挥发性有机物的提取和回收;溶剂还可以用于土壤修复、大气污染控制以及废弃物管理等方面。
5. 实验室应用类:溶剂在实验室中广泛应用于溶解、稀释、制备溶液等实验操作。
实验室中常用的溶剂有乙醇、醚类、甲醇、二甲苯等。
6. 家居应用类:溶剂在家居生活中也有一定的应用。
例如,有机溶剂可以用于清洁玻璃、地板、家具、电器等日常用品;溶剂还可以用于除去油漆、胶水等污渍。
总结起来,溶剂的应用非常广泛,从工业生产到医药制剂,从冶金提取到环境保护,无处不见溶剂的身影。
不同用途的溶剂可能需要具备不同的性质,例如挥发性、毒性、溶解力强度等。
因此,在应用溶剂时需要根据具体需求选择适合的溶剂。

文献总结——溶剂对化学反应的影响应用化学08—2班殷金昌2008302052 溶剂对于反应速率、平衡甚至反应机理都有很重大的影响,绝大多数在溶剂中发生的有机化学反应,溶剂的性质对反应速率和反应平衡都是非常重要的。
溶剂可分极性溶剂和非极性溶剂,极性溶剂又可分为质子溶剂和非质子偶极溶剂。
溶剂效应对反应速度常数的影响依赖于溶剂化反应物分子和相应溶剂化过渡态的相对稳定性。
对于自由基过渡态反应,溶剂效应较小;对于偶极过渡态反应,溶剂效应较大,例如非质子偶极溶剂的特点是正端藏于分子内部,负端露于分子外部,负端可以与正离子起作用,而正端却不能与负离子起作用。
因此,在非质子溶剂中,用负离子作为试剂时,由于它不被溶剂分子包围,可以很容易地进行反应,成为加快反应速度的重要手段。
由此可见溶剂在化学反应过程中起了十分重要的作用。
溶剂对反应的影响也引起了广泛的关注.近年来,在实验研究溶剂效应对有机反应影响的基础上,理论研究也逐渐受到人们的关注。
1.溶剂效应对丙烯环氧化反应的影响溶剂效应是指溶剂对于反应速率、平衡甚至反应机理的影响。
在物理有机化学中,把溶剂效应的影响作为十分重要的一部分来进行研究和讨论,可见其对化学反应的重要性。
通过对甲醇、异丙醇和仲丁醇3种醇溶剂及丙酮、乙腈和四氢呋喃等有机溶剂中环氧化反应活性进行了研究。
实验结果活性顺序为:甲醇>异丙醇>仲丁醇>乙腈>丙酮>四氢呋哺。
以催化反应机理为基础。
通过电子效应、空间位阻效应、溶剂极性、物理扩散和分配、溶剂氧化副反应、环氧丙烷(P0)醚化副反应、催化剂失活和丙烯溶解度等多种因素分析了溶剂对环氧化反应的影响.其中溶剂极性是影响反应的重要因素。
采用不同的溶剂进行丙烯环氧化反应。
如甲醇、乙醇等对反应有利,丙烯环氧化反应活性较高;非质子溶剂则对反应不利,反应活性相对较低,以甲醇为溶剂时。
环氧丙烷容易与带活泼氢原子的甲醇发生开环反应141,生成大量丙二醇单甲醚。

溶剂溶剂是指能将其它物质溶解而形成均一相溶液体物质。
溶剂在液态涂料中起着很重要的作用,对涂料的粘度、光泽、流平性、润湿性、附着力等性能有很大的影响。
溶解:两种或两种以上的物质相组成一个相的过程叫溶解。
一般在一个相中应呈均匀状态,其构成成份的物质可以以分子或原子状态相互溶合,生成的相称为溶液。
在溶液中过量的成分叫溶剂,量少的成分叫溶质。
溶解作用是一个复杂的过程,其影响因素很多,一般表现在以下几个方面:(1)、相同分子、原子间的引力与不同分子、原子间引力的强弱关系。
(2)、分子极性(可引起缔合效应的程度)(3)、分子复合物的形成。
(4)、溶质、溶剂的分子结构、分子量。
(5)、溶剂化作用。
(6)、溶剂、溶质活性基团的种类与数目。
有机物普遍遵循“相似相溶”原理,即化学组成类似的物质互溶性好,极性溶剂易溶解极性物质。
另外,溶解的性能还受环境介质条件的影响。
涂料所用溶剂主要着眼于溶剂的以下五个特性:(1)、溶解力:即指溶质被分散和溶解的能力。
溶剂的溶解力应包括以下几个方面:a、将物质分散成小颗粒的能力b、溶解物质的速度c、将物质溶至某一浓度的能力d、溶解大多数物质的能力e、与稀释剂混合组成溶剂的能力溶剂对不同的树脂溶解力不一样,对某种树脂溶解力很强,而对另一种树脂溶解力却可能很小,甚至不溶,这便是溶剂对树脂溶解力的相对性、选择性、因此正确选用溶剂必须了解每种成膜物质相应的溶剂品种,否则用错溶剂会造成涂料的混浊、沉淀、析出、失光、甚至报废。
(2)、挥发速度:挥发速度是指溶剂从涂层中挥发到空气中的速度。
挥发速度受溶剂沸点、环境温度、有效挥发面积、溶剂本身的表面张力,蒸气压以及特定涂料体系的性质等因素的影响。
溶剂挥发速度和溶剂沸点有一定的判别关系:一般来讲,沸点低的溶剂比沸点高的溶剂挥发速度快。
故常用沸点的高低来大致区分溶剂挥发的快慢。
溶剂按沸点的高低分为三类:a、低沸点溶剂:沸点低于100℃。
如丙酮、乙醇、醋酸乙酯等。


溶剂概述和溶剂效应溶剂概述和溶剂效应摘要:对化学反应中溶剂的种类和作⽤做概述,以及溶剂效应在紫外,荧光,红外,核磁波谱和液相⾊谱中的作⽤。
关键词:溶剂溶剂效应吸收光谱液相⾊谱1,溶剂1.1溶剂的定义溶剂是⼀种可以溶化固体,液体或⽓体溶质的液体,继⽽成为溶液,最常⽤的溶剂是⽔。
1.2溶剂的分类溶剂按化学组成分为有机溶剂和⽆机溶剂有机溶剂是⼀⼤类在⽣活和⽣产中⼴泛应⽤的有机化合物,分⼦量不⼤,常温下呈液态。
有机溶剂包括多类物质,如链烷烃、烯烃、醇、醛、胺、酯、醚、酮、芳⾹烃、氢化烃、萜烯烃、卤代烃、杂环化物、含氮化合物及含硫化合物等等,多数对⼈体有⼀定毒性。
(本⽂主要概述有机溶剂在化学反应以及波谱中的应⽤)2,溶剂效应2.1溶剂效应的定义溶剂效应是指溶剂对于反应速率,平衡甚⾄反应机理的影响。
溶剂对化学反应速率常数的影响依赖于溶剂化反应分⼦和相应溶剂化过渡态的相对稳定性。
2.2溶剂效应在紫外,荧光,红外,核磁中的应⽤2.2.1溶剂效应在紫外吸收光谱中的应⽤[5]有机化合物紫外吸收光谱的吸收带波长和吸收强度,与所采⽤的溶剂有密切关系。
通常,溶剂的极性可以引起谱带形状的变化。
⼀般在⽓态或者⾮极性溶剂(如正⼰烷)中,尚能观察到振动跃迁的精细结构。
但是改为极性溶剂后,由于溶剂与溶质分⼦的相互作⽤增强,使谱带的精细结构变得模糊,以⾄完全消失成为平滑的吸收谱带。
这⼀现象称为溶剂效应。
例如,苯酚在正庚烷溶液中显⽰振动跃迁的精细结构,⽽在⼄醇溶液中,苯酚的吸收带⼏乎变得平滑的曲线,如图所⽰2.2.1.1溶剂极性对n→π*跃迁谱带的影响[2]n→π*跃迁的吸收谱带随溶剂的极性的增⼤⽽向蓝移。
⼀般来说,从以环⼰烷为溶剂改为以⼄醇为溶剂,会使该谱带蓝移7nm:如改为以极性更⼤的⽔为溶剂,则将蓝移8nm。
增⼤溶剂的极性会使n→π*跃迁吸收谱带蓝移的原因如下:会发⽣n→π*跃迁的分⼦,都含有⾮键电⼦。
例如C=O在基态时碳氧键极化成Cδ+=Oδ-,当n电⼦跃迁到π*分⼦轨道时,氧的电⼦转移到碳上,使得羰基的激发态的极性减⼩,即Cδ+=Oδ-(基态)→C=O(激发态)。
溶剂的分类与用途溶剂的品种类别很多,按其化学成分和来源可分为下列几大类:(1)萜烯溶剂:绝大部分来自松树分泌物。
常用的有松节油、松油等。
松节油对天然树脂和树脂的溶解能力大于普通的香蕉水,大于苯类。
其溶解速度相对较低,合乎油漆刷上及潮湿的建议。
(2)石油溶剂;这类溶剂属于烃类。
是从石油中分馏而得。
常用的有汽油、松香水、火油等。
汽油挥发速度极快,危险性大,一般情况下不用来作溶剂。
松香水是油漆中普遍采用的溶剂,其特点是毒性较小,一般用在油性漆和磁性漆中。
(3)煤焦溶剂:这类溶剂也属烃类。
就是将煤电炉而得。
常用的存有苯、甲苯、二甲苯等。
苯的溶解能力很强,就是天然干性油、树脂的强离溶剂,不能溶解虫胶,但毒性小,溶解慢,油漆中通常不常采用,通常并作洗涤剂;甲苯的溶解能力与苯相近,主要做为醇酸油漆溶剂,也可以并作环氧树脂、喷漆等的稀释剂用,少量用在洗涤剂中采用;二甲苯的溶解性略低于甲苯,溶解比甲苯快,毒性比苯大,可以替代松香水并作强力溶剂。
(4)脂类溶剂:是低碳的有机酸和醇的结合物,一般常用的有醋酸丁脂、乙酸乙脂、醋酸乙脂、醋酸戊脂等。
醋酸丁脂毒性大,通常用在喷漆中,易于施工,还可以避免树脂和硝酸纤维划出;醋酸乙脂熔化力比丁脂不好,常于醋酸丁脂采用在木器等硝酸纤维漆中;醋酸戊脂溶解较快,用在纤维油漆中能改良流干性和红肿性。
(5)酮类溶剂:它是一种有机溶剂,主要用来溶解硝酸纤维。
常用的有丙、甲乙酮、甲异丙酮、环路已酮、甲已酮等。
丙酮熔化力极强,溶解速度快能够以任何比例溶水,所以难变硬而并使漆膜干活后变浅、结皮。
通常与溶解快的溶剂氰化钠。
大多用在喷漆、快干黏合剂中。
但丙酮极容易冷却,用时应特别注意防雷;甲乙酮比丙酮溶解快,熔化力梢差,可以单独采用;甲异丙酮熔化力低,挥发性相对较低,避免漆膜红肿的能力很强;环路已酮溶解快,溶解性不好,可以并使漆膜在潮湿中构成明亮光滑的表面,避免气泡的产生。
(6)醇类溶剂:它是一种有机溶剂,能与水混合,常用的有乙醇、丁醇等。
溶剂化效应
溶剂化效应是指溶剂的添加而使表面张力减小的现象。
一般来讲,溶剂添加到水中会使水的表面张力降低,使液体更容易渗入细胞膜甚至其他细致的多孔介质中。
比如,当溶剂添加到水中,水的表面张力会降低,使液体更容易渗入细胞膜中,这可以简化药物的溶解过程,并使药物更容易进入细胞内,促进药物的吸收和作用。
此外,溶剂的添加也会减少表面张力,改变乳化系统的组成,改变乳化系统的稳定性,改变溶液的粘度,改变溶液的透明度,增加表面活性剂等。
因此,溶剂化效应是药物制剂准备过程中重要的因素,对药物的吸收、作用和稳定性也有重要的影响。
溶剂化结构阴离子溶剂-概述说明以及解释1.引言1.1 概述溶剂化结构、阴离子和溶剂在溶液中起着至关重要的作用。
溶剂化结构指的是溶质分子在溶剂中形成的有序结构,这种结构可以影响溶质的稳定性、活性和反应性。
阴离子是一种带有负电荷的离子,它在溶液中会与阳离子形成离子对,并影响溶液的性质。
而溶剂则是溶解物质的介质,不同的溶剂对溶质的溶解度、反应速率等都有影响。
本文将重点探讨溶剂化结构、阴离子和溶剂在溶液中的相互作用及影响。
通过对这些关键因素的深入研究,可以更好地理解溶解过程中的分子间相互作用机制,为进一步探索化学反应、生物过程等提供重要的理论基础。
1.2 文章结构文章结构部分主要包括引言、正文和结论三个部分。
在引言部分,作者会对文章进行简要的概述,介绍文章的目的和重要性。
正文部分是文章的主体部分,通常包括多个章节,详细讨论研究对象的相关内容。
结论部分则对研究结果进行总结,提出展望和结论,强调研究的重要性和可行性。
文章结构的设计旨在使读者能够清晰地了解文章的逻辑结构和研究思路,帮助读者理解作者的观点和研究成果。
1.3 目的本文旨在探讨溶剂化结构、阴离子和溶剂之间的相互作用关系,通过深入研究这些关键概念,揭示它们在化学反应和溶液中的重要作用。
通过对这些内容的分析和讨论,可以有助于我们更好地理解溶剂化过程和溶剂中的离子行为,从而为相关领域的研究提供理论支持和实践指导。
同时,本文也旨在促进对溶液化学和配合物化学的深入理解,为相关领域的研究和应用提供新的思路和方法。
最终目的是推动溶剂化结构研究和相关领域的发展,为化学领域的学术研究和实际应用做出贡献。
2.正文2.1 溶剂化结构溶剂化结构是指在溶液中,溶剂分子围绕着溶质分子形成的一种特定的空间结构。
这种结构在化学反应和物理性质中起着重要的作用。
溶剂分子通过静电作用、范德华力、氢键等相互作用与溶质分子发生作用,形成一个稳定的溶剂化层。
这个层结构既能稳定溶质分子的结构,也能影响溶质的反应活性。
溶剂化作用和水合作用溶剂化作用和水合作用是物质溶解过程中的两个重要概念。
它们描述了溶剂和溶质之间的相互作用,对于理解溶解过程和溶液的性质具有重要意义。
溶剂化作用是指溶剂分子与溶质分子之间的相互作用力。
在溶解过程中,溶剂分子与溶质分子之间的相互作用力会破坏溶质分子之间的相互作用力,使溶质分子从固态或液态转变为溶解态。
溶剂化作用的强弱决定了溶解过程的速度和程度。
溶剂化作用的强弱与溶剂分子和溶质分子之间的相互作用力有关。
当溶剂分子与溶质分子之间的相互作用力较强时,溶剂化作用也较强,溶解过程较快;当溶剂分子与溶质分子之间的相互作用力较弱时,溶剂化作用也较弱,溶解过程较慢。
水合作用是指溶质分子与水分子之间的相互作用力。
水分子是一种极性分子,由于其氧原子的电负性较高,使得水分子呈现部分正电荷和部分负电荷的特性。
当溶质分子中存在带正电荷或带负电荷的官能团时,水分子会与其发生氢键作用,形成溶质分子的水合物。
水合作用可以增强溶液的稳定性,并影响溶液的物理性质和化学性质。
例如,水合作用可以影响溶液的密度、电导率、折射率等物理性质,还可以影响溶液中的化学反应速率和平衡常数。
溶剂化作用和水合作用在生物体内起着重要作用。
生物体内的许多化学反应发生在水中,水的溶剂化和水合作用对于维持生物体内的稳定环境和生命活动至关重要。
在生物体内,溶剂化作用和水合作用可以影响溶质的分子结构和功能,调控生物化学反应的速率和方向。
因此,对于理解生物体内的化学过程和生命现象,溶剂化作用和水合作用的研究具有重要意义。
溶剂化作用和水合作用是溶解过程中的两个重要概念。
它们描述了溶剂和溶质之间的相互作用,对于理解溶解过程和溶液的性质具有重要意义。
在生物体内,溶剂化作用和水合作用对于维持生物体内的稳定环境和生命活动至关重要。
通过深入研究溶剂化作用和水合作用,我们可以更好地理解化学反应和生命现象的本质。