高中化学奥林匹克竞赛辅导讲座(1)
- 格式:doc
- 大小:418.50 KB
- 文档页数:23

高中化学竞赛专题讲座教案
主题:化学竞赛的基本知识和应试技巧
目标:通过本次讲座,学生将掌握化学竞赛的基本知识,了解常见的应试技巧,提高应试能力。
一、引言(5分钟)
介绍化学竞赛的重要性,激发学生对化学竞赛的兴趣。
二、化学竞赛的基本知识(15分钟)
1. 化学竞赛的类型及要求
2. 常见的竞赛题型和题材
3. 竞赛题目的难易度和分值分布
4. 常见的竞赛规则和注意事项
三、化学竞赛的应试技巧(20分钟)
1. 如何阅读和理解竞赛题目
2. 如何解答选择题和计算题
3. 如何运用化学知识和思维方法解答主观题
4. 如何高效备考和应对考试压力
四、实例分析与练习(20分钟)
结合真实的竞赛题目,分析解题思路和方法,引导学生进行练习和应用。
五、答疑与交流(10分钟)
学生对化学竞赛相关问题进行提问,老师进行答疑解惑,促进学生之间的交流与分享。
六、总结与展望(5分钟)
总结本次讲座的内容和收获,展望未来在化学竞赛中取得更好的成绩。
教学方法:讲授结合互动,理论联系实际,案例分析与实践操作相结合。
课后作业:学生自主复习,完成相关练习题目。
评价方法:学生的课堂参与度、讲座笔记、课后作业完成情况。
教学反思:通过本次讲座,希望学生能够了解化学竞赛的基本知识和应试技巧,提高应试能力,为参加化学竞赛做好充分准备。

全国高中化学奥林匹克竞赛辅导讲座-第1讲气体全国高中化学奥林匹克竞赛辅导讲座第1讲气体【竞赛要求】气体。
理想气体标准状态。
理想气体状态方程。
气体密度。
分压定律。
气体相对分子质量测定原理。
【知识梳理】一、气体气体、液体和固体是物质存在的三种状态。
气体的研究对化学学科的发展起过重大作用。
气体与液体、固体相比较,具有两个明显特点。
1、扩散性当把一定量的气体充入真空容器时,它会迅速充满整个容器空间,而且均匀分布,少量气体可以充满很大的容器,不同种的气体可以以任意比例均匀混合。
2、可压缩性当对气体加压时,气体体积缩小,原来占有体积较大的气体,可以压缩到体积较小的容器中。
二、理想气体如果有这样一种气体:它的分子只有位置而无体积,且分子之间没有作用力,这种气体称之为理想气体。
当然它在实际中是不存在的。
实际气体分子本身占有一定的体积,分子之间也有吸引力。
但在低压和高温条件下,气体分子本身所占的体积和分子间的吸引力均可以忽略,此时的实际气体即可看作理想气体。
三、理想气体定律1、理想气体状态方程将在高温低压下得到的波义耳定律、查理定理和阿佛加德罗定律合并,便可组成一个方程:pV= nRT (1-1)这就是理想气体状态方程。
式中p是气体压力,V是气体体积,n是气体物质的量,T是气体的绝对温度(热力学温度,即摄氏度数+273), R 是气体通用常数。
在国际单位制中,它们的关系如下表:表1-1 R的单位和值p V n T R国际单位制Pa m3 mol K 8.314 或</P><P> kPa dm3 mol K 8.314 </P><P>(1-1 )式也可以变换成下列形式:pV= RT (1-2)p = ?=则:=(1-3)式中m为气体的质量,M为气体的摩尔质量,为气体的密度。
对于一定量(n —定)的同一气体在不同条件下,则有:=(1-4)如果在某些特定条件下,将(1-1 )、(1-2 )和(1-3 )式同时应用于两种不同的气体时,又可以得出一些特殊的应用。

高中化学奥林匹克竞赛辅导讲座第15讲 生物分子化合物和高分子化合物初步 【竞赛要求】糖的基本概念。
葡萄糖、果糖、甘露糖、半乳糖。
糖苷。
纤维素与淀粉。
氨基酸、多肽与蛋白质的基本概念。
DNA 与RNA 。
【知识梳理】 一、糖类糖类物质是指多羟基醛或多羟基酮以及能水解生成多羟基醛或多羟基酮的化合物。
糖类可分为单糖、低聚糖和多糖。
(一)单糖1、单糖的组成及结构 (1)葡萄糖的组成及结构 ①链状结构式由元素分析和分子量测定确定了葡萄糖的分子式为C 6H 12O 6。
其平面结构式为:CH 2OHCHOHCHOHCHOHCHOHCHO其费歇尔投影式为:D –(+)–葡萄糖CHOCH 2OH OH OHHO OH HHH H在葡萄糖的投影式中,定位编号最大的手性碳原子上的羟基位于右边,按照单糖构型的D 、L 表示法规定,葡萄糖属于D – 型糖,又因葡萄糖的水溶液具有右旋性,所以通常写为D –(+)– 葡萄糖。
葡萄糖是已醛糖,分子中有4个手性碳原子,应有16个光学异构体,其中8个为D 型,8个为L 型。
2、变旋光现象及环状结构式变旋光现象:某些旋光性化合物的旋光度在放置过程中会逐渐上升或下降,最终达到恒定值而不再改变的现象。
实验发现,结晶葡萄糖有2种。
一种是从乙醇溶液中析出的晶体(熔点146℃),配成水溶液测得其比旋光度为+112度,通常称为α – D –(+)– 葡萄糖,该水溶液在放置过程中,其比旋光度逐渐下降到 +52.7度的恒定值;另一种是从吡啶溶液中析出的晶体(熔点150℃),配成水溶液测得其比旋光度为+19度,称为β – D –(+)– 葡萄糖,该水溶液在放置过程中,比旋光度逐渐上升到 +52.7度的恒定值。
上述实验现象用开链式结构难以解释。
人们提出:葡萄糖具有分子内的醛基与醇羟基形成半缩醛的环状结构。
由于六元环最稳定,故由C 5上的羟基与醛基进行加成,形成半缩醛,并构成六元环状结构,组成环的原子中除了碳原子外,还有一个氧原子。

高中化学奥赛讲座(一)烃的衍生物【竞赛要求】卤代烃、醇、酚、醚、醛、酮、酸、酯、胺、酰胺、硝基化合物、磺酸的基本性质及相互转化。
异构现象。
【知识梳理】一、卤代烃(一)卤代烃的化学反应卤代烃是烃分子中一个或多个氢原子被卤素原子取代后所生成的化合物。
卤代烃分子结构中含有C—X键,由于卤素的电负性比碳大,碳卤键中电子云偏向卤素,使碳原子带部分正电荷,卤素易以X-的形式被取代,这种取代称为亲核取代反应(简写为SN)。
活泼金属也可以与卤代烃反应,生成金属有机化合物。
由于碳卤键的极性,使β碳原子上的氢原子与卤素原子一起脱去,发生消除反应而形成碳碳重键。
另外卤代烃还可被多种试剂还原生成烃。
卤代烃的化学反应如下:1、亲核取代反应(1)水解反应RX + H2O ROH + HX卤代烷水解是可逆反应,而且反应速度很慢。
为了提高产率和增加反应速度,常常将卤代烷与氢氧化钠或氢氧化钾的水溶液共热,使水解能顺利进行。
RX + H2O ROH + NaX(2)氰解反应RX + NaCN RCN + NaX氰基经水解可以生成为羧基(–COOH),可以制备羧酸及其衍生物。
也是增长碳链的一种方法。
如由乙烯来制备丙酸:CH2═CH2 CH3CH2Cl CH3CH2CN CH3CH2COOH(3)氨解反应RX + NH3 RNH2(4)醇解反应RX + NaOEt ROEt + NaX(5)与硝酸银的醇溶液反应RX + AgNO3 RONO2 + AgX↓此反应常用于各类卤代烃的鉴别。
不同卤代烃与硝酸银的醇溶液的反应活性不同,叔卤代烷 > 仲卤代烷 > 伯卤代烷。
另外烯丙基卤和苄基卤也很活泼,同叔卤代烷一样,与硝酸银的反应速度很快,加入试剂可立即反应,仲卤代烷次之,伯卤代烷加热才能反应。
2、消除反应卤代烷与氢氧化钾的醇溶液共热,分子中脱去一分子卤化氢生成烯烃,这种反应称为消除反应,以E表示。
RCH2CH2Br + NaOH RCH═CH2 + NaBr + H2O不同结构的卤代烷的消除反应速度不同,3oR-X > 2oR-X > 1oR-X 。
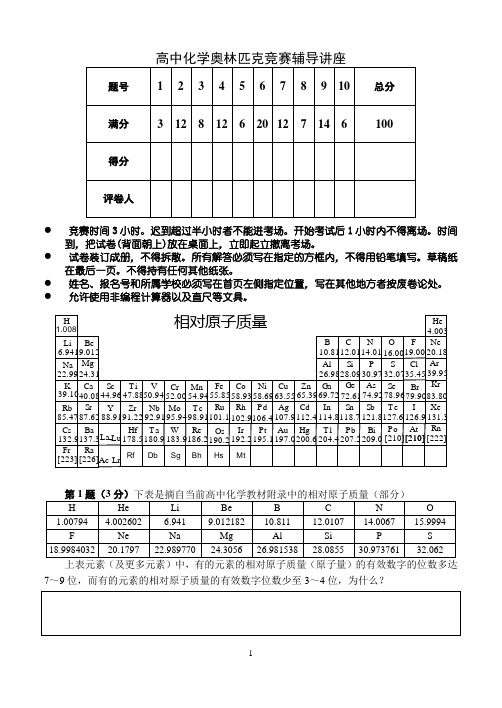
● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
● 允许使用非编程计算器以及直尺等文具。
1.008Zr Nb Mo Tc Ru Rh Pd Ag CdIn Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar KrXe Rn相对原子质量Rf Db Sg Bh Hs Mt7~9位,而有的元素的相对原子质量的有效数字位数少至3~4位,为什么?第2题(12分)将H 2O 2慢慢加入到SbF 5的HF 溶液中得一白色固体A ,A 是一种盐类,其阴离子呈八面体结构。

高中化学竞赛专题讲座立体化学高中化学奥赛专题讲座――立体化学近年来,无论是高考,还是全国竞赛,涉及空间结构的试题日趋增多,成为目前的热点之一。
本讲座将从最简单的几种空间正多面体开始,与大家一同探讨中学化学竞赛中与空间结构有关的内容。
第一讲中学化学中几种常见的晶体及应用一.晶体的概念及宏观性质: 1.晶体是指具有规则外形的固体。
其结构特征是内部的原子或分子在三维空间的排布具有特定的周期性,即隔一定距离重复出现。
2.通性:(1)均匀性;(2)各向异性:晶体在不同方向上显示不同的性质;(3)具有固定的熔点;(4)对称性:这在很大程度上决定了晶体的性质。
3.分类:除四种基本类型外,还有一种是过渡型晶体(混合型晶体)。
如石墨晶体。
二.晶胞的概念及常见类型:1.概念:在晶体结构中具有代表性的基本的重复单位称为晶胞。
晶胞在三维空间无限重复就产生了宏观的晶体。
2.基本要点:①晶胞必须是平行六面体;②同一晶体中所划分出来的同类晶胞的大小和形状完全相同;③晶胞是晶体结构中的基本的重复单位,但不一定是最小的重复单位。
若一个晶胞只有一个最小重复单位,则称素晶胞,否则称复晶胞。
例:金属钠简单立方晶胞面心立方晶胞体心立方晶胞3.几种常见的晶胞:中学中常见的晶胞为立方晶胞。
立方晶胞中粒子数的计算方法如下:(1)顶点粒子有1/8属于晶胞;(2)棱边粒子有1/4属于晶胞;(3)面心粒子有1/2属于晶胞;(4)体心粒子按1全部计入晶胞。
[实例分析]①氯化钠、氯化铯晶胞(配位数分别为6和8)NaCl、CsCl晶体密度的计算是常遇到的问题。
其关系式如下:ρ=m/v=(n×M)/V对于NaCl晶体,设晶胞的边长为a,有ρ=(4×MNaCl)/(a3×NA)对于CsCl晶体,设晶胞的边长为a,有ρ=(1×MCsCl)/(a3×NA)[练习]如图所示,直线交点处的圆圈为NaCl晶体中Na+或Cl-所处的位置,请将其中代表Na+的圆圈涂黑(不考虑体积大小),以完成NaCl的晶体结构示意图。
化学竞赛专题讲座胡征善第一讲物质结构理论原子结构与元素周期律物质结构分子结构晶体结构一、原子结构与元素周期律(一)原子结构1.四个量子数(2) 副(角)量子数(l)——决定多电子原子核外电子能量的次要因素和原子轨道(原子轨函)形状,它决定电子绕核运动的角动量。
l可取0,1,2,3,……(n—1)s原子轨道的角度分布图s轨道电子云的角度分布图p原子轨道的角度分布图p轨道电子云的角度分布图d 原子轨道的角度分布图D 轨道电子云的角度分布图原子轨道Y 和电子云Y 2的区别:因为原子轨道Y 是解薛定锷方程的结果,其值有正负,且︱Y ︱<1,所以在电子云Y 2的图形中没有正负号且形状较“瘦”些。
(3) 磁量子数(m )——决定原子轨道(原子轨函)在空间的伸展方向,决定轨道角动量在磁场方向上的分量。
其数目为m = 2l +1。
m = 2l +1l = 0 m = 0 s 轨道无方向性,在空间只有1种取向 l = 1 m = +1,0,—1 p 轨道在空间有3种取向 l = 2 m = +2,+1,0,—1,+2 d 轨道在空间有5种取向 l = 3 m = +3,+2,+1,0,—1,+2 ,—3 f 轨道在空间有7种取向 l = 4 m = +4,+3,+2,+1,0,—1,+2 ,—3,—4 g 轨道在空间有9种取向才有有意义的解。
自旋量子数是由于自旋电子产生的磁场与电子绕核运动产生的磁场相互作用的结果。
顺时针方向 逆时针方向 2.多电子原子的结构理论 (1)中心势场模型多电子原子中的每一个电子都看作只受中心的有效核电荷的吸引,而不受其他电子影响的单电子体系。
用有效核电荷(Z*)代替核电荷(Z ),则对多电子原子中的电子运动状态像处理氢原子一样。
第i 个电子的能级公式为:(2)屏蔽效应其他电子对某个选定电子的排斥作用归结为对核电荷的抵消作用。
对于核外第i 个电—13.6 eV (Zi*)2n 2Ei ==子而言,其他电子对原子核的屏蔽常数为σi ,则该电子所受到原子核的有效核电荷的吸引为Zi*== Z —σi ,故有:第i 个电子的能级公式为: (3) 钻穿效应由于角量子数不同,电子钻到核附近的几率不同,因而电子的能量不同。
高中化学奥林匹克竞赛辅导氧族元素一、氧族元素简介氧族元素包括氧(O)、硫(S)、硒(Se)、碲(Te)、钋(Po)五个元素,价层电子构型为n s2n p4。
氧族元素与电负性比它们大的元素化合时,氧化数可呈现+2、+4、+6(O的氧化数最高为+2,如OF2)。
氧族元素处于+6氧化态时只有氧化性,处于+4氧化态时既有氧化性又有还原性。
氧族元素的性质二、氧及其化合物1.氧的单质氧有两种常见的同素异形体,即O2和O3。
O3为V型结构,中心O原子为sp2杂化,含一个π34键。
它和SO2、NO2-等微粒互为等电子体。
O3分子具有弱极性,偶极矩μ=0.53D。
O2是无色气体,其液体和固体都是淡蓝色的,工业上用分馏液态空气来制备O2。
实验室可以用加热KMnO4、KClO3固体(MnO2作催化剂),或者MnO2催化H2O2分解得到。
O3因其特殊的鱼腥臭味而得名,具有比O2更强的氧化性,可使湿润的淀粉-KI试纸变蓝:O3+2KI+H2O=2KOH+I2+O2。
O3可以用作工业废水处理剂,效率高且无污染。
如,CN-+O3=OCN-+O2。
2.H2O:H2O是地球上分布最广泛的物质,是最重要的化合物之一,H2O的分子结构为V型,键角为104.5°,具有很强的极性。
H2O分子中存在氢键,其熔沸点高于同主族其它元素的氢化物。
H 2O 的式量为18.02,在沸点时测得其相对分子量是18.64,此时H 2O 分子一部分以二聚物[(H 2O)2] 存在。
H 2O 分子之间以氢键缔合。
在液态水中,存在是3个、4个……更多数目的H 2O 分子缔合而成的缔合分子。
水有很高的热稳定性,加热到2000K 时也只有0.6%的水分解。
3.H 2O 2:H 2O 2分子中两个O 原子以非极性共价键相连,-O-O-键称为过氧键,两个H 原子和两个O 原子不在同一个平面上,其立体结构如图所示:H 2O 2是无色的粘稠液体,分子间有氢键。
由于极性比水强,在固态和液态时,H 2O 2分子缔合的程度比水大,所以沸点比水高,达150℃。
清泉州阳光实验学校高中化学奥林匹克竞赛辅导讲座第3讲化学热力学根底【竞赛要求】热力学能〔内能〕、焓、热容、自由能和熵的概念。
生成焓、生成自由能、标准熵及有关计算。
自由能变化与反响的方向性。
吉布斯-亥姆霍兹方程极其应用。
范特霍夫标准熵及其应用。
热化学循环。
【知识梳理】一、根本概念1、体系和环境体系:我们研究的对象,称为体系。
环境:体系以外的其它部分,称为环境。
例如:我们研究杯子中的H2O,那么H2O是体系,水面上的空气,杯子皆为环境。
当然,桌子、房屋、地球、太阳也皆为环境。
但我们着眼于和体系亲密相关的环境,即为空气和杯子等。
又如:假设以N2和O2混合气体中的O2作为体系,那么N2是环境,容器也是环境。
按照体系和环境之间的物质、能量的交换关系,将体系分为三类:〔1〕敞开体系:既有物质交换,也有能量交换。
〔2〕封闭体系:无物质交换,有能量交换。
〔3〕孤立体系:既无物质交换,也无能量交换。
例如:一个敞开瓶口,盛满热水的瓶子,水为体系,那么是敞开体系;假设加上一个盖子,那么成为封闭体系;假设将瓶子换成杜瓦瓶〔保温瓶〕,那么变成孤立体系。
热力学上研究得多的是封闭体系。
2、状态和状态函数状态:由一系列表征体系性质的物理量所确定下来的体系的一种存在形式,称为体系的状态。
状态函数:确定体系状态的物理量,是状态函数。
例:某理想气体体系n=1mol,p=1.013×105Pa,V=2dm3,T=273K这就是一种存在状态〔我们称其处于一种标准状态〕。
是由n,p,V,T所确定下来的体系的一种状态,因此n,p,V,T都是体系的状态函数。
状态一定,那么体系的状态函数一定。
体系的一个或者者几个状态函数发生了变化,那么体系的状态也要发生变化。
始态和终态:体系变化前的状态为始态;变化后的状态为终态。
状态函数的改变量:状态变化始态和终态一经确定,那么状态函数的改变量是一定的。
例如:温度的改变量用△T表示,那么△T=T终-T始同样理解△n,△p,△V等的意义。
高中化学奥林匹克竞赛辅导讲座第11讲主族元素及其化合物【竞赛要求】卤素、氧、硫、氮、磷、碳、硅、锡、铅、硼、铝。
碱土金属、碱金属、稀有气体。
常见难溶盐。
氢化物的基本分类和主要性质。
常见无机酸碱的形态和基本性质。
氧化物和氢氧化物的酸碱性和两性。
【知识梳理】一、氢和稀有气体(一)氢氢位于周期表的第一周期IA族,具有最简单的原子结构。
氢在化学反应中有以下几种成键情况:1、氢原子失去1s电子成为H+。
但是除了气态的质子外,H+总是与其它的原子或分子相结合。
2、氢原子得到1个电子形成H-离子,主要存在于氢和IA、IIA中(除Be外)的金属所形成的离子型氢化物的晶体中。
3、氢原子和其它电负性不大的非金属原子通过共用电子对结合,形成共价型氢化物。
此外,与电负性极强的元素相结合的氢原子易与电负性极强的其它原子形成氢键,以及在缺电子化合物中存在的氢桥键。
(二)稀有气体1、稀有气体的存在、性质和制备价电子层结构He Ne Ar Kr Xe Rn1s22s22p63s23p64s24p65s25p66s26p6(1)存在:稀有气体的价电子结构称为饱和电子层结构,因此稀有气体不易失去电子、不易得到电子,不易形成化学键,以单质形式存在。
(2)物性:稀有气体均为单原子分子,He是所有单质中沸点最低的气体。
(3)制备:①空气的液化②稀有气体的分离2、稀有气体化合物[PtF6]-O2 + PtF6 = O2由于O2的第一电离能(1175.7 kJ·mol-1)和氙的第一电离能(1171.5 kJ·mol-1)非常接近,于是想到用氙代替氧可能会发生同样的反应。
结果成功了。
Xe + PtF6 = Xe +[PtF6]-(1)氟化物①制备:氙和氟在密闭的镍反应器中加热就可得到氙氟化物F2 + Xe(过量)→XeF2F2 + Xe(少量)→XeF4F2 + Xe(少量)→XeF6②性质(a)强氧化性:氧化能力按XeF2——XeF4——XeF6顺序递增。
一般情况被还原为单质。
二、s区元素(一)通性1、它们的价电子构型为ns 1~2,内层为稀有气体稳定电子层结构。
价电子很易失去呈+1、+2氧化态。
都是活泼性很高的金属,只是碱土金属稍次于碱金属而己。
2、有较大的原子半径。
因为每一周期是从碱金属开始建立新的电子层。
原子半径变化的规律:同周期从IA 到IIA 减小,同族中从上到下增大。
3、电离势和电负性均较小,其变化规律为同周期从IA 到IIA 增大,同族中从上到下顺序减小。
(二)单质1、存在由于它们的化学活泼性,决定它们只可能以化合物形式存在于自然界中。
如盐(X -、CO -23、SiO -23、SO -24等);氧化物(Li 2O 、BeO 等) 2、性质(1)物性:单质具有金属光泽,有良好的导电性和延展性,除Be 和Mg 外,其它均较软。
它们在密度、熔点、沸点和硬度方面往往差别较大。
(2)化性:活泼。
①它们具有很高的化学活泼性,能直接或间接地与电负性较高的非金属元素形成相应的化合物。
如可与卤素、硫、氧、磷、氮和氢等元素相化合。
一般均形成离子化合物(除Li 、Be 及Mg 的卤化物外)。
②单质与水反应放出氢气。
其中Be 和Mg 由于表面形成致密的氧化膜因而对水稳定。
③标准电极电势均很负,是很强的还原剂。
它们的还原性在于态及有机反应中有广泛的应用。
如高温下Na 、Mg 、Ca 能把其它一些金属从氧化物或氯化物中还原出来。
3、制备:单质的制备多数采用电解它们的熔盐。
如电解NaCl 、BeCl 2、MgCl 2等。
注意:不能电解KCl ,因为会产生KO 2和K ,发生爆炸。
其他方法:①金属置换KCl + Na → NaCl +K ↑(K 比Na 易挥发,离开体系; NaCl 晶格能大于KCl )BeF 2 + Mg → MgF 2 + Be②热分解4KCN = 4K + 4C + 2N 22MN 32M +3N 2 (M = Na 、K 、Rb 、Cs )③热还原K 2CO 3 + 2C 2K ↑+ 3CO2KF + CaC 2 CaF 2 + 2K ↑+ 2C1273~1423K 1473K真空(三)氧化物和氢氧化物1、碱金属的氧化物比碱土金属的氧化物种类多。
它除有正常氧化物外,还有过氧化物、超氧化物及臭氧化物。
如碱金属在空气中燃烧时,只有Li的主要产物是Li2O(正常氧化物),而Na、K、Rb、Cs的主要产物分别是Na2O2(过氧化物)、KO2(超氧化物)、RbO2(超氧化物)和Cs2O2(过氧化物)。
2、氢氧化物除Be(OH)2呈两性外,其余均为中强碱或强碱。
(四)盐类1、碱金属的盐类有MX(卤化物)、MNO3、M2SO4、M2CO3、M3PO4等。
它们的共性如下:①都是离子晶体(Li盐除外);②都易溶解。
除Li盐和极少数大阴离子组成的盐以外,例如LiF、Li2CO3、Li3PO4、Na[Sb(OH)6]、NaZn(UO2)3(CH3COO)9·6H2O等均难溶。
③热稳定性均很高,但Li 2CO3和硝酸盐除外,它们加热会分解:④易形成复盐。
光卤石类通式:M+Cl·MgCl2·6H2O (M+ = K+,Rb+,Cs+)SO4·MgSO4·6H2O (M+ = K+,Rb+,Cs+)矾类通式:M22、碱土金属盐类其溶解度与碱金属盐有些差别。
它们的碳酸盐、磷酸盐和草酸盐均难溶。
BaSO4、BaCrO4的溶解度亦很小。
它们的碳酸盐在常温下均较稳定(BeCO3例外),但加热可分解。
热稳定性由Mg到Ba顺序增强。
三、p区元素(一)卤族元素1、通性(1)外层电子结构ns2np5,很容易得到一个电子呈八电子稳定结构,所以卤族元素显强氧化性。
(2)氧化能力F2>Cl2>Br2>I2F2、Cl2可与所有金属作用,Br2、I2可与除贵金属外所有金属作用。
F2是最强的氧化剂,能与稀有气体反应生成XeF2、XeF4、XeOF4;与水猛烈反应放出O2。
(3)化合价:由卤素电子层结构ns2np5决定,除了易获得一个电子显– 1价外,氯、溴、碘的原子最外层电子结构中存在空的nd轨道,当这些元素与电负性更大的元素化合时,它们的nd轨道可以参加成键,原来成对的p电子拆开进入nd轨道中,因此这些元素可以表现更高的氧化态+1、+3、+5、+7。
这一类化合物主要是卤素含氧化合物和卤素互化物,主要形成共价键。
氟原子外层电子结构是2s22p5,价电子是在L层上,没有空d轨道,而且F 的电负性最大,仅显+1价。
2、卤化氢制备:在实验室里由浓H2SO4与NaCl作用制得少量HCl。
而HBr、HI不能由浓H2SO4与NaBr、NaI作用制得,这是因为浓H2SO4对所生成的HBr及HI有氧化作用,使其中一部分被氧化成单质Br2及I2析出。
H2SO4(浓) + 2HBr = Br2 + SO2 + 2H2OH2SO4(浓) + 8HI = 4I2 + H2S + 4H2O可由H3PO4代替H2SO4制备HBr、HI,避免以上氧化作用。
性质:HF最稳定,高温下不分解,而HI在300℃即大量分解为I2与H2。
HF有强腐蚀性,并能腐蚀玻璃。
SiO2 + 4HF = SiF4 + 2H2O △G o = – 75.2 kJ·mol-13、卤化物及多卤化物(1)氯化物AgCl、Hg2Cl2、PbCl2,CuCl难溶于水,其它易溶于水。
(2)由于氟的氧化性强,元素在氮化物中可呈高氧化态。
例如一般卤素银盐为AgX,但有AgF2存在。
由于碘离子还原性强,碘化物中元素呈低价氧化态,如FeI2较稳定。
(3)卤化物可和相同或不相同的卤素分子形成多卤化物,最常见的多卤化物是KI3,是由I2溶于KI中形成。
多卤化物所含的卤素可以是一种,也可以是两种或三种,如RbBrCl2、CsBrICl。
只有半径大,电荷少的金属离子适于形成多卤化物。
4、卤素的含氧酸卤素的含氧酸以氯的含氧酸最为重要。
因素含氧酸和含氧酸盐的许多重要性质,如酸性、氧化性、热稳定性、阴离子碱的强度等都随分子中氧原子数的改变而呈规律性的变化。
以氯的含氧酸和含氧酸盐为代表将这些规律总结在表中。
卤素含氧酸及其盐的稳定性与它们的氧化能力有相应的关系。
稳定性较差,氧化能力较强。
反之,稳定性高的氧化能力就弱。
(二)氧族元素1、通性(1)价电子层结构ns2np4,氧化态–2、+2、+4、+6,氧仅显–2价(除H2O2及OF2外)。
(2)氧族元素原子最外层6个电子,因而它们是非金属(钋除外),但不及卤素活泼。
(3)随着原子序数增大,非金属性减弱,氧硫是非金属、硒、碲是半金属,钋是典型金属。
氧的电负性最高,仅次于氟,所以性质非常活泼,与卤族元素较为相似。
2、过氧化氢制备:电解60%H2SO4溶液,减压蒸馏得H2S2O8,水解可得H2O2。
H2S2O8 + 2H2O = 2H2SO4 + H2O2↑性质:①不稳定性:H2O2 = H2O + 1/2O2(光照及少量金属离子存在都能促进分解)②氧化还原性:由于H2O2氧化数处于中间,所以既显氧化性又显还原性,以氧化性为主。
③弱酸性:H2O2+Ba(OH)2 = BaO2+2H2O3、硫化氢和硫化物(1)硫化氢制备:FeS + 2HCl = FeCl2 + H2SH2S是一种有毒气体,需在通风橱中制备。
实验室中以硫代乙酰胺水解产生H2S。
CH3CSNH2 + 2H2O = CH3COONH4 + H2S性质:①还原性。
硫化氢水溶液不能长久保存,可被空气中的氧气氧化析出S。
②沉淀剂。
由于大多数金属硫化物不溶于水,在定性分析中,以H2S作为分离溶液中阳离子的沉淀剂。
检验:以Pb(Ac)2试纸检验,H2S使试纸变黑:H2S+Pd(Ac)2 = PdS+2HAc(2)硫化物为什么大多数金属硫化物难溶于水,从结构观点来看,由于S2-变形性大,如果阳离子的外电子构型是18、18+2或8~18电子构型,由于它们的极化能力大,变形性也大,与硫离子间有强烈的相互极化作用,由离子键向共价键过渡,因而生成难溶的有色硫化物。
4、硫酸浓H2SO4与稀H2SO4氧化性不同。
在稀H2SO4,显氧化性的主要是H+。
浓H2SO4是强氧化剂,其中显氧化作用的是S6+,它可以氧化其他物质,而本身被还原成低氧化数的SO2、S、H2S等等5、亚硫酸及其盐性质:①不稳定性。
②由于S4+ 氧化数处于中间,既显还原性,又显氧化性,以还原性为主。
配制Na2SO3溶液必须随配随用,放置过久则失效。
③Na2SO3与S作用。
(三)氮族元素1、通性(1)价电子层结构为ns2np3,主要氧化态为–3、+3、+5。
(2)氮族元素得电子趋势较小,显负价较为困难。