无机化学考研辅导1
- 格式:doc
- 大小:51.00 KB
- 文档页数:9


化学考研重点知识点解析化学考研是为了进一步深造和提高自身专业能力的学术考试,其中涉及到的知识点繁多而复杂。
本文将对化学考研的重点知识点进行解析,以帮助考生更好地备考。
一、无机化学知识点解析无机化学是化学考研中的重要部分,其中的一些重点知识点主要包括:1. 元素周期表:考生需要熟悉元素周期表中各元素的周期性和趋势规律,包括原子半径、电离能、电负性等。
2. 化学键和分子结构:考生需要了解各种化学键的性质和形成机制,以及分子的结构、构型和性质。
3. 配位化学:考生需要了解配位化合物的形成机制、配位键和配位数的概念,以及配位化合物的性质和应用。
4. 化学反应和化学平衡:考生需要掌握化学反应的速率、平衡常数和化学平衡的移动规律,以及与之相关的反应动力学和统计热力学知识。
二、有机化学知识点解析有机化学也是考研中的重点内容,主要涉及以下几个方面的知识点:1. 有机化学基本理论:考生需要了解有机化学的基本概念、离子和分子的稳定性、有机反应机理等基础知识。
2. 合成有机化学:考生需要熟悉有机化合物的合成方法和反应机制,了解有机反应中的键断裂和键形成。
3. 有机化合物的结构和性质:考生需要了解有机化合物的结构特点、光电性质、酸碱性质等,以及与之相关的分析方法。
4. 重要的有机化合物:考生需要掌握一些重要的有机化合物,如醇、酮、醛、羧酸等的结构和性质。
三、物理化学知识点解析物理化学作为化学考研的核心内容,其中一些重点知识点包括:1. 热力学和热力学平衡:考生需要了解热力学基本概念、状态函数、热力学定律,以及热力学平衡条件和算法。
2. 化学动力学:考生需要熟悉化学反应速率、反应机理、速率常数等动力学概念,以及影响化学反应速率的因素。
3. 电化学:考生需要了解电化学基本理论、电解池、电化学反应等概念,以及与之相关的电解质溶液的结构和性质。
4. 量子化学:考生需要了解量子力学的基本原理和量子化学的基本概念,以及与之相关的分子轨道理论和近似的应用。





山西省考研化学专业无机化学重点知识点梳理无机化学是化学学科的重要分支之一,是研究无机物质的性质、结构及其化学反应的学科。
在山西省考研化学专业中,对于无机化学的重点知识点的掌握是非常重要的。
本文将对山西省考研化学专业无机化学的重点知识点进行梳理,以帮助考生更好地复习备考。
一、原子与分子结构1. 电子结构原子的电子结构是无机化学的基础,了解原子的能级构型、电子轨道和电子排布规则是必须的。
例如,需要了解电子云模型、玻尔理论、量子力学模型等,以及电子排布的原则和规律,如泡利不相容原理、奥卡规则等。
2. 元素周期表元素周期表是无机化学的基础工具,考生需要掌握元素周期表的结构和元素周期规律,包括周期性变化规律和族群的特征。
此外,还需了解元素周期表中元素的命名和元素符号的含义。
3. 化学键化学键是原子之间的相互作用,包括离子键、共价键和金属键等。
考生需要了解不同类型的化学键的定义、特点和性质,以及它们的形成机制和影响因素。
二、无机化学基本概念和理论1. 配位化学配位化学是无机化学的重要分支,研究配位化合物的结构和性质,包括配位数、配位键和合成方法等。
考生需要了解配位化合物的命名规则和结构特征,以及配位反应的类型和机理。
2. 化学反应化学反应是无机化学的核心内容,包括酸碱中和反应、氧化还原反应、配位反应等。
考生需要了解不同类型的化学反应的定义、性质、条件和应用,以及反应的速率和平衡。
3. 锕系元素锕系元素是无机化学中的一类重要元素,具有丰富的放射性同位素和广泛的应用价值。
考生需要了解锕系元素的特点、放射性衰变过程和应用领域,以及与环境和人体的关系。
三、无机化合物的性质和应用1. 酸碱与盐酸碱与盐是无机化学的基础,考生需要了解酸碱与盐的定义、性质和常见的实验室制备方法。
此外,还需了解酸碱中和反应、酸碱指示剂和盐的命名规则。
2. 无机产业原料与功能材料无机产业原料和功能材料是无机化学的重要应用领域,包括矿石、金属及其合金、陶瓷材料、无机非金属材料等。

第 1 章原子结构一、教学基本要求1. 初步了解原子核外电子运动状态的近代概念、原子能级、波粒二象性、波函数和电子云;2. 熟悉四个量子数对核外电子运动状态的描述;3. 熟悉s、p、d原子轨道的形状和方向;4. 掌握原子核外电子排布的一般规律及s、p、d、f区元素的电子结构特征;5. 会从原子的电子层结构说明元素性质,并熟悉原子半径、电离能、电子亲合能、电负性的概念和周期性变化。
二、要点1. 原子序数(atomic number) 元素原子核内的质子数。
2.原子质量单位((atomic mass unit) 表示单个原子的质量的单位。
一个原子质量单位(u)为碳原子(12C)质量的1/12。
3.质量数(mass number) 原子核内质子数与中子数之和,称作该原子的质量数。
4.光电效应(photoelectric effect) 用一定频率的电磁辐射轰击物质的表面,释放出电子的现象。
5.波粒二象性(wave-particle duality) 微观粒子(如光子、电子等)在不同条件下能分别显示出波动性和微粒性的特征称为波粒二象性,是微观粒子的基本属性之一。
光在衍射中显示出波动性,而在光电效应中则又显示出微粒性。
6.不确定原理(uncertainty principle) 指不可能同时测得电子的动量及其在空间的确切位置。
7.波动力学模型(wave mechanical model) 基于波粒二象性、海森堡的测不准原理可将电子可视作物质波等理论的量子理论模型。
8.波函数(wave functions) 波动力学方程的数学解就是波函数或原子轨道。
是量子力学中表征微观粒子或其体系运动状态的函数。
在原子中核外电子的运动状态就是用波函数Ψ来描述的, 是量子力学的基本方程(薛定谔方程)的解,它不是一个数值,而是一个函数式。
微观粒子的各种物理量,都可通过波函数来确定。
在空间某点,微观粒子(如电子等)出现的几率密度,跟波函数绝对值的平方|Ψ|2成正比。


无机化学(理论部分)知识点应用归纳1、无机物(分子或离子)构型:(1)简单分子(或离子):(2)配合物:2、物质的熔、沸点(包括硬度):(1)晶体类型:原子晶体,离子晶体,金属晶体,分子晶体(2)离子晶体:(3)分子晶体(4)金属晶体:金属键(与价电子、价轨道有关)3、物质的稳定性:(1)无机小分子:(2)配合物:4、物质的磁性:(1)无机小分子:MO (掌握双原子分子轨道能级图)(共价双原子分子)(2)配合物:5、物质的颜色:(1)无机小分子:极化理论(2)配合物:6、无机物溶解度:(1)离子晶体:(2)共价化合物:7、物质的氧化还原性:影响因素(1)溶液酸、碱度(2)物质的聚集状态8、化学反应方向:(1)热力学数据: 、、、、等(2)软硬酸碱理论9、分子极性、键的极性、键角、键长等:10、推导元素在周期表中的位置:能级组取值,选择—组合理量子数:四个量子数取值规则11、溶液中有关质点浓度计算:化学平衡,电离平衡,沉淀—溶解平衡,氧化—还原平衡,配合解离平衡:利用多重平衡规则,K是关键12、常见的基本概念:对角线规则;惰性电子对效应;Lewis酸、碱;质子酸、碱;缓冲溶液;屏蔽效应;钻穿效应;同离子效应;盐效应;镧系收缩;电负性;电离势;电子亲合势;晶格能;键能;有效核电荷及求法等。
二.无机化学(元素部分)(1)结构(2)性质:重点是化学性质3—6 有效原子序数(EAN)规则(Effective atomic number)必考一、概念1927年英国化学家西奇维克提出,是指中心原子的电子数和配体给予中心原子的电子数之和。
即中心原子形成稳定配合物的EAN应等于紧跟它后面的惰性原子的序数。
主要用于羰基及其它非经典配合物结构中。
如:[Cr(CO)6]→24e-+12e-=36e-[Fe(CO)5] →26e-+10e-=36e-→Kr(氪) -36e-[Co(NH3)6]3+→24e-+12e-=36e-对于中心原子三偶数电子的,可直接形成羰基配合物,而一般中心原子为奇数电子的羰基配合物多不稳定,(不能满足EAN),所以它们容易氧化,还原或聚和成多核配合物,以符合EAN要求,如V为23e-,在形成V(CO)6的总电子数为35,它不稳定,易被还原成[V(CO)6]-。
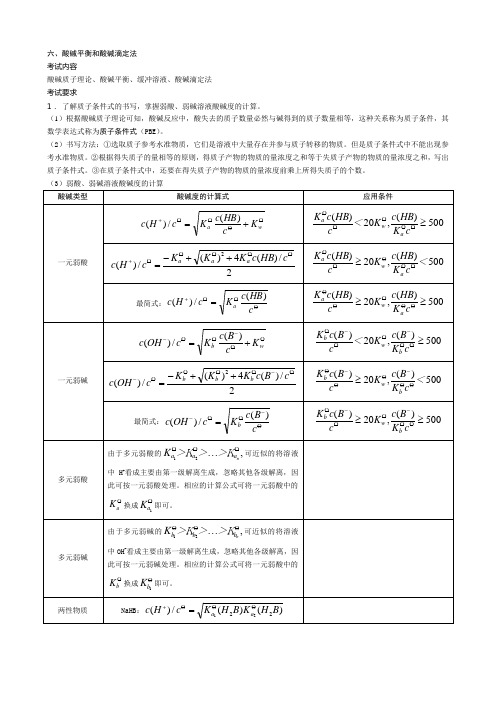
六、酸碱平衡和酸碱滴定法 考试内容酸碱质子理论、酸碱平衡、缓冲溶液、酸碱滴定法 考试要求1. 了解质子条件式的书写,掌握弱酸、弱碱溶液酸碱度的计算。
(1)根据酸碱质子理论可知,酸碱反应中,酸失去的质子数量必然与碱得到的质子数量相等,这种关系称为质子条件,其数学表达式称为质子条件式(PBE )。
(2)书写方法:①选取质子参考水准物质,它们是溶液中大量存在并参与质子转移的物质。
但是质子条件式中不能出现参考水准物质。
②根据得失质子的量相等的原则,得质子产物的物质的量浓度之和等于失质子产物的物质的量浓度之和,写出质子条件式。
③在质子条件式中,还要在得失质子产物的物质的量浓度前乘上所得失质子的个数。
(3)弱酸、弱碱溶液酸碱度的计算 酸碱类型酸碱度的计算式应用条件一元弱酸OO O O ++=wa K cHB c K c H c )(/)(500)(,20)(≥O O O OO c K HB c K <c HB c K a w a 2/)(4)(/)(2O OO O O+++-=c HB c K K K c H c a a a500)(,20)(<c K HB c K c HB c K a w a OO O O O ≥ 最简式:OO O+=c HB c Kc H c a)(/)(500)(,20)(≥≥OO O O O c K HB c K c HB c K a w a 一元弱碱OO-O O-+=wbK c B c K c OH c )(/)(500)(,20)(≥O O -O O-O c K B c K <c B c K b w b 2/)(4)(/)(2O -O O O O-++-=c B c K K K c OH c b b b500)(,20)(<c K B c K c B c K b w b O O -O O-O ≥ 最简式:O-O O -=c B c K c OH c b)(/)(500)(,20)(≥≥O O -O O-O cK B c K c B c K b w b 多元弱酸由于多元弱酸的,21OO O ⋯naa a >K >>K K 可近似的将溶液中H +看成主要由第一级解离生成,忽略其他各级解离,因此可按一元弱酸处理。

化学考研无机化学重点知识归纳无机化学是化学考研中的重点知识之一,它研究的是无机物质的性质、结构、合成方法和反应机理等。
掌握无机化学的重点知识对于考研生来说至关重要。
本文将针对无机化学的重点知识进行归纳和总结,并按照相应的格式呈现出来,以帮助考生更好地复习和备考。
一、周期表和元素周期性周期表是无机化学的基础,它按照元素的原子序数和化学性质进行了系统排列。
掌握周期表的相关知识对于理解元素周期性和化学反应具有重要意义。
1.1 周期表的构成周期表由横向的周期和纵向的族组成。
周期指的是周期表中横向的行数,族指的是周期表中纵向的列数。
周期表的左侧是金属元素,右侧是非金属元素,具有明显的金属性和非金属性。
1.2 周期表中的元素周期性元素周期性是指元素性质随着周期表的排列而周期性地变化。
主要涉及到原子半径、电离能、电负性、价态等性质的变化规律。
例如,原子半径随周期数增加而减小,原子半径随族数增加而增大。
1.3 周期表中的主族元素和过渡金属元素主族元素是周期表中1A~8A族的元素,它们的电子结构稳定,容易进行化学反应。
过渡金属元素是周期表中3B~2B族的元素,它们的内层电子结构稳定,电子填充在外层d轨道上,具有良好的导电性和催化性能。
二、氧化还原反应氧化还原反应是无机化学中一种重要的反应类型,涉及到电子的转移和价态的改变。
了解氧化还原反应的性质和常见类型有助于理解和预测无机化学反应的过程和产物。
2.1 氧化还原反应的基本概念氧化还原反应是指电子从一个物质转移到另一个物质的化学反应。
氧化是指物质失去电子,还原是指物质获得电子。
在氧化还原反应中,有电子的转移和价态的改变。
2.2 氧化还原反应的常见类型常见的氧化还原反应类型包括氧化、还原、置换、还原-置换、氧化还原间离子电子反应等。
每种类型的反应具有独特的特点和反应条件。
三、配位化学配位化学是无机化学中研究配合物的合成、结构和性质的一门学科。
掌握配位化学的相关知识可以帮助考生了解配合物的形成机制和性质,以及其在催化、荧光与生物活性方面的应用。

考研无机化学知识点梳理无机化学是化学的一个重要分支,研究非有机物质的性质、结构及其变化规律。
在考研无机化学的复习过程中,准确把握知识点是非常关键的。
本文将对考研无机化学的重要知识点进行梳理,以帮助考生更好地掌握相关内容。
一、元素周期表元素周期表是无机化学中最基础的知识点之一,它将元素按照原子核的电子排布规律进行分类。
元素周期表可以根据不同的特征进行划分,如金属性、非金属性、半金属等。
考生需要掌握元素周期表中各个元素的周期、族及其周期性质,如原子半径、电离能、电负性等。
二、化学键和晶体结构化学键是无机化学中的另一个重要概念,包括离子键、共价键和金属键等。
根据电负性差异不同,化学键的性质也有所区别。
此外,晶体结构是无机化学中的重要内容。
晶体结构可以按照晶体的几何形状进行分类,如立方晶系、四方晶系、六方晶系等。
考生需要了解不同晶体结构的特点以及其对晶体性质的影响。
三、配位化学和配合物配位化学是研究中心原子或离子(配体)与周围原子或离子(受体)之间的配位作用及其规律。
配合物是通过配位作用形成的化合物,具有特殊的性质和结构。
考生需要熟悉配位化学的基本概念和配位体的分类,以及了解配合物的结构、命名规则和性质等。
四、无机化合物的性质与应用无机化合物具有丰富的性质和广泛的应用,考生需要熟悉各种无机化合物的性质以及与生产和生活相关的应用。
例如,氧化物在电池、催化剂和材料科学中有重要应用,硫化物在矿石提取和防腐剂中应用广泛。
考生需要了解各种无机化合物的性质和应用,以便在考试中对相关问题做出准确回答。
五、酸碱理论和溶液化学酸碱理论是无机化学中的重要理论之一,包括阿伦尼乌斯酸碱理论、布朗斯特德酸碱理论和路易斯酸碱理论等。
溶液化学是研究溶液中各种物质之间相互转化和反应机制的一门学科。
考生需要了解不同酸碱理论的基本原理和应用,以及溶液中各种离子之间的反应和平衡机制。
六、电化学和电池原理电化学是研究电能与化学能之间相互转化关系的学科,包括电解池和电化学电池两个方面。

无机化学考研辅导讲座(上)二.无机化学(元素部分)(1)结构(2)性质:重点是化学性质第一讲分子结构(molecular structure)1-1 离子键理论一、基本要点活泼金属和活泼非金属的原子反应时,生成的化合物如NaCl等都是离子型化合物,它们具有一些固有的特征,如它们都以晶体的形式存在,具有较高的熔、沸点,在熔融态或水溶液中可导电等。
这种由于原子间发生电子转移,生成正负离子,并通过静电库仑作用而形成的化学键称为离子键。
通常,生成离子键的条件是两原子的电负性差大于1.7以上,由离子键形成的化合物叫做离子键化合物。
二、离子特征1、离子电荷:是指原子在形成离子化合物过程中失去或获得的电子数。
正离子电荷通常是+1、+2、+3或+4;阴离子:-1、-2,而-3、-4的负离子一般都是含氧酸根离子或配阴离子。
2、离子的电子构型:(1)2e构型:1s2,如Li+,Be2+(2)8e构型:(n-1)ns2(n-1)p6:Na+,Mg2+,Ba2+等(3)9~17e构型:(n-1)ns2(n-1)p6(n-1)d1~9:Fe2+,Mn2+等(4)18e构型:(n-1)ns2(n-1)p6(n-1)d10:Cu+,Ag+,Zn2+等(5)18+2e构型:(n-1)ns2(n-1)p6(n-1)d10ns2:Sn2+,Pb2+等3、离子半径:(变化规律):同一元素:负离子>原子>低价正离子>高价正离子同族元素同价离子:从上→下,半径增大同一周期:从左→右,半径r↓三、晶格能(U)1、定义:指相互远离的气态正离子和负离子结合成1mol离子晶体时所释放的能量绝对值,或1mol离子晶体解离成自由气态离子所吸收的能量的绝对值。
2、计算:晶格能不能用实验直接测量,通常有两种方法计算:(1)库仑作用能模型理论计算:A为马德隆(Madelung)常数,与晶格类型有关;n是与原子的电子构型有关的因子;Z1Z2为正负离子的电荷数。

考研化学无机化学重要知识点梳理无机化学是化学科学的重要分支之一,它研究无机物质的结构、性质、合成和反应等方面的内容。
对于考研化学的学生来说,无机化学是必修的一门课程,下面将对考研化学无机化学的重要知识点进行梳理和总结。
一、元素周期表元素周期表是化学中重要的基础知识,它是由化学元素按照一定规律排列形成的表格。
元素周期表每个元素的周期数和族数都代表着该元素的电子排布规律和化学性质。
考研化学中,需要了解元素周期表的基本结构和元素的周期趋势规律,如原子半径的变化规律、离子半径的变化规律以及电离能、电子亲和能等的变化规律。
二、配位化学配位化学是无机化学重要的一个分支,它研究的是过渡金属离子或主族金属离子与配体之间的结合关系和形成的配合物。
在考研化学中,需要了解配体的命名规则、配位数的确定、配位键的形成原理以及配合物的结构和性质等内容。
三、主族化学主族元素是元素周期表中位于周期表左侧的元素,考研化学中主要研究的是周期表第13至18族的元素。
主族元素化合物的结构和性质是考研化学的重点内容之一,需要了解主族元素的周期性规律、主族元素化合物的结构和性质以及主族元素在生活中的应用等知识点。
四、过渡金属化学过渡金属是元素周期表中位于d区的元素,考研化学中需要重点研究的是3d到5d区的过渡金属元素。
过渡金属具有丰富的化学性质和广泛的应用价值,在考研化学中需要了解过渡金属的电子排布规律、过渡金属离子和配体的配位关系以及过渡金属催化剂的原理等知识点。
五、无机材料化学无机材料是指由无机化合物制备而成的材料,包括无机非金属材料、无机金属材料和无机复合材料等。
考研化学中需要了解无机材料的制备方法、性质和应用等知识点。
例如,常见的无机材料包括陶瓷材料、玻璃材料、催化材料等,考生需要了解它们的制备工艺、结构和性能等方面的知识。
六、无机反应无机反应是无机化学中重要的内容之一,它包括离子反应、氧化还原反应、酸碱反应等。
在考研化学中,需要了解无机反应的基本概念和反应机理,掌握常见无机反应的制备条件和化学方程式,了解反应速率、反应平衡和反应热力学等方面的知识。

河北省考研化学科目无机化学重点知识点梳理无机化学是化学科学的重要分支,研究无机元素、化合物以及它们之间的反应。
作为河北省考研化学科目的一部分,无机化学知识点的掌握对于考生来说至关重要。
本文将梳理河北省考研化学科目无机化学的重点知识点,以帮助考生更好地复习备考。
一、元素周期表及周期性元素周期表是无机化学的基础,对其掌握是理解化学反应和化学性质的关键。
元素周期表是由按照元素的原子序数大小排列的,所有元素根据其性质可以划分为不同的区块。
常见的区块有:1. 镧系和锕系元素:这两个区块位于元素周期表的底部,包括57-71号和89-103号元素。
这些元素具有一些共同的化学性质,例如镧系元素通常具有相似的电子结构和氧化态。
2. 主族元素:主族元素是元素周期表的S和P区块,包括1-2族和13-18族。
它们的最外层电子结构决定了它们的化学性质,主族元素通常具有相似的化学性质。
3. 过渡金属:过渡金属位于元素周期表的中央区域,从3至12族。
这些元素常见的特点是反应性中等、形成多种氧化态以及在化学反应中起催化剂作用。
此外,元素周期表还包括其他区块,如金属、非金属、卤素等等。
学生需要对元素周期表的结构和元素的周期性趋势有所了解,包括电离能、电负性、原子半径等。
二、配位化学配位化学是研究配位化合物的形成和性质的学科。
在无机化学考研中,配位化学作为重要的知识点,需要掌握以下内容:1. 配位键:配位化合物通过配位键连接中心金属离子和配体。
掌握不同配位键中的键能和配合物的稳定性是重要的。
2. 配位数:指一个中心金属离子周围配体的数量,掌握不同配位数的特点和常见配位数的配合物是重要的。
3. 配体:指配位化合物中与中心金属离子连接的分子或离子。
掌握不同配体的名称、结构和性质是必要的。
4. 配合物名称:了解符号法和常用命名法,能够正确给出给定配合物的名称。
5. 配位反应:配位反应是指配位化合物中配体的进出过程。
学生需要掌握不同配位反应的机理和条件。

4、H3PO4、H4P2O7、HPO3加入AgNO3→正磷酸为黄色沉淀,焦、偏磷酸为白色沉淀,偏磷酸能使蛋白质溶液产生沉淀。
六、As、Sb、Bi硫化物1、As、Sb、Bi的硫化物在结构上类似于它们的氧化物,但由于S2-半径大,而且A s(Ⅲ)、Sb(Ⅲ)、Bi(Ⅲ)又是18+2e-型,M(Ⅲ)与S2-之间有较大的极化效应,所以其硫化物更接近共价化合物,在水中溶解度很小,颜色较深,As2S3(黄)、Sb2S3(黑)、Bi2S3(黑)、As2S5(淡黄)、Sb2S5(橙黄)。
2、As、Sb、Bi硫化物酸碱性不同,在酸碱中溶解情况也有很大区别。
与氧化物相似,As2S3基本为酸性;Sb2S3是两性,Bi2S3为碱性。
所以As2S3甚至不溶解于浓HCl,Sb2S3溶于浓HCl,又溶于碱;Bi2S3只溶解于浓HCl不溶于碱。
Sb2S3+6NaOH=Na3SbO3+Na3AsS3+3H2OSb2S3+12HCl=2H3SbCl6+3H2S↑Bi2S3+6HCl=2BiCl3+3H2S↑其中Na3AsS3与Na3SbS3看成是砷(锑)酸盐中O被S取代的产物。
3、用酸性氧化物与碱性氧化物互相作用生成含氧酸盐一样,硫代酸盐可由酸性金属硫化物与碱性金属硫化物互相作用而生成。
3Na2S+As2S3=2Na3AsS33Na2S+Sb2S3=2Na3SbS3对于Bi2S3呈碱性,不溶于Na2S中。
由于As2S5和Sb2S5酸性比M2S3强,更易溶于碱的硫化物中:3Na2S+As2S5=2Na3AsS43(NH4)2S+Sb2S5=2(NH4)3SbS44、As2S3、Sb2S3与M2O3相似,具有还原性,易被多硫化物氧化,As2S3+Na2S2→Na3AsS4Sb2S3+(NH4)2S2→(NH4)3SbS4Bi2S3中Bi(Ⅲ)还原性极弱,不与多硫化物作用。
5、所有硫代酸盐只存在中性或碱性,遇酸分解成硫化物和H2S气体。
第九讲碱金属和碱土金属一、通性ⅠA→ⅡA s区,价电子构型为ns1~21、单质轻、软,熔点低2、半径大,电离能及电负性小,具有强还原性,是活泼的金属3、化合物大多是离子型晶体,氧化物的水合物一般是强碱,碱和盐是强电解质,且强酸盐一般不水解。
二、锂的特殊性1、Li的标准电极电势最负,但其和水反应的剧烈程度不如钠和钾1Li的熔点高(180℃)反应过程产生的热不足以使之熔化,而钠和钾熔点低(98℃和65℃),从而钠和钾与水反应快。
2Li和H2O的产物LiOH溶解度较小,覆盖在Li的表面,阻碍水和Li的进一步反应。
2、Li在水中是最强的还原剂,但却不是金属性最强的元素。
Li的标准电极电势最负(-3.04V),可以认为是最强的还原剂,而元素的金属性和非金属主要是由其电离能和电负性所决定的。
电离能小,电负性小则金属性强;反之,则非金属性强,在IA中,从上到下,电离能和电负性逐渐减小,因而决定最强的金属不是Li。
那么Li为何有最小的电势呢?这和其有较大的水合能有关,从热化学循环可知,其电极过程的能量变化(忽略熵变):△H=S+I+△h H三、s区元素在空气中燃烧的产物1、 IA M(I)+O2 → Li2O, Na2O2, MO2(K,Rb,Cs)IIA M(II)+O2→MO(常压)或MO2(Ca,Sr,Ba)(高压)2、 M和非金属反应生成离子晶体时,如果阴阳离子具备一定的匹配条件,则可达到最好的能量效应,实验和理论分析得到经验规则:(1)半径较小的阳离子趋向于和半径较小的阴离子结合,半径较大的阳离子趋向于和半径较大的阴离子结合;(2)价数高的阳离子趋向于和价数高的阴离子相结合,价数低的阳离子和价数低的阴离子结合(3)半径小的离子趋向于和价数高的异号离子结合,这样可得到较高能量效应,生成稳定化合物。
因此,Li+和半径小的O2-生成Li2O,而半径大的K+、Rb+、Cs+则和O2-生成MO2型超氧化合物。
Na+比Li+大,比K+小,趋向于和半径大但价数高的O22-结合,生成Na2O2。
例1:说明下列反应方向:(1)KBr+LiF=KF+LiBr(2)Na2SO4+BaCl2=BaSO4+2NaCl(3)2NaCl+CaF2=2NaF+CaCl2(4)Na2S+CaCO3=Na2CO3+CaS由以上经验规则可推得反应(1)、(3)以逆反应进行,而(2)、(4)以正反应方向进行。
四、s区元素金属的氢氧化物1、溶解度:碱金属氢氧化物易溶,而相应的碱土金属氢氧化物溶解度却小得多,且同族从上到下溶解度递增(和相应的氧化物溶解度变化趋势相同)。
这主要是由于OH-为较小的阴离子,它趋向于和小阳离子与价数高的阳离子结合形成稳定的化合物。
其晶格能较大,晶格不易被破坏,在水中溶解度就小。
Be(OH)2、Mg(OH)2的溶解度较低主要是由于Be2+、Mg2+较小,有较强的极化能力,可极化OH-变形,使形成的氢氧化物带有较多的共价成分,因而在极性溶剂中溶解度就小。
2、碱性:金属氢氧化物碱性强弱,可用金属离子的离子势中来判断,Ф=Z/r,如果Ф值大,说明金属与氧原子之间的引力大,该化合物易产生酸式电离:M-O-H→MO-+H+倘若Ф值小,则表明金属和氧原子之间引力小,该化合物就易做碱式电离:M-O-M=M++OH-一般用---值来测出金属氢氧化物的碱性,即:----<0.22 金属氢氧化物呈碱性0.22--<0.32 金属氢氧化物呈两性----->0.32 金属氢氧化物呈酸性习题1:一般而言,钠盐和钾盐的溶解度较大,一般的高氯酸盐也是易溶的,但为什么NaClO4的溶解度不大,而KClO4更难溶?习题2:说明下列事实:(1)LiClO4易溶于水,而NaClO4溶解度较小,KClO4、RbClO4、CsClO4的溶解度更小?(2)IA族卤化物中,LiF溶解度最小。
(3)TlI和KI属于类质同晶体KI易溶于水,而TlI难溶于水?习题3:溶液中pH值对于Mg和Ba作还原剂时还原能力有何影响?习题4:完成并配平下列反应方程式。
(1)2Na2O2+2H2O(2)Na2O2+2H2O(冷)=(3)2KO2+2H2O=(4)2Na+H2=(5)Na2O2+2Na=五、对角线规则在周期表中左上角元素性质和右下角元素相似的现象,称为对角线规则:如Li-Mg、Be-Al、B-Si、C-P等,Li与Mg,B与Al 相似的原因与离子的“极化力”相似有关。
1、Li与Mg相似性表现在:1Li、Mg与氧反应只形成普通的氧化物2Li、Mg可与N2,C形成离子型氮化物或碳化物3Li、Mg的氢氧化物受热分解得氧化物4碳酸盐受热分解为Li2O、MgO5Li+、Mg2+水合热较大6Li、Mg的氟化物、碳酸盐、磷酸盐难溶于水7LiCl、MgCl2有共价性,可溶于有机溶剂8Li、Mg可形成一系列有机化合物,如LiCH3、Mg(CH3)2等,RMgX(格氏试剂),有机合成中广泛应用9Li、Mg水合氯化物受热水解:LiCl·H2O=LiOH+HCl↑MgCl2·6H2O=Mg(OH)Cl+HCl↑+5H2O2、Be、Al的相似性表现在:1标准电极电势相似:φBe2+/Be=-1.85V,φAl3+/Al=-1.66V2氧化物为两性3BeCl2、AlCl3为共价化合物,易升华,可溶于有机溶剂,BeCl2(s)为无限链状结构,气态下BeCl2(g)是单体,AlCl3是双聚体:聚合体中有三中心四电子键。
4Be、Al对冷浓HNO3都有钝化作用5BeO、Al2O3都有高硬度,高熔点7Be2+、Al3+盐加热易水解8Be2C、Al4C易水解,产物都为CH4Be与Al的差异性:Be与CO32-产生配位,而Al3+在CO32-中水解Be2++2CO32-=[Be(CO3)2]2-2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑练习题1.试举例说明锂与镁的相似性.2.用化学反应方程式表示由食盐制备下列物质.(1) 金属钠(2) 氢氧化钠(3) 过氧化钠(4) 碳酸钠3.简单回答下列问题(1) CsF具有较高的离子性,但CsF熔点却较低?(2) 碱土金属比相邻的碱金属的熔点高,硬度大?(3) BeCl2为共价化合物,而MgCl2、CaCl2等为离子化合物(4) Mg(OH) 2溶于NH4Cl溶液而不溶于NaOH溶液?4.简单回答下列各题(1)LiF溶解度比AgF小,LiI溶解度却比AgI大?(2)在水中的溶解度LiClO4>NaClO4>KClO4(3)Be(OH) 2为两性物质而Mg(OH) 2却显碱性?5.为什么Na2O2常被用作制氧剂?6.Li的标准电极电势比钠低,为什么Li与水作用时没有金属剧烈?7.碱金属与碱土金属和氧反应,各生成何种物质?8.简述S区元素的微观结构与通性9.Li. Be 特殊性的本质原因是什么?试述对角线规则及其成因,Li—Mg有何相似性?10.什么是焰色反应?说出它的应用?11.给出下列物质的化学式:萤石;生石膏;重晶石;天青石;方解石;光卤石;智利硝石;芒硝;纯碱;烧碱。
12.简答题:一固体混合物可能含有MgCO3,Na2SO4,Ba(NO3)2,AgNO3和CuSO4。
混合物投入水中得到无色溶液和白色沉淀;将溶液进行焰色试验,火焰呈黄色;沉淀可溶于稀盐酸并放出气体。
试判断哪些物质肯定存在,哪些物质可能存在,哪些物质肯定不存在,分析原因。
第十讲铜锌副族一、ds区元素的通性1、价电子构型:分别为(n-1)d10ns1和(n-1)d10ns2,ⅠB和ⅡB 通常称为ds区元素。
2、氧化态:铜族有变价Cu(+1,+2),Ag(+1),Au(+1,+3);Zn族:Zn(+2),Cd(+2),Hg(+1,+2)3、都是金属4、金属活泼性从上到下减弱5、IB有较好的导电导热延展性,熔沸点较高。
二、ds区元素和s区元素性质的对比1、主要物理性质IA单质金属的熔点、沸点、硬度均低,IB金属具有较高的熔点和沸点,有良好的延展性、导热性、导电性;IIB族金属的熔、沸点均比IIA族低,汞在常温下为液体,IIA与IIB金属导电、导热性、延展性均较差(仅镉有延展性)2、化学活泼性s区元素为活泼金属,易被空气中的O2氧化,不仅能从稀酸中置换出H2,而且也能和水反应产生H2,同族元素的活泼性自上而下增大。
ds区元素一般为不活泼的金属,在空气中比较稳定,与水几乎不起反应,同族内的活泼性自上而下减弱。
3、氢氧化物的酸碱性ds区元素氢氧化物是弱碱,易脱水分解,而s区元素的氢氧化物绝大多数是强碱,并且非常稳定,Be(OH)2和Zn(OH)2都是两性的4、化合物的键型及形成配合物的倾向由于ds区元素具有18e-构型,因而它们的化合物所表现的共价性,不管在程度还是范围是均比s区元素化合物所表现的共价性大。
Cu族元素由于次外层电子刚充满不稳定,易失去1~2个d 电子,因此Cu族有+1、+2、+3氧化态,而IA一般只有+1,由于具有较多的d电子及外层空轨道,ds区元素有强烈的形成配合物的倾向,而s区元素除了和大环配体外一般较难形成配合物。
三、ds区元素单质的重要化学性质1、IB与ⅡB金属活泼性比较ⅡB族金属活泼性大于IB族金属2、空气中稳定性ds区金属在空气中室温下是稳定的。
但Cu和Zn在潮湿空气中能形成碱式碳酸盐,反应为:2Cu+O2+CO2+H2O=Cu2(OH)2CO33、对酸稳定性除了可溶于王水外,金和所有的酸都不反应Au+4HCl+HNO3=H[AuCl4]+NO+2H2O4、对碱稳定性Zn是ds区中唯一能与碱反应的金属Zn+2H2O+2NaOH=Na2[Au(OH)4]+H2四、ds区元素的重要化合物1、氧化物和氢氧化物在ds区元素盐溶液中加入碱,可得相应的氢氧化物,但AgOH 和Hg(OH)2不稳定,易立即分解为氧化物2Ag++2OH-=Ag2O+H2OHg2++2OH-=HgO+H2OCuOH易分解得红色Cu2O,氧化物中ZnO为两性,CuO以碱性为主,略显两性,其余均为碱性氧化物.淡蓝色的Cu(OH)2受热也发生分解反应:Cu(OH)2=CuO+H2O. Cu(OH)2也为微弱的两性化合物.Zn(OH)2和Cd(OH)2均为白色沉淀,前者为两性化合物。
后者是碱性化合物。
二者均和Cu(OH)2一样可溶于NH4+存在的氨水中,反应式为:Zn(OH)2+2NH3+2NH4+=[Zn(NH3)4]2++2H2OCd(OH)2+2NH3+2NH4+=[Cd(NH3)4]2++2H2OCu(OH)2+2NH3+2NH4+=[Cu(NH3)4]2++2H2O2、卤化物ⅡB族元素的卤化物较为重要,主要有ZnCl2、HgCl2(升汞)、HgI2和Hg2Cl2(甘汞)。