医学化学讲稿31
- 格式:doc
- 大小:60.00 KB
- 文档页数:2


医用化学说课稿单元说课:糖类我说课的题目是医用化学的第十一章《糖类》,这本书是化学工业出版社出版的高职高专十二五规划教材。
下面我将从课程单元分析、教学策略、学法指导、教学设计、预期效果分析五个方面展开说课。
课程单元分析(说内容)指导思想首先简单概括一下教学指导思想《医用化学》课程作为高职护理专业的基础课程,授课对象是护理专业一年级新生,这门课程内容涵盖了与医学相关的化学基本理论、基本知识和基本技能等方面。
化学是是一门历史悠久而充满活力的自然科学,它和医学的关系非常密切。
人体内许多生理现象和病理现象都包含着复杂的化学变化。
人体的营养物质在体内的代谢也同样遵循化学的基本原理。
疾病的诊断、治疗,与化学密切相关。
因此,必须掌握一定的化学知识,才能更好的为临床医学服务。
护理专业学好化学非常必要,而糖类在高职护理专业的后续课程如生物化学、药理学中也都属于重要内容,在医用化学中学习的糖类知识是学好续课程的基础。
在这门课上学生将会掌握重要糖类的结构特征和主要化学性质,学会对不同类型的糖进行鉴别,为未来的专业学习和医疗工作打下坚实基础。
下面介绍本节课内容在教材体系中的地位和作用,糖类这一章处在本课程靠后的位置,它属于医用化学中有机化学的重要内容。
在医用化学课程中,有机化学占了很大一部分比重,本教材中有机化学又主要分为烃类,烃的衍生物,天然有机化合物三大模块。
这三大模块组成了比较完整的有机化学知识体系。
其中天然有机化合物包含了糖类、蛋白质、核酸、萜类、甾体化合物等。
本教材将糖类单独列成一章,突显出其重要性,把它安排在烃的衍生物之后,是因为它和烃、烃的衍生物有着密切的联系,从知识内涵看,糖类属于多官能团化合物,是烃的衍生物的延续和发展。
从学生的认知水平看,已经对各种官能团的结构、性质和反应有了一定的认识和理解。
学习本章,不仅使学生懂得糖类的重要知识,还能对已有知识起到巩固和深化的作用。
教学目标依据新课程理念,本着对教材结构和内容的理解,结合学生的学习基础和认知特点,确定学习目标如下:知识与技能1、熟悉常见糖类的结构组成、主要化学性质,了解一些医学上常见的糖类用途。

天然药物化学讲课稿范文药物化学是研究天然药物的成分和结构以及其在人体内的代谢过程的学科之一。
天然药物指的是从动植物中提取的药物,其主要特点是由多种成分组成,具有广谱的生物活性。
天然药物中的化学成分主要包括生物碱、酚类化合物、多糖类、皂苷等。
生物碱是天然药物中较常见的一类成分,具有多种生物活性,如镇痛、抗菌、抗癌等。
酚类化合物是天然药物中具有抗氧化和抗炎作用的重要成分。
多糖类主要存在于植物药材中,具有抗肿瘤、免疫调节等功效。
皂苷则具有一定的溶血作用和降低血脂的功效。
天然药物中的这些化学成分对于人体的作用机制主要是通过调节生物体内的代谢过程来发挥治疗作用。
例如,生物碱可以通过与细胞膜上的受体结合,调节细胞信号传导通路,从而达到抑制肿瘤生长和减轻疼痛的效果。
酚类化合物则可以通过抗氧化作用保护细胞免受氧化应激的损伤,减轻炎症反应。
多糖类则可以激活机体的免疫系统,增强免疫力。
皂苷则可以抑制胆固醇的合成,降低血脂浓度。
尽管天然药物具有广泛的生物活性,但其在研发和使用过程中也存在一些问题。
首先,天然药物的提取和纯化过程较为复杂,易受到外界因素的干扰。
其次,天然药物中的活性成分结构复杂,不易确定其药效靶点。
再次,天然药物的副作用和毒性也需要引起重视。
为了克服这些问题,天然药物化学研究将对天然药物进行结构修饰和合成改造,以提高其活性和稳定性,并减少不良反应。
通过合理设计和优化药物分子的结构,可以改变其药物代谢途径和生物利用度,进而提高其疗效。
此外,通过合成类似物和衍生物的方法,可以拓展天然药物的结构空间,发现新的候选药物。
总结起来,天然药物化学作为研究天然药物的成分和结构的学科,对于了解药物的作用机制和进行药物的合成改造具有重要意义。
通过深入研究和应用天然药物化学,可以为新药的发现和开发提供理论基础和技术支持。
同时,也需要注意天然药物的副作用和毒性,确保其在临床应用中的安全性和有效性。
2007---2008学年第一学期第15周第1页第一部分:复习引入:提问什么叫同分异构?它如何分类?答:分子式相同而结构式不同的异构叫做同分异构,同分异构包括构造异构(也称结构异构)和立体异构。
构造异构是指分子中原子或官能团的连接顺序或方式不同而产生的异构,包括碳链异构、官能团异构、位置异构和互变异构。
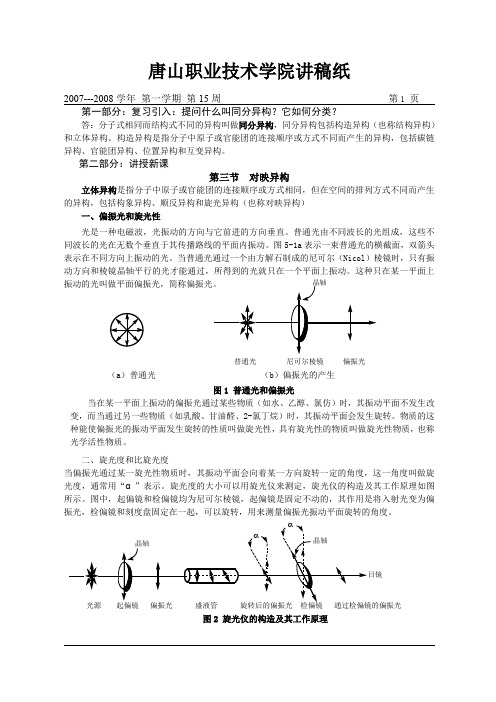
第二部分:讲授新课第三节对映异构立体异构是指分子中原子或官能团的连接顺序或方式相同,但在空间的排列方式不同而产生的异构,包括构象异构、顺反异构和旋光异构(也称对映异构)一、偏振光和旋光性光是一种电磁波,光振动的方向与它前进的方向垂直。
普通光由不同波长的光组成,这些不同波长的光在无数个垂直于其传播路线的平面内振动。
图5-1a表示一束普通光的横截面,双箭头表示在不同方向上振动的光。
当普通光通过一个由方解石制成的尼可尔(Nicol)棱镜时,只有振动方向和棱镜晶轴平行的光才能通过,所得到的光就只在一个平面上振动。
这种只在某一平面上普通光尼可尔棱镜偏振光(a)普通光(b)偏振光的产生图1 普通光和偏振光当在某一平面上振动的偏振光通过某些物质(如水、乙醇、氯仿)时,其振动平面不发生改变,而当通过另一些物质(如乳酸、甘油醛、2-氯丁烷)时,其振动平面会发生旋转。
物质的这种能使偏振光的振动平面发生旋转的性质叫做旋光性,具有旋光性的物质叫做旋光性物质,也称光学活性物质。
二、旋光度和比旋光度当偏振光通过某一旋光性物质时,其振动平面会向着某一方向旋转一定的角度,这一角度叫做旋光度,通常用“α”表示。
旋光度的大小可以用旋光仪来测定,旋光仪的构造及其工作原理如图所示。
图中,起偏镜和检偏镜均为尼可尔棱镜,起偏镜是固定不动的,其作用是将入射光变为偏振光,检偏镜和刻度盘固定在一起,可以旋转,用来测量偏振光振动平面旋转的角度。
图2 旋光仪的构造及其工作原理2007---2008学年 第一学期 第15周 第2 页 偏振光振动平面旋转的方向是根据刻度盘旋转的方向确定的,若刻度盘以逆时针方向旋转,表明被测物质是左旋体,用“-”表示,若刻度盘以顺时针方向旋转,表明被测物质是右旋体,用“+”表示。


医学化学教案范文教案名称:医学化学教学目标:1.理解医学化学的基本概念和原理。
2.了解医学化学在医学领域中的应用。
3.掌握医学化学实验室中常见的仪器和试剂的使用方法。
教学内容:1.医学化学的基本概念和原理a.介绍医学化学的定义和发展历程。
b.讲解医学化学中的基本概念,如离子、分子、化学键等。
c.介绍基本的化学反应和化学平衡原理,如酸碱反应、氧化还原反应等。
d.讲解溶液中的浓度计算方法和浓度单位。
e.介绍常见的化学元素和它们在生物体内的分布和生物功能。
2.医学化学的应用a.讲解医学化学在临床诊断中的应用,如血液与尿液检查。
b.介绍医学化学在药物研发和药物监测中的应用。
c.讲解医学化学在遗传学和分子生物学研究中的应用。
3.实验教学a.介绍医学化学实验室中常见的仪器和试剂,如分光光度计、pH计、色谱仪等。
b.讲解医学化学实验的设计和操作步骤。
c.指导学生进行医学化学实验,如溶液的配制、酸碱中和反应的观察等。
d.教授学生实验数据的处理和分析方法。
教学方法:1.讲授:使用多媒体教具,结合图表和实例进行讲解,解释医学化学的基本概念和原理。
2.互动讨论:提问学生并引导他们进行讨论,激发学生思维,加深对医学化学的理解。
3.实验操作:安排实验实践活动,让学生亲自操作仪器和试剂,加深对医学化学实验的理解和掌握。
教学评估:1.课堂小测:通过课堂小测考察学生对医学化学基本概念和原理的理解和记忆能力。
2.实验报告:要求学生按照规定的格式撰写实验报告,包括实验目的、操作步骤、结果及分析等。
3.课堂讨论:引导学生进行小组讨论,根据所学知识分析和解决实际临床问题。
教学资源:1.多媒体教具:使用电子课件、视频等多媒体教具辅助教学。
2.实验仪器:提供分光光度计、pH计、色谱仪等实验仪器供学生操作。
3.教材和参考书:根据课程内容选用合适的医学化学教材和参考书。
教学安排:本课程总共需要12学时,每学时计划50分钟。
教学进度安排:第一学时:介绍医学化学的基本概念和原理。
2011---2012学年 第一学期 第4周 第1 页 第一部分:复习引入1、提问:什么叫物质的量浓度?答:物质的量浓度:物质的量浓度简称浓度,定义为溶质B 的物质的量nB 除以溶液的体积V ,即: 单位: mol·L -1;mmol·L -1;μmol·L -1。
2、提问:什么叫质量浓度? 答:溶质B 的质量m B 除以溶液的体积V ,即: 单位:g·L -1 3.提问:物质的量浓度与质量浓度的换算是什么?答: ρB =c B ×M B第二部分:讲授新课 第二节 溶液的渗透压力一、渗透现象和渗透压力在一杯纯水中加入几滴红墨水,过一会儿,整杯水就逐渐变红,最后得到浓度均匀的红色液体,这是因为溶质分子和溶剂分子相互扩散的结果。
扩散是一种双向运动,在任何纯溶剂和溶液之间或两种不同浓度的溶液之间,都会有扩散现象发生。
即:只要存在浓度差,就会由扩散现象发生。
扩散的结果,得到均匀一致的溶液。
半透膜是一种只允许某些物质(小分子如水分子、离子)透过而不允许另一些物质(大分子如蛋白质分子等)透过的薄膜,如鸡蛋膜、动物肠衣、膀胱膜、细胞膜、毛细血管壁等。
用半透膜将两不同浓度溶液隔开,则会产生单向扩散现象,这种现象称作渗透现象。
象这样由溶剂分子通过半透膜,由纯溶剂进入溶液(或由稀溶液进入浓溶液)的自发过程称为渗透现象,简称渗透。
产生渗透现象必须具备的条件:一是要有半透膜;二是膜两侧溶液要存在的浓度差。
渗透与扩散的区别:扩散是高浓度向低浓度扩散;渗透是由低浓度向高浓度渗透。
当溶液与纯溶剂用半透膜隔开时,为了阻止渗透现象的发生而施加于溶液液面上的额外压力称为渗透压力,用П表示,单位:Pa 或KPa 。
如果被半透膜隔开的是两种不同浓度的溶液,为阻止渗透现象发生,应在较浓溶液上施加一压力,这一压力应是两溶液的渗透压力之差。
反渗透:若选用一种高浓度耐高压的半透膜把纯溶剂和溶液隔开,如果在溶液一侧外加一个大于渗透压的压力时,水不仅不从溶剂向溶液渗透,反而从溶液中向溶剂中扩散,这种现象称为反渗透。
有关化学的演讲稿大学生化学是一门关于物质的科学,它研究了物质的组成、性质和变化。
作为一名大学生,我对化学产生了浓厚的兴趣,并且认为化学在我们的日常生活和社会发展中发挥着重要作用。
在本演讲稿中,我将为大家介绍一些有关化学的知识和应用,希望可以增进对这门学科的了解。
首先,让我们来谈谈化学在医学领域的应用。
化学不仅可以帮助医生诊断疾病,还可以制造药物来治疗疾病。
例如,药物如何选择适合的剂量和途径是一个关键的问题。
化学家通过研究药物在体内的代谢和排泄过程,帮助医生确定药物的最佳用量和给药途径,以确保药物的安全和有效。
此外,化学分析技术也被广泛应用于药物研发过程中,帮助科学家分析药物的结构、纯度和稳定性。
通过化学的帮助,药物研究和开发取得了巨大的进展,为人类健康提供了许多有效的治疗方案。
除了医学领域,化学还在环境保护中起到了重要的作用。
我们都知道环境污染是一个严重的问题,化学可以帮助我们更好地理解和解决这个问题。
例如,化学分析技术可以检测污染物的种类和浓度,帮助科学家监测环境质量并采取相应的措施。
此外,化学还可以开发新的材料和技术,用于环境污染物的净化和处理。
例如,化学吸附剂可以有效地去除废水中的有害物质,化学催化剂可以加速废气中有害物质的分解。
通过化学的努力,我们可以更好地保护我们的环境,创造一个更加清洁和可持续的世界。
另外,化学在能源领域也发挥着重要作用。
能源是现代社会的核心需求,而化学可帮助我们更高效地利用和储存能源。
例如,化学反应可以转换不同形式的能量,例如化学能转化为电能或热能。
此外,化学还可以帮助我们研发新的能源材料,例如电池和太阳能电池板。
通过研究和应用化学原理,我们可以提高能源利用效率,减少对传统能源的依赖,实现可持续能源的目标。
最后,让我们来谈谈化学对于食品安全的重要性。
食品安全是关系到每个人的健康和生存的问题,化学可以确保食物的质量和安全。
化学分析可以检测食物中的有害物质,例如农药残留和重金属污染。
2008---2009学年第一学期第19周第1页
实验:糖、胺、酰胺的性质
一、实验目的
通过糖、苯胺和尿素性质的实验,加深对糖、胺、酰胺等化合物性质的认识,进一步体会各类有机物的分子结构与其化学性质的关系,并掌握一些有机物的简单鉴别方法。
二、实验原理
1、糖
糖是多羟基醛、多羟基酮或它们的脱水缩合物。
单糖及分子结构中含有半缩醛(酮)羟基的二糖都有还原性,能将班氏试剂还原成砖红色的Cu2O沉淀。
蔗糖等不含半缩醛(酮)羟基的糖则无还原性。
蔗糖在酸或酶的存在下水解,生成葡萄糖和果糖,因而水解液具有还原性。
多糖是由许多单糖分子缩合而成的高分子化合物,无还原性。
但多糖在酸或酶的存在下水解,可生成许多小分子单糖,水解液具有还原性。
淀粉为一多糖,经水解先生成各种糊精、麦芽糖,最终水解产物是葡萄糖,因此水解液具有还原性。
淀粉与碘液作用呈现蓝色,当淀粉水解时,分子由大逐渐变小,遇碘液的颜色也由蓝色向紫色、红色变化,当淀粉水解到麦芽糖、葡萄糖时,遇碘液则不显色,因此可用碘液来检验淀粉的水解程度。
糖在浓硫酸存在下,与α-萘酚反应显紫色,此颜色反应称为莫利许反应,常用于糖类化合物的检出。
2、胺
苯胺是芳香族伯胺,微溶于水,呈弱碱性,能与无机强酸作用生成可溶性的苯胺盐。
苯胺分子中氨基和苯环互相影响,p-π共轭的结果,使苯环上邻、对位氢原子活泼性增加,容易与溴水反应,生成2,4,6-三溴苯胺白色沉淀,用此反应可鉴别苯胺。
苯胺能与乙酐发生酰化反应,生成乙酰苯胺。
3、尿素
尿素是碳酸的二酰胺,具有弱碱性,能与硝酸作用生成难溶于水的盐。
尿素在碱性溶液中经加热,水解而放出氨气。
将尿素(固体)加热至熔点以上(150~160℃),2分子尿素脱去一分子氨而生成缩二脲。
缩二脲分子中含有2个肽键。
凡化合物分子中含有2个或2个以上肽键时,在碱性溶液中均可与CuSO4生成紫红色的配合物,此颜色反应称为缩二脲反应。
三、实验方法和注意事项
1、糖的性质
(1)糖的还原性:取5支试管,编好号码,各加入1ml班氏试剂,再分别加入0.11mol·L-1葡萄糖、0.11mol·L-1果糖、0.06mol·L-1蔗糖、0.06mol·L-1麦芽糖、20g·L-1淀粉溶液各10滴。
摇匀后,把试管放入沸水浴中加热2~3分钟,观察那支试管中生成砖红色沉淀,尤其注意蔗糖和淀粉溶液的实验结果,解释所观察到的现象。
(2)蔗糖的水解:取2支试管,各加入0.06mol·L-1蔗糖溶液1ml,然后于第一支试管中加入3滴浓盐酸,第二支试管中加入3滴蒸馏水,摇匀后将两支试管同时放入沸水浴中加热5~10分钟,取出冷却后,第一支试管中加入1mol·L-1Na2CO3溶液中和弱碱性(加到没有气泡发生为止,或用石蕊试纸检查)。
然后将2支试管各加入班氏试剂10滴,摇匀,再放入沸水浴中加热2~3分钟,观察并比较两试管结果。
(3)淀粉与碘的作用:取1支试管,加入20g·L-1淀粉溶液5滴,加水1ml,然后加入1滴碘试液,摇匀,观察呈现的颜色。
将此试管加热至沸有何现象?放冷后,又有什么变化,为什么?
(4)淀粉的水解:取1支试管,加入20g·L-1淀粉溶液2ml,再加浓盐酸3滴,摇匀,再沸水浴中加热10~15分钟,加热使每隔2~3分钟用滴管吸出1滴反应液,置于点地板上的1个凹穴中,加碘试液1滴,注意观察其颜色变化,待反应液与碘试液不再显色时,继续加热1~2分钟。
取出试管,冷却后,用1mol·L-1Na2CO3中和为弱碱性,加入班氏试剂5~10滴,再在沸水浴中加入2~3分钟,观察结果。
(5)莫利许反应:取4支试管,分别加入0.11mol·L-1葡萄糖、0.11mol·L-1果糖、0.06mol·L-1
2008---2009学年第一学期第19周第2页
蔗糖、20g·L-1淀粉溶液各1ml,各加入新配置的莫利许试剂2滴,摇匀后,将试管倾斜成45°角,分别沿试管壁徐徐注入浓硫酸1ml,切勿摇动。
然后小心竖起试管,糖溶液和浓硫酸清楚地分为两层,注意观察两液面之间有无紫色环出现!如无紫色环出现,可在水浴中温热后再进行观察。
2、苯胺的性质
(1)苯胺的弱碱性:取1支试管,加入3滴苯胺和1ml水,振摇,观察苯胺是否完全溶解?然后加入浓盐酸2~3滴,振摇后观察溶液是否澄清,为什么?
(2)与溴水反应:在1支试管中,加入1滴苯胺和2~3ml水,振摇后逐滴加入饱和溴水2~3滴,观察结果。
(3)苯胺的酰化反应:取1只干燥试管,加入苯胺10滴,逐滴加入乙酐10滴,边加边振摇,并将试管放入冷水中冷却。
然后加入5ml水,振摇后观察有何现象发生。
3、尿素的性质
(1)尿素的弱碱性:取1支试管,加入5mol·L-1尿素溶液5滴,然后加入5滴浓硝酸,观察有何现象?
(2)尿素的水解:在1支试管中,加入2.5mol·L-1氢氧化钠溶液10滴,5mol·L-1尿素溶液5滴,将试管加热,并将润湿的红色石蕊试纸放在试管口,观察颜色的变化。
(3)缩二脲的生成和缩二脲反应:取1支干燥试管,加入约0.2克尿素,在酒精灯焰上加热至熔化,随即有氨气放出(嗅其气味或用润湿的红色石蕊试纸检查),继续加热至试管内的物质凝固,此生成物即为缩二脲。
将试管放冷后,加入2ml水和2.5mol·L-1氢氧化钠溶液3~5滴,用玻璃棒搅拌并加热,尽量使固体溶解。
然后将一部分上层清液转入另一支试管中,逐滴加入0.06mol·L-1CuSO41~2滴,观察有何颜色产生?
4、注意事项:
(1)蔗糖和淀粉水解实验中,在加班氏试剂前需将溶液中和为弱碱性。
否则没有实验现象。
(2)苯胺的酰化反应所使用的试管必须是干燥的。
(3)缩二脲反应中,硫酸铜的用量不能过量,过量颜色为蓝色。
三、学生分组实验:(教师作巡视指导)
四、指导学生完成实验报告。