蛋白酶活性的测定
- 格式:doc
- 大小:17.50 KB
- 文档页数:4

蛋白酶活力测定实验报告
实验目的:
通过测定蛋白酶的活力,了解其功能和活性。
实验原理:
蛋白酶是一类能够水解蛋白质的酶,可以将蛋白质分解为多肽和氨基酸。
蛋白酶活力是指单位时间内酶水解蛋白质的能力,通常以单位时间内水解的底物的量来表示。
本实验使用的方法是酶促反应测定法。
首先,将待测蛋白酶与底物混合,反应一定时间后,停止反应并添加淀粉溶液产生反应终止剂,最后用碘化钾溶液滴定反应产物。
实验步骤:
1. 预备试剂:制备蛋白酶和底物的工作液,制备淀粉溶液和反应终止剂,制备碘化钾溶液。
2. 实验装置:准备滴定装置和试管架。
3. 设置实验条件:保持温度恒定,控制pH值。
4. 实验操作:在试管中加入待测蛋白酶和底物工作液,反应一定时间后,加入淀粉溶液和反应终止剂,最后用碘化钾溶液滴定。
5. 记录数据:记录滴定所需碘化钾的体积,计算出酶活力。
实验结果:
根据实验数据,计算出蛋白酶的活力,通常以单位时间内水解的底物的量来表示。
实验讨论:
分析实验结果,比较不同条件下蛋白酶的活力差异,并讨论影响蛋白酶活力的因素。
实验结论:
通过分析实验结果,得出结论,总结蛋白酶活力与其他因素之间的关系,并提出可能的应用前景。
实验总结:
总结实验过程,评价实验结果及数据,提出改进意见,并对今后可能的研究方向进行展望。
参考文献:
列出所参考的文献。

蛋白酶活性的测定方法
蛋白酶活性的测定方法有多种,常见的方法包括:
1. 比色法:基于酶催化底物的产物与染色剂之间发生化学反应的原理。
测定过程中,酶水解底物产生的产物与染色剂发生反应形成有色产物,通过测定产物的吸光度来估计酶活性的强弱。
2. 荧光法:利用荧光底物的酶催化产物发出的荧光信号来测定酶活性。
荧光强度与酶催化产物的浓度成正比,通过测定荧光强度来分析酶活性。
3. 放射性标记法:将底物标记上放射性同位素,使其具有放射性。
通过测定底物放射性崩解的程度来估计酶活性的大小。
4. 免疫学方法:利用特异性抗体与酶结合形成抗原-抗体-酶复合物,测定抗原-抗体-酶复合物的活性来检测酶活性的强弱。
5. 吸收光谱法:利用特定的酶底物,通过测量其吸收光谱的变化来分析酶活性的强弱。
需要根据具体实验目的和条件选择适合的测定方法。

蛋白酶酶活测定方法一、实验原理:一定条件下不仅能够水解蛋白质中的肽键,也能够水解酰胺键和酯键,因此可用蛋白质或人工合成的酰胺及脂类化合物作为底物来测定蛋白酶的活力。
本实验选用酪蛋白为底物,测定微生物蛋白酶水解肽键的活力。
酪蛋白经蛋白酶作用后,降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中,溶解于三氯醋酸(TCA)溶液的肽的数量与酶的数量和反应时间成正比。
在280nm波长下测定溶液吸光度的增加,计算酶的活力。
一分钟内1mg牛血清蛋白(BSA)相当的非蛋白性Lowry试液显色物质的增量值定义为一个蛋白酶活性单位(IU)。
二、试剂配制:A溶液:含2%KCl,1%TrltonX-100的50mM磷酸盐缓冲溶液(pH 6.0)试样TG酶溶液:直接取发酵样12000rpm离心5min,取上清测定。
底物溶液:精确称取底物二甲基酪蛋白0.250g,加入50mM PB缓冲溶液(pH 6.0)10mL,常温搅拌30min使其溶解后备用。
三、操作步骤:1. 试样1)将底物溶液放入37℃恒温水浴中预热备用2)试管中加入试样TG酶溶液0.2mL后放入恒温水浴中,10min后加入已预热的底物溶液1mL,立即振荡混合,于37℃反应60min3)反应结束后,加入12% TCA溶液1mL,再于37℃反应30min,使反应终止4)20℃,3000rpm,20min离心后取上清备用。
2.空白1)试管中加入已预热底物溶液1mL,再加入12% TCA溶液1mL,振荡混合后,于37℃反应60min2)加入试样TG酶溶液0.2mL,振荡混合后,于37℃反应30min3)20℃,3000rpm,20min离心后取上清备用。
四、Lowry法显色反应试管中分别加入试样清液和空白清液各0.2mL,加入A溶液1mL,振荡混合后室温下放置10min,然后加入试剂B 0.1mL,振荡混合后,于37℃反,空白的吸应30min。
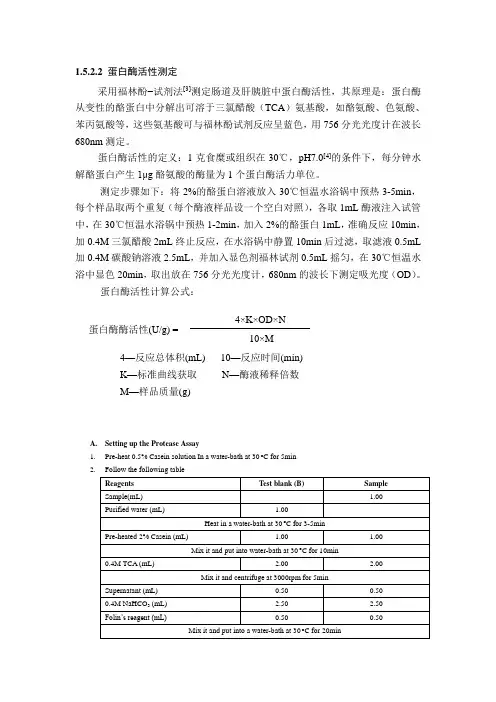
1.5.2.2 蛋白酶活性测定采用福林酚−试剂法[3]测定肠道及肝胰脏中蛋白酶活性,其原理是:蛋白酶从变性的酪蛋白中分解出可溶于三氯醋酸(TCA )氨基酸,如酪氨酸、色氨酸、苯丙氨酸等,这些氨基酸可与福林酚试剂反应呈蓝色,用756分光光度计在波长680nm 测定。
蛋白酶活性的定义:1克食糜或组织在30℃,pH7.0[4]的条件下,每分钟水解酪蛋白产生1μg 酪氨酸的酶量为1个蛋白酶活力单位。
测定步骤如下:将2%的酪蛋白溶液放入30℃恒温水浴锅中预热3-5min ,每个样品取两个重复(每个酶液样品设一个空白对照),各取1mL 酶液注入试管中,在30℃恒温水浴锅中预热1-2min ,加入2%的酪蛋白1mL ,准确反应10min ,加0.4M 三氯醋酸2mL 终止反应,在水浴锅中静置10min 后过滤,取滤液0.5mL 加0.4M 碳酸钠溶液2.5mL ,并加入显色剂福林试剂0.5mL 摇匀,在30℃恒温水浴中显色20min ,取出放在756分光光度计,680nm 的波长下测定吸光度(OD )。
蛋白酶活性计算公式:4—反应总体积(mL) 10—反应时间(min) K —标准曲线获取 N —酶液稀释倍数 M —样品质量(g)A. Setting up the Protease Assay1. Pre-heat 0.5% Casein solution In a water-bath at 30 o C for 5min2. Follow the following table蛋白酶酶活性(U/g) =4×K×OD×N 10×M3.4.Follow the following table to determine sample blank。

实验四蛋白酶活力的测定一、实验目的1、了解蛋白酶活力测定的原理;2、掌握蛋白酶活力测定的方法。
二、实验原理蛋白酶在一定条件下不仅能够水解蛋白质中的肽键,也能够水解酰胺键和酯键,因此可用蛋白质或人工合成的酰胺及酯类化合物作为底物来测定蛋白酶的活力。
本实验选用酪蛋白为底物,测定微生物蛋白酶水解肽键的活力。
酪蛋白经蛋白酶作用后,降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽就沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中,溶解于三氯醋酸溶液中的肽的数量正比于酶的数量和反应时间。
在280nm波长下测定溶液吸光度的增加,就可计算酶的活力。
三、实验试剂①微生物蛋白酶萃取液(0.01g/ml):称取1.0g酶制剂,加100ml蒸馏水搅拌30min,在4℃下离心分离后,将上层清夜置于冰箱中保存,使用前稀释一定倍数;② 0.02mol/L磷酸盐缓冲液(pH7.5);③ 1%酪蛋白溶液:取1.0g酪蛋白,加100ml 0.2mol/L磷酸盐缓冲液(PH7.5),加热并搅拌使它完全分散,然后置于冰箱中保存;④ 5%三氯醋酸(TCA)溶液。
四、实验步骤1、将5%TCA溶液和1%酪蛋白溶液在37℃下保温。
2、取四支15ml具塞试管,分别标上记号A1、A0、B1和B0。
在A1和A0试管中各吸入0.20ml酶液,在B1和B0试管中各吸入0.40ml酶液,分别用0.2mol/L 磷酸盐缓冲液定容至2.00ml。
在A0和B0试管中各吸入6.00ml5%三氯醋酸溶液,上述四支试管都置于37℃水浴中保温。
3、在各试管中吸入2.00ml 1%酪蛋白溶液,在37℃下保温10min(准确计时)后,再向A1和B1试管中吸入6.00ml5%三氯醋酸溶液。
4、将试管从水浴中取出,在室温下放置1h,用少量上清液润湿滤纸后过滤,保留滤出液。
5、在280nm波长下,分别以A0和B0滤液为空白,测定A1和B1滤液的吸光度。

1 蛋白酶活力的测定1.1 原理采用福林-酚试剂法。
福林-酚试剂在碱性条件下可被酚类化合物还原呈蓝色(钼蓝和钨蓝混合物),由于蛋白质分子中有含酚基的氨基酸(如酪氨酸、色氨酸等),可使蛋白质及其水解产物呈上述反应。
因此可利用此原理测定蛋白酶活力。
通常以酪蛋白为底物,在一定pH值和温度条件下,同酶液反应,经一段时间后终止酶促反应,经离心或过滤除去酪蛋白筹沉淀物后取上清液,用Na2CO3碱化,再加入福林-酚试剂显色,蓝色的深浅与滤液中生成产物酪氨酸量成正比;酪氨酸含量用分光光度计在660nm波长处测定,从而计算出蛋白酶的活力。
1.2 试剂1.2.l 福林-酚试剂向2000mL的磨口回流瓶中加入100g钨酸钠(Na2WO4?2H2O)、25g钼酸钠及700mL的去离子水,再加入50mL85%的磷酸及浓盐酸l00mL,充分混合后,接上回流冷凝管,以文火回流10h,结束后再加入150g的硫酸锂(LiSO4)、50mL去离子水及数滴溴水,再继续沸腾15min,以驱除过量的溴,冷却后滤液呈黄绿色(如仍呈绿色,需再重复滴加溴水的步骤),加去离子水定容至1000mL乱,过滤,滤液置于棕色试剂瓶中,贮于冰箱中可长期保存备用。
此溶液使用时可按1:3比例用去离子水稀释。
1.2.2 0.4mol/L三氯乙酸(TCA)溶液精确称取TCA65.4g,加去离子水定容至1000mL。
1.2.3 0.4mo1/L碳酸钠溶液精确称取无水碳酸钠42.4g,加去离于水溶解后,定容至1000mL。
1.2.4 pH值3~6醋酸缓冲液精确取NaAc?3H2O16g与268mL浓度为6mol/L醋酸溶液混合,用去离子水稀释定容至1000mL。
1.2.5 2%酪蛋白底物缓冲液1.2.5.1 测试酸性蛋白酶缓冲液精确称取酪蛋白20g,加入0.1mol/L氢氧化钠20mL(用去离子水配制),在水浴中加热溶解,然后用pH值3.6醋酸缓冲液定容至1000mL。

精品文档蛋白酶活性的测定方法(GB/T23527-2009)1 原理蛋白酶对酪蛋白、乳清蛋白、谷物蛋白等都有很好的水解作用。
磷钨酸和磷钼酸混合试剂,即福林 - 酚试剂,碱性条件下极不稳定,易被酚类化合物还原而呈蓝色反应(钨兰和钨兰混合物)。
由于蛋白质中含有具有酚基的氨基酸(酪氨酸、色氨酸、苯丙氨酸),因此,蛋白质及其水解产物也呈此反应。
利用蛋白酶分解酪素(底物)生成含酚基氨基酸的呈色反应,来间接测定蛋白酶的活力。
2 仪器和设备2.1 分析天平:精度 0.0001g2.2 恒温水浴:精度土 0.2 C2.3 计时表2.4 分光光度计2.5 沸水浴器2.6 振荡混合器2.7 pH计:精度0.01pH单位3 试剂和溶液3.1 乳酸缓冲液(pH=3.0)适用于酸性蛋白酶甲液:称取乳酸( 80%-90%)1 0 .6g, 加水溶解并定容至 1000ml。
乙液:称取乳酸钠(70% 16g,加水溶解并定容至1000ml.使用溶液:取甲液 8ml, 加乙液 1ml, 摇匀,稀释一倍,即成 0.05mol/L 乳酸缓冲溶液。
3.2 磷酸缓冲液的制备(pH=7.5)适用于中性蛋白酶准确称取磷酸氢二钠( Na2HPO3.12H2O)6.02 和磷酸二氢钠( NaH2PO3.2H2O) 0.5g, 加水定容至1000ml3.3 硼酸缓冲液(pH=10.5)适用于碱性蛋白酶甲液:称取硼酸钠19.08g, 加水溶解并定容至 1000ml。
乙液:称取氢氧化钠 4.0g, 加水溶解并定容至 1000ml. 使用溶液:取甲液500ml, 加乙液 400ml, 摇匀,用水稀释至 1L。
3.4 0.4mol/L 碳酸钠溶液:准确称取无水碳酸钠 42.4g, 以蒸馏水溶解定溶至 1000ml.3.5 0.4mol/L 的三氯醋酸液:准确称取 65.4 三氯醋酸, 以蒸馏水溶解定溶至 1000ml3.6 0.5mol/L 的 NaOH:准确称取2g NaOH溶解并定至100ml3.7 10.00mg/ml 酪素溶液称取酪素 1.000g, 准确至 0.001g, 用少量的 0.5mol/L 的氢氧化钠溶液(若为酸性蛋白酶则用浓乳酸 2-3 滴)润湿,, 加入适量的各适宜的缓冲液约80ml,在沸水浴中边加热边搅拌,直至完全溶解,冷却后,转入100ml容量瓶中 , 用适宜的缓冲液稀释至刻度 , 此溶液在冰箱内贮存 , 有效期为三天 .3.8 100卩g/ml酪氨酸标准溶液3.8.1准确称取预先于105C干燥至恒重的L-酪氨酸0.1000g ,用1mol/L 的盐酸 60ml 溶解后定容至 100ml, 即为 1.00mg/ml 的酪氨酸溶液 .精品文档3.8.2 吸取 1.00mg/ml 酪氨酸标准溶液 10.00ml, 用 0.1mol/L 盐酸定容至100ml,即得100.0卩g/ml L-酪氨酸标准溶液.3.9 酶样的制备准确称取 1.000g 固体酶或移取 1ml 液体酶样,用少量的适宜缓冲液溶解并用玻璃棒捣研 , 然后将上清液倒入 100ml 容量瓶, 沉渣中再添入少量缓冲液捣研多次 , 最后全部移入容量瓶 , 稀释到刻度 , 用四层纱布过滤。


一、脲酶活性测定方法(苯酚钠-次氯酸钠比色法)1.称取5g过100目筛的风干土样于50ml容量瓶中,加入1ml甲苯使其与土样充分混匀静置15min,使土壤中微生物被完全杀死;2.往瓶中加入10ml 100g/L的尿素溶液和20ml柠檬酸盐缓冲液,仔细混匀后置于37℃恒温下培养24h;3.用加热至38℃的蒸馏水稀释至刻度线(甲苯应浮在刻度线之上),摇匀,过滤;4.每一土样都设置用水代替基质的对照;对整个实验,设置无土壤的对照,以检验试剂的纯度;5.吸取3ml滤液到50ml容量瓶中,用水稀释至15ml,然后加入4ml苯酚钠溶液,并加入3ml次氯酸钠溶液,每次加完试剂都要摇匀;6.静置20min后,使其充分显色,定容显色液,于分光光度计578nm处比色,脲酶活性以24h后1g土壤中铵态氮的mg数表示。
1.取25ml酪氨酸基质溶液于100ml三角瓶中,于30℃水浴保温;2.加入5g鲜土,1ml甲苯,混匀后,30℃恒温箱中培养48h;3.取出三角瓶,加入25ml蛋白质沉淀剂,静置30min,待蛋白质沉淀后用干滤纸过滤;4.取2ml滤液于试管中,加入0.55mol/L Na2CO35ml,33% Folin试剂1ml,立即振荡;5.将试管放入30℃恒温水浴中,显色30min;6.用分光光度计在波长680nm处测定光密度,由标准曲线查出酪氨酸含量。
1.称取5g鲜土(过10目)于50ml刻度试管中,加0.2ml甲苯和9ml Tris缓冲液,混匀后加入1ml 0.05mol/L L-天冬酰胺溶液,混匀,37℃下培养2h后,加入35ml KCl-Ag2SO4混合溶液,混合均匀,静置冷却至室温(约5min),用KCl-Ag2SO4混合溶液定容,混匀;2.吸取20ml L-天冬酰胺溶液前,加入KCl-Ag2SO4混合溶液。

蛋白酶活性采用茚三酮比色法测定
称取29过lm二筛的风干土样置于IOOml三角瓶中。
往三角瓶中加入0.5ml甲苯,摇匀后放置15分钟。
再加入10ml用pH7.4磷酸缓冲液配制的白明胶溶液,将瓶塞紧,小心摇荡。
将三角瓶置于30℃恒温箱中,培养24h。
培养结束后,将瓶中悬液用致密滤纸过滤至另一三角瓶中。
吸取sml滤液于一试管中,加 0.5ml0.IN硫酸和 3ml20%硫酸钠以沉淀蛋白质,然后再过滤到另一试管中。
于上述试管中加入lm120/0荀三酮溶液,将混合物仔细摇荡,并在煮沸的水浴上
加热 10min。
将着色液转移到50ml容量瓶中,并用蒸馏水稀释至刻度。
用光电比色计于56Onm处进行比色测定。
实验设无土对照和无基质对照。
蛋白酶活性以24h后19土壤中酶促反应后生成的甘氨酸毫克数表示。
中性磷酸酶活性采用磷酸苯二钠比色法测定
取10.00g新鲜土壤(<lmm)于 100ml容量瓶中,加入1.5ml甲苯,室温下静置15min,然后加 10ml磷酸苯二钠溶液和ZOml柠檬酸缓冲溶液,盖上瓶塞,充分混匀后,37’C下培养3h,用38.C去离子水定容至IOOml,摇匀后迅速过滤。
同时做空白对照,用10ml去离子水代替磷酸苯二钠溶液。
三次重复。
取上述滤液卜4ml于 50ml容量瓶中,加 2.5ml缓冲液,混匀后用去离子水稀释至大约4Oml,再加0.5m12,6一二滇2424酮氯亚按溶液,室温下20一3Omin,定容至50ml,在 600nm处比色测定。
结果以24h后19土壤中释放出的酚的mg数表示。

华南农业大学综合实验报告实验项目名称:酶活力测定实验项目性质:综合实验计划学时:所属课程名称:食物与发酵工业分析实验完成时间:2013.05.10糖化酶活力测定(直接滴定法)一、原理采用可溶性淀粉为底物,在必然的pH值与温度下,使之水解为葡萄糖 (还原糖),以直接滴定法测定。
二、试剂及仪器(1)碱性酒石酸铜钾溶液(使历时等体积混合甲、乙溶液):甲液:称取15.693g硫酸铜(Cu2SO4·5H2O),0.05g次甲基蓝,用水溶解并稀释定容至1000mL;乙液:称取50g酒石酸钠钾,54g氢氧化钠,4g亚铁氰化钾,用水溶解并稀释定容至1000mL(2) 0.1%标准葡萄糖溶液:准确称取1g无水葡萄糖(预先在100-1050C 烘干),用水溶解,加5mL浓盐酸,用水定容至1000mL。
(3) pH4.6乙酸-乙酸钠缓冲溶液:0.2mol/L乙酸溶液:量取11.8mL冰乙酸,用水稀释至1000mL;0.2mol/L 乙酸钠溶液:称取27.2g乙酸钠(CH3COONa·3H2O),用水定容至1000mL;pH4.6乙酸-乙酸钠缓冲液:取0.2mol/L的乙酸溶液和0.2mol/L的乙酸钠溶液等体积混合。
(4) 0.1mol/L氢氧化钠溶液:称取4g氢氧化钠,用水溶解并定容至1000mL。
(5) 2%可溶性淀粉溶液:准确称取2g可溶性淀粉(预先于10-105 0C烘干),加少量水调匀,倾入80mL滚水中,继续煮沸至透明,冷却后用水定容至100mL。
(6)固体曲(7)滴定管、电子天平、烧杯、恒温水浴锅、脱脂棉、容量瓶、移液管、三角瓶3、测定步骤(1) 5%固体曲浸出液制备:称取5.0g固体曲(以绝干曲计),置于250mL 烧杯中,加90mL水和10mL pH4.6乙酸-乙酸钠缓冲溶液,搅匀,于30℃水浴中保温浸1小时,每隔15min搅拌一次。
用脱脂棉过滤,滤液为5%固体曲浸出液。
(2)固体曲糖化液的制备:吸取25mL 2%可溶性淀粉溶液,置于50mL容量瓶中,于30℃水浴预热10min。
SUMO蛋白酶活性片段的表达、纯化及活性测定
SUMO蛋白酶被认为在多种细胞过程中起着调节作用。
为了
进一步研究SUMO蛋白酶的生物学功能,需要进行其活性片
段的表达、纯化及活性测定。
首先,可以使用质粒构建技术从人类cDNA库中克隆SUMO
蛋白酶的一个片段,如Ulp1,Ulp2或Ulp3。
将其插入到表达
载体中,并进行适当的序列验证。
接下来,需要选择适当的宿主细胞进行表达。
常用的宿主细胞为大肠杆菌,但也存在其他表达系统,如酵母菌表达系统。
通过在表达时添加不同的诱导剂,可以控制蛋白的表达量和时机。
之后,需要对表达的蛋白进行纯化。
可以利用亲和纯化柱进行初步的纯化,然后再使用离子交换、凝胶过滤和透析等方式进行进一步的纯化。
纯化后的蛋白需要经过SDS-PAGE和Western blot验证。
最后,需要对SUMO蛋白酶活性片段进行活性测定。
可以观
察其对SUMO修饰蛋白的去SUMO化作用。
可以通过Western blot、荧光标记或质谱等方法进行定量。
活性测定的
结果可以用于进一步研究SUMO蛋白酶的生物学功能及调节
机制。
在表达、纯化和活性测定这一系列实验中,需要严格控制实验条件和研究方法。
同时,还需要注意跟踪和记录实验结果,以便后续分析和讨论。
一、实验目的1. 学习和掌握蛋白酶活性检测的基本原理和方法。
2. 了解蛋白酶的特性和作用。
3. 通过实验,学会使用相关仪器和操作技能。
二、实验原理蛋白酶是一种能够水解蛋白质的酶,其活性是指在一定条件下,蛋白酶催化蛋白质水解的能力。
蛋白酶活性检测通常采用紫外分光光度法,通过测定反应体系中蛋白质的降解程度来评估蛋白酶的活性。
三、实验材料与仪器1. 实验材料:(1)蛋白酶样品(2)底物:酪蛋白(3)缓冲液:磷酸盐缓冲液(pH 7.0)(4)其他试剂:硫酸铜、碘化钾、氢氧化钠等2. 实验仪器:(1)紫外分光光度计(2)恒温水浴锅(3)电子天平(4)移液器(5)试管(6)烧杯四、实验步骤1. 准备实验试剂和仪器。
2. 配制底物溶液:称取一定量的酪蛋白,加入适量磷酸盐缓冲液,溶解后备用。
3. 设置实验组:(1)取若干个试管,分别加入不同浓度的蛋白酶样品。
(2)在每个试管中加入相同体积的底物溶液。
(3)将试管放入恒温水浴锅中,设定温度为37℃,反应一定时间。
4. 设置对照组:(1)取若干个试管,分别加入相同体积的蛋白酶样品和底物溶液。
(2)将试管放入恒温水浴锅中,设定温度为37℃,反应一定时间。
5. 测定反应体系中蛋白质的降解程度:(1)取一定体积的反应体系,加入硫酸铜和碘化钾溶液。
(2)用紫外分光光度计测定反应体系的吸光度。
(3)根据吸光度计算蛋白质的降解程度。
6. 数据处理和分析:(1)绘制蛋白酶活性与酶浓度、反应时间的关系曲线。
(2)分析蛋白酶的特性和作用。
五、实验结果与分析1. 实验结果:(1)不同浓度的蛋白酶样品对底物溶液的降解程度不同。
(2)随着反应时间的延长,蛋白质的降解程度逐渐增加。
2. 分析:(1)蛋白酶的活性与酶浓度呈正相关,即酶浓度越高,活性越强。
(2)在一定反应时间内,蛋白酶活性随着反应时间的延长而增加,但当反应时间过长时,活性逐渐降低,可能是因为蛋白酶自身发生降解。
六、实验结论1. 通过本实验,掌握了蛋白酶活性检测的基本原理和方法。
酶工程实验报告一一、实验目的本次酶工程实验的主要目的是通过实际操作,深入了解酶的性质、作用机制以及酶的分离纯化和活性测定方法。
同时,培养我们的实验操作技能、观察分析能力和科学思维方法,为今后从事相关领域的研究和工作打下坚实的基础。
二、实验原理酶是一种具有生物催化功能的蛋白质或 RNA 分子。
它们能够在温和的条件下高效地催化各种化学反应,具有高度的特异性和催化效率。
本实验中所涉及的酶主要是蛋白酶和淀粉酶。
蛋白酶能够水解蛋白质中的肽键,将蛋白质分解为小分子肽和氨基酸。
其活性可以通过测定水解产物的生成量或底物的消耗量来进行评估。
淀粉酶能够水解淀粉分子中的α-1,4 糖苷键,将淀粉分解为麦芽糖和葡萄糖等小分子物质。
其活性通常通过测定淀粉的水解程度来确定,常用的方法是碘量法。
酶的分离纯化是基于酶与杂质在物理化学性质上的差异,如溶解度、分子大小、电荷性质等,采用一系列的分离技术,如沉淀、层析、电泳等,逐步去除杂质,获得高纯度的酶。
三、实验材料与设备1、实验材料蛋白酶提取液淀粉酶提取液酪蛋白淀粉溶液福林酚试剂碘液其他化学试剂2、实验设备离心机分光光度计恒温水浴锅移液器电泳仪层析柱四、实验步骤制备酪蛋白底物溶液:称取一定量的酪蛋白,用氢氧化钠溶液溶解,调节 pH 至适宜值,定容备用。
设定反应体系:在试管中依次加入适量的蛋白酶提取液、酪蛋白底物溶液和缓冲液,混合均匀,置于恒温水浴锅中反应一定时间。
终止反应:反应结束后,加入三氯乙酸溶液终止反应。
测定吸光度:离心去除沉淀,取上清液,加入福林酚试剂显色,在分光光度计上测定吸光度。
计算蛋白酶活性:根据标准曲线计算出反应生成的酪氨酸量,从而计算出蛋白酶的活性。
2、淀粉酶活性的测定制备淀粉溶液:称取一定量的淀粉,用缓冲液溶解,加热糊化,冷却后定容备用。
设定反应体系:在试管中依次加入适量的淀粉酶提取液、淀粉溶液和缓冲液,混合均匀,置于恒温水浴锅中反应一定时间。
终止反应:反应结束后,加入碘液终止反应。
蛋白酶活性的测定方法(GB/T23527-2009)1 原理蛋白酶对酪蛋白、乳清蛋白、谷物蛋白等都有很好的水解作用。
磷钨酸和磷钼酸混合试剂,即福林-酚试剂,碱性条件下极不稳定,易被酚类化合物还原而呈蓝色反应(钨兰和钨兰混合物)。
由于蛋白质中含有具有酚基的氨基酸(酪氨酸、色氨酸、苯丙氨酸),因此,蛋白质及其水解产物也呈此反应。
利用蛋白酶分解酪素(底物)生成含酚基氨基酸的呈色反应,来间接测定蛋白酶的活力。
2 仪器和设备2.1 分析天平:精度0.0001g2.2 恒温水浴:精度±0.2℃2.3 计时表2.4 分光光度计2.5 沸水浴器2.6 振荡混合器2.7 pH计: 精度0.01pH单位3 试剂和溶液3.1 乳酸缓冲液(pH=3.0)适用于酸性蛋白酶甲液:称取乳酸(80%-90%)10.6g,加水溶解并定容至1000ml。
乙液:称取乳酸钠(70%)16g,加水溶解并定容至1000ml.使用溶液:取甲液8ml,加乙液1ml,摇匀,稀释一倍,即成0.05mol/L乳酸缓冲溶液。
3.2 磷酸缓冲液的制备(pH=7.5)适用于中性蛋白酶准确称取磷酸氢二钠(Na2HPO3.12H2O)6.02和磷酸二氢钠(NaH2PO3.2H2O)0.5g,加水定容至1000ml3.3 硼酸缓冲液(pH=10.5) 适用于碱性蛋白酶甲液:称取硼酸钠19.08g,加水溶解并定容至1000ml。
乙液:称取氢氧化钠4.0g,加水溶解并定容至1000ml.使用溶液:取甲液500ml,加乙液400ml,摇匀,用水稀释至1L。
3.4 0.4mol/L碳酸钠溶液:准确称取无水碳酸钠42.4g,以蒸馏水溶解定溶至1000ml.3.5 0.4mol/L的三氯醋酸液:准确称取65.4三氯醋酸,以蒸馏水溶解定溶至1000ml3.6 0.5mol/L的NaOH:准确称取2g NaOH溶解并定至100ml3.7 10.00mg/ml酪素溶液称取酪素1.000g,准确至0.001g,用少量的0.5mol/L的氢氧化钠溶液(若为酸性蛋白酶则用浓乳酸2-3滴)润湿,,加入适量的各适宜的缓冲液约80ml,在沸水浴中边加热边搅拌,直至完全溶解,冷却后,转入100ml容量瓶中,用适宜的缓冲液稀释至刻度,此溶液在冰箱内贮存,有效期为三天.3.8 100μg/ml酪氨酸标准溶液3.8.1 准确称取预先于105℃干燥至恒重的L-酪氨酸0.1000g ,用1mol/L 的盐酸60ml 溶解后定容至100ml,即为1.00mg/ml的酪氨酸溶液.3.8.2 吸取1.00mg/ml酪氨酸标准溶液10.00ml,用0.1mol/L盐酸定容至100ml,即得100.0μg/ml L-酪氨酸标准溶液.3.9 酶样的制备准确称取1.000g固体酶或移取1ml液体酶样,用少量的适宜缓冲液溶解并用玻璃棒捣研,然后将上清液倒入100ml容量瓶,沉渣中再添入少量缓冲液捣研多次,最后全部移入容量瓶,稀释到刻度,用四层纱布过滤。
实验四蛋白酶活力的测定
一、实验目的
1、了解蛋白酶活力测定的原理;
2、掌握蛋白酶活力测定的方法。
二、实验原理
蛋白酶在一定条件下不仅能够水解蛋白质中的肽键,也能够水解酰胺键和酯键,因此可用蛋白质或人工合成的酰胺及酯类化合物作为底物来测定蛋白酶的活力。
本实验选用酪蛋白为底物,测定微生物蛋白酶水解肽键的活力。
酪蛋白经蛋白酶作用后,降解成相对分子质量较小的肽和氨基酸,在反应混合物中加入三氯醋酸溶液,相对分子质量较大的蛋白质和肽就沉淀下来,相对分子质量较小的肽和氨基酸仍留在溶液中,溶解于三氯醋酸溶液中的肽的数量正比于酶的数量和反应时间。
在280nm波长下测定溶液吸光度的增加,就可计算酶的活力。
三、实验试剂
①微生物蛋白酶萃取液(ml):称取酶制剂,加100ml蒸馏水搅拌30min,在4℃下离心分离后,将上层清夜置于冰箱中保存,使用前稀释一定倍数;
②L磷酸盐缓冲液();
③1%酪蛋白溶液:取酪蛋白,加100ml L磷酸盐缓冲液(),加热并搅拌使它完全分散,然后置于冰箱中保存;
④5%三氯醋酸(TCA)溶液。
四、实验步骤
1、将5%TCA溶液和1%酪蛋白溶液在37℃下保温。
2、取四支15ml具塞试管,分别标上记号A1、A0、B1和B0。
在A1和A0试管中各吸入酶液,在B1和B0试管中各吸入酶液,分别用L磷酸盐缓冲液定容至。
在
A0和B0试管中各吸入%三氯醋酸溶液,上述四支试管都置于37℃水浴中保温。
3、在各试管中吸入 1%酪蛋白溶液,在37℃下保温10min(准确计时)后,再向A1和B1试管中吸入%三氯醋酸溶液。
4、将试管从水浴中取出,在室温下放置1h,用少量上清液润湿滤纸后过滤,保留滤出液。
5、在280nm波长下,分别以A0和B0滤液为空白,测定A1和B1滤液的吸光度。
五、计算
1、在规定的实验条件下,以每分钟增加吸光度定义为一个酶单位。
2、每克酶制剂中酶活力的计算:
∆A ×1000 / (t ×w) 酶活力单位/克酶制剂
式中,∆A——样品与空白吸光度差值(即A1和B1的吸光值);t ——酶作用时间(本实验为10min);w——反应中酶的用量,g
六、说明
1、微生物蛋白酶粗提取液在较宽广的PH范围表现出活力,但是在接近中性条件下最有最高活力。
2、微生物蛋白酶在45℃以下可保持较长时间的稳定性。
七、思考题
1、蛋白酶有哪几类
2、影响酶活力的因素有哪些
3、使用紫外分光光度计时应注意哪些问题
六、数据记录与处理
A1 = B1 = 酶含量为 ml
酶活力1 = ∆A × 1000 / (t × w)
= ×1000/10/=×105酶活力单位/克酶制剂
酶活力2= ∆A × 1000 / (t × w)
= ×1000/10/=×105酶活力单位/克酶制剂
平均值= (×105+ ×105)=141375酶活力单位/克酶制剂
平均相对相差= (143250 - 139500)/141375 × 100%=%
七、思考题
1、蛋白酶有哪几类
答:①按蛋白酶水解蛋白质的方式:A内肽酶:切开蛋白质分子内部肽键,生成相对分子质量较小的多肽类;B外肽酶:切开蛋白质或多肽分子氨基或羧基末端的肽键,而游离出氨基酸的酶类;C水解蛋白质或多肽的酯键;D水解蛋白质或多肽的酰胺键。
②按酶的来源可分为:动物蛋白酶、植物蛋白酶、微生物蛋白酶
③微生物蛋白酶又可分为:细菌蛋白酶、霉菌蛋白酶、酵母蛋白酶和放线菌蛋白酶
④按蛋白酶作用的最适PH可以分为(A)~的酸性蛋白酶,(B)~的碱性蛋白酶,(C)PH7~8的中性蛋白酶
2、影响酶活力的因素有哪些
答:酶活力是酶催化某一化学反应的速率来表示的。
酶活力的大小即酶含量的多少,可以用每克酶制剂或每毫升酶制剂含有多少酶单位来表示,酶活力的测定也就是测定酶促反应的速率。
①酶浓度对酶活力的影响:酶促反应速率与酶分子的浓度呈正比,在一定范围内,当底物分子浓度足够时,酶分子越多,底物转化的速度越快。
②底物浓度对酶活力的影响:若酶的浓度为定值,底物的起始浓度越低时,酶促反应速度与底物浓度呈正比,即随底物浓度的增加而增加。
当所有的酶与底物结合生成中间产物后,即使再增加底物浓度,中间产物浓度也不会增加,酶促反应速度也不会增加。
③温度对酶活力的影响:在适宜的温度范围内,酶促反应速度随温度升高而增加,超过最适反应温度,酶活力将会下降。
④PH对酶活力的影响:酶在最适PH范围内表现出活性,大于或小于最适PH,都会降低酶活性。
⑤激活剂对酶活力的影响:某些无机阳离子、阴离子、有机化合物可作为激活剂,能够激活酶,使其表现出催化活性或强化其催化活性。
⑥抑制剂对酶活力的影响:酶的抑制剂能够减弱、抑制甚至破坏酶的活力,它可降低酶促反应速度。
3、使用紫外分光光度计时应注意哪些问题
答:①使用的比色皿必须洁净,并注意配对使用。
手指应拿毛玻璃面的两侧,装盛样品量以2/3为度。
透光面要用擦镜纸擦拭干净。
②比色皿使用前应用试样润洗,使用后应立即用自来水冲洗干净,倒置晾干。
③测定溶液的吸光度值应在~间最符合吸收定律,线性好,读数误差小。
④吸光值在测定前应用空白溶液校正调零,再进行测定。