闪蒸过程的计算-分离工程
- 格式:ppt
- 大小:1.77 MB
- 文档页数:40

重点:掌握分离过程的特征,分离因子和固有分离因子的区别,平衡分离和速率分离的原理.难点:用分离因子判断一个分离过程进行的难易程度,分离因子与级效率之间的关系。
•1、说明分离过程与分离工程的区别?•2、实际分离因子与固有分离因子的主要不同点是什么?•3、怎样用分离因子判断分离过程进行的难易程度?•4、比较使用ESA与MSA分离方法的优缺点。
•5、按所依据的物理化学原理不同,传质分离过程可分为那两类?•6、分离过程常借助分离剂将均相混合物变成两相系统,举例说明分离剂的类型. 1、下列哪一个是机械分离过程()(1)蒸馏(2)吸收(3)膜分离(4)离心分离2、下列哪一个是速率分离过程()(1)蒸馏(2)吸附(3)膜分离(4)沉降3、下列哪一个是平衡分离过程()(1)蒸馏(2)热扩散(3)膜分离(4)离心分离1、分离技术的特性表现为其()、()和().2、分离过程是(混合过程)的逆过程,因此需加入()来达到分离目的。
3、分离过程分为()和()两大类4、分离剂可以是()或(),有时也可两种同时应用.5、若分离过程使组分i及j之间并没有被分离,则()。
6、可利用分离因子与1的偏离程度,确定不同分离过程分离的().7、平衡分离的分离基础是利用两相平衡(组成不等)的原理,常采用()作为处理手段,并把其它影响归纳于()中.8、传质分离过程分为()和()两类。
9、速率分离的机理是利用溶液中不同组分在某种()作用下经过某种介质时的()差异而实现分离。
10、分离过程是将一混合物转变为组成()的两种或几种产品的哪些操作。
11、工业上常用()表示特定物系的分离程度,汽液相物系的最大分离程度又称为()。
12、速率分离的机理是利用传质速率差异,其传质速率的形式为()、()和().13、绿色分离工程是指分离过程()实现。
14、常用于分离过程的开发方法有()、().1、分离过程是一个()a。
熵减少的过程;b.熵增加的过程;c。
熵不变化的过程;d。

收稿日期:2023-01-25基金项目:吉林省高等教育教学改革立项课题(项目编号:20213F2GPTD003E );东北电力大学教学研究课题(项目编号:J202051)作者简介:吕楠(1987-),副教授,研究方向:功能材料,。
安徽化工ANHUI CHEMICAL INDUSTRYVol.49,No.5Oct.2023第49卷,第5期2023年10月基于OBE 理念的课程目标达成情况评价及持续改进机制——以“化工分离工程”课程为例吕楠,郑胜,张誉腾,王帝淞,杨春华,李强(东北电力大学化学工程学院,吉林吉林132012)摘要:以工程教育专业认证为背景,遵循以学生为中心、成果导向和持续改进的教学理念,以能源化学工程专业开设的“化工分离工程”课程为例,介绍了课程目标达成情况评价及持续改进机制。
研究结果可为化工类工程教育专业认证相关问题提供参考。
关键词:专业认证;分离工程;课程目标;持续改进doi :10.3969/j.issn.1008-553X.2023.05.036中图分类号:G642.0文献标识码:A文章编号:1008-553X (2023)05-0158-05工程教育专业认证是针对高等教育开设的工程类专业,其由专业机构进行专业性认证,旨在为相关工程技术人才进入工业界从业提供国际承认的预备教育质量保证。
2016年中国正式加入了“华盛顿协议”。
近年来,工程教育专业认证已成为国内工科专业的发展趋势,它不仅可以规范专业建设,而且可以提高学生工程实践能力,为学生今后就业、升学以及长期职业发展创造有利条件,同时增强了专业的核心竞争力和社会影响力,是实现工程教育国际互认和工程师资格国际互认的重要基础[1-2]。
工程教育专业认证旨在全面提高我国工程人才培养质量,培养造就一大批创新能力强、适应经济社会发展需要的高素质工程技术人才,因此开展工程认证对专业的发展意义重大[3-4]。
工程认证标准的底线是要求建立面向产出的培养目标、毕业要求和课程质量评价机制。


lng闪蒸量计算
"LNG闪蒸量"是液化天然气(LNG)在一定条件下发生的液化气体的蒸发量,通常是在储存或输送LNG的过程中考虑的参数之一。
计算LNG闪蒸量需要考虑温度、压力等因素,可以使用一些基本的物性和热力学公式。
下面是简化的计算LNG闪蒸量的步骤:
1.计算初始液相体积:确定初始的LNG液相体积(V_initial)。
2.确定储存或输送过程中的温度和压力:确定在储存或输送LNG的过程中的温度(T)和压力(P)。
3.使用物性数据计算饱和蒸汽压:利用LNG的物性数据,如饱和蒸汽压的相关数据,计算在给定温度下LNG的饱和蒸汽压。
4.根据蒸汽压计算蒸发量:使用饱和蒸汽压等数据,可以利用相应的热力学公式计算LNG在给定条件下的闪蒸量。
请注意,具体的计算需要考虑到LNG的具体物性,以及在实际运输和储存中可能存在的各种因素。
理论上,闪蒸量的计算可能涉及到热力学方程、物性数据以及具体系统的工程参数。
在实际应用中,可能需要借助专业软件或者实验数据来进行更准确的计算。


分离过程是混合过程的逆过程,因此需加入分离剂来达到分离目的. 分离过程分为机械分离和传质分离两大类.分离剂可以使能量或物质,有时也可以两种都应用.衡量分离过程的难易程度用分离因子表示,处于相平衡状态的分离程度为固有分离因子(理想分离因子).分离因子表示任一分离过程所达到的分离程度,其定义式为…固有分离因子是根据相对挥发度来计算的,它与实际分离因子的差别用级效率来表示.传质分离过程分为平衡分离和速率分离.速率分离的机理是利用溶液中不同组分在某种推动力(压差,浓度差,电位差)作用下经过某种介质时的传质速率(透过率,迁移率,扩散速率)差异而实现分离的.分离过程是一个熵减少的过程,速率分离可分为膜分离和场分离两大类. 机械分离过程的分离对象是两相以上的混合物,通过简单的分相就可以分离,而相间并无物质传递发生.这类过程有过滤,沉降,离心分离,旋风分离,和静电除尘.当分离因子αi,j=1时,表示组分i和j之间并没有分离.当αi,j>1,组分i 富集于1相,而组分j富集于2相.当αi,j<1,组分i富集于2相,组分j富集于1相.分离因子与固有分离因子的关系是αsi,j>αi,j分离过程:分离工程是将以混合物转变为组分互不相同的两种或几种产品的操作.分离过程的特点:分离某种混合物成为不同产品的过程,是个熵减少的过程,不能自法进行,因此需要外界对系统做功(或输入能量和加入物质)方能进行.分离过程可以分为几类:1气液传质过程,如吸收.2汽液传质过程,如液体的精馏和蒸馏;3液液传质过程,如萃取;4,液固分离过程,如结晶,浸取;5气固传质过程,如固体干燥,吸附.分离因子:表示任一分离过程所达到的分离程度,因为分离装置的目的是为了生产不同的产品,故以产品组分之间的关系来定义.αi,j为固有分离因子,也称相对挥发度,它不受分离设备的影响.将实际分离设备所能达到的分离因子与理想分离因子的差别用级效率来表示.常用的汽液相平衡的基本关系式为PφiV yi=PφiLxi和PφiV yi=fiLγiLxi相对挥发度的定义是两组分的相平衡常数之比.相平衡条件是汽液两相中温度压力相等,且每一组分的化学位相等.完全理想系的相平衡关系是Pyi=Pi0xi.泡点温度:一定压力下加热液体混合物,当液体混合物开始汽化产生第一个汽泡时的温度.泡点压力:是指在一定温度下降低系统压力,当液体混合物开始汽化产生气泡时的压力.用于泡点计算的调整公式为……若初始温度所求得∑kixi>1,说明ki值越大,表明所设温度高于泡点温度.若初设压力所求得的∑kixi>1,说明ki值偏大,表明所设压力低于泡点压力.若初设温度所求得的∑yi/ki>1,说明ki值偏小,表明所设温度低于泡点温度.若初设压力P求得的∑yi/ki>1,说明ki值偏小,表明所设压力高于泡点压力.单级分离是指两相经一次紧密接触达到平衡状态后随即引离得过程,由于平衡两相的组分不同,因而可起到一个平衡级的分离作用.闪蒸按照体系与环境有无热量交换分为等温闪蒸和绝热闪蒸.若组分为zi的物系,∑kizi<1,时其相态为过冷液体.在进行闪蒸计算时,徐判断混合物在指定温度作用下是否处于两相态区.平衡常数计算ki=pi0,的成立条件是气相是理想气体,液相是理想溶液. 气液相平衡k值越大,说明该组分越易挥发.当气相为理想气体混合物,液相为非理想溶液时,其气液相平衡关系为Pyi=γPixi.系统温度大于露点时,体系处于过热汽相.当物系处于泡露点之间时,体系处于气液两相.进行等温闪蒸时,对满足(∑kizi>1,∑zi/ki>1,)条件时系统处于两相区.在一定温度下和压力下,由物料组成计算出的∑kixi-1>0,且∑zi/ki-1<0,该进料状态为过热汽相.纯组分的蒸发不是闪蒸过程,闪蒸过程有部分冷凝,部分汽化,气焓截流等.泡点温度(压力)是在恒温(压)下加热液体混合物,当液体混合物开始汽化出现第一个气泡时的温度(压力),简称泡点.露点压力(温度)是在恒压(温)下加热液体混合物,当气体混合物开始冷凝出现第一液滴时的压力(温度),简称露点.判断一个化工设备中的物料所处的状态.首先通过分析确定该化工设备中的物料组成zi,然后测定其温度和压力,根据Ki=f(TD)计算后,对进料作如下检验:∑kizi=1,T=Tb,进料处于泡点.>1,T>Tb,可能为气液两相区.<1,T<Tb,进料为过冷液体.∑zi/ki=1,T=Tb,进料处于露点.>1,T<Tb,可能汽液两相区.<1,T>Tb,进料为过热蒸汽.只有∑kizi>1,和∑zi/ki>1,时,混合物处于汽液两相区.多相分精馏中,关键组分是指有设计者指定浓度或提高分离要求的组分. 在塔顶和塔釜同时出现的组分为分配组分.分配组分是指在溜出液和釜液均出现的组分;非分配组分是指仅在溜出液或釜液出现的组分.清晰分割是指溜出液中除了重关键组分外,没有其他重组分,釜液中除了轻关键组分外,没有其他轻组分.非清晰分割法假设各组分在塔内的分布在全回流时分布一致.特殊精馏是既加入能量分割剂,又加入物质分离剂的精馏过程.如加入的新组分和被分离系统的一个或几个组分形成最低恒沸物从塔顶蒸出,这种特殊精馏叫恒沸精馏,加入的恒沸剂为新组分.恒沸剂与组分形成最高沸点的恒沸物时,恒沸剂从塔釜出来.最低恒沸物压力降低使恒沸组成中汽化潜热小的组分增加.恒沸剂的沸点应比原溶液沸点相差10’C以上.在一定温度和组成下,AB混合物形成最低沸点,恒沸物的条件为(p>Pa0>Pb0)由耳波和马多克恩关联图求理论级数时,要求进料状态必须是泡点进料.均相恒沸物在低压下其活度系数之比Y1,Y2应等于(P20)与(P10)之比. 若加入的新组分不与原系统中任一组分形成恒沸物,而其沸点又较原系统任一组分高.从釜液离开精馏塔.这类特殊精馏叫萃取精馏,所加入的新组分叫作萃取剂.A,B两组分的相对挥发度αab越小,AB两组分越难分离.吉利兰关联图,关联了四个物理量之间的关系,最小理论级数,最小回流比,理论级数.简捷法的描述,1,计算简便,2可为精确计算提供初值.3所需物性数据少. 多组分精馏中,回流比小于最小回流比时无论多少理论级都不能满足分离要求.全回流操作不能用于正常生产稳定过程.当精馏塔在全回流操作时,所需理论板数最少,不进料,不出产品.有关理论板数Nm,Nm与进料组成和进料状态均无关.用芬斯克公式求全塔理论板数时,式中相对挥发度应为全塔相对挥发度的平均值.全回流操作时,精馏塔进料F=0,馏出液D=0和釜液W=0的流率.如果二元物系,A12>0,A21>0,则此二元物系所形成的溶液一定是正偏差溶液.如果二元物系有最低恒沸物存在,则此二元物系所形成的溶液一定是正偏差溶液.对于气体为理想气体,液体为非理想溶液的二元物系,形成恒沸物需满足条件….对一个恒沸精馏过程,从塔内分出的最低温度的恒沸物,则有较纯组分的产品应从塔釜得到.对形成恒沸物的物系,在恒沸点其气相组成必等于液相组分.经过恒沸点轻重组分互换.在恒沸点,其露点温度和泡点温度相等.对形成恒沸物的某体系,当压力确定后,其恒沸温度和恒沸组成确定.除恒沸点外,在其余组分下,精馏仍具有分离作用.所有非均相恒沸物都具有最低恒沸点.对于最高沸点恒沸物,压力增加使恒沸组成中汽化潜热小的组分增加. 随着构成恒沸物各组分的纯组分的蒸汽压差的增大,恒沸组成变化规律为:最低恒沸物向含低沸点组分的浓度区移动,最高恒沸物向含高沸点组分多的浓度区移动.在一定温度和组分下,AB混合物的总蒸汽压力为P,若P>Pa0,且P>Pb0,则该溶液最低沸点恒沸物.容易形成恒沸物的为各组分的化学结构不相似,其沸点差较小.萃取精馏过程选择的萃取剂最好应与沸点低的组分形成正偏差溶液. 萃取精馏时若饱和液体进料,萃取剂应该从精馏段上不和进料级进料.当萃取塔塔顶产品不合格时,可采用加大萃取剂的用量的方法来调节.在萃取精馏中,当进料为饱和液体进料时,精馏段液相中溶液浓度可近似看为不变.简捷法求普通精馏过程理论级数的步骤:1,根据工艺条件要求,找出一对关键组分.2,由清晰分割估算塔顶,塔釜产物的量及组成.3,根据塔顶塔釜组成计算相应的温度,求出平均相对挥发度.4,用Fenske公式计算最少理论板数Nm.5用Umberwood法计算最小回流比Rm,并选适宜的操作回流比R.6确定适宜的进料位置.7,根据Nm,Rm和R,用Gilliland图求理论级数N.恒沸剂的选择原则;1,必须与原溶液中至少一组分形成最低恒沸物,且其沸点较低,2,恒沸剂在恒沸物中的比例越小越好,汽化潜热应小,使恒沸剂的用量少.3,恒沸剂易分离和回收,即形成非均相恒沸物,则可采用冷却分层的办法回收,若为均相,需要采用萃取精馏或其他办法回收.4无毒,无腐蚀,热稳定性好,价廉易得.恒沸精馏是在原溶液中添加恒沸剂S使其溶液中至少一个组分形成最低(最高)恒沸物,以增大原物料组分间相对挥发度差的非理想溶液的多元精馏.萃取精馏是加入的新组分不和原物系中的组分形成恒沸物,只改变组分间的相对挥发度,而其沸点比物系中其他组分的沸点高,从精馏塔的塔釜引出.所加入的新组分称为萃取剂.吸收过程主要由塔顶塔釜两个级完成的.相对吸收率与吸收率相等的条件是吸收剂中不含溶质.用于吸收的相平衡表达式为……当温度降低,压力升高时有利于吸收.应用平均吸收因子法进行计算时,假设各平衡级的吸收因子相等.通常多组分精馏有2个关键组分,多组分吸收有1个关键组分.吸收操作中,最小液气比下,关键组分的吸收因子和关键组分的吸收率在数值上相等.吸收过程在塔顶的限度yi,1≧Kixi,0为它决定了尾气中最低浓度.蒸出因子定义式为S=KV/L,其值可反映蒸出过程分离的难易程度.相对吸收率与吸收率相等的条件是吸收剂中不含溶质.吸收剂的再生常采用的是用蒸汽或惰性气体的蒸出塔;用再沸器的蒸出塔;用再沸器的精馏塔.吸收过程中通常气体过热蒸汽,液体为过冷液体.化学吸收按反应类型又分为为可逆反应和不可逆反应两类.多组分吸收过程采用图解梯级法的依据是贫气吸收.当体系的yi=yi*时,没有物质的净转移.在多组分吸收中,吸收主要发生于塔顶附近几个级的组分是难溶组分. 在多组分吸收中,吸收主要发生于全塔所有级的组分是关键组分.吸收塔的气、液相最大负荷处应在塔的顶部.在板式塔的吸收中,原料中的平衡常数小的组分主要在塔下部少数几块板被吸收在板式塔的吸收中,原料中关键组分组分主要在全部塔板被吸收.难吸收组分主要在塔的塔顶级被吸收.平均吸收因子的适用范围是贫气吸收.洗手操作中,若要提高关键组分的相对吸收率应采用最有效措施是提高压力.吸收过程各组分的吸收量主要发生在塔顶一级和塔釜一个理论级.通常对物理吸收操作最有利的操作条件是低温高压.平衡常数较少的组分是吸收剂中的溶解度大的组分.简述吸收和精馏过程的主要不同点:1,原理不同.吸收是根据各组分溶解度不同进行分离的.精馏是利用组分间相对挥发度不同使组分分离.2塔式不同.3,传质形式不同.吸收是单向传质,精馏是双向传质.4,温度范围变化不同.5,物料的预分布不同.6,精馏有两个关键组分,吸收只有一个.7,组分分布不同.吸附分离是利用吸附剂选择吸附某组分的方法实现气体液体混合物的分离.透过曲线是以为时间横坐标绘制而成.吸附分离机理分别为位阻差异;动力学差异;平衡差异.固定床吸附器中,若吸附的透过曲线越陡,说明吸附剂性能越好.以下过程的需要的膜两侧静压差推动力为反渗透>超滤>微滤.水不适合做超临界流体.。

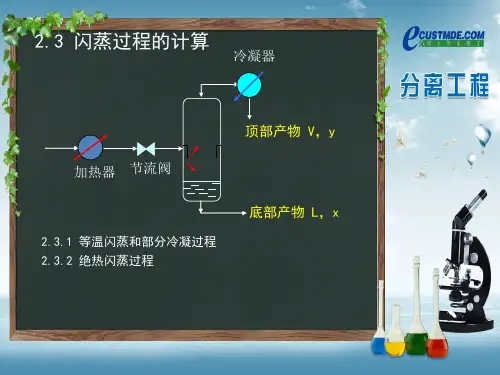
第二章精馏Chapter 2 Distillation主要内容及要求:1.相平衡常数计算:状态方程法,活度系数法2.泡点、露点计算(1)泡点计算:在一定P(或T)下,已知x i,确定T b(或P b)和y i(2)露点计算: 在一定P(或T)下,已知y i,确定T b(或P b)和x i3.等温闪蒸计算:给定物料的量与组成,计算在一定P和T下闪蒸得到的汽相量与组成,以及剩余的液相量与组成。
4.掌握多组分精馏过程的基本原理、流程以及简捷计算方法;5.掌握萃取精馏和共沸精馏的原理、流程及其简捷计算法。
授课主要内容:2.1 概述2.2 汽液相平衡2.3 精馏计算2.4 特殊精馏2.5 板效率2.1 概述精馏原理:精馏是分离液体混合物的单元操作,是利用混合物中各组分挥发度的差异及回流的工程手段,实现组分的分离。
不适宜用普通精馏进行分离的物系:1. 1→AB α2.1=AB α3. 热敏性物料4. 难挥发组分的稀溶液2.1.1 理论板、板效率以及填料的理论板当量高度(HETP )1. 理论板理论板= f(相平衡,分离要求,操作参数)⏹ 所谓理论塔板,如右图所示,即气、液两相在塔板上充分接触,混合进行传质、传热后,两相组成均匀且离开塔板的气、液两相呈相平衡关系。
显然,在相同条件下,理论板具有最大的分离能力,是塔分离的极限能力。
该状态可由热力学方法求解确定,离开塔板的气、液两相存在的相平衡关系由以下关系式表达: ⏹ 相平衡关系:y i =k i ·x i相平衡关系是传质过程趋向的目标,或所达到的热力学极限状态。
理论板是一个理想化了的两相间接触传质场所,也称为平衡级。
理论板符合以下三条假设:1)进入该板的不平衡物流在其间充分接触传质,使离开该板的汽液两相物流间达到了相平衡;2)在该板上发生接触的汽液两相各自完全均匀,板上各点汽相浓度和液相浓度各自都相同;3)该板上充分接触后的汽液两相实现了完全机械分离,不存在夹带、泄漏。



《分离工程》复习提要第一章绪论1、质分离过程的分类:机械分离过程、传质分离过程(分为平衡分离过程和速率分离过程)2平衡分离过程——借助分离媒介(如热能、溶剂和吸附剂),使均相混合物系统变成两相系统,再以混合物中各组分在处于相平衡中不等同的分配为依据而实现分离。
分离媒介分为:能量媒介ESA和物质媒介MSA。
3、分离因子、固有分离因子的定义第二章多组分分离基础(一)设计变量1、概念设计变量-——在计算前,必须由设计者赋值的变量。
固定设计变量N x 描述进料物流的变量设计变量数N i 系统压力可调设计变量N aN x是指描述进料物流的变量(如进料组成、流量、温度和压力等)及系统压力。
事实上已被给定或最常被给定的量。
N a则是由设计者来决定的。
2、单元的设计变量.(会用下法求单设计变量)单元的设计变量N i = N v– N c(1)独立变量数N vN v可由①出入系统的各物流的独立变量数;②系统和环境进行能量交换的情况决定。
1)物流的独立变量数任一单相物流N v = f + 1=c + 22)当系统和环境有能量交换时,N v应加上描述能量交换的变量数。
(2)约束关系数N c的确定约束关系包括:1)物料平衡式数目等于组分数c;2)能量平衡式每个系统只有一个;3) 相平衡关系式 有c (π- 1)个; 4)化学平衡式 一般不予考虑;5)内在关系式 指约定关系,如物流间温差、压力.N a e== N i e- N x e3、装置的设计变量(会确定分离装置的设计变量数) 步骤:(1)按每一单相物流有c+ 2个变量,计算进料物流所确定的固定设计变量数;(2)确定装置中具有不同压力的数目(压力等级数),当忽略由于摩擦阻力而引起的微小压力降时,装置内共有几个操作压力;(3)上两项之和即为固定设计变量数N x u;(4)将①串级单元的数目;②分配器的数目;③侧线采出单元的数目;④传热单元的数目相加,便是整个装置的可调设计变量数N a u。