胶质瘤和淋巴瘤的鉴别
- 格式:ppt
- 大小:4.30 MB
- 文档页数:20

原发性脑淋巴瘤(PLB)的CT、MRI影像特点分析目的:通过PLB的CT、MRI影像表现特征提高诊断准确性。
方法:收集7例经病理证实的PLB的CT、MRI影像资料综合分析。
结果7例PLB患者半数以上多发(4/7),75%的病灶分布于脑深部中线附近(12/16)。
脑深部肿瘤形态以类圆形结块为主,CT平扫病灶密度为等密度或略高密度。
MRI平扫病灶多为等T1或稍长T1信号、等T2或稍长T2信号,增强检查病灶均明显强化。
结论:PLB临床特征无特殊,可以根据典型的CT及MRI影像特征做出初步诊断。
标签:原发性脑淋巴瘤CT MRI原发性脑淋巴瘤(primary lymphoma of the brain,PLB)是一种较少见的颅内恶性肿瘤,约占全部颅内原发性肿瘤的1%,绝大部分为非霍奇金淋巴瘤,且多为B细胞性[1]。
以往多见于50~60岁上老年人,近年发病率尤其是年轻人发病率明显增加。
1 资料和方法1.1 一般资料收集2008年3月-2009年3月经病理证实的PLB 7例,其中男5例,女2例,发病年龄19~74岁,平均46.5岁。
临床表现无特殊,包括颅压增高、脊髓压迫、神经麻痹、精神异常等症。
1.2 检查方法全部7例患者行CT平扫、CT增强、MRI平扫或者MRI增强检查。
1例患者增加磁共振弥散成像(DWI)及磁共振波普(MRS)检查。
MRI平扫检查包括SE横断面、矢状面或冠状面TlWI、T2WI及FLAIR序列。
MRI增强检查为注射钆剂后行横断面、矢状面及冠状面T1WI序列扫描。
2 结果2.1 CT、MRI表现2.1 CT、MRI表现①分布:7例患者中半数以上病灶多发(4/7),多数病灶位于脑深部中线附近(12/16)。
多数在幕上(14/16)。
②形态:脑实质内病灶多为大小不等类圆形结节、肿块影,水肿及占位效应与肿瘤大小正相关。
累及脑膜显示不均匀增厚。
无明显出血、囊变或钙化征象。
③CT平扫病灶多为均匀等密度或略高密度(13/16),少量病灶密度不均匀(3/13)[图1],2个病灶累及脑膜,颅骨尚好。


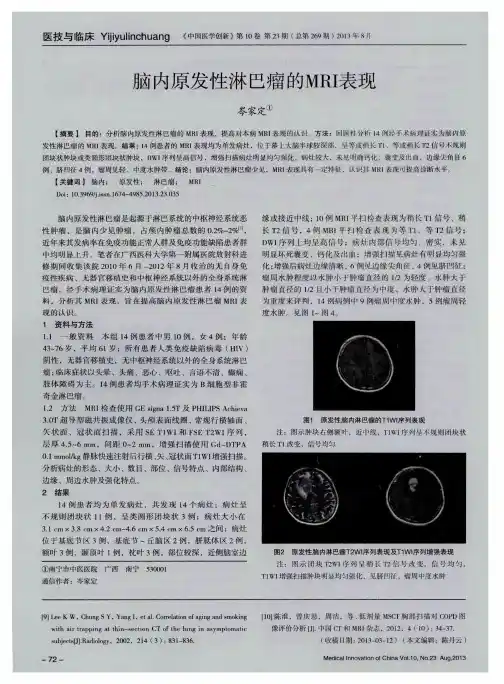
脑内原发性淋巴瘤的MRI表现作者:岑家定来源:《中国医学创新》2013年第23期【摘要】目的:分析脑内原发性淋巴瘤的MRI表现,提高对本病MRI表现的认识。
方法:回顾性分析14例经手术病理证实为脑内原发性淋巴瘤的MRI表现。
结果:14例患者的MRI表现均为单发病灶,位于幕上大脑半球较深部,呈等或稍长T1、等或稍长T2信号不规则团块状肿块或类圆形团块状肿块,DWI序列呈高信号,增强扫描病灶明显均匀强化,病灶较大,未见明确钙化、囊变及出血,边缘尖角征6例、脐凹征4例,瘤周见轻、中度水肿带。
结论:脑内原发性淋巴瘤少见,MRI表现具有一定特征,认识其MRI表现可提高诊断水平。
【关键词】脑内;原发性;淋巴瘤; MRI脑内原发性淋巴瘤是起源于淋巴系统的中枢神经系统恶性肿瘤,是脑内少见肿瘤,占颅内肿瘤总数的0.2%~2%[1],近年来其发病率在免疫功能正常人群及免疫功能缺陷患者群中均明显上升。
笔者在广西医科大学第一附属医院放射科进修期间收集该院2010年6月-2012年8月收治的无自身免疫性疾病、无器官移植史和中枢神经系统以外的全身系统淋巴瘤,经手术病理证实为脑内原发性淋巴瘤患者14例的资料,分析其MRI表现,旨在提高脑内原发性淋巴瘤MRI表现的认识。
1 资料与方法1.1 一般资料本组14例患者中男10例,女4例;年龄43~76岁,平均61岁;所有患者人类免疫缺陷病毒(HIV)阴性,无器官移植史,无中枢神经系统以外的全身系统淋巴瘤;临床症状以头晕、头痛、恶心、呕吐、言语不清、癫痫、肢体障碍为主。
14例患者均手术病理证实为B细胞型非霍奇金淋巴瘤。
1.2 方法 MRI检查使用GE signa 1.5T及PHILIPS Achieva 3.0T超导型磁共振成像仪,头颅表面线圈,常规行横轴面、矢状面、冠状面扫描,采用SE T1WI和FSE T2WI序列,层厚4.5~6 mm,间距0~2 mm,增强扫描使用Gd-DTPA0.1 mmol/kg 静脉快速注射后行横、矢、冠状面T1WI增强扫描。

常见颅内肿瘤鉴别诊断要点幕上肿瘤鉴别诊断1.星形胶质细胞瘤:肿瘤多发生在髄质。
CT密度、MRI信号不均匀,增强扫描呈不规则强化或不规则环形强化,并随肿瘤恶性程度增高而递增,其强化程度不如脑膜瘤明显,且不均一,不直接与脑膜相连,也不出现颅骨骨质改变。
2.少突胶质细胞瘤:CT示不规则混合密度影,病灶内条状或片状钙化就是其特征表现。
3.室管膜瘤:源于脑实质或源于侧脑室而突入脑实质得室管膜瘤呈分叶状,肿瘤内斑点状细小钙化;而星形胶质细胞瘤多呈圆形,钙化较大呈片状或弧形。
4.脑膜瘤:脑实质外良性肿瘤,影像学示脑外占位征象。
CT示圆形或类圆形稍高或明显高密度影,增强明显强化,瘤内可见囊变或钙化,瘤周多伴水肿,以广基与硬膜相连,多伴有附着处骨质改变cMRI肿瘤信号与灰质相似,T1等信号,T2 高或等信号。
肿瘤边缘清楚,可见包膜、引流静脉及颅骨改变。
5.转移瘤:既往有肿瘤病史者出现颅内压增高症状与局限定位体征,首先考虑转移瘤。
无肿瘤病史,40岁以上人群短期内病悄进展迅速,在脑皮质与髓质交界处出现圆形病灶,单发或多发,其密度不均匀,增强扫描示环形强化,可伴有颅骨转移,为破坏性,也应考虑转移瘤。
其与脑内病灶有一定距离。
多发性转移瘤应与多发性脑脓肿、结核球、淋巴瘤、多发性硬化以及多中心胶质瘤相鉴别。
单发转移瘤与胶质瘤、淋巴瘤、脑脓肿鉴别。
6.淋巴瘤:CT不均匀略高密度,增强后均匀强化,但边缘不如脑膜瘤锐利,强化亦不如脑膜瘤明显,且不与脑膜相连,亦无骨质改变。
7.脑脓肿:CT示圆形或卵圆形密度减低影,增强后明显环形增强,其病灶增强环多规则而连续,片薄相对均匀,边界清楚,周围脑组织低密度水肿带明显。
多发囊性转移瘤与脑脓肿在CT上常难以区分,但脑脓肿有感染源或发热史,抗感染治疗后病灶缩小或消失。
8.脑梗塞:与脑血管分布区相吻合,CT复查病灶密度进行性下降,边界清楚,占位征象消失,并可出现局灶性脑萎缩。
9.动静脉畸形:CT示不规则混合密度,无占位效应,钙化明显,可伴有局限性脑萎缩。

导读:从90年代起,DWI就被应用于帮助发现早期卒中和其它一些神经病学疾病。
至今已有20余年的发展,我们对于DWI的应用和认知也越来越成熟。
本文主要针对的是神经系统的DWI应用。
DWI原理简介为了理解DWI的概念,必须要理解细胞微环境内的自由扩散和扩散受限。
1827年布朗用显微镜观察悬浮在水中的花粉颗粒时,发现花粉颗粒在水中不停地作无规则运动。
自由水分子不停的随机运动,即布朗运动。
相反,细胞微环境内的水分子运动被细胞分隔间的相互作用所阻碍。
DWI序列是反应水分子自由弥散的序列。
DWI高信号的原因主要包括两种,一种是真性弥散受限,其ADC值降低;另一种是弥散未受限的高信号,其ADC值不降低,主要是因为T2投射效应。
弥散受限的原因主要包括三类:一是细胞毒性水肿,二是细胞密集度增加,三是液体的粘稠度增高。
图1 弥散受限原理T2投射效应是由于T2的延长导致的DWI的高信号,而ADC值不降低。
因此DWI上的高信号病灶可能反应了强T2透射效应,而不是真正的弥散减少(图2)。
DWI高信号的常见疾病包括脑梗死、脑脓肿、脑肿瘤、脱髓鞘疾病、代谢中毒性疾病、CJD等。
图2 T2透射效应(35岁女性,多发性硬化)脑梗死DWI序列是诊断脑梗死的主要检查方法。
在脑梗死最初几分钟内,脑组织能量代谢受到破坏,Na-K+/ATP酶和其他离子泵发生衰竭,使细胞内外的离子失去平衡,大量的细胞外水进入到细胞内,形成细胞毒性水肿。
整个梗死区的含水量并未增加,只是细胞内、外的含水量发生了变化。
此时,T2WI、T1WI和FLAIR都不能显示病灶,只在能显示水分子弥散运动的DWI才能显示病灶。
图3 脑梗死MRI表现(发病2小时)细胞毒性水肿,细胞内水分子增加,引起细胞肿胀,造成细胞外间隙变小,细胞外水分子减少,细胞外间隙扭曲变形,梗死区水分子弥散运动减低,ADC值变小,DWI显示为高信号,ADC图显示为低信号。
最早在30分钟内即可显示DWI高信号。

脑胶质瘤诊疗规范(2018年版)一、概述脑胶质瘤是指起源于脑神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,世界卫生组织(WHO)中枢神经系统肿瘤分类将脑胶质瘤分为Ⅰ-Ⅳ级,Ⅰ、Ⅱ级为低级别脑胶质瘤,Ⅲ、Ⅳ级为高级别脑胶质瘤。
本规范主要涉及星形细胞、少突胶质细胞和室管膜细胞来源的高、低级别脑胶质瘤的诊治。
我国脑胶质瘤年发病率为5-8/10万,5年病死率在全身肿瘤中仅次于胰腺癌和肺癌。
脑胶质瘤发病机制尚不明了,目前确定的两个危险因素是:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。
此外,亚硝酸盐食品、病毒或细菌感染等致癌因素也可能参与脑胶质瘤的发生。
脑胶质瘤临床表现主要包括颅内压增高、神经功能及认知功能障碍和癫痫发作三大类。
目前,临床诊断主要依靠计算机断层扫描(CT)及磁共振成像(MRI)检查等影像学诊断,磁共振弥散加权成像(DWI)、磁共振弥散张量成像(DTI)、磁共振灌注成像(PWI)、磁共振波谱成像(MRS)、功能磁共振成像(fMRI)、正电子发射计算机断层显像(PET)等对脑胶质瘤的鉴别诊断及治疗效果评价有重要意义。
脑胶质瘤确诊需要通过肿瘤切除或活检获取标本,进行组织和分子病理学检查,确定病理分级和分子亚型。
目前主要的分子病理标记物包括:异柠檬酸脱氢酶(IDH)突变、染色体1p/19q联合缺失状态(co-deletion)、O6-甲基鸟嘌呤-DNA甲基转移酶(MGMT)启动子区甲基化、α地中海贫血伴智力低下综合征X连锁基因(ATRX)突变、端粒酶逆转录酶(TERT)启动子突变、人组蛋白H3.3(H3F3A)K27M突变、BRAF基因突变、PTPRZ1-MET基因融合、miR-181d、室管膜瘤RELA基因融合等1,2。
这些分子标志物对脑胶质瘤的个体化治疗及临床预后判断具有重要意义。
脑胶质瘤治疗以手术切除为主,结合放疗、化疗等综合治疗方法。
手术可以缓解临床症状,延长生存期,并获得足够肿瘤标本用以明确病理学诊断和进行分子遗传学检测。




胶质瘤病理诊断标准全文共四篇示例,供读者参考第一篇示例:胶质瘤是一种常见的脑部肿瘤,起源于星形细胞或神经胶质细胞,通常病理上表现为恶性。
其病理诊断标准对于患者的治疗和预后都至关重要。
在临床实践中,胶质瘤的病理诊断主要依赖于病理学家对组织标本的细致观察和评估,同时结合免疫组化染色和分子生物学检测,以得出准确的诊断。
关于胶质瘤的病理诊断标准,主要包括以下几个方面:一、组织学形态特征胶质瘤的组织学形态特征是病理学家最常用的诊断依据之一。
在显微镜下观察,胶质瘤的细胞呈星形或梭形,胶质细胞核大而异形,胞浆丰富,胶质纤维增生明显。
胶质瘤的增生呈现不规则状,可形成明显的网状结构或血管模拟,伴有炎症细胞浸润等特征,并且通常具有高度核分裂活性。
二、免疫组化染色免疫组化染色在胶质瘤的病理诊断中扮演着重要的角色。
通过对肿瘤标本进行多种抗体染色,可以检测特定的蛋白质在肿瘤组织中的表达情况。
常用的标记物包括GFAP(神经胶质纤维酸性蛋白)、Ki-67(增殖细胞核抗原)和p53等。
阳性GFAP染色结果表明肿瘤起源于星形胶质细胞,Ki-67阳性率高则提示肿瘤增殖活性明显,p53过表达则可提示肿瘤的恶性程度。
三、分子生物学检测近年来,分子生物学检测在胶质瘤的病理诊断中越来越受到重视。
通过检测肿瘤细胞的基因突变、染色体异常或表达水平,可以为病理诊断提供更为准确的依据。
经典的例子包括IDH(异柠檬酸脱氢酶)基因突变和MGMT(O6-甲基化鸟嘌呤-DNA-甲基转移酶)基因甲基化状态等。
IDH突变通常出现在低级别胶质瘤中,而MGMT甲基化状态则与对放疗药物的敏感性密切相关。
胶质瘤的病理诊断标准是一个综合性的过程,需要结合组织学形态特征、免疫组化染色和分子生物学检测等多方面信息,以得出准确的诊断结果。
随着医学科技的不断进步和发展,相信未来会有更多更准确的病理诊断方法出现,为胶质瘤患者的治疗提供更为精准的指导。
希望通过科学家和医生的共同努力,未来能够更好地控制和治疗这种疾病,为患者的健康保驾护航。
常见颅内肿瘤的影像学表现(共6页)-本页仅作为预览文档封面,使用时请删除本页-一、胶质瘤二、胶质瘤起源于神经胶质细胞,包括星形细胞瘤、少突胶质瘤、室管膜瘤和脉络丛乳头状瘤等。
最常见的原发性脑肿瘤,约占颅脑肿瘤的40%-50 %。
星形细胞瘤为胶质瘤中最常见的一类肿瘤(占 40%),占颅内肿瘤的 17%。
成人多见于幕上,儿童多见于小脑。
星形细胞瘤多位于大脑半球白质区,传统的柯氏(Kernohan) 分类法将星形细胞瘤分为 I-Ⅳ级:I 级呈良性;Ⅲ、Ⅳ级呈恶性;Ⅱ级是一种良恶交界性肿瘤。
另一种为三类法,即“良性”或低度恶性星形细胞瘤、间变性星形细胞瘤、多形性胶质母细胞瘤。
其中 I、Ⅱ级相当于“良性”或低度恶性星形细胞瘤,Ⅲ级相当于间变性星形细胞瘤,Ⅳ级为胶质母细胞瘤。
“良性”或低度恶性及间变性星形细胞瘤各占星形细胞瘤的 25%-30%。
可发生于任何年龄,但多发于青年人,成人好发于幕上,儿童好发于小脑。
胶质母细胞瘤占星形细胞瘤的 40%-50%,好发于中老年人,多位于幕上。
局灶性或全身性癫痫发作是本病最重要的临床表现,神经功能障碍和颅内压增高经常在后期。
【影像学表现】1.CT:(1)幕上 I、Ⅱ级星形细胞瘤:大多数表现为脑内低密度病灶,少数为混合密度灶,部分病人瘤内可见钙化。
肿瘤边界不清晰,瘤周水肿少见且较轻。
增强后扫描常无明显强化,少数表现为肿瘤或囊壁和囊内间隔的稍微强化,有的有壁结节甚至花环状强化。
(2)幕上Ⅲ、Ⅳ级星形细胞瘤:病灶密度不均匀,以低密度或等密度为主的混合密度最多。
肿瘤内的高密度常为出血。
低密度为肿瘤的坏死或囊变区。
肿瘤多有脑水肿。
增强扫描几乎所有的肿瘤均有强化,可呈不规则的环状或者花环状强化,在环壁上还可见强化不一的瘤结节。
若沿胼胝向对侧生长则呈蝶状强化,占位征象明显。
(3)小脑星形细胞瘤:囊性者平扫为均匀水样低密度,边界清晰,囊壁可有钙化,增强扫描囊壁结节不规则强化。
壁结节较大,在1 cm 以上。
胶质瘤病理学特点-概述说明以及解释1.引言1.1 概述胶质瘤是一种常见的中枢神经系统肿瘤,起源于胶质细胞,是导致严重神经系统疾病和死亡的主要原因之一。
胶质瘤病理学特点是指在组织学和细胞学层面上观察到的一系列特殊特征和变化。
在组织学上,胶质瘤的特点主要包括瘤细胞的异常增殖和浸润性生长。
与正常的脑组织相比,胶质瘤细胞数量增多,并且排列紧密。
此外,胶质瘤细胞的胞质核比率高,细胞核具有异型性,即形态和大小不一致。
瘤细胞常常形成集结体、索状结构和囊腔等特征,交织在胶质纤维网中。
在瘤组织中还可能存在瘤周血管增生、坏死和出血等变化。
从细胞学上观察,胶质瘤细胞具有高度异质性。
不同于正常神经细胞具有特定的神经元功能和形态特征,胶质瘤细胞在形态和功能上呈现出明显的异常和多样性。
胶质瘤细胞常常失去正常胶质细胞的限制性生长特性,导致无控制地增殖和扩散。
此外,胶质瘤细胞的细胞质内含有丰富的颗粒物质,如胶质纤维和胶质结节等。
胶质瘤病理学特点的研究对早期诊断、治疗和预后评估具有重要的临床价值。
通过观察和分析组织学和细胞学的特点,可以确定胶质瘤的类型、分级和预后。
病理学特点还可以指导临床医生选择合适的治疗方案,如手术切除、放疗和化疗等。
此外,对胶质瘤病理学特点的深入理解还有助于揭示胶质瘤发生发展的分子机制和预测治疗效果。
尽管我们已经取得了一些关于胶质瘤病理学特点的重要发现,但仍有许多问题需要进一步研究和探索。
未来的研究应该致力于深入了解胶质瘤细胞的分子特征和致病机制,为个体化治疗提供更好的基础。
此外,研究人员还应该积极探索新的治疗策略,并通过病理学特点的发现和应用,不断改进胶质瘤的诊断和治疗效果。
综上所述,胶质瘤病理学特点在胶质瘤的诊断、治疗和预后评估中具有重要的作用。
通过深入研究和理解胶质瘤的组织学和细胞学特点,我们可以为患者提供更准确和有效的个体化治疗。
未来的研究将进一步揭示胶质瘤的分子机制,并进一步改善胶质瘤的治疗效果。
中国中枢神经系统胶质瘤诊断与治疗指南(最全版)第一章概述胶质瘤是指起源于神经胶质细胞的肿瘤,是最常见的原发性颅内肿瘤,WHO中枢神经系统肿瘤分类将胶质瘤分为WHOⅠ~Ⅳ级,Ⅰ、Ⅱ级为低级别胶质瘤,Ⅲ、Ⅳ级为高级别胶质瘤[1]。
本指南主要涉及低级别胶质瘤、高级别胶质瘤、大脑胶质瘤病和室管膜瘤的诊治。
近30年来,原发性恶性脑肿瘤发生率逐年递增,年增长率为1%~2%,在老年人群尤为明显[2]。
根据美国脑肿瘤注册中心(Central Brain Tumor Registry of the United States, CBTRUS)统计,胶质瘤约占所有中枢神经系统肿瘤的27%,约占恶性肿瘤的80%;在原发性恶性中枢神经系统肿瘤中,胶质母细胞瘤(Glioblastoma, GBM, WHOⅣ级)的发病率最高,占了46.1%,约为3.20/10万,且男性多于女性;其次是弥漫性星形细胞瘤,发病率为0.53/10万。
GBM的发病率随着年龄的增长而增加,最高发的年龄为75~84岁,新诊断的中位年龄是64岁[3]。
胶质瘤发病机制尚不明了,目前确定的两个危险因素是:暴露于高剂量电离辐射和与罕见综合征相关的高外显率基因遗传突变。
近年来,高级别胶质瘤发病机制研究的热点包括:等位基因的杂合性缺失及基因的遗传性变异研究,DNA错配修复,细胞信号通路紊乱(如EGFR及PDGF通路),PI3K/Akt/PTEN、Ras和P53/RB1通路基因突变和肿瘤干细胞研究等。
胶质瘤临床表现主要包括颅内压增高及神经功能缺失。
目前,诊断主要依靠CT及MRI检查等影像学诊断,一些新的MRI序列,如磁共振弥散加权成像和弥散张量成像(DWI和DTI)、磁共振灌注成像(PWI)、磁共振波谱成像(MRS)和功能磁共振成像(fMRI)开始应用于临床,对提高诊断水平及判断预后有重要意义。
正电子发射计算机断层显像(PET)和单光子发射计算机断层成像术(SPECT)对于鉴别肿瘤复发与放射性坏死有一定帮助。