免疫缺陷动物模型
- 格式:ppt
- 大小:5.51 MB
- 文档页数:39


免疫缺陷小鼠模型品系介绍免疫缺陷动物,是指先天性遗传突变或用人工方法造成一种或多种免疫系统组成成分缺陷的动物。
免疫缺陷大小鼠是研究肿瘤、癌症干细胞、造血、人源化和传染病的强大异种移植模型的工具鼠。
以前高度免疫缺陷小鼠由于缺乏完整的人体免疫系统的相关因素,如小鼠与人MHC不相容性,以及缺乏人特异的生长因子、细胞因子和趋化因子,不能完全重现人体免疫系统。
现在小鼠模型主要通过基因改造高度免疫缺陷小鼠的方式,以期降低小鼠微环境的干扰,或者表达人的生长因子使人的某些免疫细胞亚群更成熟,或者转入人的HLA 解决组织相容性问题。
这些改造包括:(1)敲除小鼠造血分化相关基因,为人的HSC分化提供更好的微环境,如小鼠KIT受体突变,可以改善红细胞生成、血小板形成和HSC植入。
敲除小鼠Flt3L配体(FMS-related tyrosine kinase 3 ligand,介导小鼠树突状细胞扩增),可以促进人单核和树突状细胞发育。
(2)导入人的细胞(生长、趋化)因子,如SCF、M-CSF 、GM-CSF、IL-2、IL-3、IL-7、IL-15、TPO等,这些可以促进人的某些免疫细胞亚群更成熟。
(3)解决组织相容性问题,如转入人的HLA-A2和DR1,敲除小鼠的H2-B2m等。
通过以上一种或者多种基因修饰方式,以期提高人源化小鼠PBMC和HSC细胞定植和分化能力,并减小异源免疫排斥(Xeno-GvHD),更好的重建人免疫系统。
2020年,赛业与genOway达成战略合作伙伴关系。
genOway 成立于1999年,是欧美科研与医药界首选的实验鼠金牌供应商。
(重度免疫缺陷小鼠)BRGSF小鼠是赛业与genOway合作引进的精选成品鼠之一。

《利用基因编辑工具制备RAG1敲除的免疫缺陷猪模型》一、引言近年来,随着基因编辑技术的快速发展,CRISPR-Cas9等基因编辑工具在生物学和医学领域的应用越来越广泛。
其中,制备基因敲除动物模型是基因编辑技术的重要应用之一。
RAG1是一种在哺乳动物免疫系统中发挥重要作用的基因,其编码的蛋白参与T细胞和B细胞的发育和成熟。
因此,制备RAG1敲除的免疫缺陷猪模型对于研究人类免疫系统相关疾病具有重要意义。
本文旨在介绍利用基因编辑工具制备RAG1敲除的免疫缺陷猪模型的方法和实验结果。
二、材料与方法1. 实验动物与基因编辑工具本实验采用猪作为实验动物,利用CRISPR-Cas9基因编辑工具进行RAG1基因敲除。
2. 基因编辑操作流程(1)构建RAG1基因敲除载体:通过PCR技术扩增RAG1基因特定序列,并设计CRISPR-Cas9系统识别序列,构建RAG1基因敲除载体。
(2)猪胚胎操作:将构建好的载体通过显微注射技术注入猪胚胎中,使胚胎细胞发生基因编辑。
(3)胚胎移植:将经过基因编辑的胚胎移植到代孕母猪体内,待其发育成猪只。
3. 实验设计与分组将实验猪只分为实验组和对照组,实验组为RAG1基因敲除猪只,对照组为正常猪只。
三、实验结果1. 基因编辑效率经过基因编辑操作后,通过对编辑后的胚胎进行PCR和测序验证,发现RAG1基因在实验组猪只中成功被敲除,且编辑效率达到预期目标。
2. 免疫缺陷表现实验组猪只表现出明显的免疫缺陷表现,如T细胞和B细胞数量减少、免疫应答能力降低等。
而对照组猪只未出现明显的免疫缺陷表现。
3. 生长发育及生理指标实验组和对照组猪只在生长发育及生理指标方面无明显差异,说明RAG1基因敲除未对猪只的生长发育产生明显影响。
四、讨论本实验成功制备了RAG1敲除的免疫缺陷猪模型,为研究人类免疫系统相关疾病提供了重要的动物模型。
通过对实验组猪只的免疫缺陷表现进行分析,可以进一步探究RAG1在哺乳动物免疫系统中的作用及其相关疾病的发病机制。

免疫缺陷动物模型一、概述免疫缺陷动物是指由于先天性遗传突变,或用人工的方法,培育一种或多种免疫功能缺陷的动物。
1962年,苏格兰医师Issacson等首先发现无胸腺裸小鼠。
1969年,丹麦学者Rygaard首次成功地将人类恶性肿瘤移植于裸小鼠体内,肿瘤在体内存活并生长。
从此,免疫缺陷动物开创了肿瘤学、免疫学、细胞生物学的新的里程碑。
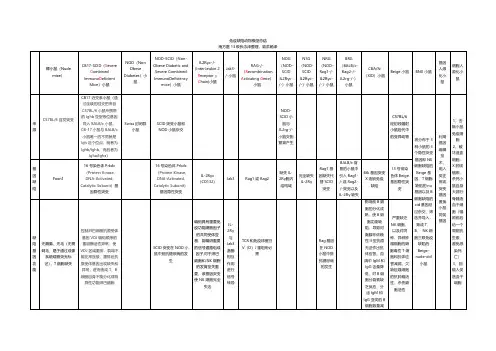
二、按免疫功能缺陷的种类常分为1、T-淋巴细胞功能缺陷动物:裸小鼠、裸大鼠、裸牛、裸豚鼠等。
2、B-淋巴细胞功能缺陷动物:CBA/N小鼠、Arabin马和Quarter马等马属动物。
3、NK细胞功能缺陷动物:Beige小鼠。
4、联合免疫缺陷动物:Scid小鼠等其他人工定向培育的多种免疫功能缺陷动物。
三、常见的免疫缺陷动物1、裸小鼠是指先天性无胸腺,且无被毛的小鼠,简称为裸小鼠。
其突变基因为裸基因,符号为:nu,是一个隐性突变基因,位于小鼠的第11号染色体上。
目前,此基因已导入到不同品系的小鼠中,常见的有BALB/c-nu、C3H-nu、C57BL/6-nu等。
裸鼠的解剖生理特点:①毛囊发育不良,外观上看几乎没有被毛,故称“裸鼠”;②无胸腺,仅有胸腺残迹或异常的胸腺上皮。
故不能分泌胸腺素,不能使T细胞正常分化,而T细胞室移植排异的主要细胞。
B细胞基本正常但功能欠佳。
有较高的NK细胞数量和活性。
③因为IgG的产生需要T细胞和巨噬细胞的参与,其免疫球蛋白主要是IgM,只有极少量的IgG。
④自发肿瘤现象罕见,可能与NK细胞的活性高有关。
⑤裸鼠易患鼠肝炎和病毒性肺炎。
⑥纯合裸鼠母性极差,且受孕率低,乳房发育不良。
通常以纯合雄鼠与带有nu基因的杂合雌鼠可获1/2裸鼠。
⑦裸鼠需饲养在屏障环境中。
自裸鼠问世以来,已广泛应用于肿瘤学、微生物学、免疫学、寄生虫学、遗传学、毒理学、临床医学等研究中。
2、裸大鼠1953年,英国科学家首次在大鼠中发现一种外观与裸小鼠相似,只是被毛不想裸小鼠那样全无,通过解剖和免疫学检查发现其也是无胸腺、缺乏T细胞功能,B细胞功能正常,细胞活力增强,繁殖方式与裸小鼠相同,且能接受异种组织和细胞移植,且因其体型大,用一只裸大鼠可为常规血液学和血清生物化学分析实验提供足够的血样,同时大鼠易于进行外科手术,为肿瘤移植和肿瘤供血研究提供了方便。

《利用基因编辑工具制备RAG1敲除的免疫缺陷猪模型》一、引言随着生物医学技术的飞速发展,基因编辑工具如CRISPR-Cas9等在动物模型制备中发挥着越来越重要的作用。
RAG1基因是免疫系统发育过程中的关键基因,其突变或敲除将导致严重的免疫缺陷。
本研究旨在利用基因编辑工具制备RAG1敲除的免疫缺陷猪模型,以期为人类免疫性疾病的研究和治疗提供更为可靠的动物模型。
二、材料与方法1. 实验材料本实验所需材料包括:基因编辑工具(如CRISPR-Cas9系统)、RAG1基因敲除载体、猪胚胎、培养基等。
2. 实验方法(1)设计并构建RAG1基因敲除载体,利用基因编辑工具对载体进行验证和优化。
(2)将RAG1基因敲除载体导入猪胚胎中,通过显微操作技术将胚胎注射到代孕母猪体内。
(3)观察并记录代孕母猪的妊娠情况,待胚胎发育成活体猪后,进行基因型鉴定和表型观察。
三、实验结果1. 基因编辑效率及验证利用CRISPR-Cas9系统成功构建了RAG1基因敲除载体,并成功将该载体导入猪胚胎中。
经过基因型鉴定,发现RAG1基因成功被敲除,且敲除效率较高。
2. 猪模型表型观察RAG1敲除的免疫缺陷猪表现出严重的免疫缺陷症状,包括对常见病原体的易感性增加、淋巴细胞数量减少等。
这些症状与人类某些免疫缺陷疾病的表现相似,为研究人类免疫性疾病提供了可靠的动物模型。
3. 猪模型的应用价值RAG1敲除的免疫缺陷猪模型可用于研究人类免疫缺陷疾病的发病机制、病理变化以及治疗策略。
此外,该模型还可用于评估新型药物或治疗方法的疗效和安全性。
四、讨论本实验成功利用基因编辑工具制备了RAG1敲除的免疫缺陷猪模型,为研究人类免疫性疾病提供了可靠的动物模型。
在实验过程中,我们优化了基因编辑工具,提高了RAG1基因的敲除效率。
此外,我们还观察到RAG1敲除的免疫缺陷猪表现出与人类免疫缺陷疾病相似的症状,这为进一步研究人类免疫缺陷疾病的发病机制、病理变化以及治疗策略提供了重要的基础。

《利用基因编辑工具制备RAG1敲除的免疫缺陷猪模型》一、引言随着生物医学技术的飞速发展,基因编辑工具如CRISPR-Cas9等在动物模型制备中发挥着越来越重要的作用。
这些工具不仅使我们在研究特定基因的功能时有了新的选择,还能帮助我们深入了解人类疾病的发展机制,从而为疾病的预防和治疗提供新的策略。
本论文将探讨如何利用基因编辑工具制备RAG1敲除的免疫缺陷猪模型,为相关研究提供理论依据和实验方法。
二、RAG1基因与免疫缺陷RAG1基因是一种在哺乳动物免疫系统中发挥重要作用的基因。
该基因的突变或缺失会导致免疫系统发育不全,从而引发严重的免疫缺陷。
因此,制备RAG1敲除的免疫缺陷猪模型对于研究人类免疫缺陷疾病具有重要意义。
三、基因编辑工具的选择与应用目前,CRISPR-Cas9是应用最广泛的基因编辑工具之一。
该技术具有高效率、高特异性等优点,能够实现对特定基因的精确编辑。
在本研究中,我们将利用CRISPR-Cas9系统对猪的RAG1基因进行敲除。
四、实验方法1. 选择适当的猪胚胎并对其进行基因型鉴定;2. 构建携带CRISPR-Cas9系统的慢病毒载体;3. 制备病毒液,并将病毒液注入猪胚胎;4. 对基因编辑后的猪胚胎进行培养并移植到母猪体内;5. 对成功产下的仔猪进行基因型鉴定和免疫表型分析。
五、结果与讨论通过本实验,我们成功制备了RAG1敲除的免疫缺陷猪模型。
这些猪模型在免疫系统发育方面存在明显的缺陷,表现出与人类免疫缺陷疾病相似的症状。
此外,我们还发现RAG1基因的敲除对猪的生长发育和其他生理功能无明显影响。
这为进一步研究RAG1基因在免疫系统中的作用提供了有力的工具。
在实验过程中,我们还发现了一些值得关注的问题。
首先,CRISPR-Cas9系统的精确性对于避免非特异性编辑至关重要。
我们通过优化靶点选择和慢病毒载体的构建等方法,有效降低了非特异性编辑的发生率。
其次,对于如何实现更高效的基因编辑仍需进一步研究。



免疫缺陷动物发展方向
1. 其中最受关注的便是NRG小鼠(Rag2,IL2rg双敲小鼠),普遍认为是当今免疫缺陷程度最高的动物模型。
将可诱导的uPA系统引入该品系,生产出URG小鼠,据研究人员表示,URG足以媲美FRG 小鼠,可以重建最高80%的人类肝脏组织,用来研究HBV和HCV感染,以及药物毒性和代谢过程。
大鼠具有更加明确的质量标准并可以提供足够的血液便于实验操作。
2. NRG与Fah-/-小鼠杂交获得的FRG小鼠成为了人源化肝脏研究领域最重要的模型,利用这个模型,使得我们研究得以研究肝脏纤维化疾病,肝脏代谢性疾病,药物代谢途径,肝脏肿瘤疾病,人类寄生虫(疟疾)和感染性疾病。
3. NOD-scid小鼠与IL2rg-/-杂交所得的品系NOG(NOD/Shi-scid,IL-2Rγnull)小鼠,与NOD/scid小鼠相比,NOG小鼠的人体细胞和组织移植存活率显著提高,同时能够植入更高比例的正常或癌变人类细胞和组织。
另外,NOG小鼠还能满足作为人类免疫系统模型的需求,植入人类造血干细胞后,NOG小鼠的外周淋巴组织可以产生人类T细胞。

《利用基因编辑工具制备RAG1敲除的免疫缺陷猪模型》一、引言在生物学与医学领域,免疫缺陷模型为研究人类免疫系统的基本功能及各种疾病发展提供了重要工具。
其中,利用基因编辑技术构建的基因敲除动物模型因其直接操作性及精准性成为了研究的重要方向。
RAG1作为影响早期B细胞发育的关键基因,通过基因编辑制备RAG1敲除的免疫缺陷猪模型对于探索人类免疫系统的功能和免疫缺陷相关疾病的机制具有深远意义。
本文将详细阐述如何利用基因编辑工具制备RAG1敲除的免疫缺陷猪模型。
二、RAG1基因与免疫系统RAG1基因是影响早期B细胞发育的关键基因,对于淋巴细胞的正常发育及免疫系统功能的发挥具有重要作用。
通过对RAG1基因进行敲除,可以模拟B细胞发育过程中的缺陷,进而为研究相关疾病提供重要模型。
三、基因编辑工具的选择与应用目前,基因编辑技术主要包括ZFNs(锌指核酸酶)、TALENs(转录激活因子类效应核酸酶)和CRISPR-Cas9等。
在制备RAG1敲除的免疫缺陷猪模型中,我们选择CRISPR-Cas9系统。
该系统具有操作简便、精准度高、效率高等优点,可以有效地实现对RAG1基因的敲除。
四、制备过程1. 实验设计与猪只选择:选择适合实验的成年雌性猪只,并进行适当的饲养与准备工作。
2. 基因编辑:利用CRISPR-Cas9系统对RAG1基因进行敲除。
设计并合成针对RAG1基因的sgRNA(单链引导RNA)和Cas9蛋白,将它们导入猪的胚胎细胞中,实现对RAG1基因的精确切割。
3. 胚胎细胞培养与筛选:将经过基因编辑的胚胎细胞进行培养,并利用荧光标记等方法筛选出成功敲除RAG1基因的细胞。
4. 胚胎移植:将筛选出的成功敲除RAG1基因的胚胎细胞移植回母猪体内,待其发育成活体猪只。
5. 模型验证:通过PCR、测序等方法验证RAG1基因是否成功敲除,并观察猪只的免疫系统功能是否出现缺陷。
五、模型验证与结果分析经过上述过程,我们成功制备了RAG1敲除的免疫缺陷猪模型。
《利用基因编辑工具制备RAG1敲除的免疫缺陷猪模型》一、引言随着生物医学技术的飞速发展,基因编辑工具如CRISPR-Cas9等在动物模型制备中发挥着越来越重要的作用。
RAG1基因是一种在免疫系统中发挥关键作用的基因,其缺陷会导致免疫系统发育不全。
为了研究RAG1基因在免疫系统中的作用,以及探索相关疾病的治疗策略,我们利用基因编辑工具制备了RAG1敲除的免疫缺陷猪模型。
本文将详细介绍该模型的制备过程、特点及潜在应用。
二、材料与方法1. 实验动物与基因编辑工具本实验选用猪作为实验动物,利用CRISPR-Cas9基因编辑工具进行RAG1基因的敲除。
2. 基因编辑过程(1)设计并构建CRISPR-Cas9表达载体,以实现对RAG1基因的特异性切割。
(2)将表达载体导入猪胚胎细胞,使其在细胞内表达Cas9蛋白并切割RAG1基因。
(3)通过显微操作技术,将编辑后的胚胎细胞移植回母猪体内,使其发育成RAG1敲除的猪。
3. 模型特点评估(1)对RAG1敲除猪进行免疫系统相关指标的检测,如T 细胞、B细胞数量及功能等。
(2)评估RAG1敲除猪的免疫缺陷程度,以及其在疾病抵抗能力方面的变化。
三、结果与讨论1. 模型制备结果通过上述方法,我们成功制备了RAG1敲除的免疫缺陷猪模型。
在基因编辑过程中,我们观察到RAG1基因的表达被有效敲除,且在猪的免疫系统中产生了明显的缺陷。
2. 模型特点分析(1)免疫系统缺陷表现:RAG1敲除猪表现出明显的免疫系统发育不全,T细胞、B细胞数量减少,免疫应答能力降低。
(2)疾病抵抗能力变化:RAG1敲除猪在面对病原体感染时,其抵抗能力明显减弱,易于发生感染和疾病。
(3)模型优点:该模型能够真实反映RAG1基因缺陷对免疫系统的影响,为研究RAG1基因在免疫系统中的作用提供了有效的工具。
同时,该模型还可用于探索相关免疫系统疾病的治疗策略。
3. 潜在应用(1)科学研究:该模型可用于研究RAG1基因在免疫系统发育和功能维持中的作用,以及相关免疫系统疾病的发生机制。