高考化学大一轮学考复习考点突破第三章第11讲铝及其重要化合物新人教版
- 格式:ppt
- 大小:2.51 MB
- 文档页数:5

2023高考化学一轮复习知识点:铝及其化合物1500字铝(Al)是一种常见的金属元素,原子序数为13,位于元素周期表的第三周期上。
它的原子结构包含13个质子和13个电子。
铝是地壳中的第三大元素,大约占地壳总质量的8%,在自然界中主要以氧化铝(Al2O3)的形式存在。
铝是一种轻便而又耐腐蚀的金属,具有良好的导电性和导热性。
这些特性使得铝在各种领域中得到广泛应用,如航空航天、汽车制造、建筑和包装等。
铝也是可回收利用的金属,所以在环保方面也有很大的优势。
铝的化学性质主要体现在与其他元素形成化合物的过程中。
下面我们来介绍一些常见的铝化合物:1. 氧化铝(Al2O3):氧化铝是铝最常见的化合物,它是一种无机物,也被称为刚玉或红宝石。
氧化铝具有很高的熔点和硬度,因此在炼钢、陶瓷和磨料的制造中得到广泛应用。
2. 氢氧化铝(Al(OH)3):氢氧化铝是一种白色的沉淀物,常常出现在铝与水反应的产物中。
它是一种弱碱性物质,可以用作制造铝盐、消化剂和防酸剂。
3. 硫酸铝(Al2(SO4)3):硫酸铝是一种无机盐,常见的形式是无色结晶体。
硫酸铝可以用作石油和纸浆工业中的催化剂,也是一种常见的水处理剂。
4. 氯化铝(AlCl3):氯化铝是一种无机物,常见的形式是白色结晶体。
它可以用作催化剂、阻燃剂和制药工业中的原料。
5. 碳酸铝(Al2(CO3)3):碳酸铝是一种稀有的铝化合物,常见的形式是无色结晶体。
它可以用作陶瓷和玻璃工业中的原料。
除了上述化合物,铝还可以与许多其他元素形成配合物或有机化合物。
这些化合物在化学工业、医药领域和农药制造中具有广泛的应用。
在学习铝及其化合物的过程中,需要了解铝的性质、制备方法、应用领域以及常见的化学反应。
同时,还需要掌握化学计算、化学方程式的书写和平衡等基础知识。
通过理论学习和实验实践相结合的方式,可以更好地理解和掌握铝及其化合物的相关知识。


高考化学一轮复习:第11讲镁、铝、铜及其重要化合物金属冶炼一、选择题1.(2021·北京西城区高三测试)我国出土的文物呈现了瑰丽的历史文化。
下列文物中,主要成分属于合金的是( )A.西夏佛经纸本B.西汉素纱禅衣C.唐兽首玛瑙杯D.东汉青铜奔马解析:选D A项错误;西汉素纱禅衣是丝绸的一种,主要成分不属于合金,故B项错误;唐兽首玛瑙杯的主要成分是二氧化硅,不属于合金,故C项错误;东汉青铜奔马是铜合金,主要成分属于合金,故D项正确。
2.中华人民共和国勋章使用铜胎镀金材质,主要元素为国徽、五角星、中国结、如意、兰花等,主色调为红色和金色。
下列关于金属材料的说法正确的是( ) A.铁是人类在生产、生活中最早使用的金属材料B.金、银、铜是应用最广泛的金属材料C.钛被誉为“21世纪的金属”,应用前景很广阔D.铜是导电性、导热性最好的有色金属解析:选C。
铜是人类最早使用的金属材料,A错;铁、铝及其合金是应用最广泛的金属材料,B错;银的导电性比铜好,D错。
3.下列关于铝及其化合物的说法不正确的是( )A.Al既可用于食品包装,也可用作建筑材料B.Al2O3既可用来冶炼金属Al,也可用作耐火材料C.明矾[KAl(SO4)2·12H2O]既可用作净水剂,也可用作消毒剂D.Al(OH)3既可用作治疗胃酸过多的药物,也可用来制备一些铝盐解析:选C。
A项,金属铝具有良好的延展性,因此铝可以制成铝箔用于食品包装,金属铝也可用作建筑材料,如铝合金门窗等,正确;B项,电解熔融的Al2O3可冶炼金属Al,由于Al 2O 3具有耐高温的性质,也可用作耐火材料,正确;C 项,明矾[KAl(SO 4)2·12H 2O]溶于水后,Al 3+能发生水解反应,生成的Al(OH)3胶体具有吸附作用,可用作净水剂,但 Al(OH)3 并不具有消毒作用,错误;D 项,Al(OH)3与胃酸中的盐酸反应生成氯化铝和水,正确。

铝的重要化合物考点深度剖析【考点深度剖析】一、铝的重要化合物(一)氧化铝1.性质及用途2.Al2O3的提取由铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)提取Al2O3的两大工艺流程:(二)氢氧化铝1.物理性质白色胶状固体,不溶于水,有较强的吸附性。
2.化学性质(1)Al(OH)3的电离(2)两性氢氧化物[注意] Al(OH)3不溶于弱酸(如H 2CO 3),也不溶于弱碱(如氨水)。
(3)受热分解:2Al(OH)3=====△Al 2O 3+3H 2O 。
3.制备Al(OH)3的三种方法方法一:可溶性铝盐溶液与过量氨水反应 离子方程式:Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +4方法二:向可溶性偏铝酸盐溶液中通入过量CO 2 离子方程式:AlO -2+2H 2O +CO 2===Al(OH)3↓+HCO -3 方法三:相互促进水解法(三)常见的铝盐1.硫酸铝钾是由两种不同的金属离子和一种酸根离子组成的复盐。
2.明矾的化学式为KAl(SO 4)2·12H 2O ,它是无色晶体,可溶于水,水溶液pH <7(填“<”“>”或“=”)。
明矾可以净水,其净水的原理是:Al 3++3H 23(胶体)+3H +,Al(OH)3胶体吸附水中杂质形成沉淀而净水。
3.明矾溶液与Ba(OH)2溶液反应的离子方程式 (1)Al 3+恰好完全沉淀:2Al 3++3SO 2-4+3Ba 2++6OH -===2Al(OH)3↓+3BaSO 4↓。
(2)SO2-4恰好完全沉淀:Al3++2SO2-4+2Ba2++4OH-===2BaSO4↓+AlO-2+2H2O。
(四)铝及其化合物之间的转化1.“铝三角”转化关系写出实现上述各步转化的离子方程式。
(1)①Al3++3NH3·H2O===Al OH3↓+3NH+4②Al3++3AlO-2+6H2O===4Al(OH)3↓③Al3++3OH-===Al(OH)3↓(2)Al(OH)3+3H+===Al3++3H2O(3)Al3++4OH-===AlO-2+2H2O(4)AlO-2+4H+===Al3++2H2O(5)①AlO-2+CO2+2H2O==3↓+HCO-3或2AlO-2+CO2+3H2O==3↓+CO2-3②AlO-2+H++H2O===Al(OH)3↓(6)Al(OH)3+OH-===AlO-2+2H2O2.含铝化合物转化关系的应用(1)判断离子共存问题①Al3+与OH-及AlO-2、CO2-3、S2-等弱酸根阴离子因生成沉淀或发生相互促进的水解反应而不能共存。


铝及其重要化合物一、铝、镁的性质及应用1.铝的结构和存在铝位于元素周期表第三周期ⅢA 族,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中有关反应的化学方程式或离子方程式: ①AlO 2――→常温形成致密的氧化膜――→点燃4Al +3O 2=====点燃2Al 2O 3②2Al+3Cl 2=====点燃2AlCl 3 ③Al酸―――→氧化性酸遇冷的浓硫酸或浓硝酸钝化―――→非氧化性酸2Al +6HCl===2AlCl 3+3H 2↑④2Al+2NaOH +2H 2O===2NaAlO 2+3H 2↑ ⑤2Al+Fe 2O 3=====高温Al 2O 3+2Fe(铝热反应) 4.对比记忆镁的化学性质铝镁与非金属反应 能被Cl 2、O 2氧化2Mg +O 2=====点燃2MgO 3Mg +N 2=====点燃Mg 3N 2与水反应 反应很困难能与沸水反应Mg +2H 2O=====△Mg(OH)2+H 2↑与碱反应能溶于强碱溶液不反应与某些氧化物反应能与Fe2O3、M nO2、Cr2O3等金属氧化物发生铝热反应能在CO2中燃烧:2Mg+CO2=====点燃2MgO+C纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
题组一对比掌握铝、镁的性质1.镁、铝单质的化学性质以相似为主,但也存在某些重大差异性,下列物质能用于证明二者存在较大差异性的是( )①CO2②盐酸③NaOH溶液④水A.①④ B.②③ C.①③ D.②③④答案 C解析Al能与NaOH溶液反应而Mg不能;Mg能在CO2中燃烧而Al不能。
2. 下列说法错误的是()。
A.铝与Fe2O3发生铝热反应后固体物质增重(2014·全国新课标,9C)B.Al片溶于NaOH溶液,产生气体:2Al+2OH-+2H2O===2AlO-2+3H2↑(2014·北京理综,9D) C.工业上电解熔融状态的Al2O3制备Al(2012·广东理综,10B)D.铝制容器可盛装浓H2SO4(2010·重庆理综,8A)解析铝与Fe2O3发生铝热反应:2Al+Fe2O3=====高温Al2O3+2Fe,反应前后固体物质的质量不变。


课时规范练9 镁、铝及其重要化合物一、选择题:本题包括11小题,每小题只有1个选项符合题意。
1.氢氧化铝和碳酸钙都可作为治疗胃酸过多的内服药成分,两者( )A.都属于强电解质B.都难溶于水C.都具有两性D.治疗时都产生气体2.(浙江1月选考)下列关于铝及其化合物的说法不正确的是( )A.明矾可用作净水剂和消毒剂B.利用铝热反应可冶炼高熔点金属C.铝可用作包装材料和建筑材料D.氢氧化铝可用作治疗胃酸过多的药物3.下列叙述正确的是( )A.镁制容器可盛装热的浓硫酸B.镁的金属性比铝的金属性强C.氢氧化镁能溶于过量氨水D.镁在空气中燃烧生成的固体只有MgO4.下列物质的制备方法正确的是( )A.氯化铝溶液和硫化钠溶液反应制备Al2S3B.用镁粉和空气反应制备Mg3N2C.用铝粉和MnO2制得锰D.用电解熔融氯化铝的方法制得单质铝5.下列有关海水提镁的说法正确的是( )A.得到Mg(OH)2沉淀的化学反应方程式为2NaOH+MgCl2Mg(OH)2↓+2NaClB.加入盐酸,Mg(OH)2(s)Mg2+(aq)+2OH-(aq)平衡正向移动C.在空气中加热灼烧MgCl2·6H2O可得到无水氯化镁D.电解熔融氯化镁时金属镁在阳极析出6.常温下,下列各组离子在指定溶液中能大量共存的是( )A.中性溶液中:Cl-、Mg2+、Al3+、K+B.1.0 mol·L-1的NaAlO2溶液中:Cl-、HC O3-、K+、Ca2+C.在强碱性环境中:Al O2-、Si O32-、Na+、K+D.0.1 mol·L-1明矾溶液中:N H4+、Al O2-、HC O3-、Na+7.(四川成都树德中学适应性考试)将mg镁铝合金投入到500 mL 2 mol·L-1的盐酸中,固体完全溶解,收集到5.6 L气体(标准状况下)。
向反应所得溶液中加入4 mol·L-1的氢氧化钠溶液,沉淀达到最大值为13.60 g,则m的值为( )A.11.48B.9.35C.8.50D.5.108.(山东第一次质量检测)下列实验操作、现象与结论不对应的是( )续表D向Al2(SO4)3溶液中逐滴加入NaOH 溶液至过量先生成白色沉淀,后沉淀消失Al(OH)3具有酸性9.(山东聊城高三期末)侯德榜改进的制碱工艺打破了西方对我国的技术封锁,至今仍在使用。

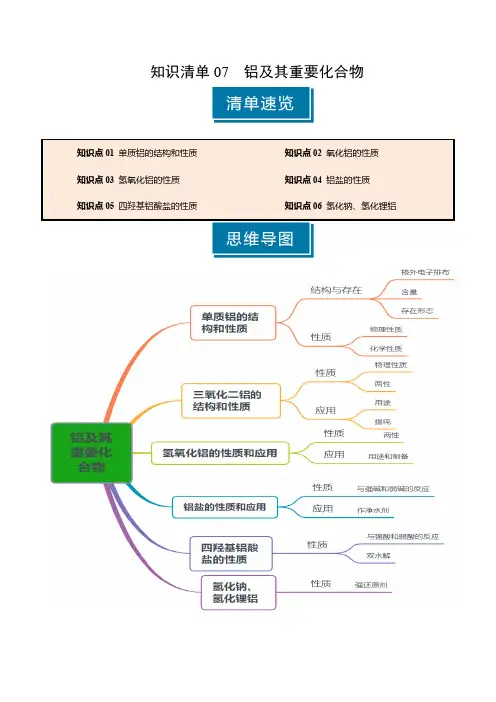
知识清单07 铝及其重要化合物知识点01 单质铝的结构和性质1.铝的结构和存在原子结构示意图结构周期表中的位置第三周期ⅢA 族含量地壳中含量最丰富的金属,仅次于氧、硅存在形态自然界中的铝全部以化合态存在2.物理性质色质态银白色有金属光泽的质软的固体熔沸点熔点660.4℃,沸点2467℃三性延展性、导热性和导电性良好物理性质密度2.7g/cm 3,是一种轻金属3.与非金属单质的反应(1)与氯气反应2Al +3Cl 2=====点燃 2AlCl 3(2)与硫的反应2Al +3S =====△Al 2S 3(3)与氧气反应:Al+O 2→Al 2O 3①Al -------→O 2常温具有抗腐蚀性,原因:表面生成一层致密的氧化物阻止铝和氧气继续反应②Al -------→O 2点燃放出大量的热,发出耀眼的白光4.铝热反应(1)实验装置(2)反应:2Al+Fe 2O 32Fe+Al 2O 3(3)本质:Al 和不活泼金属氧化物的置换反应(4)引发操作:加入少量KClO 3,插上Mg 条并点燃(5)特点:反应放出大量的热,得到熔融的金属(6)应用:冶炼V 、Cr 、Mn 等难熔金属;焊接钢轨①冶炼V :10Al+3V 2O 55Al 2O 3+6V ②冶炼Cr :2Al+Cr 2O 32Cr+Al 2O 3③冶炼Mn :4Al+3MnO 23Mn+2Al 2O 3④冶炼Cu :2Al+3Cu 2O6Cu+Al 2O 35.铝与酸的反应(1)氧化性酸①Al ---------------------→浓硝酸、浓硫酸常温钝化②Al ---------------------→浓硝酸、浓硫酸加热剧烈反应,分别放NO 2和SO 2气体③Al ----------→稀硝酸常温放NO 气体 Al +NO -3+4H +===Al 3++NO ↑+2H 2O(2)非氧化性酸:Al ---------------------→稀盐酸、稀硫酸常温放H 2①关系式:2Al~6H +~3H 2↑②离子方程式:2Al+6H +2Al 3++3H 2↑6.铝与强碱溶液的反应(1)化学:2Al+2NaOH+6H2O 2Na [Al (OH )4]+3H 2↑(2)离子:2Al+2OH -+6H2O 2[Al (OH )4]-+3H 2↑(3)铝和强碱溶液的反应过程①置换反应:2Al+6H 2O2Al (OH )3+3H 2↑②中和反应:Al (OH )3+NaOH Na [Al (OH )4]③还原剂是Al ,氧化剂是H 2O7.铝与盐溶液的置换反应(1)CuSO 4-------→Al Cu ;AgNO 3-------→AlAg (2)FeCl 3-------→Al少量Fe 2+;FeCl 3-------→Al过量Fe 8.铝的制备及用途(1)制备:电解熔融Al 2O 3:2Al 2O 3(熔融)=====通电冰晶石4Al +3O 2↑。

第二节铝及其化合物铝的性质及应用1.铝的物理性质及用途物理性质状态色泽密度熔点沸点硬度导电、导热性延展性固态银白色2.7 g·cm-3660.4℃ 2 467℃较小很好良好用途纯铝用作导线,铝合金用于制备汽车、飞机、生活用品等2.铝的原子结构和存在铝位于元素周期表中第三周期第ⅢA,原子结构示意图为○+132 8 3 。
铝在地壳中含量丰富,仅次于氧,自然界中的铝全部以化合态存在。
3.铝的化学性质写出图中有关反应的化学方程式或离子方程式:①②2Al+3Cl 2=====△2AlCl 3③④2Al+2OH -+2H 2O===2AlO -2+3H 2↑ ⑤2Al+Fe 2O 3=====高温 2Fe +Al 2O 31.判断下列描述的正误(正确的打“√”,错误的打“×”)。
(1)铝制餐具可长时间存放两性或碱性食物。
( )(2)铝与NaOH溶液反应的离子方程式为Al+2OH-===AlO-2+H2↑。
( )(3)铝的还原性强,易在空气中锈蚀,所以铝制品的使用时间很短。
( )(4)铝的导电性强,且价格低廉,常用于制造电线、电缆。
( )(5)用铝粉和氧化镁的粉末混合共热可冶炼出镁。
( )答案:(1)×(2)×(3)×(4)√(5)×2.将下列物质及其用途用“——”连接起来。
①A l A.治疗胃酸过多②明矾B.门窗合金、飞机材料③Al(OH)3C.耐火材料④Al2O3D.净水剂答案:①-B ②-D ③-A ④-C3.金属铝的化学性质活泼,能与酸反应,常温下为什么能用铝制槽车来储运浓硫酸?提示:常温下,浓H2SO4能使铝“钝化”,故可用铝制品盛装浓H2SO4。
4.铝的化学性质活泼,为什么铝制品有较好的抗腐蚀性能?提示:铝在常温下易被空气中的O2氧化,表面形成一层致密的氧化物薄膜,起保护作用。
5.相同质量的铝分别与足量的稀盐酸、NaOH溶液发生反应,产生H2的量相同吗?提示:相同。
2021年化学高考一轮复习--铝及其化合物一、铝铝元素在元素周期表中位于第三周期ⅢA族。
铝为银白色金属,熔点为660.40C,沸点为24670C密度为2.7g·cm-3,导电性仅次于银、铜和金。
1.铝跟非金属反应:常温下,铝被空气里的氧气氧化,在表面生成一层致密的氧化物薄膜,阻止内部的金属继续与氧气反应。
铝在空气中强热:4Al+3O22Al2O3(反应放出大量的热和耀眼的白光,因此铝可用于制造燃烧弹、信号弹、火箭推进剂等。
铝与氮气在高温下反应:2Al+N22AlN,铝容易和卤素反应,常温下和氯气激烈化合生成三氯化铝;在溴中燃烧铝粉生成三溴化铝。
在高温下也能和硫、氮气、碳直接化合成Al2S3、AlN、Al4C3(2000℃)。
2.铝与酸反应(1)与非氧化性强酸(稀硫酸、盐酸)反应:2Al+6H+ =2Al3++3H2↑(2)常温下,铝、铁遇浓硫酸、浓硝酸发生钝化。
所以可用铝制容器盛装浓硫酸或浓硝酸。
(3)加热时,铝与热浓硫酸、浓硝酸反应:2Al+6H2SO4(浓) Al2(SO4)3+3SO2↑+6H2O(4)铝与稀硝酸反应不产生H2。
3.铝与强碱溶液反应:2Al+6H2O=Al(OH)3↓+3H2↑,Al(OH)3+NaOH=NaAlO2+2H2O。
上述两个反应叠加得:2Al+2NaOH+2H2O= 2NaAlO2+3H2↑4.铝与某些金属氧化物反应:2Al+Fe2O3Al2O3+2Fe,这个反应称为铝热反应,铝粉和氧化铁粉末的混合物称为铝热剂.铝热反应可用于焊接钢轨,可用于冶炼Ni、Mn、V等难熔金属。
如10Al+3V2O55Al2O3+6V ,8Al+3Co3O44Al2O3+9Co,8Al+3Fe3O44Al2O3+9Fe等。
例1、下列说法正确的是。
①铝在空气中不易氧化是因为性质不活泼②由于铝的导电性比铜、银都强,所以常用其制造电线、电缆③常温下,由于铝与浓硫酸钝化时不反应,所以可用铝制槽车运送浓硫酸④铝既能溶于酸,又能溶于碱⑤将一块带有氧化膜的铝片与过量的浓NaOH溶液完全反应后,取澄清溶液将其蒸干,得纯净的NaAlO2固体⑥两份相同质量的铝粉,分别与足量的盐酸和氢氧化钠溶液反应,产生的氢气的质量前者多⑦不直接用铝片跟稀硝酸反应制硝酸铝主要是因为铝在稀硝酸中发生钝化⑧常温下,相同的铝片分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完⑨与Al反应能产生H2的溶液中一定大量共存:Fe2+、K+、NO-3、SO2-4⑩浓硝酸滴入用砂纸打磨过的铝条中,产生红棕色气体⑪用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,说明铝的熔点较低⑫用NaOH溶液除去镁粉中的杂质铝:2Al+2OH−+2H2O===2AlO-2+3H2↑例1、④⑥⑫【解析】铝在空气中会与O2反应生成致密的氧化物薄膜,①错误;铝的导电性比铜、银都弱,②错误;钝化是形成致密的氧化膜阻碍反应进行,不是不反应,③错误;铝既能溶于酸,又能溶于碱,且均反应放出氢气,④正确;铝片与过量的浓NaOH溶液完全反应后,蒸干得到的不是纯NaAlO2,⑤错误;由Al与盐酸、氢氧化钠溶液反应的方程式易知相同质量的Al与足量的盐酸和氢氧化钠溶液反应,产生的H2的质量相等,⑥正确;铝只与浓硝酸之间有钝化作用,稀硝酸没有钝化作用,不直接用铝片跟稀硝酸反应制硝酸铝主要是因为铝片与HNO3反应生成污染环境的NO 等气体,同时由于铝不纯,制备的硝酸铝不纯,⑦错误;常温下铝与浓硝酸、浓硫酸发生钝化不可能完全溶解,⑧错误;与Al能放出氢气的,同业可能显酸性也可能显碱性,若是碱性,则Fe2+和OH-不共存,若酸性,NO3-在酸性条件下具有强氧化性,不产生H2,⑨错误;常温下铝在浓硝酸中钝化,观察不到红棕色NO2气体,⑩错误;铝在空气中加热生成氧化铝的熔点较高,所以内部熔化的铝不会滴落,⑪错误;铝能够与氢氧化钠反应而镁不能,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,⑫正确。