电子排布式、电子排布图、原子结构示意图比较大全
- 格式:xls
- 大小:2.29 MB
- 文档页数:2



考纲解读1.认识原子核的结构,懂得质量数和的含义,掌握构成原子的微粒间的关系,了解元素、核素、同位素的涵义。
2.认识原子核外电子的运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.3.了解多电子原子中核外电子分层排布遵循的原理,掌握1~36号元素的电子排布(原子结构示意图、电子排布式)。
4.了解原子结构模型的发展历史了解原子“基态”、“激发态”的概念。
知识再现一.原子的构成1.原子的构成原子中微粒的作用2.原子中有关量的关系:电性关系质子数= 核电荷数= 核外电子数= 原子序数质量关系质量数(A)= 质子数(Z) + 中子数(N)二.同位素1.概念2.同位素的特点同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。
3.与同素异形体、同分异构体、同系物的比较例题1、据报道,月球上有大量3He存在,以下关于3He的说法正确的是A、是4He的同分异构体B、比4He多一个中子C、是4He的同位素D、比4He少一个质子2、已知自然界氢的同位素16O、17O、18O,氢的同位素有H、D,从水分子的原子组成来看,自然界的水一共有 A、3种 B、6种 C、9种 D、12种3、1999年曾报道合成和分离子含高能量的正离子N5+的化合物N5AsF6,下列叙述中错误的是A、N5+共有34个核外电子B、N5+中氮一氮原子间以共有电子对结合C、化合物中N5AsF6中As化合价为-1D、化合物N5A S F6中F化合价为-1三、核外电子的运动1.核外电子的运动特征核外电子质量,运动速率,运动的空间,确定的轨道。
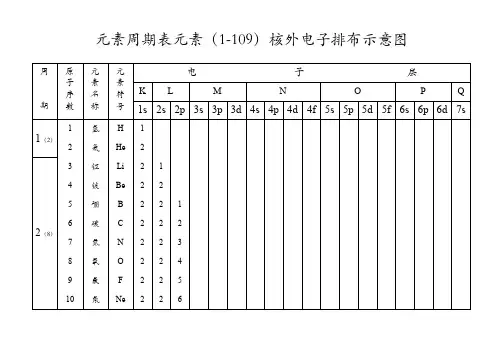
2.电子云能级(原子轨道)电子云的轮廓图称之为原子轨道.四.核外电子的排布1.核外电子的排布能层(电子层)n 符号K L M N O P Q能级(原子轨道)每一能层的电子的能量也可能不同,又将能层分成相应的能级。
第n能层中,就有个能级,分别为ns 但不一定每一个能级中都有电子。
能级数=序数。


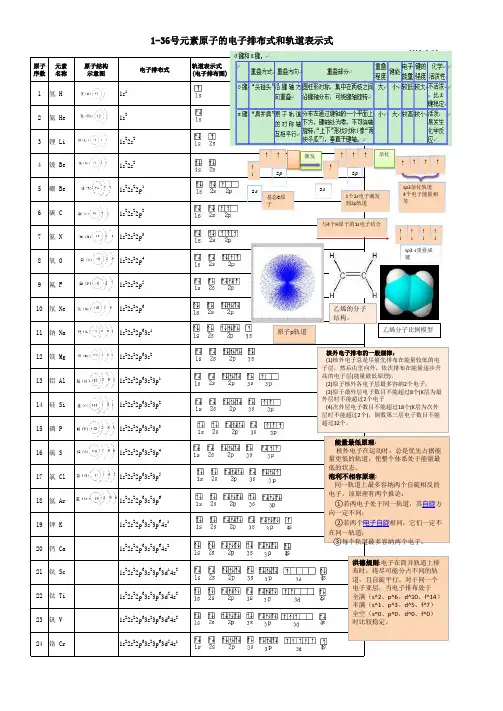
原子结构与性质1、电子排布式:如:氧原子电子排布式:1s2 2s2 2p42、电子排布图:3、原子结构示意图:4、核外电子排布:5、电子式:6、结构式:H-O-H练习1:1、A、B、C、D、E代表5种元素。
请填空:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为________;(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的元素符号为________;(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为______________________________________________________。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E 的元素符号为________,其基态原子的电子排布式为____________________________________________________。
(5)F元素的原子最外层电子排布式为n s nn p n+1,则n=________;原子中能量最高的是________电子,其原子轨道呈________形。
解析:(1)由题意知,A元素基态原子核外电子排布式为1s22s22p3,所以A为氮元素。
(2)氩为18号元素,B的负一价离子电子层结构与氩相同,所以B为氯,C为钾。
(3)因为D元素正三价离子的3d能级为半充满即3d5,由此推知D元素基态原子的核外电子排布式为1s22s22p63s23p63d64s2,因此为铁元素。
(4)E元素基态原子的M层全充满,且N层没有成对电子,只有一个未成对电子,由此推出核外电子排布式为:1s22s22p63s23p63d104s1,因此为铜元素(5)s能级只有1个原子轨道,故最多只能容纳2个电子,即n=2,所以元素F的原子最外层电子排布式为2s22p3,由此可知F是N元素;根据核外电子排布的能量最低原理,可知氮原子的核外电子中2p能级的能量最高,p电子的原子轨道呈纺锤形。



族
IA IIA ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0周期表中纵列数第1列第2列
第3列
第4列
第5列
第6列
第7列
第8列
第9列
第10列
第11列
第12列
第13列
第14列
第15列
第16列
第17列
第18列第一周期(1-2号)
原子序数元素符号名称
1 H 氢
2 He 氦
2种元素电子排布式 1s 1
1s 2
电子排布图
原子结构
示意图
第二周期(3-10号)
原子序数元素符号名称
3 Li 锂
4 Be 铍
5 B 硼
6 C 碳
7 N 氮
8 O 氧
9 F 氟10 Ne 氖
8种元素电子排布式 1s 22s 1 1s 22s 2
1s 22s 22p 1
1s 22s 22p 2
1s 22s 22p 3
1s 22s 22p 4
1s 22s 22p 5
1s 22s 22p 6
电子排布图
原子结构示意图
第三周期(11-18号)
原子序数元素符号名称
11 Na 钠12 Mg 镁13 Al 铝14 Si 硅15 P 磷16 S 硫17 Cl 氯18 Ar 氩8种元素电子排布式1s 22s 22p 63s 1
1s 22s 22p 63s 2
1s 22s 22p 63s 23p 1
1s 22s 22p 63s 23p 2
1s 22s 22p 63s 23p 3
1s 22s 22p 63s 23p 4
1s 22s 22p 63s 23p 5
1s 22s 22p 63s 23p 6
电子排布图
原子结构示意图
第四周期18种(19-36号)原子序数元素符号名称
19 K 钾
20 Ca 钙
21 Sc 钪
22 Ti 钛23 V 钒
24 Cr 铬
25 Mn 锰26 Fe 铁
27 Co 钴28 Ni 镍
29 Cu 铜
30 Zn 锌
31 Ga 镓
32 Ge 锗
33 As 砷
34 Se 硒
35 Br 溴
36 Kr 氪
电子排布式
【Ar 】4s 1
1s 22s 22p 63s 23p 64s 2
1s 22s 22p 63s 23p 63d 14s
2
【Ar 】3d 24s 2
1s 22s 22p 63s 23p 63d 34s
2
1s 22s 22p 63s 23p 63d 54s 1
【Ar 】3d 24s 2
1s 22s 22p 63s 23p 63d 64s
2
【Ar 】3d 74s 2
1s 22s 22p 63s 23p 63d 84s
2
1s 22s 22p 63s 23p 63d 104s 1
1s 22s 22p 63s 23p 63d 104s 2
1s 22s 22p 63s 23p 63d 104s 24p 1
1s 22s 22p 63s 23p 63d 104s 24p 2
【Ar 】3d 104s 24p 3
1s 22s 22p 63s 23p 63d 104s 24p 4
【Ar 】3d 104s 24p 5
【Ar 】3d 104s 24p 6
第五周期18种
37-54号价电子排布式
4s 1
4s 23d 14s 23d 24s 2
3d 34s 23d 54s 13d 54s 2
3d 64s 23d 74s 2
3d 84s 2
3d
10
4s 13d 104s 24s 24p 14s 24p 24s 24p 34s 24p 44s 24p 54s 24p 6
第六周期32种55-86号 镧系电子排布图
价电子排布图
第七周期?种
满32种87-满118号
锕系
原子结构示意图
共价键分类
s-sσ键
s-pσ键
p-pσ键p-pΠ键分子或离子CO 2SO 2 CO 32-CH 4NH 4+ 中心原子杂
化轨道类型
sp
sp2sp3
a 64+2=65-1=4x 234H 2O NH 3b
2
21sp3sp3
中心原子上
的孤对电子数0100
分子或离子的
价层电子对数
2
3
3
4
VSEPR模型名称直线形
平面三角形平面三角形正四面体形正四面体形
分子或离子的立体构型名称
直线形V形平面三角形正四面体形正四面体形
配合物形成:颜色改变、溶解度改变
无机含氧酸分子酸性
1、对于同一种元
素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。
2、含氧酸的通式
可写成(HO)mROn,R相同,n值越大,酸性越强。
注意:碳酸因溶解度较小,酸性弱。
1-36号元素电子排布式、电子排布图、原子结构示意图比较·分子结构与性质学习参考 开远一中高三化学备课组周艳芳编拟
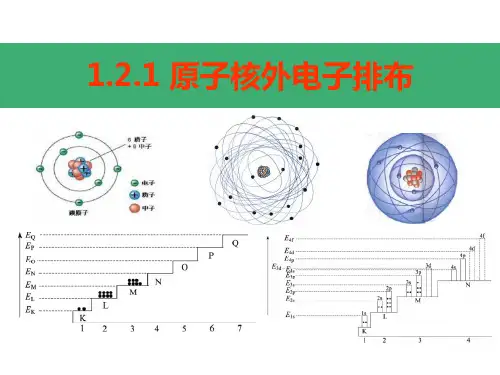
Ⅷ 电子云和原子轨道:
(1)电子运动的特点:①质量极小 ②运动空间极小 ③极高速运动。
电子运动只能用统计的观点来描述它在原子核外各处出现的概率——电子云。
常把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图成为原子轨道。
S的原子轨道是球形的(右下图), 能层序数越大,原子轨道的半径越大。
ns np (n≥2) nd (n≥3) nf (n≥4)
P的原子轨道(右下图)是哑铃状(或纺锤形)的,每个P能级有3个轨道,互相垂直,分别以Px、Py、Pz为符号。
P原子轨道的平均半径也随能层序数增大而增大。
能层序数n越大,原子轨道的半径越大。
这是由于1s,2s,3s……电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
分子结构与性质
杂化轨道类型sp3 sp sp2
中心原子上的孤对电子数=1/2(a-xb) a为中心原子的价电子数;x为与中心原子结合的原子数;用价层电子对互斥模型判断下列分子或离子的构型VSEPR模型杂化轨道数=中心原子孤对电子对数+中心原子结合的原子数
b为与中心原子结合的原子最多能接受的电子数 氢为1,其它原子=8-该原子的价电子数。
AB X 型 价层电子对互斥理论对几种分子或离子的立体构型推测
族行周期元素种类 分子或离子的
立体构型
+11
+321
+11281
+19
2881+422+523
+624
+725+826
+927+1028
+22
+17287+16286+15285
+14284+13283
+12282
+20
2882
+21
2892
+18288
+36
28188
+22
28102
+23
28112
+24
28131+25
28132
+26
28142
+27
28152
+28
28162
+29
28181
+30
28182
+31
28183
+32
28184
+33
28185+34
28186+3528187
轴对称镜面对称
形成配合物的条件:①配位体有孤电子对;②中心原子有空轨道。
法二:价层电子对数=(中心原子价层电子数+配原子数×n+电荷数)/2说明:配原子为H,X-F,Cl,Br,I
n=1;配原子为O,S n=0;配原子为N n=-1。
电荷数:带正电减带负电加。