蛋白质SDS聚丙烯酰胺凝胶电泳配方
- 格式:docx
- 大小:11.43 KB
- 文档页数:1


蛋白质S D S聚丙烯酰胺
凝胶电泳配方
The manuscript was revised on the evening of 2021
分离胶;一块胶配5mL
每一块胶需要约4mL, 留出约2-3cm的距离,用水封口,防止空气接触。
室温放置30min后,可以看到水和胶的界面重新出现。
弃去上层水,倒入凝缩胶。
凝缩胶:一块胶配2mL
10%(W/V)过硫酸铵
1 称取1g APS
2加入10mL 去离子水
3储存于4℃可使用两周时间,过期失去催化作用。
5* Tris-Glycine Buffer (SDS-PAGE电泳缓冲液)
1.
Tris
Gly 94g
SDS 5g
2加入800mL去离子水,搅拌溶解
3定容至1L,室温保存。
5*SDS-PAGE Loading Buffer
离心管
1M Tris-HCl
SDS
BPB 25mg
甘油
2加去离子水溶液后定容至5mL
3小份(500uL/份)分装后,于室温保存
4使用前将25uL的2-ME加到每小份中
5加入2-ME的Loading Buffer 可在室温下保存一个月左右。


实验⼗聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋⽩质实验⼗聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋⽩质【实验⽬的】1. 了解和掌握聚丙烯酰胺凝胶电泳的技术和原理;2. 掌握⽤此法分离蛋⽩质组分的操作⽅法。
【实验原理】在⽣物化学、分⼦⽣物学和基因(遗传)⼯程实验中,常常要进⾏蛋⽩质和核酸的分离⼯作。
聚丙烯酰胺凝胶电泳(Polyacrylamide Gel Electrophoresis, PAGE)是以聚丙烯酰胺凝胶作为⽀持介质进⾏蛋⽩质或核酸分离的⼀种电泳⽅法。
聚丙烯酰胺凝胶是由丙烯酰胺单体(acrylamide,简称ACR)和交联剂N,N-甲叉双丙烯酰胺(N,N-methylene bisacrylsmide 简称BIS)在催化剂的作⽤下聚合交联⽽成的三维⽹状结构的凝胶。
通过改变单体浓度与交联剂的⽐例,可以得到不同孔径的凝胶,⽤于分离分⼦量⼤⼩不同的物质。
聚丙烯酰胺凝胶聚合的催化体系有两种:(1)化学聚合:催化剂采⽤过硫酸铵,加速剂为N,N,N,N-四甲基⼄⼆胺(简称TEMED)。
通常控制这⼆种溶液的⽤量,使聚合在1⼩时内完成。
(2)光聚合:通常⽤核黄素为催化剂,通过控制光照时间、强度控制聚合时间,也可加⼊TEMED 加速反应。
聚丙烯酰胺凝电泳常分为⼆⼤类:第⼀类为连续的凝胶(仅有分离胶)电泳;第⼆类为不连续的凝胶(浓缩胶和分离胶)电泳。
⼀般地,不连续聚丙烯酰胺凝胶电泳有三种效应:①电荷效应(电泳物所带电荷的差异性);②凝胶的分⼦筛效应(凝胶的⽹状结构及电泳物的⼤⼩形状不同所致)。
③浓缩效应(浓缩胶与分离胶中聚丙烯酰胺的浓度及pH的不同,即不连续性所致)。
因此,样品分离效果好,分辨率⾼。
SDS即⼗⼆烷基硫酸钠(Sodium Dodecyl Sulfate,简称SDS)是阴离⼦表⾯活性剂,它能以⼀定⽐例和蛋⽩质结合,形成⼀种SDS-蛋⽩质复合物。
这时,蛋⽩质即带有⼤量的负电荷,并远远超过了其原来的电荷,从⽽使天然蛋⽩质分⼦间的电荷差别降低仍⾄消除。
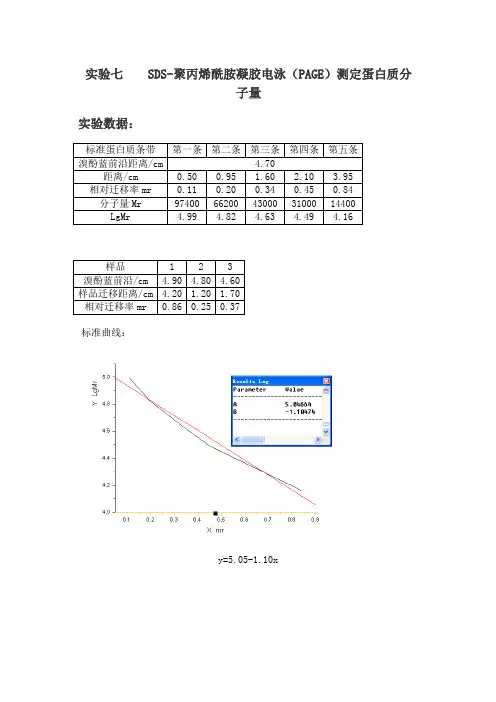
实验七SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量实验数据:标准蛋白质条带第一条第二条第三条第四条第五条溴酚蓝前沿距离/cm 4.70距离/cm 0.50 0.95 1.60 2.10 3.95 相对迁移率mr 0.11 0.20 0.34 0.45 0.84 分子量Mr 97400 66200 43000 31000 14400LgMr 4.99 4.82 4.63 4.49 4.16样品 1 2 3溴酚蓝前沿/cm 4.90 4.80 4.60样品迁移距离/cm 4.20 1.20 1.70相对迁移率mr 0.86 0.25 0.37标准曲线:y=5.05-1.10x结果:样品 1 2 3Mr 12706 59566 43954mr 4.104 4.775 4.643一. 实验目的和要求1 学习SDS-PAGE测定蛋白质分子量的原理。
2 掌握垂直板电泳的操作方法。
3 运用SDS-PAGE测定蛋白质分子量及染色鉴定。
二 .实验原理带电质点在电场中向带有异相电荷的电极移动,这种现象称为电泳。
区带电泳是在半固相或胶状介质上加一个点或一薄层样品溶液,然后加电场,分子在支持介质上或支持介质中迁移。
支持介质的作用主要是为了防止机械干扰和由于温度变化以及大分子溶液的高密度而产生的对流。
区带电泳使用不同的支持介质,早期有滤纸、玻璃珠、淀粉粒、纤维素粉、海砂、海绵、聚氯乙烯树脂;以后有淀粉凝胶、琼脂凝胶、醋酸纤维素膜,现在则多用聚丙烯酰胺(PAGE)和琼脂糖凝胶。
PAGE根据其有无浓缩效应,分为连续系统和不连续系统两大类,连续系统电泳体系中缓冲液pH值及凝胶浓度相同,带电颗粒在电场作用下,主要靠电荷和分子筛效应。
不连续系统中由于缓冲液离子成分,pH,凝胶浓度及电位梯度的不连续性,带电颗粒在电场中泳动不仅有电荷效应,分子筛效应,还具有浓缩效应,因而其分离条带清晰度及分辨率均较前者佳。
SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基磺酸钠), SDS能断裂分子内和分子间氢键,破坏蛋白质的二级和三级结构,强还原剂能使半胱氨酸之间的二硫键断裂,蛋白质在一定浓度的含有强还原剂的SDS溶液中,与SDS分子按比例结合,形成带负电荷的SDS-蛋白质复合物,这种复合物由于结合大量的SDS,使蛋白质丧失了原有的电荷状态形成仅保持原有分子大小为特征的负离子团块,从而降低或消除了各种蛋白质分子之间天然的电荷差异,由于SDS与蛋白质的结合是按重量成比例的,因此在进行电泳时,蛋白质分子的迁移速度取决于分子大小。

实验8 SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的相对分子量Mr原理蛋白质在聚丙烯酰胺凝胶电泳中, 蛋白质的迁移率取决于它所带净电荷及分子的大小和形状。
在聚丙烯酰胺凝胶系统中加入阴离子去污剂十二烷基磺酸钠(sodium dodecyl sulfate,简称SDS)和还原剂(如巯基乙醇)处理蛋白质样品, 则蛋白质分子中的二硫键被还原, 1g蛋白质可定量结合1.4g SDS。
由于SDS呈解离状态, 使蛋白质亚基带上大量的负电荷, 其数值大大超过蛋白质分子原有的电荷量, 因而掩盖了不同种类蛋白质间原有的电荷差别。
各种蛋白质-SDS复合物表现出相等的电荷密度, 在聚丙烯酰胺凝胶上电泳时, 它们纯粹按照分子的大小由凝胶的分子筛效应来进行分离, 有效迁移率与相对分子量的对数成很好的线性关系。
用这种方法测定蛋白质的Mr, 简便、快速, 只需要廉价的设备和μg量的蛋白质样品。
所得的结果, 在Mr为15000~200000的范围内, 与用其他方法测得的Mr相比, 误差一般在±10%以内。
因此SDS测定Mr的方法, 已得到非常广泛的应用和迅速的发展。
现在经SDS-聚丙烯酰胺凝胶研究过的蛋白质已经有很多种了。
实验证明, 在蛋白质溶液中加入SDS和巯基乙醇后, 巯基乙醇可使蛋白质分子中的二硫键;SDS能使蛋白质的氢键、疏水键打开, 并结合到蛋白质分子上形成蛋白质-SDS复合物。
在一定的条件下, SDS与大多数蛋白质的结合比为1.4gSDS/1g蛋白质。
由于十二烷基硫酸根带负电, 使各种蛋白质的SDS复合物都带上相同密度的负电荷, 它的量大大超过了蛋白质分子原有的电荷量, 因而掩盖了不同种类的蛋白质间原有的电荷差别。
1.在用SDS-凝胶电泳法测定蛋白质的Mr时, 应注意以下几个问题:如果蛋白质-SDS复合物不能达到1.4gSDS/1g蛋白质的比率并具有相同的构象, 就不能得到准确的结果。
影响蛋白质和SDS结合的因素主要有以下3个: ⑴二硫键是否完全被还原: 只有在蛋白质分子内的二硫键被彻底还原的情况下, SDS才能定量地结合到蛋白质分子上去, 并使之具有相同的构象。



SDSPAGE所有详细试剂配方SDS-(聚丙烯酰胺凝胶电泳)是一种常用于蛋白质分析的实验技术。
该技术通常涉及到几种试剂,如胶溶液、缓冲液、电泳缓冲液、染色溶液等。
下面是SDS-常见的试剂配方及其详细说明。
一、胶溶液配方:1. 30%(w/v)丙烯酰胺(acrylamide)溶液- 在称量瓶中称取30g丙烯酰胺,并用蒸馏水调至100ml。
搅拌溶解直至均匀。
-这是制备聚丙烯酰胺凝胶的基础溶液。
2. 响应稀释液(Response diluent)-用于稀释聚丙烯酰胺溶液以获得不同浓度的凝胶。
-可通过将聚丙烯酰胺溶液与水按1:3体积比混合来制备响应稀释液。
二、缓冲液配方:1. 离子化追踪剂(Tris-Glycine running buffer)-用于凝胶电泳盒中电解质的运行。
-配方为:3g Tris base (pH 8.8)14.4g glycine将固体溶解于1L蒸馏水中,并调整pH至8.8三、电泳缓冲液配方:1. 离子化追踪剂(Tris-Glycine SDS running buffer)-用于在电泳过程中提供离子追踪剂。
-配方为:30g Tris base144g glycine10gSDS将固体溶解于1L蒸馏水中。
2. 加速剂(stacking gel buffer)- 用于形成凝胶中的聚集堆积层(stacking layer)。
-配方为:30g Tris base (pH 6.8)144g glycine1gSDS将固体溶解于1L蒸馏水中,并调整pH至6.8四、样品处理缓冲液配方:1. 样品加载缓冲液(sample loading buffer)-用于处理蛋白样品,以便在凝胶上获得良好的分离效果。
-配方为:0.5M Tris-HCl(pH 6.8)20%(v/v)甘油10%(w/v)SDS0.05%(w/v)溴酚蓝(bromophenol blue)旋转混合并加入蛋白样品。
五、凝胶染色溶液配方:1. 吸附性染色剂(Coomassie blue staining solution)-用于染色聚丙烯酰胺凝胶上分离的蛋白质。

sds聚丙烯酰胺凝胶电泳测定蛋白质实验报告实验报告:SDS聚丙烯酰胺凝胶电泳测定蛋白质1. 实验目的:本实验旨在使用SDS聚丙烯酰胺凝胶电泳技术对蛋白质进行分离和测定,并研究样品中蛋白质的分子量。
2. 实验原理: SDS聚丙烯酰胺凝胶电泳是一种常用的蛋白质分离和测定方法。
在此方法中,蛋白质样品首先与SDS(十二烷基硫酸钠)反应,使蛋白质在电泳过程中带有负电荷。
然后,蛋白质样品被加载到聚丙烯酰胺凝胶中,经过电泳分离。
由于SDS的作用,蛋白质在凝胶中的迁移速度与其分子量成反比。
最后,通过染色或蛋白质标记物检测,可以确定蛋白质的相对分子量。
3. 实验步骤: a. 准备SDS聚丙烯酰胺凝胶:按照制备凝胶的方法制备所需的聚丙烯酰胺凝胶,包括配制凝胶溶液、注射样品孔和负载样品等步骤。
b. 样品制备:将待测蛋白质样品加入SDS缓冲液,并加热至高温,使蛋白质与SDS反应,使其带负电荷。
c. 电泳操作:将样品加载到凝胶中,连接电源进行电泳,设定合适的电压和时间进行分离。
d. 染色和可视化:电泳完成后,将凝胶染色以可视化蛋白质条带,常用的染色方法包括银染、共染等。
e. 分析和测定:根据标准蛋白质的移动距离和相对分子量,通过比较和分析样品中蛋白质的相对分子量。
4. 实验结果:在实验中,通过SDS聚丙烯酰胺凝胶电泳分离和染色,观察到样品中的蛋白质条带。
根据标准蛋白质的移动距离和相对分子量,可以推断样品中蛋白质的相对分子量。
实验结果可以用图表形式展示,包括蛋白质条带的位置和相对分子量的估计。
1/ 25. 结果分析与讨论:分析实验结果,比较样品中蛋白质的相对分子量与已知标准蛋白质的相对分子量之间的差异。
根据条带的位置和相对分子量的估计,可以推断样品中的蛋白质组成和含量。
讨论实验中可能出现的误差和不确定性,并提出改进的建议。
6. 结论:根据实验结果,可以得出关于样品中蛋白质的相对分子量和组成的结论。
总结实验的目的、方法和结果,并指出实验的局限性和未来的研究方向。
实验四 SDS 聚丙烯酰胺凝胶电泳测蛋白质分子量姓名:mangogolaSDS 聚丙烯酰胺凝胶电泳测定蛋白质分子量的原理是:蛋白质在电泳中的迁移速率取决于其所带电荷、分子大小以及形状等因素,而大多数蛋白质与SDS 按一定比例结合(1:1.4/g:g ),这样使各种蛋白质的SDS-复合物都带上相同密度的负电荷,而且形状为短轴相同的雪茄烟形。
由此蛋白质分子的电泳迁移率仅取决于其分子量,在特定凝胶浓度下,一定范围内的蛋白质分子量对数与迁移率呈直线关系,选择分子量范围和性质与待测样品相近的蛋白质作标准蛋白,与样品同时电泳计算得到标准曲线,并根据待测样品的相对迁移率在标准曲线上查出其分子量。
一.实验过程1.凝胶工作液的配制2.灌制分离胶将制胶玻璃板清洗安装紧密后,插入制孔器,在距制孔器下端1cm 处做一标记,取下制孔器将分离胶溶液加入两块玻璃板之间至标记处。
然后立即用注射器向凝胶液面轻轻铺上一层厚约0.5cm 的dd 水,目的是使凝胶面平整,放置待其聚合凝固。
3.灌制浓缩胶将分离胶上的双蒸水用注射器取出并用滤纸吸干,放入制孔器,用滴管灌入浓缩胶至玻璃板顶端待其聚合凝固。
4.待测样品的制备取0.1ml 透析除盐后的样品稀释液(浓度在0.2mg/ml 左右),加入0.1ml 样品溶解液,混匀后沸水浴5min ,冷却。
(沸水浴的目的是使蛋白质变性成肽链,便于与SDS 结合,甘油可以增加蛋白质的比重,便于沉降到加样孔底部,不易飘散) 5.加样和电泳将电极缓冲液注入缓冲液槽,然后轻轻拔出制孔器,加样后连接电泳仪,记录每个加样孔的样品类型及上样量。
浓缩胶使用50V 恒压,分离胶使用100V 恒压。
浓缩胶浓度4%,交联度2.7%[Acr (30%):Bis (0.8%)]溶液0.67ml dd 水3.05ml0.5M pH6.8 Tris-Hcl (0.4%SDS )溶液 1.25mlTEMED (原液)6ul将以上成分加入小烧杯中轻轻摇匀,加入10%的硫代硫酸铵0.026ml ,摇匀后灌胶。
sds聚丙烯酰胺凝胶电泳实验报告SDS聚丙烯酰胺凝胶电泳实验报告。
实验目的:本实验旨在通过SDS聚丙烯酰胺凝胶电泳技术对蛋白质进行分离和分析,从而了解蛋白质的分子量和含量。
实验原理:SDS聚丙烯酰胺凝胶电泳是一种常用的蛋白质分离技术,它利用SDS(十二烷基硫酸钠)对蛋白质进行线性解离,使蛋白质呈现负电荷,并且使蛋白质的分子量与迁移速率成线性关系。
通过凝胶电泳,可以将蛋白质按照其分子量大小进行分离,从而得到蛋白质的分子量和含量信息。
实验步骤:1. 制备凝胶,首先制备聚丙烯酰胺凝胶,将蛋白质样品加入样品缓冲液中,并加入SDS蛋白质变性剂进行变性处理。
2. 蛋白质样品加载,将处理后的蛋白质样品加载到凝胶孔中。
3. 电泳分离,将凝胶置于电泳槽中,加入电泳缓冲液,施加电场进行电泳分离。
4. 凝胶染色,电泳结束后,将凝胶进行染色,观察蛋白质条带。
实验结果:经过SDS聚丙烯酰胺凝胶电泳分离,观察到蛋白质在凝胶上呈现出不同的条带,根据条带的位置和密度可以初步判断蛋白质的分子量和含量。
通过实验数据的分析,我们可以得到蛋白质的分子量和相对含量信息。
实验结论:通过本次实验,我们成功利用SDS聚丙烯酰胺凝胶电泳技术对蛋白质进行了分离和分析,得到了蛋白质的分子量和含量信息。
这些数据对于进一步研究蛋白质功能和结构具有重要意义。
实验总结:SDS聚丙烯酰胺凝胶电泳是一种简单、快速、准确的蛋白质分离技术,广泛应用于生物化学和分子生物学领域。
通过本次实验,我们对该技术有了更深入的了解,并且掌握了实验操作的关键步骤和注意事项。
希望通过今后的实验实践,能够进一步提高实验技能,为科研工作打下坚实的基础。
分离胶;一块胶配5mL
每一块胶需要约4mL, 留出约2-3cm的距离,用水封口,防止空气接触。
室温放置30min后,可以看到水和胶的界面重新出现。
弃去上层水,倒入凝缩胶。
凝缩胶:一块胶配2mL
10%(W/V)过硫酸铵
1 称取1g APS
2加入10mL 去离子水
3储存于4℃可使用两周时间,过期失去催化作用。
5* Tris-Glycine Buffer (SDS-PAGE电泳缓冲液)
1.
Tris 15.1g
Gly 94g
SDS 5g
2加入800mL去离子水,搅拌溶解
3定容至1L,室温保存。
5*SDS-PAGE Loading Buffer
1.10ml 离心管
1M Tris-HCl (pH6.8) 1.25mL
SDS 0.5g
BPB 25mg
甘油 2.5ml
2加去离子水溶液后定容至5mL
3小份(500uL/份)分装后,于室温保存
4使用前将25uL的2-ME加到每小份中
5加入2-ME的Loading Buffer 可在室温下保存一个月左右。