化学键与化学反应中的能量变化
- 格式:doc
- 大小:261.00 KB
- 文档页数:3




课时分层作业(八)化学键与化学反应中的能量变化(建议用时:40分钟)[合格基础练]1.下列说法不正确的是()A.大多数的化合反应是释放能量的反应B.大多数的分解反应是吸收能量的反应C.化学反应必然伴随着能量的变化D.吸收能量的反应都需要加热[答案]D2.下列反应中生成物总能量高于反应物总能量的是()A.碳酸钙受热分解B.乙醇燃烧C.铝与氧化铁粉末反应D.氧化钙溶于水A [生成物总能量高于反应物总能量则说明反应过程需要吸收能量。
]3.下列变化过程需要吸收能量的是( )A.2H2+O2错误!2H2OB.Cl+Cl―→Cl2C.CaO+H2O===Ca(OH)2D.H2―→H+HD [H2在O2中燃烧放出大量的热,生石灰溶于水放热,原子间化合放出能量,而拆开H—H则需吸收能量。
]4.下列反应既属于氧化还原反应,又属于吸热反应的是() A.实验室制H2B.用Al焊接钢轨C.Ba(OH)2·8H2O与NH4Cl晶体反应D.灼热的碳放入CO2中D [实验室制H2的反应Zn+H2SO4===ZnSO4+H2↑是放热的氧化还原反应;焊接钢轨的原理是2Al+Fe2O3错误!2Fe+Al2O3是放热的氧化还原反应;C项是吸热的复分解反应。
]5.下列反应过程中的能量变化与如图一致的是( )A.2Al+Fe2O3错误!2Fe+Al2O3高温2COB.C+CO2=====C.CaCO3错误!CaO+CO2↑D.C+H2O(g)错误!CO+H2A [铝热反应属于放热反应,反应物具有的总能量高于生成物具有的总能量,故A选项正确;B、C、D三项均为吸热反应,反应物具有的总能量低于生成物具有的总能量,故错误。
] 6.下列反应符合如图所示的是( )A.铝片与盐酸的反应B.消石灰与NH4Cl晶体的反应C.酸碱中和反应D.甲烷在氧气中的燃烧反应B [由图示可知:反应物总能量低于生成物总能量,故为吸热反应.]7.破坏1 mol H2中的化学键吸收的能量为Q1 kJ,破坏1 mol O2中的化学键吸收的能量为Q2 kJ,形成1 mol H2O中的化学键释放的能量为Q3 kJ。


第12课时化学键与化学反应中能量变化的关系学案A【自主探究】【课前预习】根据教材有关内容填写下列空白:1、物质发生化学反应的同时还伴随着变化,而这种能量变化又通常表现为变化。
2、一个化学反应的过程,本质上就是的过程。
3、在任何的化学反应中总伴有的变化。
原因:当物质发生化学反应时,断开反应物中的化学键要能量,而形成生成物中的化学键要能量。
是化学反应中能量变化的主要原因。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于。
若E(反应物总能量)>E(生成物总能量),为反应。
若E反应物总能量<E(生成物总能量),为反应。
4、一个化学反应是吸收能量还是放出能量取决于旧键断裂的相对大小。
分析解答:1、能量的、热能、2、旧化学键断裂和新化学键形成、3、能量、吸收、放出、化学键的断裂和形成、反应物的总能量与生成物的总能量的相对大小、放热、吸热4、所需总能量与新键形成所需总能量。
B【合作探究】【问题探究1】为什么有的化学反应会放出热量,而有的化学反应却需要吸收热量呢?【教师点拨】一个化学反应有如下几个特点:1.有新物质生成,新物质和反应物总能量不同。
2.反应中要遵循能量守恒。
3.反应物与生成物的能量差若以热能形式表现即为放热和吸热。
如果二者能量比较接近,则放热和吸热不明显。
分析解答: 各种物质中都储存有化学能。
不同物质由于组成、结构不同,因而所包含的化学能也不同。
在化学反应中,随着物质的变化,化学能也随之改变。
一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
∑E(反应物)>∑E(生成物)——放出能量∑E(反应物)<∑E(生成物)——吸收能量【即学即练1】下列说法中正确的是()A. 物质发生化学反应都伴随着能量变化B. 伴有能量变化的物质变化都是化学变化C. 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同D. 一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量【问题探究2】氢气和氯气的混合气体遇到强光会发生什么现象?为什么?(已知断开1molH-H键要吸收436kJ的能量,断开1mol Cl-Cl键要吸收243 kJ的能量,而形成1molHCl 分子中的H-Cl键会放出431 kJ的能量)【教师点拨】化学反应的本质是反应物中化学键的断裂和生成物中化学键的形成。
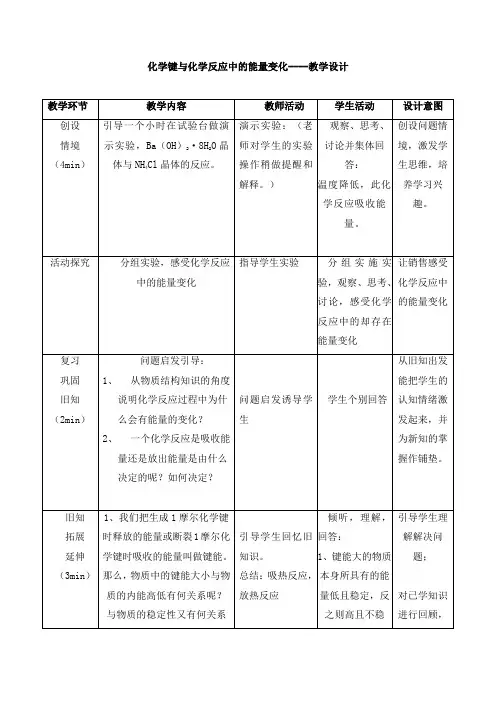
化学键与化学反应中的能量变化----教学设计耗436 KJ能量、拆开1moL0=O 键需消耗496 KJ能量、形成1moLH-O键需释放463 KJ能量。
试从化学键的角度分析反应:2H2+O2=2H2O的能量变化?引导学生思考相关问题流,有序的、主动的发言。
面检查阅读自学效果;提高学生合作意识和语言表达能力多媒体演示;归纳小结并板书(12min)1、化学反应的实质是什么?2、化学键的断开及形成与能量变化之间是什么关系?3、整个化学反应的能量变化取决于什么?多媒体演示,讲解,归纳小结并板书。
眼到:观看多媒体;耳到:认真听取老师的讲解口到:跟老师一起分析归纳手到:做笔记心到:理解关键知识点1、采用多媒体软件进行形象化教学;运用简明的图示说明抽象的内容,注重学生的学习过程和知识形成过程。
2、归纳小结,突出重点内容。
思考与交流(2min)思考:化学反应的能量变化全部为热量变化吗?其大小与哪些因素有关?让学生自主思考和相互交流讨论并分析:首先取决于化学键的强弱;对一个特定反应,也与反应物的质量和各物质的聚集状态等有关。
为下节课的内容做铺垫,激发学生继续探究的热情。
引申(1min)如何在化学方程式中正确反映热量变化引申课堂教学课后思考并预习。
提高课堂深度归纳小结归纳小结结论。
理解记忆认真听讲,做归纳、小结,化学键与化学反应中的能量变化----评测练习1、当堂练习⑴. 下列说法不正确的是( )A.任何化学反应都伴随能量变化.B.化学反应中的能量变化都表现为热量的变化C.反应物的总能量高于生成物的总能量时,发生放热反应.D.反应物的总能量低于生成物的总能量时,发生吸热反应.⑵.下列反应既属于氧化还原反应, 又是吸热反应的是( )A.铝片与稀盐酸的反应.B.Ba(OH)2·8H2O与NH4Cl的反应.C.灼热的碳与CO2的反应 D.甲烷在氧气中的燃烧反应⑶、H2在CI2中燃烧产生苍白色火焰。
在反应过程中,断裂1 mol H2中的化学键消耗能量Q1KJ,断裂1 mol CI2中的化学键消耗能量Q2KJ,形成1 molHCI 中的化学键释放能量Q3KJ。



化学反应中的能量变化与化学键在化学领域中,我们经常听到能量变化与化学反应的密切关系。
化学反应不仅仅是物质间原子的重新排列,同时也涉及能量的转化和变化。
这种能量变化与化学键的形成和断裂密切相关。
本文将就化学反应中的能量变化和化学键这两个关键概念进行探讨。
一、能量变化与化学反应化学反应过程中,物质间的化学键会发生断裂和形成,从而导致反应物转化为生成物。
而在这一过程中,能量也会发生变化。
根据能量的转移方向,化学反应可以分为吸热反应和放热反应两种类型。
1. 吸热反应在一些化学反应中,反应物吸收外界热量,从而使反应体系的温度升高。
这种反应称为吸热反应。
在吸热反应中,生成物的能量高于反应物的能量,化学键的形成需要外界能量的输入。
以燃烧反应为例,例如乙醇和氧气发生燃烧反应生成二氧化碳和水。
在这个过程中,乙醇和氧气的化学键断裂,同时新的化学键形成。
由于燃烧反应伴随着大量的热量释放,因此属于放热反应。
2. 放热反应在另一些化学反应中,反应物的分子能量高于生成物,因此在反应过程中会释放出能量。
这种反应称为放热反应。
在放热反应中,化学键的形成释放出的能量大于化学键断裂时吸收的能量。
例如合成反应中的酸与碱反应生成盐和水。
在这个反应中,盐的生成与酸和碱分子间的化学键形成相关,这种化学键的形成会伴随着能量的释放。
二、化学键的能量变化化学键是原子间通过共享电子而形成的连接。
在化学反应中,化学键的形成和断裂直接影响着整个反应的能量变化。
1. 化学键的形成化学键的形成是有吸热性质的,它需要消耗一定的能量。
在反应物中,原子之间的电子发生重新分配和再组合,形成较为稳定的结构。
这个过程是伴随着能量的吸收的。
2. 化学键的断裂化学键的断裂是有放热性质的,它会释放出能量。
当反应物中的原子重新排列时,原本连接的化学键会被断裂,这个过程中释放出的能量可以用于反应物向生成物的能量转化。
化学键的形成和断裂对整个反应过程的能量变化起着至关重要的作用。
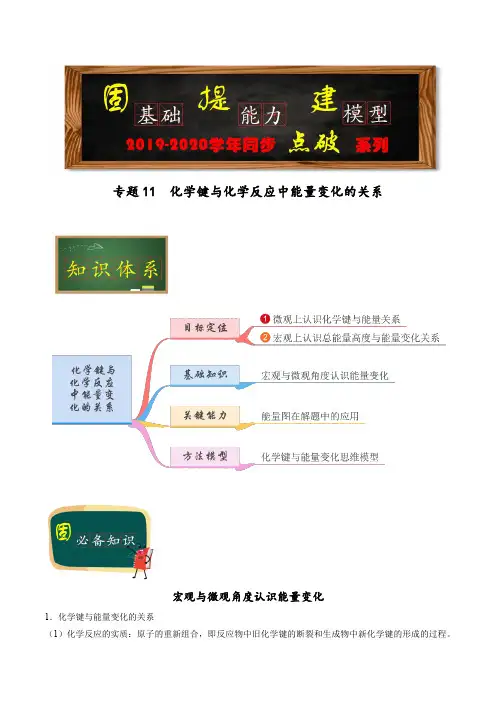
专题11 化学键与化学反应中能量变化的关系宏观与微观角度认识能量变化1.化学键与能量变化的关系(1)化学反应的实质:原子的重新组合,即反应物中旧化学键的断裂和生成物中新化学键的形成的过程。
(2)化学反应中能量变化的本质原因(微观角度)E 1>E 2,反应吸收能量;E 1<E 2,反应放出能量。
2.化学反应中能量变化的决定因素(宏观角度) (1)物质的稳定性与能量的关系(2)化学反应中能量变化的决定因素(用E 表示物质能量)⎩⎪⎨⎪⎧E (反应物)>E (生成物)⇒化学反应放出能量E (反应物)<E (生成物)⇒化学反应吸收能量 【典例1】已知断裂1 mol 共价键所需要吸收的能量分别为H—H :436 kJ ,I—I :151 kJ ,H—I :299 kJ ,下列对H 2(g)+I 2(g)2HI(g)的反应类型判断错误的是( )A .放出能量的反应B .吸收能量的反应C .氧化还原反应D .化合反应【答案】B【解析】依题意,断裂1 mol H—H键和1 mol I—I键吸收的能量为436 kJ+151 kJ=587 kJ,生成2 mol H—I 键放出的能量为299 kJ×2=598 kJ,因为598 kJ>587 kJ,所以,该反应的正反应是放出能量的反应;根据反应式可知该反应是化合反应,也是氧化还原反应。
能量图在解题中的应用1.如果反应物所具有的总能量大于生成物所具有的总能量,反应物转化为生成物时化学反应放出能量,反之,化学反应吸收能量。
如图所示:2.既可以利用所有化学键的键能计算具体反应中的能量变化,又可以根据化学反应中的能量变化计算某一个具体的化学键的键能。
计算公式:化学反应中的能量变化值=反应物的断键吸收的总能量(或总键能)-生成物的成键放出的总能量(或总键能)。
计算出的数值如果为正值,意味着该反应为吸热反应;计算出的数值如果是负值,意味着该反应为放热反应。
第一节化学能与热能第1课时化学键与化学反应中能量变化的关系[学习目标定位] 1.运用微观的思想,从反应物分子和生成物分子中化学键变化的角度,在本质上认识物质变化与能量变化的关系。
2.知道化学键的断裂和形成是化学反应中能量变化的主要原因,知道化学反应中的能量变化和物质具有的能量之间的关系。
一断开或形成1 mol某化学键的能量变化1.化学反应的本质是原子(或原子团)的重新组合,即反应物中旧化学键的断裂和生成物中新化学键的形成。
2.物质中的原子之间是通过化学键结合的。
断开反应物中的化学键要吸收能量,形成生成物中的化学键要放出能量。
3.断开或形成1 mol H2中化学键的能量变化(1)在1 mol氢分子中,含有2 mol氢原子,含有1 mol H—H键。
(2)已知在25 ℃和101 kPa条件下,由2 mol H原子形成1 mol H—H键时,放出436 kJ的能量。
若要使1 mol氢分子变为2 mol氢原子时,需要断开1 mol H—H键,其能量变化是吸收436_kJ的能量。
4.断开或形成1 mol CH4中化学键的能量变化(1)CH4的电子式是,结构式是,1 mol CH4分子中含有4 mol C—H键。
(2)在CH4中,断开1 mol C—H键要吸收415 kJ的能量。
若要形成1 mol CH4中的C—H键其能量变化是放出4_mol×415_kJ·mol-1=1_660_kJ的能量。
[归纳总结]在25 ℃和101 kPa的条件下,由原子形成1 mol化学键时所放出的能量,与断开1 mol相同化学键所吸收的能量是相等的。
[活学活用]1.已知1 g 氢气完全燃烧生成水蒸气时放出能量121 kJ ,且氧气中1 mol O===O 键完全断裂时需要吸收能量496 kJ ,水蒸气中1 mol H —O 键形成时放出能量463 kJ ,则氢气中1 mol H —H 键断裂时吸收能量为( )A.920 kJB.557 kJC.436 kJD.188 kJ答案 C解析 由1 g H 2完全燃烧生成水蒸气时放出能量121 kJ 可知:2 g H 2(即含1 mol H —H 键)完全燃烧生成水蒸气时放出的能量为121 kJ ×2=242 kJ 。
化学键的能量键能与化学反应的能量变化化学键是化学物质中原子之间的强有力连接。
化学键的能量决定了化学反应的进行和能量的变化。
在化学反应中,化学键能量的变化直接影响着反应的放热或吸热性质。
一、化学键能量的定义与测定化学键能量是指在形成化学键过程中,断开1摩尔一种化学键所需吸收的能量,单位通常用焦耳(J)或千焦耳(kJ)表示。
化学键能量的测定主要方法有谱学方法、能量守恒定律以及热效应法。
二、化学反应中的能量变化化学反应涉及反应物之间的化学键的破裂和新化学键的形成。
根据能量守恒定律,反应物中化学键的能量变化等于生成物中化学键的能量变化,同时还包括其他能量变化,如放热或吸热。
根据反应物与生成物的化学键能量差,化学反应可以分为放热反应和吸热反应。
1. 放热反应放热反应指在反应过程中,化学键能量的变化导致反应释放能量。
反应物中的化学键能量高于生成物中的化学键能量,因此在反应过程中,放热反应会释放出热量,使周围环境升温。
例如,燃烧反应是一种放热反应,燃烧过程中化学键能量的释放导致火焰和热量的产生。
2. 吸热反应吸热反应指在反应过程中,化学键能量的变化导致反应吸收能量。
反应物中的化学键能量低于生成物中的化学键能量,因此在反应过程中,吸热反应会吸收外界热量,导致周围环境降温。
例如,溶解反应是一种吸热反应,溶解过程中化学键能量的吸收导致溶液的温度下降。
三、化学键能量与反应的速率和平衡化学键能量的大小与反应速率和反应平衡关系密切。
1. 反应速率反应速率是指单位时间内反应物消耗或生成物的生成量。
化学键能量越高,反应物分子之间的吸引力越大,反应速率越慢。
相反,化学键能量越低,反应物分子活动性越高,反应速率越快。
2. 反应平衡化学键能量对反应平衡也有影响。
在反应初期,反应物浓度较高,反应速率较快。
但随着反应的进行,生成物浓度增加,化学键能量的变化导致反应速率逐渐降低。
当反应物和生成物之间的化学键能量相等时,反应达到平衡,反应速率不再改变。
诊断题
1.如下图所示是101 kPa时氢气在氯气中燃烧生成氯化氢气体的能量变化,则下列有关说法中不正确的是()
A.1 mol H2中的化学键断裂时需要吸收436 kJ能量
B.2 mol HCl分子中的化学键形成时要释放862 kJ能量
C.1molH2(g)和1molCl2(g)的能量之和大于2molHCl(g)的能量
D.该反应H2(g)+Cl2(g)=2HCl(g) △H>0
化学键H—H Cl—Cl H—Cl
生成1mol化学键时
436kJ 243 kJ 431 kJ 放出的能量
A.1/2H2(g)+1/2Cl2(g)=HCl(g) △H=—91.5 kJ/mol
B.H2(g)+ Cl2(g)=2HCl(g) △H=—183 kJ/mol
C.1/2H2(g)+1/2Cl2(g)=HCl(g) △H=+91.5 kJ/mol
D.2HCl(g) =H2(g)+ Cl2(g) △H=+183 kJ/mol
3.已知H—H键的键能为436 kJ·mol-1,N≡N键的键能为945 kJ·mol-1,N—H键的键能为391 kJ·mol-1。
则下列有关工业合成氨反应的热化学方程式正确的是()。
A.N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1
B.N2(g)+3H2(g)===2NH3(g) ΔH=+1 471 kJ·mol-1
C.N2(g)+3H2(g)===2NH3(g) ΔH=+93 kJ·mol-1
D.N2(g)+3H2(g)===2NH3(g) ΔH=-1 471 kJ·mol-1
4.SF6是一种优良的绝缘气体,分子结构中只存在S-F键。
已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ,则S(s)+3F2(g)===SF6(g)的反应热ΔH为()
A.-1 780 kJ/mol B.-1 220 kJ/mol
C.-450 kJ/mol D.+430 kJ/mol
5.已知1 g氢气完全燃烧生成水蒸气时放出的热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 molH-O键形成时放出热量463 kJ,则1 molH-H键断裂时吸收热量为() A.920 kJ B.557 kJ C.436 kJ D.188 kJ
反馈题
1.肼(H 2NNH 2)是一种高能燃料,有关化学反应的能量变化如下图所示,已知断裂1 mol 化学键所需的能量(kJ):N≡N 为942、O =O 为500、N —N 为154,则断裂1 mol N —H 键所需的能量(kJ)是 ( )
A .194
B .391
C .516
D .658
2.化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。
如图为N 2(g)和O 2(g)反应生成NO(g)过程中的能量变化: 下列说法中正确的是 ( )
A .1 mol N 2(g)和1 mol O 2(g)反应放出的能量为180 kJ
B .1 mol N 2(g)和1 mol O 2(g)具有的总能量小于2 mol NO(g)具有的总能量
C .通常情况下,N 2(g)和O 2(g)混合能直接生成NO
D .NO 是一种酸性氧化物,能与NaOH 溶液反应生成盐和水
3.化学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时化学键 P —P P —O O===O P===O
键能/(kJ·mol -1) 172 335 498 X
烧的产物结构如下图所示,则上表中X =____(470)。
4.用Cl 2生产某些含氯有机物时会产生副产物HCl 。
利用反应A ,可实现氯的循环利用。
反应A :4HCl +O 2CuO/CuCl 2400℃
2Cl 2+2H 2O (1)已知:反应A 中,4 mol HCl 被氧化,放出
115.6 kJ 的热量。
①反应A 的热化学方程式是__________________________________________________。
②断开1 mol H -O 键与断开1 mol H -Cl 键所需能量相差约为________ kJ , H 2O 中H -O 键比HCl 中H -Cl 键(填“强”或“弱”)________。
诊断题答案
1.D 2.B 3.A 4.B 5.C
反馈题答案
1.B 2.B
3.①4HCl(g)+O 2(g)
400℃CuO/CuCl 2 2Cl 2(g)+2H 2O(g)ΔH =-115.6 kJ/mol ②32 强。