Tris-甘氨酸电泳缓冲液(5×)
- 格式:pdf
- 大小:168.42 KB
- 文档页数:1

Western Blot 实验基本步骤一、原理Western blotting(免疫印迹)是在蛋白质电泳分离和抗原抗体检测的基础上发展起来一项检测蛋白质的技术。
它将SDS聚丙烯酰胺凝胶电泳的高分辨力与抗原抗体反应的特异性相结合。
经过PAGE分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键吸附蛋白质,且能保持电泳分离的多肽类型及生物学活性不变。
以固相载体上的蛋白质或多肽作为抗原,与对应飞抗体起免疫反应,再与酶或同位素标记的第二抗体其反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。
该技术广泛应用于检测蛋白水平的表达。
既可以定性,又可以半定量的Western是初步鉴定蛋白质最方便也是最通用的方法。
典型的印迹实验包括三个步骤:①蛋白质的电泳分离②将电泳后凝胶上的蛋白质转移至固体膜上,用非特异性,非反应活性分子封闭固体膜上未吸附蛋白质区域③免疫学检测。
免疫印迹克服了聚丙烯酰胺凝胶电泳后直接在凝胶上进行免疫学分析的弊端,极大地提高了其利用率、分辨率和灵敏度,使其成为使用最广泛的免疫化学方法之一。
第一阶段为SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)。
抗原等蛋白样品经SDS处理后带阴电荷,在聚丙烯酰酰凝胶中从阴极向阳极泳动,分子量越小,泳动速度就越快。
此阶段分离效果肉眼不可见(只有在染色后才显出电泳区带)。
第二阶段为电转移。
将在凝胶中已经分离的条带转移至硝酸纤维素膜上,选用低电压(100V)和大电流(1~2A),通电45min转移即可完成。
此阶段分离的蛋白质条带肉眼仍不可见。
第三阶段为酶免疫定位。
将印有蛋白质条带的硝酸纤维素膜(相当于包被了抗原的固相载体)依次与特异性抗体和酶标第二抗体作用后,加入能形成不溶性显色物的酶反应底物,使区带染色。
阳性反应的条带清晰可辨,并可根据SDS-PAGE时加入的分子量标准,确定各组分的分子量。
western显色的方法主要有以下几种:i. 放射自显影ii. 底物化学发光ECLiii. 底物荧光ECFiv. 底物DAB呈色现常用的有底物化学发光ECL和底物DAB呈色,体同水平和实验条件的是用第一种方法,目前发表文章通常是用底物化学发光ECL。
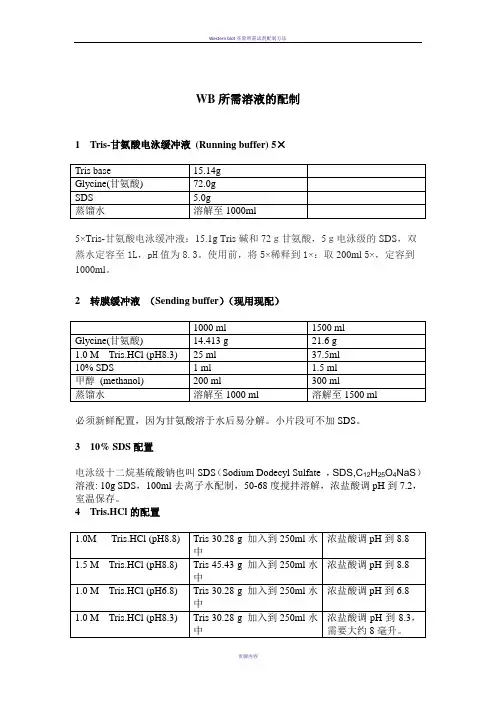
WB所需溶液的配制1Tris-甘氨酸电泳缓冲液(Running buffer) 5×Tris base 15.14gGlycine(甘氨酸) 72.0gSDS 5.0g蒸馏水溶解至1000ml5×Tris-甘氨酸电泳缓冲液:15.1g Tris碱和72g甘氨酸,5g电泳级的SDS,双蒸水定容至1L,pH值为8.3。
使用前,将5×稀释到1×:取200ml 5×,定容到1000ml。
2转膜缓冲液(Sending buffer)(现用现配)1000 ml 1500 mlGlycine(甘氨酸) 14.413 g 21.6 g1.0 M Tris.HCl (pH8.3) 25 ml 37.5ml10% SDS 1 ml 1.5 ml甲醇(methanol) 200 ml 300 ml蒸馏水溶解至1000 ml 溶解至1500 ml必须新鲜配置,因为甘氨酸溶于水后易分解。
小片段可不加SDS。
310% SDS配置电泳级十二烷基硫酸钠也叫SDS(Sodium Dodecyl Sulfate,SDS,C12H25O4NaS)溶液: 10g SDS,100ml去离子水配制,50-68度搅拌溶解,浓盐酸调pH到7.2,室温保存。
4Tris.HCl的配置1.0M Tris.HCl (pH8.8) Tris 30.28 g 加入到250ml水中浓盐酸调pH到8.81.5 M Tris.HCl (pH8.8) Tris 45.43 g 加入到250ml水中浓盐酸调pH到8.81.0 M Tris.HCl (pH6.8) Tris 30.28 g 加入到250ml水中浓盐酸调pH到6.81.0 M Tris.HCl (pH8.3) Tris 30.28 g 加入到250ml水中浓盐酸调pH到8.3,需要大约8毫升。
注:Tris的分子量是121.4. 4度储存。
5 10% APS (Ammonium persulfate ; 过硫酸铵)的配置称取1g过硫酸铵,加超纯水溶解并定容至10ml,分装到1.5ml微量离心管中,负30度冻存。

Western Blot 相关实验方法与试剂(湿转法)人工肝实验室学习姚瑶(一)目的蛋白提取:(1)单层贴壁细胞总蛋白的提取:1、倒掉细胞培养液,加入Hanks液洗涤一次后倒掉,根据所用细胞决定是否用胰酶消化,加入适量(约5ml)新鲜细胞培养液后,将贴壁细胞吹起,并转移至4支离心管内,配平后,1500转离心10min。
2、倒掉上清,用4度预冷PBS溶液洗涤沉淀,1500转离心10min。
共洗三次,每次十分钟。
3、倒掉上清,吸净,每管加入50ul 细胞裂解液RIPA,吹散,加入后由于DNA的释放可迅速变粘稠,故应尽快转移至1.5ml EP 管内,-20℃裂解30min。
4、超声波细胞裂解仪上将各管裂解15s。
(可不做)5、4℃,12000转离心10min。
6、将上清转移至0.5ml EP管中,每管100ul,冰浴待用。
(2)组织中总蛋白的提取:1、取约100mg肝组织于研磨器内,加入500ul 细胞裂解液RIPA,研磨后吸出于1.5ml EP管内,再加入500ul RIPA,研磨后吸出于上EP管内。
冰上裂解30min。
2、配平后,4℃,14000转离心10min。
3、将上清分装于0.5ml EP管内,每管100ul,冰浴待用(二)蛋白含量的测定:1、稀释标准品:10ul标准品C液+90ul PBS溶液,混匀。
2、按0、1、2、4、8、12、16、20ul将稀释后的标准品加入于96孔板内,并用PBS将各孔补足20ul。
3、将第2、3排96孔板分别加入样品1ul、0.5ul,(可采用倍比稀释法),并用PBS将各孔补足20ul。
4、配制工作液:按A液:B液=50:1配制适量工作液,每孔加入200ul。
5、37℃水浴30min。
6、酶标仪测定各孔OD值(A570,Mode1)。
7、绘制标准曲线,计算样品蛋白浓度。
(三)SDS-PAGE电泳:(1)清洗玻璃板(2)灌胶与上样:1、配胶:根据目的蛋白的大小,决定分离胶的浓度。

SDS是阴离子去污剂,能断裂分子内和分子间的氢键,破坏蛋白分子的二、三级结构。
作用有四:去蛋白质电荷、解离蛋白质之间的氢键、取消蛋白分子内的疏水作用、去多肽折叠。
而强还原剂如巯基乙醇,二硫苏糖醇能使绊胱氨酸残基间的二硫键断裂。
在样品和凝胶中加入还原剂和SDS后,分子被解聚成多肽链,解聚后的氨基酸侧链和SDS结合成蛋白- SDS 胶束,所带的负电荷大大超过了蛋白原有的电荷量,这样就消除了不同分子间的电荷差异和结构差异。
SDS-PAGE一般采用的是不连续缓冲系统,浓缩胶是由AP催化聚合而成的大孔胶,凝胶缓冲液为pH6.7的Tris-HC1。
分离胶是由AP催化聚合而成的小孔胶,凝胶缓冲液为pH8.9 Tris-HC1。
电极缓冲液是pH8.3 Tris-甘氨酸缓冲液。
2种孔径的凝胶、2种缓冲体系、3种pH值使不连续体系形成了凝胶孔径、pH值、缓冲液离子成分的不连续性,这是样品浓缩的主要因素。
当样品液和浓缩胶选TRIS/HCL缓冲液,电极液选TRIS/甘氨酸。
电泳开始后,HCL解离成氯离子,甘氨酸解离出少量的甘氨酸根离子。
蛋白质带负电荷,因此一起向正极移动,其中氯离子最快,甘氨酸根离子最慢,蛋白居中。
电泳开始时氯离子泳动率最大,超过蛋白,因此在后面形成低电导区,而电场强度与低电导区成反比,因而产生较高的电场强度,使蛋白和甘氨酸根离子迅速移动,形成以稳定的界面,使蛋白聚集在移动界面附近,浓缩成一中间层。
过硫酸铵(AP)为催化剂,四甲基乙二胺(TEMED)为加速剂。
在聚合过程中,TEMED 催化过硫酸铵产生自由基,后者引发丙烯酰胺单体聚合,同时甲叉双丙烯酰胺与丙烯酰胺链间产生甲叉键交联,从而形成三维网状结构。
当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k、b均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量。
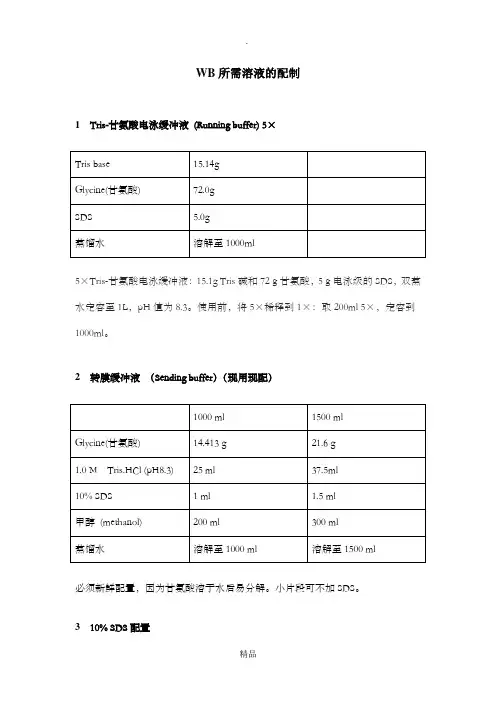
WB所需溶液的配制1Tris-甘氨酸电泳缓冲液(Running buffer) 5×5×Tris-甘氨酸电泳缓冲液:15.1g Tris碱和72g甘氨酸,5g电泳级的SDS,双蒸水定容至1L,pH值为8.3。
使用前,将5×稀释到1×:取200ml 5×,定容到1000ml。
2转膜缓冲液(Sending buffer)(现用现配)必须新鲜配置,因为甘氨酸溶于水后易分解。
小片段可不加SDS。
310% SDS配置电泳级十二烷基硫酸钠也叫SDS(Sodium Dodecyl Sulfate ,SDS,C12H25O4NaS)溶液: 10g SDS,100ml去离子水配制,50-68度搅拌溶解,浓盐酸调pH到7.2,室温保存。
4Tris.HCl的配置注:Tris的分子量是121.4. 4度储存。
5 10% APS (Ammonium persulfate ; 过硫酸铵)的配置称取1g过硫酸铵,加超纯水溶解并定容至10ml,分装到1.5ml微量离心管中,负30度冻存。
使用时尽量现配现用,短期内实验频繁可多配。
4度存则两周内用完,最多不能超过一个月。
负20度可存两个月,但一旦解冻后尽快用完。
6 10×TBS (Tris-buffered saline)的配置加HCl调pH到7.6,室温储存。
7TBST (Tris-buffered saline with Tween20) 的配置8 上样缓冲液(loading buffer)的配置SDS-PAGE加样缓冲液:pH6.8 0.5mol/L Tris缓冲液8ml,甘油6.4ml,10%SDS 12.8ml,巯基乙醇3.2ml,0.05%溴酚蓝1.6ml,H2O 32ml混匀备用。
按1:1或1:2比例与蛋白质样品混合,在沸水终煮3min混匀后再上样,一般为20-25ul,总蛋白量100μg。
9 stacking gel buffer (4×)调pH到6.8,加双蒸水到10毫升。


SDS-PAGE 操作标准一、电泳相关溶液的配制:1、30%丙稀酰胺混合溶液(100ml ):丙稀酰胺 29g (实际可以为29.2g ) 双丙稀酰胺 1g (实际可以为0.8g )用水溶解定容到100ml ,过滤,4摄氏度保存一个月。
2、5×Tris-甘氨酸电泳缓冲液:5× 1×Tris base 15.1g 25mmol/L 甘氨酸 94g 250mmol/L (pH8.3) 10%SDS (m/V ) 50mL 0.1%(m/V ) dH2O 定容至1000ml 。
3、2×SDS 凝胶加样缓冲液:1.0 mol/L pH6.8 Tris-Cl 10 mL 1.0 mol/L 二硫苏糖醇(DTT ) 20 mLSDS 4g 溴酚蓝 0.2g 甘油 20mL加水定容至100mL ,于4℃保存。
注:1.0 mol/L DTT 可替换为10% β-巯基乙醇 4、染色液的配制(1000ml ): 甲醇或者乙醇 500ml2010.06.28药物部王红勋乙酸 100ml考马斯亮蓝R250 2.5g,去离子水补至1000ml。
充分混匀后进行过滤,收集滤液备用。
当过滤速度变慢时要更换滤纸,快速过滤完,不可隔夜以免影响染色效果。
5、脱色液(1000ml):甲醇或者乙醇 250ml乙酸 80ml去离子水补至1000ml,混匀,备用。
二、SDS-PAGE分析:1、20uL收集液,加入5×样品缓冲液5ul,在80℃水浴锅中煮5min。
表一:SDS聚丙烯酰胺凝胶的有效分离范围:丙烯酰胺浓度/% 线性分离范围/kDa15 10-4312 12-6010 20-807.5 36-945.0 57-212注:丙烯酰胺:双丙烯酰胺的分子比=1:29表二、5%浓缩胶配方(积层胶、压缩胶)配制不同体积凝胶所需要各成份的体积/mL成份1 2 3 4 5 6 8 10 5%浓缩胶水 0.68 1.4 2.1 2.7 3.4 4.1 5.5 6.8 30%丙烯酰胺混合溶液 0.17 0.33 0.5 0.67 0.83 1.0 1.3 1.71.0mol/Tris(pH6.8) 0.13 0.25 0.38 0.5 0.63 0.75 1.0 1.2510%SDS 0.01 0.02 0.03 0.04 0.05 0.06 0.08 0.1 10%过硫酸铵 0.01 0.02 0.03 0.04 0.05 0.06 0.08 0.1TEMED 0.0010.0020.0030.0040.0050.006 0.008 0.01表三:分离胶配方配制不同体积和浓度凝胶所需要各成份的体积/mL 成份5 10 15 20 25 30 40 50 6%胶水 2.6 5.3 7.9 10.6 13.2 15.9 21.2 26.5 30%丙烯酰胺混合溶液 1.0 2.0 3.0 4.0 5.0 6.0 8.0 10.01.5mol/Tris(pH8.8) 1.32.53.8 5.0 6.3 7.5 10.0 12.510%SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸铵 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5TEMED 0.0040.0080.0120.0160.02 0.024 0.032 0.04 8%胶水 2.3 4.6 6.9 9.3 11.5 13.9 16.5 23.2 30%丙烯酰胺混合溶液 1.3 2.7 4.0 5.3 6.7 8.0 10.7 13.31.5mol/Tris(pH8.8) 1.32.53.8 5.0 6.3 7.5 10.0 12.510%SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸铵 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5TEMED 0.0030.0060.0090.0120.0150.018 0.024 0.03 10%胶水 1.9 4.0 5.9 7.9 9.9 11.9 15.9 19.8 30%丙烯酰胺混合溶液 1.7 3.3 5.0 6.7 8.3 10.0 13.3 16.71.5mol/Tris(pH8.8) 1.32.53.8 5.0 6.3 7.5 10.0 12.510%SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸铵 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5TEMED 0.0020.0040.0060.0080.01 0.012 0.016 0.02 12%胶水 1.6 3.3 4.9 6.6 8.2 9.9 13.2 16.5 30%丙烯酰胺混合溶液 2.0 4.0 6.0 8.0 10.0 12.0 16.0 20.01.5mol/Tris(pH8.8) 1.32.53.8 5.0 6.3 7.5 10.0 12.510%SDS 0.05 0.01 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸铵 0.05 0.01 0.15 0.2 0.25 0.3 0.4 0.5TEMED 0.0020.0040.0060.0080.01 0.012 0.016 0.02 15%胶水 1.1 2.3 3.4 4.6 5.7 6.9 9.2 11.5 30%丙烯酰胺混合溶液 2.5 5.0 7.5 10.0 12.5 15.0 20.0 25.01.5mol/Tris(pH8.8) 1.32.53.8 5.0 6.3 7.5 10.0 12.510%SDS 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5 10%过硫酸铵 0.05 0.1 0.15 0.2 0.25 0.3 0.4 0.5TEMED 0.0020.0040.0060.0080.01 0.012 0.016 0.022、按照上面配方制SDS-PAGE凝胶,安装好电泳仪,在槽中加入电极缓冲液。

SDS-PAGE电泳原理:聚丙烯酰胺凝胶是由丙烯酰胺(简称Acr) 和交联剂N,N’—亚甲基双丙烯酰胺(简称Bis)在催化剂作用下,聚合交联而成的具有网状立体结构的凝胶,并以此为支持物进行电泳。
聚丙烯酰胺凝胶电泳可根据不同蛋白质分子所带电荷的差异及分子大小的不同所产生的不同迁移率将蛋白质分离成若干条区带,如果分离纯化的样品中只含有同一种蛋白质,蛋白质样品电泳后,就应只分离出一条区带。
SDS是一种阴离子表面活性剂能打断蛋白质的氢键和疏水键,并按一定的比例和蛋白质分子结合成复合物,使蛋白质带负电荷的量远远超过其本身原有的电荷,掩盖了各种蛋白分子间天然的电荷差异。
因此,各种蛋白质-SDS 复合物在电泳时的迁移率,不再受原有电荷和分子形状的影响,而只是棒长的函数。
这种电泳方法称为SDS-聚丙烯酰胺凝胶电泳(简称SDS—PAGE)。
由于SDS-PAGE 可设法将电泳时蛋白质电荷差异这一因素除去或减小到可以略而不计的程度,因此常用来鉴定蛋白质分离样品的纯化程度,如果被鉴定的蛋白质样品很纯,只含有一种具三级结构的蛋白质或含有相同分子量亚基的具四级结构的蛋白质,那么SDS—PAGE 后,就只出现一条蛋白质区带。
TEMED:通过催化过硫酸铵形成自由基而加速丙烯酰胺与双丙烯酰胺的聚合。
过硫酸铵(AP):提供驱动丙烯酰胺与双丙烯酰胺所必须的自由基。
SDS—PAGE 可分为圆盘状和垂直板状、连续系统和不连续系统。
本实验采用垂直板状不连续系统。
所谓“不连续”是指电泳体系由两种或两种以上的缓冲液、pH 和凝胶孔径等所组成。
1.蛋白样品浓缩效应在不连续电泳系统中,含有上、下槽缓冲液(Tris—Gly,、浓缩胶缓冲液(Tris—HCl,、分离胶缓冲液(Tris—HCl,,两种凝胶的浓度(即孔径)也不相同。
在这种条件下,缓冲系统中的HCl 几乎全部解离成Cl-,两槽中的Gly (pI=,pK a=只有很少部分解离成Gly 的负离子,而酸性蛋白质也可解离出负离子。


聚丙烯酰胺凝胶电泳实验分析在很多地方看到大家都在讨论关于聚丙烯酰胺凝胶电泳的知识。
看了好多观点以后,不如自己做一个实验来分析。
更何况对于聚丙烯酰胺凝胶电泳分析必须要通过实验来验证观点。
下面就是关于聚丙烯酰胺凝胶电泳实验分析:明确实验目的:1.掌握聚丙烯酰胺凝胶电泳的原理。
2.熟悉聚丙烯酰胺凝胶电泳的操作过程。
3.了解聚丙烯酰胺凝胶电泳的特点和应用范围。
了解实验原理:聚丙烯酰胺凝胶是由丙烯酰胺(简称Acr)和交联剂甲叉双丙烯酰胺(简称Bis)在催化剂的作用下,聚合交联而成的含有酰胺基侧链的脂肪族大分子化合物。
聚丙烯酰胺凝胶具有三维网状结构,能起分子筛作用。
用它作电泳支持物,对样品的分离取决于各组分所带电荷的多少及分子大小。
此外,聚丙烯酰胺凝胶电泳还具有浓缩效应,即在电泳开始阶段,由于不连续pH梯度作用,将样品压缩成一条狭窄区带,从而提高了分离效果。
聚丙烯酰胺凝胶电泳分为垂直平板电泳和圆盘电泳,两者的原理完全相同。
由于垂直板形凝胶具有板薄、易冷却,分辨率高、操作简单、便于比较与扫描等优点,因而为大多数实验室采用。
聚丙烯酰胺凝胶电泳的分辨率比纸电泳高得多,能检出10-9~10-12g样品,特别适合于分离和测定蛋白质、核酸等生物大分子化合物。
它除了能对生物大分子物质进行定性、定量分析外,还可用以测定分子量,且是一种较先进的测定分子量的方法。
不连续变性聚丙烯酰胺凝胶电泳是使用最广泛的凝胶电泳。
不连续是指电泳的pH值不连续(样品浓缩胶缓冲液pH 6.8, 电极缓冲液pH 8.3, 分离胶pH 8.8)、凝胶不连续(一般分成样品浓缩胶和样品分离胶两层)。
变性是指样品蛋白经SDS和巯基乙醇作用后,所有蛋白质都解聚成为其构成亚基,并且都带上负电荷,形状都近似于长椭园棒状。
这种SDS-蛋白质复合物,在凝胶电泳中的迁移率,不再受蛋白质原有电荷和形状的影响,而只与园棒的长度也就是蛋白质的分子量有关。
SDS聚丙烯酰胺凝胶的有效分离笵围取决于灌制凝胶时聚丙烯酰胺的浓度和交联度,二者决定凝胶分子筛的孔径大小,而孔径又是灌胶时所用丙烯酰胺和甲叉双丙烯酰胺绝对浓度的函数。
.WB所需溶液的配制5×Tris-甘氨酸电泳缓冲液:15.1g Tris碱和72g甘氨酸,5g电泳级的SDS,双蒸水定容至1L,pH值为8.3。
使用前,将5×稀释到1×:取200ml 5×,定容到1000ml。
必须新鲜配置,因为甘氨酸溶于水后易分解。
小片段可不加SDS。
310% SDS配置电泳级十二烷基硫酸钠也叫SDS(Sodium Dodecyl Sulfate,SDS,CHONaS)41225溶液: 10g SDS,100ml去离子水配制,50-68度搅拌溶解,浓盐酸调pH到7.2,室温保存。
注:Tris的分子量是121.4. 4度储存。
5 10% APS (Ammonium persulfate ; )的配置过硫酸铵称取1g过硫酸铵,加超纯水溶解并定容至10ml,分装到1.5ml微量离心管中,负30度冻存。
使用时尽量现配现用,短期内实验频繁可多配。
4度存则两周内用完,最多不能超过一个月。
负20度可存两个月,但一旦解冻后尽快用完。
加HCl调pH到7.6,室温储存。
1 / 3.SDS-PAGE加样缓冲液:pH6.8 0.5mol/L Tris1:21:1或H2O 32ml混匀备用。
按3.2ml,0.05%溴酚蓝1.6ml,12.8ml,巯基乙醇,总蛋20-25ul3min比例与蛋白质样品混nonfat dried milk 或者0.01% antifoam A (Sigma)0.01%(v/v) sodium azide丽春红溶液:12 10毫升。
微升冰醋酸,加入0.05克丽春红,用水稀释至100 毫升)(10004%1)多聚甲醛(PFA)的配制微升氢氧化钠,全300毫升水,60度搅拌溶解,加入40克多聚甲醛,加入800毫升。
调1000PBS,加水定容到度,再加入100毫升的10×部溶解后冷却到4 4。
通风橱过滤,度保存。
pH到7.2-7.4步骤:;至7.4pH0.2%NaOHEDTA,10-20首先加毫升的水溶解再加入使溶解,再调应溶解一个再加另外一个;然后分别加入其他成分,去氧胆酸钠开盖后会飞出,2 / 3.戴口罩。
北京雷根生物技术有限公司
Tris-甘氨酸电泳缓冲液(5×)
简介:
Tris-甘氨酸电泳缓冲液又称SDS-PAGE 电泳缓冲液。
1×工作液中含有Tris 、250mM 甘氨酸、SDS 。
Tris-甘氨酸电泳缓冲液是常用的蛋白质电泳缓冲液, 本试剂是浓缩的溶液,主要由Tris 、甘氨酸、SDS 组成。
使用时需用蒸馏水或去离子水稀释后使用。
组成:
操作步骤(仅供参考):
1、用蒸馏水或去离子水稀释后使用。
注意事项:
1、 如果每次的使用量很小,可以适当分装后再使用。
2、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
有效期: 12个月有效。
相关:
编号 名称 PE0092 PE0092 Storage Tris-甘氨酸电泳缓冲液(5×) 500ml 2L RT 使用说明书 1份 编号 名称 DC0032 Masson 三色染色液 NA0016 MOPS 电泳缓冲液(10×,RNase free) NA0034
Tris-硼酸电泳缓冲液(5×TBE) PT0001
BCA 蛋白定量试剂盒 PT0013
考马斯亮蓝快速染色液 PW0053
Western 抗体洗脱液(碱性) TC1213 总胆固醇(TC)检测试剂盒(COD-PAP 单试剂比色法)。
WB所需溶液的配制1Tris-甘氨酸电泳缓冲液(Running buffer) 5×5×Tris-甘氨酸电泳缓冲液:15.1g Tris碱和72g甘氨酸,5g电泳级的SDS,双蒸水定容至1L,pH值为8.3。
使用前,将5×稀释到1×:取200ml 5×,定容到1000ml。
2转膜缓冲液(Sending buffer)(现用现配)必须新鲜配置,因为甘氨酸溶于水后易分解。
小片段可不加SDS。
310% SDS配置电泳级十二烷基硫酸钠也叫SDS(Sodium Dodecyl Sulfate,SDS,C12H25O4NaS)溶液: 10g SDS,100ml去离子水配制,50-68度搅拌溶解,浓盐酸调pH到7.2,室温保存。
4Tris.HCl的配置注:Tris的分子量是121.4. 4度储存。
5 10% APS (Ammonium persulfate ; 过硫酸铵)的配置称取1g过硫酸铵,加超纯水溶解并定容至10ml,分装到1.5ml微量离心管中,负30度冻存。
使用时尽量现配现用,短期内实验频繁可多配。
4度存则两周内用完,最多不能超过一个月。
负20度可存两个月,但一旦解冻后尽快用完。
6 10×TBS (Tris-buffered saline)的配置加HCl调pH到7.6,室温储存。
7TBST (Tris-buffered saline with Tween20) 的配置8 上样缓冲液(loading buffer)的配置SDS-PAGE加样缓冲液:pH6.8 0.5mol/L Tris缓冲液8ml,甘油6.4ml,10%SDS 12.8ml,巯基乙醇3.2ml,0.05%溴酚蓝1.6ml,H2O 32ml混匀备用。
按1:1或1:2比例与蛋白质样品混合,在沸水终煮3min混匀后再上样,一般为20-25ul,总蛋白量100μg。
9 stacking gel buffer (4×)10 5×Sample buffer (10ml)11封闭液的配置Blocking solution 要用TBST配制牛奶5% (w/v) nonfat dried milk 或者1%BSA0.01% antifoam A (Sigma)0.01%(v/v) sodium azide12丽春红溶液:100微升冰醋酸,加入0.05克丽春红,用水稀释至10毫升。
5×Tris-甘氨酸电泳缓冲液使用说明
货号:T1070
规格:500ml
保存:室温保存,有效期1年。
产品说明:
5×Tris-甘氨酸电泳缓冲液是用于蛋白变性聚丙烯酰胺凝胶电泳实验(SDS-PAGE)中的缓冲试剂。
本产品按常规方法配制而成,为5×浓缩液,便于储存、操作简便。
组份浓度:125mM Tris,1.25M Glycine,0.5%(W/V)SDS
使用说明:
本产品为5×浓缩液,临用前稀释成1×工作浓度:取100ml的5×Tris-甘氨酸电泳缓冲液,加入蒸馏水或去离子水定容至500ml混匀。
注意事项:
1.本产品为高倍浓缩液,环境温度较低时可能会有结晶析出,可加热助溶,待溶解完全后再行稀释使用;密封保存,防止污染。
2.为了您的安全和健康,请穿实验服并戴手套操作。
WB步骤Western blot 的详细操作步骤⼀.蛋⽩样品的提取1.先从-80°冰箱内取出sham 1d/3d组,SAH+PBS 1d/3d组,SAH+SP 1d/3d组,SAH+Tregs 1d/3d组脑组织样品(区分脑⽪层,海马区),并对这四种样品进⾏编号样品1,2,3,4,等脑组织在室温下复温后,⽤预冷的PBS将脑组织表⾯的⾎性物质冲洗掉,并⽤吸⽔纸吸掉组织表⾯多余的⽔分,然后分别把样品1,2,3,4放到预冷的培养⽫1,2,3,4中,分别⽤眼科剪⼑1,2,3,4将脑组织分别剪成⼀个⼤块以及⼏个⼩块。
然后分别将样品1,2,3,4称重,每个脑组织样品秤取500mg(可变化)并分别装⼊2ml的预冷的EP管中,同时把匀浆器(编上编号)置于冰盒内预冷。
2.按照每250mg脑组织加⼊1ml的RIPA的⽐例加⼊对应量的RIPA于盛有脑组织的EP管1,2,3,4中,同时按照裂解液:cocktail=1:500的体积⽐加⼊cocktail(我们有现成的试剂)(⼀种蛋⽩酶抑制剂,抑制蛋⽩酶降解蛋⽩),然后⽤眼科剪⼑(注意:不同的样品⽤不同的剪⼑,提前把剪⼑编上号1,2,3,4)将脑组织剪碎,尽量剪的碎⼀点以利于下⼀步的匀浆。
注意:这⼀步的处理过程要在冰盒中进⾏以抑制蛋⽩质的降解。
3将已经剪碎的EP管1,2,3,4中的脑组织倒⼊对应序号的匀浆器1,2,3,4中,在冰上匀浆脑组织,直⾄匀浆液变得⽆颗粒(⼤致⽤30min,最少是1次/分钟,尽量多匀浆⼏次)。
4.匀浆结束后,⽤1ml的移液枪将匀浆好的脑组织匀浆液从匀浆器中转移到对应序号的预冷的EP管1,2,3,4(提前将要⽤的EP管编上号1,2,3,4并置于冰上预冷)中.每个样品转移2ml样品匀浆液。
5. 先将盛有脑组织匀浆液的EP管配平(移液枪吸取等量)后,将其放⼊离⼼机内,4℃离⼼,18000 rpm 20min。
6. ⽤移液枪从分层后的液体中抽取上清液(⼤约吸取0.5-1ml),并转移到在冰盒中预冷的另外4个EP管1,2,3,4中,保存上清于-80度冰箱内直⾄使⽤。
北京雷根生物技术有限公司
Tris-甘氨酸电泳缓冲液(5×)
简介:
Tris-甘氨酸电泳缓冲液又称SDS-PAGE 电泳缓冲液。
1×工作液中含有25mM Tris 、250mM 甘氨酸、1%SDS 。
Tris-甘氨酸电泳缓冲液是常用的蛋白质电泳缓冲液, 本试剂是5倍浓缩的溶液,主要由125mM Tris 、1.25M 甘氨酸、5%SDS 组成。
使用时需用蒸馏水或去离子水稀释5倍后使用。
组成:
操作步骤(仅供参考):
1、用蒸馏水或去离子水稀释到1×后使用。
1、 如果每次的使用量很小,可以适当分装后再使用。
2、 为了您的安全和健康,请穿实验服并戴一次性手套操作。
编号 名称 PE0092 PE0092 Storage Tris-甘氨酸电泳缓冲液(5×) 500ml 5L RT 使用说明书 1份。