实验五染色体Ag-染色法
- 格式:ppt
- 大小:983.00 KB
- 文档页数:40


【精品】实验五植物细胞染色体组型分析一、实验目的1.了解植物细胞的染色体结构与组型。
2.掌握显微镜下植物细胞染色体组型的观察与分析方法。
3.了解植物中一些重要的基因的遗传规律。
二、实验原理染色体组型是指染色体在减数分裂过程中的排布方式。
植物细胞有异型体和同型体两种染色体组型。
异型体为一对完全同源染色体,又称同源染色体,一般为一条父源染色体和一条母源染色体。
同型体为有两个或多个富有染色质的染色体,其形状、大小和基因数目都不相同。
所有染色体的组型称为染色体组。
1.显性基因(Dominant Gene):对表现型起主导作用的基因称为显性基因,表现为显性表型。
3.等位基因(Allele):处于同一位点上的两个或几个相同或不同的基因,互称等位基因。
4.杂合子(Heterozygote):由不同的二个等位基因组成的个体,称为杂合子。
三、实验材料与设备材料:豌豆播种板、绿豆胚芽、韭菜根尖、镜片、盐酸凝胶、盐酸、无菌棉签。
设备:光学显微镜、活组织切片技术装置。
四、实验步骤1.绿豆胚芽根尖染色体制片法(1)提前准备好盐酸和盐酸凝胶。
(2)取绿豆胚芽,将其根尖植片加入好的盐酸溶液中,使其在40℃恒温水浴中加热5分钟以上。
(注意观察植片是否干燥)(3)将加热过的绿豆胚芽根尖植片用盐酸凝胶润湿,放到盐酸凝胶中的一个角落,加上盖片,用无菌棉棒挤压均匀。
(4)在其他角落加上无水乙醇75℃圆形滴底片,使其自然流至植片上,并迅速用滤纸吸掉超出的溶液。
(5)将制片好的绿豆胚芽根尖植片放在显微镜下进行观察和染色体组型的分析。
(1)提前取好豌豆播种板,选择两个完全不同的豌豆品种研究。
豌豆花朵打开后,取开放的花萼、两个雄蕊,并把大多数花粉用无菌棉棒擦去,保留少量未受损的花粉。
(2)将花药破开,取出雄蕊,并用剪刀将半个雄蕊放在一张透明胶带上。
(3)将豆荚壳破裂后,能看到裂口处有许多半透明的粘状液体,用透明胶带轻轻地沾取三次,每次用新的胶带。

实验五骨髓细胞染色体的制备及组型分析一、实验目的初步掌握骨髓细胞染色体的制片及染色技术,学习染色体组型分析方法,观察动物细胞染色体的数目和形态。
二、实验原理真核细胞染色体的数目和结构是重要的遗传指标之一。
制备染色体标本是细胞遗传学最基本的技术,优良的染色体制片是进行染色体显带、组型分析、原位杂交的先决条件。
染色体的制备在原则上可以从所有发生有丝分裂的组织和细胞悬浮液中得到。
最常用的途径是从骨髓细胞、血淋巴细胞和组织培养的细胞中制备染色体。
小型动物的染色体制片最好最有效的材料就是骨髓组织。
利用骨髓的制片技术虽然需要离心以及细致的操作,但其基本程序是简便的。
另外,在骨髓细胞中,有丝分裂指数相当高,因此可以直接得到中期细胞而不必象淋巴细胞或其它组织那样要经过体外培养。
主要的中期相来自成红细胞系统,也来自各种骨髓母细胞。
单核细胞和淋巴细胞的分裂相是较少的。
不过,在染色体制片上已无法区别上述来源。
多倍体的中期相(4n、8n和16n)往往来自于巨核细胞。
对大型动物通常采用对骨骼、脊柱或胸骨穿刺术吸取红骨髓,小型动物多采用剥离术取股骨以获得骨髓细胞。
通过骨髓得到的染色体是比较简便的,一般也无需无菌操作。
在临床上多用于白血病的研究。
在实验条件下,这种染色体是机体内真实情况的反映,因此在药品检验、环境监测、食品检验等工作以及致畸、致癌、致突变等研究中,利用骨髓制片的方法易于观察毒性物质在体内对细胞和染色体的影响。
不过,在有些情况下,穿刺取骨髓较困难,或者希望对同一个体材料进行连续的对比取材,以观察药物或环境因素对人类或动物的影响及染色体的动态变化。
这时,采用外周血细胞而不伤害供血者直接制备染色体的技术就十分有利了。
在动物实验时,可在取材前经腹腔注射有丝分裂抑制剂,一般常用秋水仙素。
秋水仙素是从百合科秋水仙属的一个种——秋水仙的器官和种子内提炼出来的一种植物碱。
因有剧毒,故使用时要特别注意,切勿使药液进入眼内或口中。



实验五-人类染色体标本制备实验目的了解人类染色体的结构和形态,学习制备人类染色体标本的方法。
实验原理人类染色体是由DNA和蛋白质组成的细胞核内生物大分子。
它们是非常细小的、线性的、染色体形态因不同的染色体而异。
人的细胞内共有46条染色体,其中,44条是自动对应的配对染色体,男性有一对性染色体(XY),女性有两条同源性的性染色体(XX)。
制备人类染色体标本需要对细胞进行处理,使其在显微镜下展示出明显的染色体结构。
常用的制备方法是细胞悬液滴落法,即将细胞悬液滴于载片上,在经过一系列的处理后,使其形成明显的染色体结构。
实验步骤1.取合适数量的细胞悬液,滴在已经清洗干净的载片上;2.将载片在干燥器中干燥1小时左右;3.取三瓶试剂,分别为80%乙醇、95%乙醇、细胞色素,放置在洁净的台面上备用;4.将载片沉于80%乙醇中,浸泡5分钟;5.将载片取出,去除乙醇,挥干后,再将载片沉于95%乙醇中,浸泡5分钟;6.将载片取出,去除乙醇,挥干后,将其浸泡在细胞色素溶液中15-30秒;7.将载片在流动自来水下快速漂洗干净,挥干,然后在100%乙醇中固定3-5分钟;8.将载片气干(可用酒精灯),涂两三滴甘油,再覆盖薄玻璃片即可。
实验结果制备好的人类染色体标本可以用显微镜观察到细胞核内的染色体。
成品的标本应该能够清晰地显示出染色体的结构和形态,如下图所示:chromosome1.jpg实验注意事项1.操作时要注意卫生和安全;2.选择细胞悬液的质量对制备染色体标本的质量会有影响;3.操作中需要用到一次性手套;4.操作时尽可能避免离心过度,避免对细胞造成破坏。
实验通过本次实验,我们学习了制备人类染色体标本的方法,掌握相关的操作技巧,对人类染色体的结构和形态有了更深入的了解。
在实验过程中,需要注意卫生和安全,避免对实验者本身和实验环境造成不必要的伤害。



报告成绩实时记录成绩实验五牛蛙骨髓染色体标本的制备与观察学生姓名学号班级座位号:同组同学日期:年月日备注:【Introduction】(1)简述染色体显色技术:将没有染色的中期染色体经过预处理后,再用不同的方法和染料处理,使染色体上出现明暗相间或深浅不同的明显而稳定的斑带。
每条染色体都可被准确识别和鉴定,甚至染色体结构异常也可被检出。
染色体显色技术分为两大类,一类是产生的染色带分布在整个染色体上,如G、Q和R带;另一类是只能使少数特定的区域显带,如C、T和N带。
染色体显色技术极大地促进了细胞遗传学的发展,使每条染色体都可被准确识别和鉴定,甚至出现小的染色体结构异常也可被检出。
(2)制备中期染色体标本的原理和应用:识别染色体的形态特征的最佳时期是细胞有丝分裂中期和早后期。
这时染色体收缩程度最大,形态最稳定,并且分散排列、易于计数。
如果在同一时间内获得不同物种的染色体标本,就可以了解不同物种之间的染色体水平的异同;或者在同一时间内获得同一物种不同技术处理条件下的染色体标本,还可以了解不同技术处理对染色体的影响。
【Materials & methods】实验仪器:复式双筒显微镜(带油镜);Motic数码互动系统;擦镜纸/盖玻片;载玻片/镊子;记号笔;小片滤纸;移液器/吸头;香柏油/二甲苯;搪瓷盘,剪刀,烧杯,小离心管,玻璃注射器;离心机,一次性手套,骨剪(实验班公用),冰箱(0℃)。
实验材料:肉用成体牛蛙(两组1只)。
实验试剂:0.65%生理盐水;甲醇—冰醋酸(3:1)固定液;蒸馏水;自来水;Giemsa染液。
实验操作:1.动物前期处理:牛蛙称重→注射秋水仙素→3.5~4小时后麻醉→取牛蛙→肢解。
2.取骨髓:剪下四肢→剔骨→剪开骨髓腔→生理盐水冲洗→分四个离心管离心→弃去上清液→生理盐水吹打沉淀物→合并于一管。
3.低渗:每管加蒸馏水1 ml→吹打混匀→30度下静置20 min。
4.固定:离心→弃去上清液→加甲醇-冰醋酸固定液l ml→固定15分钟→吹打悬浮→重复上面步骤一次→离心→弃去上清液→吹打悬浮。

实验五人类染色体标本制备【目的要求】1 •熟悉人外周血淋巴细胞培养的原理。
2.初步掌握人类外周血淋巴细胞染色体标本的制备方法。
3•了解正常人非显带染色体核型特征及核型分析方法。
【实验原理】人类间期细胞核中的遗传物质染色质,在细胞进入分裂期时,经逐级螺旋形成染色体。
在分裂期的中期,染色体达到最大程度的凝集,表现为短而粗的典型结构。
人外周血的有形成分中,只有白细胞有核,而白细胞中只有淋巴细胞(主要是小淋巴细胞)具有潜在的细胞分裂能力。
培养液中加入有丝分裂刺激剂植物血凝素(PHA)可使处于G期、具有潜在分裂能力的淋巴细胞转化为具有分裂能力的淋巴母细胞,并进入旺盛的有丝分裂周期;加入纺锤体抑制剂秋水仙素可使处于分裂过程的淋巴细胞停滞在分裂中期,在收获细胞时,用低渗剂0.075mol/L KCI对细胞进行低渗处理,可使胞膜胀破,染色体均匀分散;经离心、固定、制片等过程,最终可获得便于观察分析的染色体标本。
制备的染色体标本片,不经特殊处理,直接染色,在显微镜下观察识别,并进行核型分析的过程称为染色体非显带核型分析。
【实验用品】(一)材料:人外周静脉血。
(二)器材:吸管、刻度离心管、量筒、5ml注射器、6号针头、台式离心机、试管架、冷藏载玻片(一端磨砂)、铅笔、酒精灯、超净工作台、恒温水浴箱、载玻片、止血带、酒精棉球、显微镜、废液缸。
(三)试剂1. RPMI1640 培养液(1) RPMI1640 : RPMI1640固体培养基10.4 g,溶于1000 ml双蒸水中,抽滤除菌。
(2) RPMI1640培养液:每100 ml RPMI1640培养液中含RPMI 1640 80 ml、灭活的小牛血清20 ml、PHA 50 mg 青霉素(终浓度100 U/ml)、链霉素10000卩g (终浓度100卩g /ml), 15磅、20min高压灭菌的NaHCO调pH至7.2〜7.4,分装20小瓶,每瓶5 ml。
(3)配制方法配制过程所需的玻璃器具先用浅水洗刷干净,烘干,放入清洁液中浸泡2d,取出后用自来水冲洗15次,蒸馏水冲洗3次,双蒸水冲洗1次,烤干后包装,15磅20 min高压灭菌。
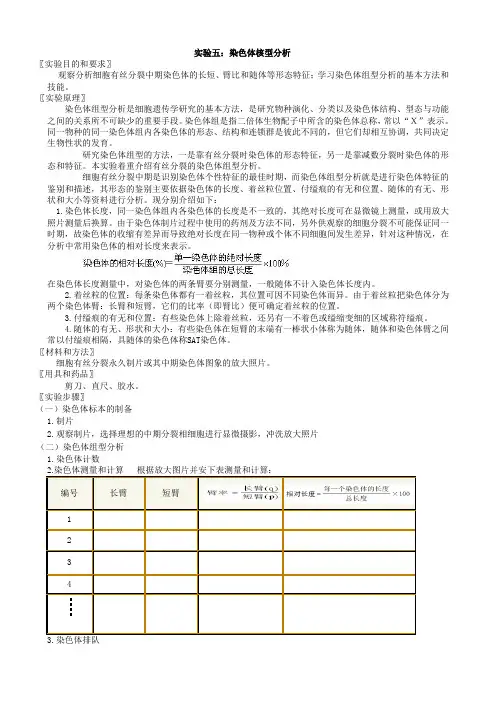
实验五:染色体核型分析〖实验目的和要求〗观察分析细胞有丝分裂中期染色体的长短、臂比和随体等形态特征;学习染色体组型分析的基本方法和技能。
〖实验原理〗染色体组型分析是细胞遗传学研究的基本方法,是研究物种演化、分类以及染色体结构、型态与功能之间的关系所不可缺少的重要手段。
染色体组是指二倍体生物配子中所含的染色体总称,常以“X”表示。
同一物种的同一染色体组内各染色体的形态、结构和连锁群是彼此不同的,但它们却相互协调,共同决定生物性状的发育。
研究染色体组型的方法,一是靠有丝分裂时染色体的形态特征,另一是靠减数分裂时染色体的形态和特征。
本实验着重介绍有丝分裂的染色体组型分析。
细胞有丝分裂中期是识别染色体个性特征的最佳时期,而染色体组型分析就是进行染色体特征的鉴别和描述,其形态的鉴别主要依据染色体的长度、着丝粒位置、付缢痕的有无和位置、随体的有无、形状和大小等资料进行分析。
现分别介绍如下:1.染色体长度,同一染色体组内各染色体的长度是不一致的,其绝对长度可在显微镜上测量,或用放大照片测量后换算。
由于染色体制片过程中使用的药剂及方法不同,另外供观察的细胞分裂不可能保证同一时期,故染色体的收缩有差异而导致绝对长度在同一物种或个体不同细胞间发生差异,针对这种情况,在分析中常用染色体的相对长度来表示。
在染色体长度测量中,对染色体的两条臂要分别测量,一般随体不计入染色体长度内。
2.着丝粒的位置:每条染色体都有一着丝粒,其位置可因不同染色体而异。
由于着丝粒把染色体分为两个染色体臂:长臂和短臂,它们的比率(即臂比)便可确定着丝粒的位置。
3.付缢痕的有无和位置:有些染色体上除着丝粒,还另有一不着色或缢缩变细的区域称符缢痕。
4.随体的有无、形状和大小:有些染色体在短臂的末端有一棒状小体称为随体,随体和染色体臂之间常以付缢痕相隔,具随体的染色体称SAT染色体。
〖材料和方法〗细胞有丝分裂永久制片或其中期染色体图象的放大照片。
〖用具和药品〗剪刀、直尺、胶水。
网状纤维染色网状纤维是非常细而短的纤维,大量堆积时则形成致密的网状,故有网状纤维之称。
疏松组织中网状纤维比较少,它多分布在结缔组织与其它组织交界处,如在上皮组织与结缔组织交界处的基膜内,毛细血管周围以及造血器官,内分泌腺的腺细胞团索和外分泌腺的腺末房周围等处均有丰富的网状纤维。
网状纤维的变化,反映了疾病的发生和发展的不同过程,对疾病的诊断有极大意义。
网状纤维的多少、粗细紧密、疏松或断裂,都是病理检验的重要指标,尤其是在临床病理诊断中,可根据其存在和分布来鉴别癌与肉瘤。
而在HE染色标本上,网状纤维不易显色。
所以网状纤维的组织化学染色,在临床病理诊断上占着相当重要的位置。
染色方法:Gordon-Sweet染色法1.Gordon-Sweet双氨氢氧化银液:10%硝酸银水溶液5ml于锥形量杯内,逐滴加浓氨水并随时摇荡。
硝酸银遇到氨水后立即产生沉淀,当加到沉淀物被溶解时,再加入3%氢氧化钠水溶液5ml。
溶液重新产生沉淀,此时再滴加氨水。
当沉淀恰好溶解后加蒸馏水至50ml。
过虑,贮存于棕色瓶中备用。
2.核固红液:核固红0.5 g,5%硫酸铝液,100 ml,加热溶解,冷却后过虑。
Gordon-Sweet染色步骤(1)蜡切片脱蜡至水。
(2) 0.5%酸化高锰酸钾液5 min。
(3)蒸馏水洗。
(4)2%草酸漂白2min。
(5)流水充分冲洗后蒸馏水洗。
(6)2 %硫酸铁胺液媒染10 min。
(7)蒸馏水洗3次。
(8)双氨氢氧化银液30秒-1 min。
(9)蒸馏水洗3次。
(10)10%甲醛1 min。
(11)流水充分冲洗后蒸馏水洗。
(12)0.2%氯化金液调色 2 min。
(13)蒸馏水洗。
(14)5%硫代硫酸钠液固定 2 min。
(15)流水充分冲洗。
(16)核固红液染10-12 min或1%中性红染5min。
(17)流水冲洗。
(18)95%、无水酒精脱水、二甲苯透明、中性树胶封固。
结果:网状纤维呈黑色,胶原纤维灰红色,核呈红色。
实验五、小鼠骨髓细胞染色体标本的制备【目的要求】1.掌握小鼠细胞染色体标本制备方法。
2.计数并观察小鼠骨髓细胞分裂中期染色体的数目及特点【基本原理】在骨髓细胞中,有丝分裂旺盛,因此不需要体外培养就可以直接得到中期细胞。
骨髓细胞具有高度的分裂活性,经秋水仙素或秋水酰胺处理后,使分裂细胞阻断在有丝分裂中期,再经低渗处理、固定、滴片、染色等步骤,可制作较好的骨髓细胞的染色体标本。
【实验用品】1.器材:解剖刀、剪刀、镊子、注射器、离心机、离心管、恒温水浴箱、冰冷载玻片、酒精灯、大培养皿、显微镜、纱布,标签纸,记号笔等;2.试剂0.1%秋水仙素溶液、Carnoy’s固定液(甲醇:冰醋酸=3:1)、0.075 mol / L KCI 溶液、Giemsa染液等。
3.材料:65-90天健康小鼠【方法与步骤】1.前处理取材前3~4 h,向腹腔内注射秋水仙素。
注射浓度随动物种类不同而异,一般每克体重注射2~6μg,注射总量不宜超过2 ml(例如一只体重50 g的蟾蜍,若按4μg / g注射,需注射浓度为0.1%的秋水仙素溶液0.2 ml )。
秋水仙素的主要作用是使分裂细胞阻断在有丝分裂中期,增加中期分裂相的比例。
2.取骨髓细胞处死动物,用装有生理盐水的注射器反复冲洗出骨髓细胞,并用注射器筒轻轻吹打,使细胞团块分散,静置片刻、待大组织团块沉淀后,用吸管将骨髓细胞悬浮液移至离心管中,以1000 r / min 离心5~10 min,弃去上清液。
3.低渗根据骨髓细胞液的多少,加0.075 mol / L的KCI液5~6 ml,在37℃水浴箱中或室温下低渗20~30 min。
低渗时间过长,易造成细胞破裂;时间过短,则染色体难以分散。
4.预固定低渗完毕,立即加入1 ml 新配制的预冷C arnoy’s固定液,用吸管将细胞轻轻吹打均匀,进行预固定。
然后以1000 r / min 离心8 min。
5.固定弃去上清液,加5~6 ml Carnoy’s液,轻轻吹打细胞,静置固定20 min。
网状纤维染色网状纤维是非常细而短的纤维,大量堆积时则形成致密的网状,故有网状纤维之称。
疏松组织中网状纤维比较少,它多分布在结缔组织与其它组织交界处,如在上皮组织与结缔组织交界处的基膜内,毛细血管周围以及造血器官,内分泌腺的腺细胞团索和外分泌腺的腺末房周围等处均有丰富的网状纤维。
网状纤维的变化,反映了疾病的发生和发展的不同过程,对疾病的诊断有极大意义。
网状纤维的多少、粗细紧密、疏松或断裂,都是病理检验的重要指标,尤其是在临床病理诊断中,可根据其存在和分布来鉴别癌与肉瘤。
而在HE染色标本上,网状纤维不易显色。
所以网状纤维的组织化学染色,在临床病理诊断上占着相当重要的位置。
染色方法:Gordon-Sweet染色法1.Gordon-Sweet双氨氢氧化银液:10%硝酸银水溶液5ml于锥形量杯内,逐滴加浓氨水并随时摇荡。
硝酸银遇到氨水后立即产生沉淀,当加到沉淀物被溶解时,再加入3%氢氧化钠水溶液5ml。
溶液重新产生沉淀,此时再滴加氨水。
当沉淀恰好溶解后加蒸馏水至50ml。
过虑,贮存于棕色瓶中备用。
2.核固红液:核固红0.5 g,5%硫酸铝液,100 ml,加热溶解,冷却后过虑。
Gordon-Sweet染色步骤(1)蜡切片脱蜡至水。
(2) 0.5%酸化高锰酸钾液5 min。
(3)蒸馏水洗。
(4)2%草酸漂白2min。
(5)流水充分冲洗后蒸馏水洗。
(6)2 %硫酸铁胺液媒染10 min。
(7)蒸馏水洗3次。
(8)双氨氢氧化银液30秒-1 min。
(9)蒸馏水洗3次。
(10)10%甲醛1 min。
(11)流水充分冲洗后蒸馏水洗。
(12)0.2%氯化金液调色 2 min。
(13)蒸馏水洗。
(14)5%硫代硫酸钠液固定 2 min。
(15)流水充分冲洗。
(16)核固红液染10-12 min或1%中性红染5min。
(17)流水冲洗。
(18)95%、无水酒精脱水、二甲苯透明、中性树胶封固。
结果:网状纤维呈黑色,胶原纤维灰红色,核呈红色。