新药研究开发与上市流程图
- 格式:docx
- 大小:27.20 KB
- 文档页数:3
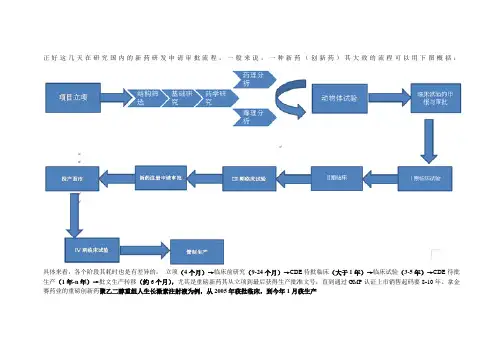
正好这几天在研究国内的新药研发申请审批流程,一般来说,一种新药(创新药)其大致的流程可以用下图概括:具体来看,各个阶段其耗时也是有差异的:立项(4个月)→临床前研究(9-24个月)→CDE待批临床(大于1年)→临床试验(3-5年)→CDE待批生产(1年-n年)→批文生产转移(约6个月),尤其是重磅新药其从立项到最后获得生产批准文号,直到通过GMP认证上市销售起码要8-10年。
拿金赛药业的重磅创新药聚乙二醇重组人生长激素注射液为例,从2005年获批临床,到今年1月获生产这份流程图和这篇文章给出了药物研发的成功率以及每个步骤所花费的时间。
总体来看,每5种进入临床的药物中只有1种能进行所有的试验和批准过程。
新药开发阶段如下:临床前试验:由制药公司进行的实验室和动物研究,以观察化合物针对目标疾病的生物活性,同时对化合物进行安全性评估。
这些试验大概需要3.5年的时间。
研发中新药申请(Investigational New Application, IND):在临床前试验完成后,公司要向FDA提请一份IND,之后才能开始进行药物的人体试验。
如果30天内FDA没有发出不予批准的申明,此IND即为有效。
提出的IND需包括以下内容:先期的试验结果,后续研究的方式、地点以及研究对象;化合物的化学结构;在体内的作用机制;动物研究中发现的任何毒副作用以及化合物的生产工艺。
另外,IND必须得到制度审核部门(the Institutional Review Board)的审核和批准。
同时,后续的临床研究需至少每年向F DA提交一份进展报告并得到准许。
临床试验,Ⅰ期:此阶段大概需要1年时间,由20~80例正常健康志愿者参加。
这些试验研究了药物的安全性方面,包括安全剂量范围。
此阶段的研究同时确定了药物在体内的吸收、分布、代谢和排泄、以及药物的作用持续时间等项目。
临床试验,Ⅱ期:此阶段需要约100到300名志愿患者参与进行一些控制研究,以评价药物的疗效。

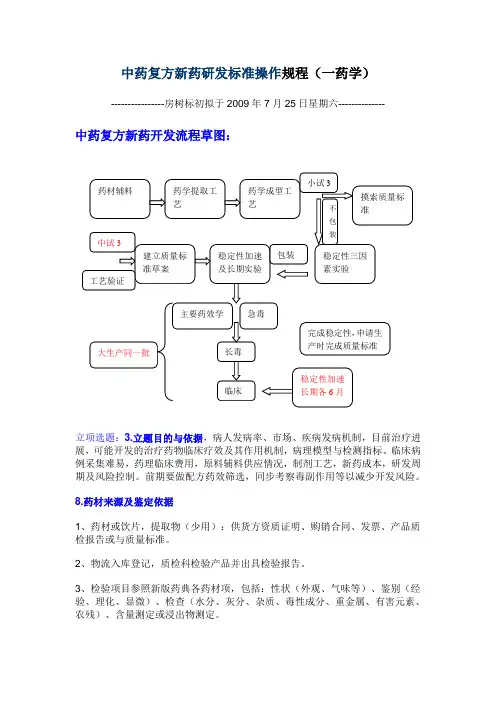
中药复方新药研发标准操作规程(一药学)----------------房树标初拟于2009年7月25日星期六--------------中药复方新药开发流程草图:立项选题:3.立题目的与依据,病人发病率、市场、疾病发病机制,目前治疗进展,可能开发的治疗药物临床疗效及其作用机制,病理模型与检测指标、临床病例采集难易,药理临床费用,原料辅料供应情况,制剂工艺,新药成本,研发周期及风险控制。
前期要做配方药效筛选,同步考察毒副作用等以减少开发风险。
8.药材来源及鉴定依据1、药材或饮片,提取物(少用):供货方资质证明、购销合同、发票、产品质检报告或与质量标准。
2、物流入库登记,质检科检验产品并出具检验报告。
3、检验项目参照新版药典各药材项,包括:性状(外观、气味等)、鉴别(经验、理化、显微)、检查(水分、灰分、杂质、毒性成分、重金属、有害元素、农残)、含量测定或浸出物测定。
9、10、11三项原料药材符合法定标准的可不提供。
12.生产工艺研究资料,工艺验证资料及文献资料,辅料来源及质量标准。
1.(12与13文献资料):文献检索包括复方中各位药材的成分、理化性质、含量测定方法、药理、药代、临床,新药制剂工艺等全面信息,为以后的药学工艺、质量标准的制定,药理模型的建立、临床方案的设计奠定科研基础。
2.辅料来源及质量标准:供货方资质证明、购销合同、发票、产品质检报告与质量标准。
物流入库登记,质检检验产品并出具检验报告。
检验项目参照新版药典各辅料项。
3.生产工艺研究资料,工艺验证资料:购进原料后,现通过实验室摸索(正交设计等摸索提取及制剂工艺)再通过实验室小试建立工艺。
注意:工艺指标选择要有意义(有效成分或指标成分),小试工艺参数最好是个范围,以便于生产条件的实现,同时也要有一个最佳工艺参数。
如提取工艺参数:溶剂量,时间、温度;直接浓缩至一定密度的浸膏,考察出膏量及有效成分含量。
可进一步考察浓缩参数:温度、压力、时间;指标可选膏的浓度。


新药从研发到上市需经过哪些流程?10 年时间,花费10亿美元,研发一款新药,无论是利益的驱动,还是拯救万千患者的成就感,药企的这一行为都值得我们尊敬。
一款新药从研发到上市都需要经过哪些流程?每一步又有哪些经验可以借鉴?本文以小分子药物为例,试着做了一个梳理,希望能对你有所帮助。
一、临床前研究1、研究开发(一般2-3年)实验室研究,寻找治疗特定疾病的具有潜力的新化合物(1)药物靶点的发现及确认这是所有工作的起点,只有确定了靶点,后续所有的工作才有展开的依据。
(2)化合物的筛选与合成根据靶点的空间结构,从虚拟化合物库中筛选一系列可匹配的分子结构,合成这些化合物,它们被称为先导化合物。
(3)活性化合物的验证与优化不是所有先导化合物都能符合要求,在这个阶段需要通过体外细胞试验验证,初步筛选出活性高、毒性低的化合物,并根据构效关系进行结构优化,这些化合物称为药物候选物。
同时也存在一个化合物对目标A 靶点没有作用,却有可能对其他的B 靶点、C 靶点有非常好活性的情况,暂且不表。
2、临床前实验(一般2-4年)这一阶段目的,一是评估药物的药理和毒理作用,药物的吸收、分布、代谢和排泄情况(ADME)。
二是进行生产工艺、质量控制、稳定性等研究(CMC)。
第一部分的实验需要在动物层面展开,细胞实验的结果和活体动物实验的结果有时候会有很大的差异。
这一步的目的是确定药物的有效性与安全性。
第二部分需要在符合GMP要求的车间完成。
(1)药理学研究包括:药效学、药动学(2)毒理学研究急毒、长毒、生殖毒性,致癌、致畸、致突变情况(3)制剂的开发总不能弄点化合物就直接往嘴里倒吧,制剂开发是药物应用的一个重要环节。
比如有的药口服吸收很差,就需要开发为注射剂。
有的药在胃酸里面会失去活性,就需要开发为肠溶制剂。
有的化合物溶解性不好,这也可以通过制剂来部分解决这个问题。
还有的需要局部给药,就需要通过制剂开发成雾化剂、膏剂等。
二、临床试验审批 Investigational New Drug(IND)三、临床试验(一般3-7年)人体试验共分三期:•Ⅰ期临床20-100例,正常人,主要进行安全性评价。






新药研究开发与上市流程图人们生活水平提高要求更多更好的新药,药物科学的发展为新药开发提供了理论基础和技术,市场经济竞争也促进了新药快速发展。
美国食品与药物管理局(FDA)近十年来每年批准上市的新药都在20种以上。
我国近年来引进新药品种很多,但需要加快创新。
新药开发是一个非常严格而复杂的过程,各药虽然不尽相同,药理研究却是必不可少的关键步骤。
临床有效的药物都具有相应的药理效应,但具有肯定药理效应的药物却不一定都是临床有效的药物。
例如抗高血压药都能降低血压,但降压药并不都是抗高血压药,更不一定是能减少并发症、延长寿命的好药。
因此新药开发研究必需有一个逐步选择与淘汰的过程。
为了确保药物对病人的疗效和安全,新药开发不仅需要可靠的科学实验结果,各国还对新药生产上市的审批与管理制定了法规,对人民健康及工商业经济权益予以法律保障。
新药来源包括天然产物、半合成及全合成化学物质。
过去选药主要方法是依靠实践经验,现在可以根据有效药物的植物分类学找寻近亲品种进行筛选或从有效药物化学结构与药理活性关系推断,定向合成系列产品,然后进行药理筛选。
近年来对于机体内在抗病物质(蛋白成分)利用DNA基因重组技术,即将DNA 的特异基因区段分离并植入能够迅速生长的细菌或酵母细胞,以获得大量所需蛋白药物。
此外,还可对现有药物进行化学结构改造(半合成)或改变剂型,也可获得疗效更好,毒性更小或应用更方便的药物。
医学教育网搜集整理新药研究过程大致可分三步,即临床前研究、临床研究和售后调研。
临床前研究包括用动物进行的系统药理研究及急慢性毒性观察。
对于具有选择性药理效应的药物,在进行临床试验前还需要测定该药物在动物体内的吸收、分布及消除消除过程。
临床前研究是要弄清新药的作用谱及可能发生的毒性反应。
在经过药物管理部门的初步审批后才能进行临床试验。
目的在于保证用药安全。
临床研究首先在10~30例正常成年志愿者观察新药耐受性,找出安全剂量。
再选择有特异指征的病人按随机分组、设立已知有效药物及空白安慰剂双重对照(对急重病人不得采用有损病人健康的空白对照),并尽量采用双盲法(病人及医护人员均不能分辨治疗药品或对照药品)观察,然后进行治疗结果统计分析,客观地判断疗效。
⼀图看懂新药研发流程
今天,不是传闻
药物不是发明的,不要再⽤阿司匹林和青霉素的例⼦了,能撞狗屎运找到的东西到现在早就被撞了个遍了。
现在新药全世界每年也就⼗来⼆⼗个,国内原创新化合物新药基本没⼏个,都是各种仿制,每个药都是多少亿美⼑多少年堆出来的。
⾸先是⽣理药理病理的研究,找到靶标(体内能被药物作⽤的有活性的⼤分⼦)
然后根据靶点,从成百上千万分⼦,计算机辅助药物设计,模拟筛选。
或者研究现有的药物的构效关系,增减基团,结构改造、修饰。
挑出⼏百上千个可能性⽐较⼤的分⼦。
⼀个个合成出来,测定体内活性、毒性和药物代谢情况。
每⼀步都会淘汰掉⼤量的分⼦。
选出⼏个药效⽐较好,毒性⽐较⼩的
设计剂型,剂型设计很⼤程度上能够决定药物的吸收特性和商业价值。
然后上报fda
开始各种临床试验
如上图。
三期临床都通过了就可以上市了。
第四期是上市之后⾯向⼤量患者的⼤样本观察。
中间每⼀个过程都可能爆出严重不良反应或疗效不⾜等问题,然后这个研发项⽬就流产了。
新药研究开发与上市流程图
人们生活水平提高要求更多更好的新药,药物科学的发展为新药开发提供了理论基础和技术,市场经济竞争也促进了新药快速发展。
美国食品与药物管理局(FDA)近十年来每年批准上市的新药都在20种以上。
我国近年来引进新药品种很多,但需要加快创新。
新药开发是一个非常严格而复杂的过程,各药虽然不尽相同,药理研究却是必不可少的关键步骤。
临床有效的药物都具有相应的药理效应,但具有肯定药理效应的药物却不一定都是临床有效的药物。
例如抗高血压药都能降低血压,但降压药并不都是抗高血压药,更不一定是能减少并发症、延长寿命的好药。
因此新药开发研究必需有一个逐步选择与淘汰的过程。
为了确保药物对病人的疗效和安全,新药开发不仅需要可靠的科学实验结果,各国还对新药生产上市的审批与管理制定了法规,对人民健康及工商业经济权益予以法律保障。
新药来源包括天然产物、半合成及全合成化学物质。
过去选药主要方法是依靠实践经验,现在可以根据有效药物的植物分类学找寻近亲品种进行筛选或从有效药物化学结构与药理活性关系推断,定向合成系列产品,然后进行药理筛选。
近年来对于机体内在抗病物质(蛋白成分)利用DNA基因重组技术,即将DNA 的特异基因区段分离并植入能够迅速生长的细菌或酵母细胞,以获得大量所需蛋白药物。
此外,还可对现有药物进行化学结构改造(半合成)或改变剂型,也可获得疗效更好,毒性更小或应用更方便的药物。
医学教育网搜集整理新药研究过程大致可分三步,即临床前研究、临床研究和售后调研。
临床前研究包括用动物进行的系统药理研究及急慢性毒性观察。
对于具有选择性药理效应的药物,在进行临床试验前还需要测定该药物在动物体内的吸收、分布及消除消除过程。
临床前研究是要弄清新药的作用谱及可能发生的毒性反应。
在经过药物管理部门的初步审批后才能进行临床试验。
目的在于保证用药安全。
临床研究首先在10~30例正常成年志愿者观察新药耐受性,找出安全剂量。
再选择有特异指征的病人按随机分组、设立已知有效药物及空白安慰剂双重对照(对急重病人不得采用有损病人健康的空白对照),并尽量采用双盲法(病人及医护人员均不能分辨治疗药品或对照药品)观察,然后进行治疗结果统计分析,客观地判断疗效。
与其同时还需进行血药浓度监测计算药动学数据。
受试病例数一般不应少于300例,先在一个医院以后可扩大至三个以上医疗单位进行多中心合作研究。
对那些需要长期用药的新药,应有50~100例病人累积用药半年至一年的观察记录。
由此制定适应证、禁忌证、剂量疗程及说明可能发生的不良反应后,再经过药政部门的审批才能生产上市。
售后调研是指新药问市后进行的社会性考查与评价,在广泛的推广应用中重点了解长期使用后出现的不良反应和远期疗效(包括无效病例)。
药物只能依靠广大用药者(医生及病人)才能作出正确的历史性评价。
一种药物从最初的实验室研究到最终摆放到药柜销售平均需要花费12年的时间。
进行临床前试验的5000种化合物中只有5种能进入到后续的临床试验,
这份报告真实再现了药物的发明和发展进程。
美国的新药批准体系也许是世界上最严格的体系。
根据国会的技术评估部在1993年2月所作的报告来看,一种药物从实验室到上柜销售平均将花去公司3.59亿美元。
这份流程图和这篇文章给出了药物研发的成功率以及每个步骤所花费的时间。
总体来看,每5种进入临床的药物中只有1种能进行所有的试验和批准过程。
新药开发阶段如下:
临床前试验:由制药公司进行的实验室和动物研究,以观察化合物针对目标疾病的生物活性,同时对化合物进行安全性评估。
这些试验大概需要3.5年的时间。
研发中新药申请(Investigational New Application, IND):在临床前试验完成后,公司要向FDA提请一份IND,之后才能开始进行药物的人体试验。
如果30天内FDA没有发出不予批准的申明,此IND即为有效。
提出的IND需包括以下内容:先期的试验结果,后续研究的方式、地点以及研究对象;化合物的化学结构;在体内的作用机制;动物研究中发现的任何毒副作用以及化合物的生产工艺。
另外,IND必须得到制度审核部门(the Institutional Review Board)的审核和批准。
同时,后续的临床研究需至少每年向FDA提交一份进展报告并得到准许。
临床试验,Ⅰ期:此阶段大概需要1年时间,由20~80例正常健康志愿者参加。
这些试验研究了药物的安全性方面,包括安全剂量范围。
此阶段的研究同时确定了药物在体内的吸收、分布、代谢和排泄、以及药物的作用持续时间等项目。
临床试验,Ⅱ期:此阶段需要约100到300名志愿患者参与进行一些控制研究,以评价药物的疗效。
这个阶段大约需要2年时间。
临床研究,Ⅲ期:此阶段持续约3年时间,通常需要诊所和医院的1000~300名患者参与。
医师通过对病患的监测以确定疗效和不良反应。
新药申请(New Drug Application, NDA):通过三个阶段的临床试验,公司将分析所有的试验数据。
如果数据能够成功证明药物的安全性和有效性,公司将向FDA提出新药申请。
新药申请必须包括公司所掌握的一切相关科学信息。
典型的新药申请有10万页甚至更多。
根据法律,FDA审核一份NDA的时限应该为6个月。
但是几乎所有案例中的新药申请从首次提交到最终获得FDA批准的过程都超过了这个时限;在1992年对于新分子实体的新药申请平均审核时间为29.9个月。
批准:一旦FDA批准了一份新药申请,此种新药就可以被医师用于处方。
公司必须继续向FDA提交阶段性报告,包括所有的不良反应报告和一些质量控制记录。
FDA还可能对一些药物要求做进一步的研究(Ⅳ期),以评价药物的长期疗效。
发明和研究安全有效的新药是一个长期、艰难和昂贵的进程。
今年,以研究为基础的制药公司将在研发方面投资126亿美元,这种投资将每五年翻一倍。
开发流程:大致如下
专业范本可能没有涵盖全面,最好找专业人士审核后使用,感谢您的下载!。