2018年中考化学复习资料第07讲酸的性质(含解析)
- 格式:doc
- 大小:656.00 KB
- 文档页数:25

2018初中化学方程式之酸的化学性质各位读友大家好,此文档由网络收集而来,欢迎您下载,谢谢新一轮中考复习备考周期正式开始,中考网为各位初三考生整理了中考五大必考学科的知识点,主要是对初中三年各学科知识点的梳理和细化,帮助各位考生理清知识脉络,熟悉答题思路,希望各位考生可以在考试中取得优异成绩!下面是《2018初中化学方程式之酸的化学性质》,仅供参考!酸+ 金属-------- 盐+ 氢气酸+ 金属氧化物-------- 盐+ 水氧化铁和稀盐酸反应:Fe2O3 + 6HCl ==2FeCl3 + 3H2O氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 == Fe23 + 3H2O氧化铜和稀盐酸反应:CuO + 2HCl ==CuCl2 + H2O氧化铜和稀硫酸反应:CuO +H2SO4 == CuSO4 + H2O酸+ 碱-------- 盐+ 水盐酸和烧碱起反应:HCl + NaOH == NaCl +H2O盐酸和氢氧化钙反应:2HCl + Ca2 == CaCl2 + 2H2O氢氧化铝药物治疗胃酸过多:3HCl + Al3 == AlCl3 + 3H2O硫酸和烧碱反应:H2SO4 + 2NaOH == Na2SO4 + 2H2O酸+ 盐-------- 另一种酸+ 另一种盐大理石与稀盐酸反应:CaCO3 + 2HCl == CaCl2 + H2O + CO2↑碳酸钠与稀盐酸反应: Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl各位读友大家好,此文档由网络收集而来,欢迎您下载,谢谢。

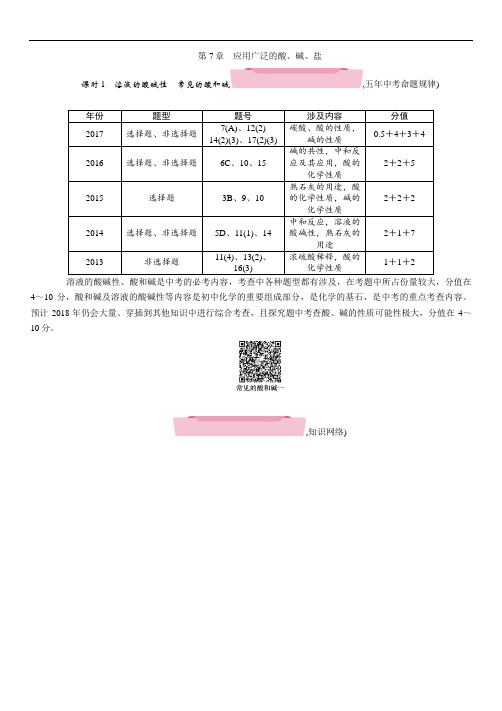
第7章应用广泛的酸、碱、盐课时1溶液的酸碱性常见的酸和碱,五年中考命题规律) 年份题型题号涉及内容分值2017 选择题、非选择题7(A)、12(2)14(2)(3)、17(2)(3)碳酸、酸的性质,碱的性质0.5+4+3+42016 选择题、非选择题6C、10、15 碱的共性,中和反应及其应用,酸的化学性质2+2+52015 选择题3B、9、10 熟石灰的用途,酸的化学性质,碱的化学性质2+2+22014 选择题、非选择题5D、11(1)、14 中和反应,溶液的酸碱性,熟石灰的用途2+1+72013 非选择题11(4)、13(2)、16(3) 浓硫酸稀释,酸的化学性质1+1+2溶液的酸碱性、酸和碱是中考的必考内容,考查中各种题型都有涉及,在考题中所占份量较大,分值在4~10分,酸和碱及溶液的酸碱性等内容是初中化学的重要组成部分,是化学的基石,是中考的重点考查内容。
预计2018年仍会大量、穿插到其他知识中进行综合考查,且探究题中考查酸、碱的性质可能性极大,分值在4~10分。
,知识网络),考点梳理)溶液的酸碱性1.酸碱指示剂(1)概念:能检验溶液__酸碱性__的试剂。
(2)酸碱指示剂在溶液中的颜色变化酸碱性指示剂酸性中性碱性石蕊溶液①__红色__②__紫色__③__蓝色__酚酞溶液④__无色__⑤__无色__⑥__红色__2.溶液的酸碱性强弱(1)溶液pH大小与酸碱的关系标准比色卡01234567891011121314――→酸性增强中性――→碱性增强(2)测定溶液的pH①测定方法:将玻璃棒蘸取的试样溶液滴在__pH试纸__上,(pH试纸不能预先__用水润湿__),把试纸呈现的颜色与__标准比色卡__对照,就可以确定__溶液的酸碱度__。
②注意事项:不能润湿;不能伸入待测液;不能测得小数值,若要测得小数值,可用pH计。
【温馨提示】测定溶液pH时,若先将pH试纸润湿,会测得碱性溶液pH偏小,酸性溶液pH偏大。
![[中考必杀技]酸的化学性质中考点击](https://img.taocdn.com/s1/m/1277b7dc6529647d272852d7.png)
[中考必杀技]酸的化学性质中考点击【知识点的认识】酸的化学性质主要有如下五个:1.酸溶液能跟酸碱指示剂起反应。
紫色石蕊试液遇酸变红,无色酚酞试液遇酸不变色。
变色情况可以简记为:“石红酚无”。
2.酸能跟多种活泼金属起反应,通常生成盐和氢气。
只有位于金属活动性顺序表中氢前面的金属才能与稀盐酸(或稀硫酸)反应,产生氢气,而位于氢后的金属却不能。
例如,常见的镁、铝、锌、铁、铜五种金属分别与稀盐酸、稀硫酸反应,具体的现象、结论(用化学方程式表示)如下表所示。
3.酸能跟金属氧化物(即碱性氧化物)反应生成盐和水。
例如,铁锈(主要成分是氧化铁)分别与盐酸、硫酸反应,具体现象、结论(用化学方程式表示)如下表所示。
4.酸能跟碱起中和反应生成盐和水。
例如,NaOH+HCl=NaCl+H2O、2NaOH+H2SO4=Na2SO4+2H2O、Ca(OH)2+2HCl=CaCl2+2H2O、Ca(OH)2+H2SO4=CaSO4+2H2O、H2SO4+Ba(OH)2=BaSO4↓(白色沉淀,不溶于硝酸)+2H2O。
5.酸能跟某些盐反应生成新酸和新盐。
例如,H2SO4+BaCl2=BaSO4↓+2HCl、HCl+AgNO3=AgCl↓(白色沉淀,不溶于硝酸)+HNO3。
有时生成的新酸不稳定,会继续分解;例如,CaCO3+2HCl=CaCl2+CO2↑+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O、NaHCO3+HCl=NaCl+CO2↑+H2O。
另外,碳酸不稳定,容易分解成二氧化碳和水。
【命题方向】该考点的命题方向主要是通过创设相关实验、问题情景或图表信息等,来考查学生对酸的化学性质的理解和掌握情况;以及阅读、分析、推断能力和对知识的迁移能力。
并且,经常将其与酸碱指示剂及其性质、金属的化学性质、酸的用途、中和反应、二氧化碳和氢气的实验室制取原理、碳酸钠和碳酸氢钠的化学性质、灭火器的反应原理、物质的推断和鉴别、碳酸根离子的检验、复分解反应的条件与实质、化学方程式的书写、有关实验操作(或现象、结论)等相关知识联系起来,进行综合考查。


2018年中考酸碱盐知识点总结一、酸的化学性质:1、酸的溶液可使紫色石蕊溶液变红,不能使无色酚酞变色2、酸+活泼金属——盐+H2↑2HCl+Mg=MgCl2+H2↑H2SO4+Mg=MgSO4+H2↑2HCl+Zn=ZnCl2+H2↑H2SO4+Zn=ZnSO4+H2↑2HCL+Fe=FeCl2+H2↑(金属溶解,有气体放出)H2SO4+ Fe=FeSO4+H2↑3 、酸+金属氧化物——盐+H2O6HCl+Fe2O3=2FeCl3+3H2O(溶液变成红褐色,红色固体溶解)3H2SO4+Fe2O3=2FeCl3+H2O2HCl+CuO=CuCl2+H2O(溶液变成蓝色,黑色固体溶解)H2SO4+CuO=CuSO4+H2O4、酸+碱——盐+H2OHCl+NaOH=NaCl+H2O2HCl+Ca(OH)2=CaCl2+H2OH2SO4+NaOH=Na2SO4+2H2OH2SO4+Cu(OH)2=2H2O+CuSO4(蓝色固体溶解,溶液变蓝)5、酸+某些盐——新酸+新盐HCl+AgNO3=AgCl↓+HNO3(生成白色沉淀,沉淀不溶于稀硝酸)H2SO4+BaCl2=BaSO4↓+H2SO4(生成白色沉淀,沉淀不溶于稀硝酸)2HCl+CaCO3=H2O+CO2↑+CaCl2 (生成气体)2HCl+Na2CO3=2NaCl+H2O+CO2↑(生成气体)二、碱的化学性质:1、碱溶液可使紫色石蕊试液变蓝,可是无色酚酞变红2 、碱+非金属氧化物——盐+H2O2NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2OCa(OH)2+CO2=CaCO3↓+H2O (生成白色沉淀)3 、碱+酸——盐+H2OHCl+NaOH=NaCl+H2O2H2SO4+Ca(OH)2=Ca SO4+H2OH2SO4+2NaOH=Na2SO+2H2O2HCl+Cu(OH)2=2HCl+CuCl2 (蓝色沉淀溶解,溶液变蓝)H2SO4+Ca(OH)2=CaSO4+2H2O4 、碱+某些盐——新盐+新碱3NaOH+FeCl3=Fe(OH)3↓+3NaCl (生成红褐色沉淀)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 (生成蓝色沉淀)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH (生成白色沉淀)Ca(OH)2+2NH4Cl=CaCl2+2NH3↑+2H2O (有刺激性气体生成)5、不溶性碱遇热分解Cu(OH)2△CuO+H2O (蓝色沉淀变黑)2Fe(OH)3=Fe2O3+H2O三、盐的化学性质:1、酸+某些盐——新酸+新盐HCl+AgNO3=AgCl↓+HNO3(生成白色沉淀,沉淀不溶于稀硝酸)H2SO4+BaCl2=BaSO4↓+H2SO4(生成白色沉淀,沉淀不溶于稀硝酸)2HCl+CaCO3=H2O+CO2↑+CaCl2 (生成气体)2HCl+Na2CO3=2NaCl+H2O+CO2↑(生成气体)2 、碱+某些盐——新盐+新碱3NaOH+FeCl3=Fe(OH)3+3NaCl (生成红褐色沉淀)2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 (生成蓝色沉淀)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH (生成白色沉淀)Ca(OH)2+ 2NH4Cl=CaCl2+2NH3↑+2H2O (有刺激性气味)3 、金属+某些金属盐=新金属+金属盐CuSO4+Fe=FeSO4+Cu (蓝色溶液变绿,铁片变红)Cu+AgNO3=CuNO3+Ag (无色溶液变蓝,红色铁片变银白色)4 、盐+盐=新盐+新盐FeCl2+2AgNO3=Fe(NO3)2+2AgCl2↓(生成不溶于稀硝酸的白色沉淀)Na2SO4+BaCl2=BaSO4+2NaClCaCl2+2AgNO3=Ca(NO3)2+2AgCl↓(生成不溶于稀硝酸的白色沉淀)。
考前冲刺知识梳理酸的化学性质及常见的酸重点一. 酸的化学性质(重要性①能使紫色石蕊溶液变色易错点:变色的是石蕊,而不是酸②能与活泼金属发生反应规律:活泼金属+酸=对应的盐+氢气2Al+6HCl=2AlCl₃+3H₂↑【例】Mg+2HCl=MgCl₂+H₂↑Fe+2HCl=FeCl₂+H₂↑Zn+2HCl=ZnCl₂+H₂↑易错点:酸是盐酸或者稀硫酸、但不能是硝酸、浓硫酸@简单初中生考察方向:描述金属与酸反应的实验现象、金属活动性比较、实验室制取氢气方向1:描述实验现象,包含三方面:固体溶解、溶液颜色变化、气体产生【例】向铁粉中加入稀盐酸,描述反应现象。
正确:铁粉逐渐溶解,有气泡产生,溶液由无色变成浅绿色错误:铁粉逐渐溶解,有氢气产生,溶液由无色变成浅绿色(描述现象,千万不能点名道姓)方向2:金属活动性比较规律:一看反应与否,二看气泡快慢,能反应的金属比不反应的金属活泼性强,产生气泡快的金属比产生气泡慢的金属强@简单初中生方向3:实验室制取氢气原料:锌粒、稀硫酸原理:Zn+H₂SO₄=ZnSO₄+H₂↑常见问题:(1) 为什么不用盐酸制取氢气?答:不使用稀盐酸,因为:盐酸易挥发,使制得的氢气中含有HCl气体(2) 为什么不用镁或铁制取氢气?答:不用镁是因为反应速度太快,不用铁是因为反应速度太慢(3) 氢气点燃前需要做什么?答:验纯③能和金属氧化物反应(复分解反应)规律:金属氧化物+酸=对应的盐+水(金属元素的化合价不变)Fe₂O₃+6HCl=2FeCl₃+3H₂O(反应前后,铁元素都是+3价,化合价未发生改变)【例】FeO+2HCl=FeCl₂+H₂O((反应前后,铁元素都是+2价,化合价未发生改变) CuO+2HCl=CuCl₂+H₂O考察方向:金属氧化物与酸的反应现象、流程题中除杂方向1:金属氧化物与酸的反应现象,与金属单质类似,要点:固体溶解,溶液颜色变化【例】向氧化铜粉末中加入稀硫酸@简单初中生答:黑色粉末逐渐溶解,溶液由无色变成蓝色方向2:流程题中除杂常见问题:流程题中,原料往往含有某些金属氧化物杂质,除去的方法一般是添加酸(盐酸或者硫酸)【2019白云一模(节选)】下图是以黄铜矿(主要成分为CuFeS₂)为原料制取胆矾晶体(CuSO₄⋅5H₂O)的流程:已知:高温焙烧时的主要反应有:2CuFeS2+O2高温Cu2S+2FeS+SO22Cu₂S+5O₂高温2CuO+2CuSO₄, 2FeS+3O₂高温=2FeO+2SO₂;(1)最适合的试剂X是 (填化学式)溶液。
第三节酸和碱的性质第一课时酸的性质【学习要求】1、了解浓盐酸和浓硫酸的性质。
2、认识酸的化学性质,理解酸的化学性质实质是氢离子的性质。
3、体会分类选取代表物,宏观与微观结合等科学认识物质的方法。
4、通过对酸性质的开放性探究活动,引领学生进一步发展科学探究能力。
【重点】1、酸的化学性质2、对酸的化学性质反应原理的微观认识【学案设计】知识回顾:什么是酸?你知道哪些酸?如何证明一瓶失去标签的无色溶液是酸?一、酸的性质1、认识浓盐酸和浓硫酸【探究活动一】浓盐酸和浓硫酸的性质(1)阅读浓盐酸和浓硫酸的标签并完成填空(2)用木条蘸取浓硫酸在滤纸上写字(3)稀释浓硫酸【形成知识】1、浓硫酸的特性,,。
2、稀释浓硫酸时,一定要把慢慢倒入,并不断用搅拌。
3、如果不慎将浓硫酸沾到皮肤上,应立即用冲洗,再涂上,以防灼伤皮肤。
2、酸的化学性质【问题组】1、稀盐酸能与哪些物质反应?你还想探究有关它们的什么知识呢?2、我们准备的实验用品,有镁条、生锈铁钉(铁锈主要成分是氧化铁)、碳酸钠、氯化铜溶液等,分析判断它们各是哪类物质的代表?为什么要选取这些物质?3、铁锈和盐酸的反应,在铁锈完全溶解后,铁钉表面有什么现象,为什么?【探究活动二】稀盐酸的化学性质完成实验并填写实验报告。
友情提示:1、分工合作,边做边记录实验现象2、酸有一定的腐蚀性,注意安全3、先固后液,药液加入4—5滴4、碳酸钠用药匙小头取绿豆粒大小5、注意滴管不要碰触井穴板实验:稀盐酸与镁条、锈铁钉、碳酸钠、氯化铜溶液的反应【形成知识】知识拓展:[动画展示]稀盐酸与镁条、碳酸钠反应的微观实质【探究活动三】稀硫酸的化学性质完成实验并填写实验报告。
实验:稀硫酸与镁条、锈铁钉、碳酸钠、氯化铜溶液的反应【形成知识】知识拓展:[动画展示]稀硫酸与镁条、碳酸钠、氯化铜反应的微观实质【问题组】1、为什么稀盐酸和稀硫酸会有相似的化学性质?2、酸具有哪些化学性质?【形成知识】酸的化学性质:酸与_________________________反应;酸与_________________________反应;酸与_________________________反应;酸与_________________________反应;酸与_________________________反应。